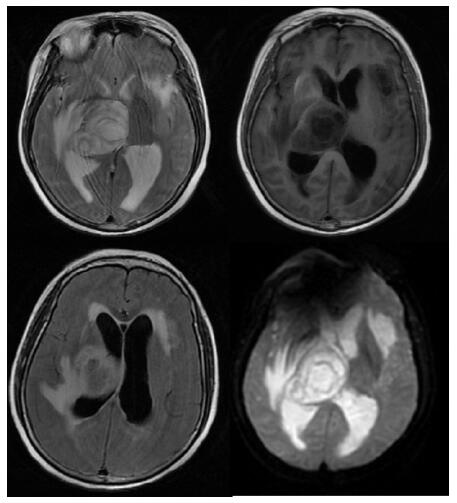
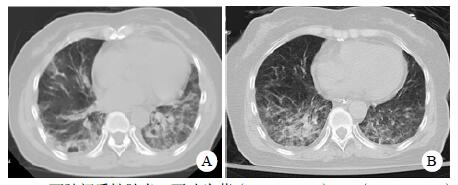
患者,女,54岁,工人,因“头晕5 d”于2019年9月29日至浙江大学附属第二医院急诊就诊。5 d前患者无明显诱因出现头晕,伴行走不稳、四肢乏力,无发热、咳嗽咳痰、胸闷气促、恶心呕吐、四肢抽搐等,未就诊。我院急诊头颅磁共振(MRI)示:右侧丘脑及左侧岛叶异常信号,局部累及右侧中脑(图 1),考虑脑多发占位性疾病。在急诊抢救室予甘露醇100 mL静滴脱水降颅压等对症治疗,5 h后患者逐渐意识模糊。急查血常规:白细胞16.1×109/L,中性粒细胞百分比73.4%;头颅CT示右侧丘脑、左侧岛叶病变,伴脑室扩张(图 2);急诊行“双侧脑室外引流术”,术中引流液呈淡血性。术后诊断:⑴(右侧丘脑)颅内占位性病变,脓肿首先考虑,肿瘤需排除;⑵脑积水;⑶脑疝。患者带气管插管转入ICU进一步治疗。当时体温38.3℃,脉搏99次/min,呼吸频率24次/min,血压169/87 mmHg(1 mmHg= 0.133 kPa),颈软,神志昏迷,右侧瞳孔3 mm,左侧瞳孔2.5 mm,对光反射迟钝。双肺呼吸音粗,可闻及少量啰音。左侧病理征阳性。患者3个月前曾因“反复胸闷气促伴发热1个月余”在本院风湿科住院,当时胸部高分辨CT示两肺间质性肺炎、下叶为著(图 3);血化验示血沉偏高,抗心磷脂抗体阳性;诊断为“间质性肺炎”,住院期间予甲泼尼龙40 mg/d静滴×8 d,60 mg/d静滴×6 d,共住院14 d;出院后予口服甲泼尼龙40 mg/d联合雷公藤多苷片每次20 mg,一日2次治疗;此后规范于本院门诊复诊。本次起病前2个月甲泼尼龙已减量至36 mg/d口服治疗。
|
| 右侧丘脑及左侧岛叶异常信号,局部累及右侧中脑 图 1 患者2019-09-29头颅MRI平扫+黑水成像 |
|
|
|
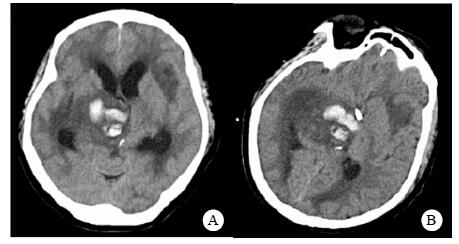
| A:右侧丘脑、左侧岛叶病变,伴脑室扩张;B:双侧脑室钻孔引流术后改变,脑室扩张较前(2019-09-29)好转,右侧丘脑、左侧岛叶病变伴出血 图 2 患者2019-09-29头颅CT平扫(A)和2019-09-30头颅CT平扫(B) |
|
|
|
| A:两肺间质性肺炎,下叶为著(2019-06-23);B:(2019-09-30)两肺间质性肺炎,下叶为著,较前(2019-06-23)部分好转 图 3 患者胸部HRCT结果 |
|
|
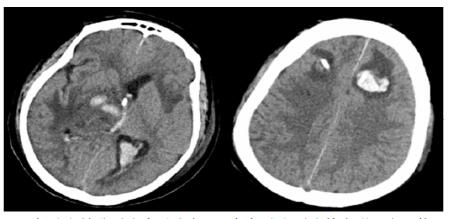
转入ICU后呼吸机辅助通气、甘露醇100 mL/8 h静滴脱水、头孢呋辛1.5 g/12 h静滴抗感染,肠内营养等支持治疗。当晚血常规:白细胞13.3×109/L,中性粒细胞百分比85.3%,C反应蛋白17.1 mg/L,降钙素原0.64 ng/mL。脑室外引流术后次日血化验:白细胞16.6×109/L,中性粒细胞百分比92.8%,C反应蛋白78.4 mg/L;从脑室外引流管留取脑脊液检验:有核细胞6×106/L,红细胞1 960×106/L,蛋白含量1.717 g/L,葡萄糖4.72 mmol/L,细菌培养阴性,涂片未找到细菌;复查头颅CT示:脑室扩张好转,右侧丘脑、左侧岛叶病变伴出血(图 2);胸部CT示,两肺间质性肺炎下叶为著,较前(2019年6月21日)部分好转(图 3)。考虑到炎症指标升高,遂改哌拉西林他唑巴坦3.375 g/12 h静滴抗感染。此后经脑室外引流管反复留取脑脊液送检涂片及培养均阴性。术后第5天行“导航下立体定向颅内病灶活检术+双侧omaya囊置入术”,术中穿刺液呈黄色黏稠脓性,考虑脑脓肿,留取脓液送高通量测序(next-generation sequencing, NGS),并升级为美罗培南2 g/8 h联合利奈唑胺0.6 g/12 h静滴抗感染治疗。术后第7天患者突发血压升高、瞳孔不等大,昏迷程度加深;急查头颅CT示,双侧脑室钻孔引流术后改变,双侧侧脑室引流管走形区出血伴血肿形成;右侧丘脑区积液、积血,双侧脑室积血新发(图 4),甘露醇加量至250 mL/8 h联合地塞米松5 mg/6 h静滴加强脱水;当日术中脓液高通量测序结果回报:皮疽诺卡菌(序列数52 867个)、支气管戈登菌(序列数10个)。确诊脑诺卡菌病,抗菌治疗方案改为亚胺培南西司他丁0.5 g/6 h静滴,联合利奈唑胺0.6 g/12 h和复方磺胺甲恶唑片(0.48 g/片)3片/6 h口服。此后患者仍伴低热,炎症指标呈上升趋势。术后2周患者再次突发血压升高、瞳孔不等大、对光反射消失、神志深昏迷,急查头颅CT示再发脑疝(图 5),急诊行“去骨瓣减压术+脑内血肿清除术”,术后患者仍呈深昏迷状态,双侧瞳孔散大、对光反射消失,次日自动出院。
|
| 双侧脑室钻孔引流术后改变,双侧侧脑室引流管走形区出血伴血肿形成;右侧丘脑区积液、积血,双侧脑室积血新发 图 4 患者2019-10-06头颅CT结果 |
|
|
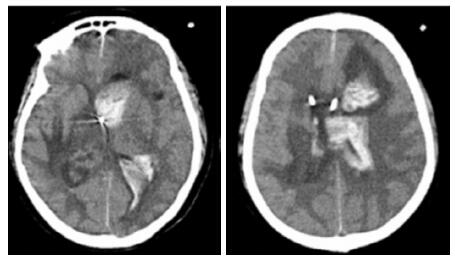
|
| 双侧侧脑室引流管走形区出血伴血肿形成;右侧丘脑区积液、积血,脑室积血;左引流管旁血肿较前(2019-10-06)增大,脑室积血增多,中线右移。左岛叶及颞叶斑块状低密度影 图 5 患者2019-10-13头颅CT平扫结果 |
|
|
诺卡菌属(Nocardia)为革兰阳性或不定的分枝杆菌,形态类似放线菌属,广泛存在于土壤、腐生物和水生环境中,是一种条件致病菌,常见于免疫抑制患者,能够引起人类局部或全身化脓性病变[1-2]。目前已知对人致病的主要有4种,分别为星型诺卡菌、巴西诺卡菌、皮疽诺卡菌(又称鼻疽诺卡菌)和豚鼠诺卡菌,其中星型诺卡菌感染最多见[3]。皮疽诺卡菌感染相对少见但相较于其他类型毒力更强[4]、更易引起播散性诺卡菌病[5],累及中枢神经系统病死率高[6]。本例患者因间质性肺炎长期口服激素及免疫抑制剂治疗,免疫功能低下,为诺卡菌感染的高危人群。以“诺卡菌”或“奴卡菌”搜索万方和CNKI数据库,近30年共检索到36例国内皮疽诺卡菌感染报道,其中只有6例累及中枢神经系统[7-12],5例表现为脑脓肿,其中3例为脓肿穿刺脓液培养阳性确诊,1例送NGS检测到病原体确诊,1例为痰培养阳性确诊(但依据不足)。
脑诺卡菌病临床表现并无特异性,可表现为头痛、局灶性神经功能缺损、意识障碍、痫性发作等,化验可表现为血白细胞、C反应蛋白、血沉等升高;影像学表现也往往无特异性,典型影像学表现为脑脓肿样病灶,中央液化区在MRI的T2像上表现为各种信号强度交替出现的“同心圆”,与组织坏死碎片的同步液化有关,也可表现为多发病灶。
目前诺卡菌的常规检测方法主要包括脓液标本培养和直接镜检,但因其生长缓慢、培养周期相对较长、标本直接涂片易与分枝杆菌和放线菌混淆等特点,总体上诊断的灵敏度不高、时效性欠佳,诊断较为困难。本例患者期间多次对脑脊液、血液等无菌体液进行培养均为阴性,涂片也未找到诺卡菌,最终依赖于术中抽吸脓液送检行NGS方得以确诊。本例在头孢呋辛、哌拉西林他唑巴坦治疗期间多次送脑脊液培养均阴性,分析可能与脑脓肿并未破溃至脑室有关,因此常规病原学检测是否能获取脓肿中的脓液是关键,本例患者术中穿刺的脓液未送培养存在不足。NGS作为新型诊断技术,相比基于培养的病原检测方法灵敏度更高,尤其对发现临床少见、培养方法复杂且非常规检测的病原体具有显著优势。本例经穿刺获取脓液行NGS检测到高序列数的皮疽诺卡菌(52 867个)得以确诊,可见可靠的微生物标本送检十分重要。在NGS报告中经常可以看到非致病性或不明确的病原体检出,本例患者NGS报告也检出低序列数的支气管戈登菌(10个),经过文献检索未见脑脓肿相关报道,故不考虑为致病病原体,可能是少量环境定植菌污染所致。
文献报道,诺卡菌对头孢曲松、阿米卡星、亚胺培南、氟喹诺酮类、米诺环素等敏感性较高,首选和甲氧苄胺嘧啶(TMP)-磺胺甲基异噁唑(SMZ)[5],用于治疗诺卡菌病的推荐治疗剂量应高于常规用量,3片/6 h或4片/8 h(0.48 g/片)为宜。对于磺胺类药物过敏或耐药患者,利奈唑胺可作为次选替代药物,也可选择与氨基糖苷类、亚胺培南、头孢曲松或氟喹诺酮类、米诺环素等联合治疗[13]。考虑到中枢神经系统感染患者血脑屏障通透性的改变,对于脑脓肿直径 > 2cm或内科治疗无效患者,建议手术切除或穿刺引流。本例患者经NGS检测确诊,缺乏药敏试验结果。考虑到皮疽诺卡菌相较于其他诺卡菌种相比耐药性更高,对磺胺类药物耐药时有报道[14-15],故经验性选择TMP-SMZ联合亚胺培南及利奈唑胺抗感染治疗,但因脑疝形成最终未能获得明显疗效。
综上所述,脑诺卡菌病临床少见,诊断困难且病死率高,合格的微生物标本送检至关重要,NGS技术的应用提高了诊断灵敏度,是常规病原学检测手段很好的补充,但也应结合临床及标本与序列数谨慎解读报告,避免误诊。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Brown-Elliott BA, Brown JM, Conville PS, et al. Clinical and laboratory features of the Nocardia spp. based on current molecular taxonomy[J]. Clin Microbiol Rev, 2006, 19(2): 259-282. DOI:10.1128/cmr.19.2.259-282.2006 |
| [2] | Wilson JW. Nocardiosis: updates and clinical overview[J]. Mayo Clin Proc, 2012, 87(4): 403-407. DOI:10.1016/j.mayocp.2011.11.016 |
| [3] | 陈晓辉, 赖丽仁, 万慧娟, 等. 肺奴卡菌病伴发脑梗死一例并文献复习[J]. 中华急诊医学杂志, 2018, 27(9): 1049-1052. DOI:10.3760/cma.j.issn.1671-0282.2018.09.021 |
| [4] | 陈玉, 杨强, 畅怡, 等. 皮疽奴卡菌肺部感染3例报道并文献复习[J]. 国际呼吸杂志, 2019, 39(10): 744-748. DOI:10.3760/cma.j.issn.1673-436X.2019.10.005 |
| [5] | Uhde KB, Pathak S, McCullum I Jr, et al. Antimicrobial-resistant nocardia isolates, United States, 1995–2004[J]. Clin Infect Dis, 2010, 51(12): 1445-1448. DOI:10.1086/657399 |
| [6] | Yorke RF, Rouah E. Nocardiosis with brain abscess due to an unusual species, Nocardia transvalensis[J]. Arch Pathol Lab Med, 2003, 127(2): 224-226. DOI:10.1043/0003-9985(2003)127<224:nwbadt>2.0.co;2 |
| [7] | 席丽艳, 鲁长明, 曾凡钦, 等. SLE并发鼻疽诺卡菌感染引起皮下及脑脓肿一例[J]. 中华皮肤科杂志, 1999, 32(5): 297-299. |
| [8] | 徐能能, 许坚. 鼻疽诺卡菌引起的肺部感染及中枢神经系统感染1例[J]. 中国感染与化疗杂志, 2018, 18(6): 649-651. DOI:10.16718/j.1009-7708.2018.06.016 |
| [9] | 程振娜, 周晓燕, 李刚, 等. 鼻疽诺卡菌引起的脑脓肿一例报道并文献复习[J]. 中华神经医学杂志, 2018, 17(3): 312-314. DOI:10.3760/cma.j.issn.1671-8925.2018.03.018 |
| [10] | 王育英, 曹敬荣, 张丽丽, 等.肺鼻疽奴卡菌病并发多发脑脓肿的病原学鉴定与临床分析[J/CD].中华实验和临床感染病杂志(电子版), 2016, 10(5): 639-642. DOI: 10.3877/cma.j.issn.1674-1358.2016.05.029. |
| [11] | 吴小燕, 于学燕, 谢毅, 等. 肺泡蛋白沉积症合并鼻疽奴卡菌脑脓肿1例[J]. 疑难病杂志, 2019, 18(6): 622-624. DOI:10.3969/j.issn.1671-6450.2019.06.019 |
| [12] | 刘逸凡, 张宁, 唐妮娜, 等. 中枢神经系统奴卡菌感染诊治分析附一例鼻疽奴卡菌脑脓肿[J]. 现代生物医学进展, 2016, 16(33): 6452-6455, 6480. DOI:10.13241/j.cnki.pmb.2016.33.013 |
| [13] | Hashemi-Shahraki A, Heidarieh P, Bostanabad SZ, et al. Genetic diversity and antimicrobial susceptibility of Nocardia species among patients with nocardiosis[J]. Sci Rep, 2015, 5: 17862. DOI:10.1038/srep17862 |
| [14] | Tremblay J, Thibert L, Alarie I, et al. Nocardiosis in Quebec, Canada, 1988–2008[J]. Clin Microbiol Infect, 2011, 17(5): 690-696. DOI:10.1111/j.1469-0691.2010.03306.x |
| [15] | Hansen G, Swanzy S, Gupta R, et al. In vitro activity of fluoroquinolones against clinical isolates of Nocardia identified by partial 16S rRNA sequencing[J]. Eur J Clin Microbiol Infect Dis, 2008, 27(2): 115-120. DOI:10.1007/s10096-007-0413-2 |
 2020, Vol. 29
2020, Vol. 29




