2 苏州大学附属第二医院急重症医学科 215004
2 Department of Emergency and Critical Care Medicine, the Second Affiliated Hospital of Soochow University, Suzhou 215004, China
脓毒症是一种全身性炎症反应综合征,是由于宿主无法对感染进行局部限制而引起的。多型核中性粒细胞(polymorphonuclear neutrophils,PMNs)是机体宿主防御的主要屏障,在脓毒症发病过程中起着重要角色。为了成功清除病原体并防止它们扩散到体循环中,PMNs被募集至感染部位吞噬侵入的病原体。另外,炎症介质与微生物终产物的协同作用可诱导PMNs活化, PMNs释放与颗粒抗菌肽和酶相关的染色质纤维网络,如DNA、髓过氧化物酶(MPO)、弹性蛋白酶和组织蛋白酶G等,称为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。Brill等[1]在深静脉血栓形成的动物模型中证实了NETs的存在,并认为NETs在脓毒症相关血管病变中的作用是基于血小板的聚集和活化。Kambas等[2]研究了脓毒症过程NETs中的组织因子(tissue factor,TF)在诱导凝血和血栓形成中所起的作用,然而调控NETs在脓毒症血栓形成中的作用机制和途径仍不明了。
干扰素长期以来被用于炎症、代谢和癌症的机制研究。研究表明干扰素-λ1(interferon-λ1, IFN-λ1)在免疫调节和辅助性T细胞分化中具有多效性[3],在不影响宿主适应性的情况下构成抗病毒防御的前线[4]。然而,IFN-λ在中性粒细胞功能的其他炎性方面,如NETs释放中的作用罕有探讨。本研究假设脓毒症血清来源的C5a补体活化导致TF表达的NETs的释放是脓毒症血栓形成的机制之一,白介素29(interleukin 29,IL-29)对NETs的释放具有负调控作用,并抑制了NETs相关的凝血酶的生成,以进一步探讨免疫机制在脓毒症血栓形成中的调节作用。
1 资料与方法 1.1 一般资料收集12例健康志愿者和12例脓毒症患者的外周血样,分别来自2018年5月至2019年6月苏州大学附属第二医院门诊和住院者,每个志愿者或患者及其亲属签署知情同意书,并得到医院伦理委员会的批准(批准号:JD-LK-2019-102-01)。脓毒症患者符合2016年美国重症医学会和欧洲重症医学会联合发布脓毒症3.0定义及诊断标准,血培养鉴定出革兰阴性菌为必备条件,D-二聚体含量 > 0.5 mg/L,CT肺血管造影、彩色多普勒超声检查显示血栓存在。
1.2 实验试剂RIPA裂解液、BCA蛋白试剂购自碧云天;重组IL‐29购自R & D公司;凝血酶-抗凝血酶(TAT)ELISA试剂盒购自Assaypro公司;4’,6-二脒基-2-苯吲哚(DAPI),碘化丙啶(PI)购自Sigma公司;人源化抗CD88抗体、小鼠抗人TF单克隆抗体,兔抗人GAPDH多克隆抗体,HRP标记的驴抗小鼠、山羊抗兔多克隆抗体,IgG1抗CD19单克隆抗体,羊抗小鼠的Alexa Fluor 488抗体,均来自Abcam公司。
1.3 实验方法 1.3.1 分离PMNs分离来自健康志愿者的肝素化静脉血中分离PMNs。根据产品说明,使用多型核分离试剂通过密度梯度离心分离PMNs,并用红细胞裂解缓冲液裂解红细胞。Giemsa染色评估嗜中性粒细胞纯度 > 98%,在不含Ca2+ / Mg2+离子的Hanks平衡盐溶液中洗涤PMNs,调节细胞数量至2×106个细胞/mL, 然后将其悬浮在RPMI 1640培养基中。
1.3.2 刺激和抑制PMNs以每孔1.5×106个细胞/mL浓度接种于6孔培养板中,根据需要预先置入多聚赖氨酸处理的无菌玻片,PMNs在37℃(5%CO2)的RPMI培养基中与来自健康对照组血清或脓毒症患者的血清一起培养3 h,终浓度为6%。据以往研究报道,6%为刺激PMNs和避免NETs降解的最佳浓度,并且PMNs释放NETs的最佳时间为3 h[5],与本实验结果基本一致(资料未显示)。为了研究IL-29是否可以作为NETs释放的有效抑制剂,重组IL-29 (50 ng/mL)预处理PMNs 30 min。为了研究C5a在脓毒症患者血清中的可能作用,首先在冰上用C5a受体阻断剂抗CD88抗体(1:50稀释)预处理细胞30 min。本研究中使用的所有试剂均不含内毒素。
1.3.3 NETs的免疫荧光染色固定和破膜:从6孔板中取出细胞爬片,用4%多聚甲醛(PFA)4 ℃过夜固定细胞。依次用磷酸盐缓冲液(PBS)洗涤,用含0.5% Triton X-100的PBS透膜。
样品染色:利用小鼠抗TF单克隆抗体(1:200稀释)进行样品染色,IgG1抗CD19单克隆抗体(1:200稀释液)作为同种型对照,多克隆羊抗小鼠的Alexa Fluor 488抗体(1:1 000)作为第二抗体,4’,6-二氨基-2-苯吲哚(DAPI,1:2 000)对DNA进行了复染,激光共聚焦显微镜成像,通过在双盲实验过程中检测200个细胞来确定NETS释放细胞的百分比。
1.3.4 蛋白质印迹PMNs通过在冰上重悬浮于RIPA缓冲液中1 h以裂解细胞。4℃下14 000 r/min离心10 min除去碎片后,用BCA蛋白质测定试剂盒(Pierce)测量蛋白质浓度。将蛋白质(每泳道约含80 μg蛋白质)在2×SDS上样缓冲液中1:1稀释,在100℃加热5 min,在变性条件下用12%SDS-PAGE分离样品,并转移至0.45 μm硝酸纤维素膜。将膜在含3%脱脂乳的Tris-HCl吐温缓冲液(TBST)溶液中封闭2 h,然后与以下一抗孵育:小鼠抗人TF mAb(1:1 000稀释),兔抗人GAPDH多克隆抗体(1:4 000稀释),在4℃温育过夜。用TBST彻底洗涤后,然后与HRP连接的完整驴抗小鼠(1:4 000稀释)或羊抗兔多克隆抗体(1:4 000稀释)分别在室温下孵育1.5 h。使用ECL检测系统检测免疫反应性蛋白质并暴露于X线胶片,凝胶成像分析仪进行吸光度扫描,采用Image J软件对图像条带作半定量分析,将TF蛋白与内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH)的比值作为各自的相对表达量。
1.3.5 酶联免疫吸附测定凝血酶-抗凝血酶(TAT)复合物浓度将1.5×106体外刺激的PMNs在37℃(5%vs)的RPMI培养基中接种于6孔培养板中,3 h后用RPMI培养基洗涤细胞两次。为了分离NETs结构,向每个孔中加入1 mL RPMI,并在剧烈搅拌后将培养基液体以1 300 r/min离心5 min收集NETs结构。将分离的NETs上清液与健康志愿者血浆以1:4的比例混合,并在37℃下孵育30 min,用TAT ELISA试剂盒测量TAT复合物水平,最低检测水平为300 pg/mL。
1.3.6 循环DNA定量将上述分离的NETs上清液在PBS中稀释1:10(v/v)。稀释后的液体与50 μL体积1 μg/mL浓度的碘化丙啶(PI)混合,PI用于标记循环DNA,荧光分析仪上536 nm激发的617 nm发射的荧光信号被记录。根据DNA标准曲线(0.1~8 μg/mL范围)计算DNA浓度,并用PBS与1 μg/mL PI混合测定自发荧光。
1.4 统计学方法采用SPSS 13.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
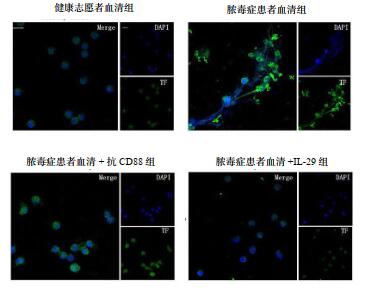
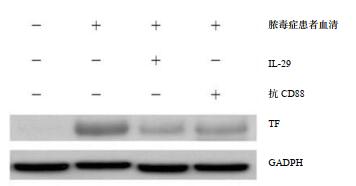
2 结果 2.1 脓毒症患者血清C5a诱导健康志愿者PMNs上TF的累积和表达TF的NETs释放TF是凝血级联反应的关键因子。为了测试源自脓毒症血清的诱导因子C5a对表达TF的NETs形成的影响,本研究采用脓毒症患者血清刺激健康志愿者PMNs,通过免疫荧光技术共聚焦显微镜双盲观察200个细胞,以TF和DAPI阳性表达为NETs释放细胞。结果显示,与健康志愿者血清孵育的PMNs释放NETs水平(4.4±2.6)%相比,表达TF的NETs释放细胞明显增多(20.5±3.7)%(q=11.34,P < 0.01)。同时通过免疫印迹对PMNs释放的NETs中TF的表达进行定位,与健康志愿者血清孵育的PMNs上TF相对表达水平(0.38±0.04)%相比,脓毒症血清C5a诱导的PMNs上TF相对表达水平明显增多(0.81±0.03)%,差异有统计学意义(q=4.81,P < 0.01)。本研究进一步评估了C5a在实验模型中的作用,将C5a受体(CD88)用抗CD88抗体阻断,在冰上处理PMNs 30 min,然后与来自脓毒症患者的血清一起孵育,与未经阻断脓毒症血清C5a诱导的PMNs上TF表达的NETs释放水平相比,阻断C5a受体后导致PMNs释放TF表达的NETs显著减少(7.3±3.1)%(q=8.73,P < 0.01)。与未阻断脓毒症血清C5a诱导的PMNs上TF相对表达水平相比,阻断后TF相对表达水平显著降低(0.57±0.02)%,(q=3.21,P < 0.05)。循环核小体和PMNs活化与深静脉血栓形成(deep venous thrombosis,DVT)之间有一定的相关性,血清中DNA含量可作为体内NETs形成的间接标志物[6],本研究发现脓毒症患者血清C5a诱导的PMNs上清液中循环DNA含量显著升高(3.40±1.11)μg/mL,用健康志愿者血清刺激的PMNs上清液中未出现上升迹象(0.42±0.17)μg/mL,两者差异有统计学意义(q=14.56,P < 0.01)。当用C5a受体阻滞剂抗CD88抗体阻断后,脓毒症患者血清C5a诱导的PMNs上循环DNA含量明显下降(0.64±0.25)μg/mL(q=12.85,P < 0.01),见表 1和图 1~2。
| 组别 | 例数 | 免疫荧光法 | 荧光光谱法 | 免疫印迹法 | 酶联免疫法 | |||
| NETs释放细胞(%) | 循环DNA(μg/mL) | TF相对表达(%) | TAT复合物(ng/mL) | |||||
| 健康志愿者血清组 | 12 | 4.4±2.6 | 0.42±0.17 | 0.38±0.04 | 3.2±0.9 | |||
| 脓毒症患者血清组 | 12 | 20.5±3.7a | 3.40±1.11c | 0.81±0.03e | 7.8±0.7g | |||
| 脓毒症患者血清+IL-29组 | 12 | 5.0±1.5b | 0.44±0.19d | 0.52±0.03f | 3.3±0.4h | |||
| 脓毒症患者血清+抗CD88组 | 12 | 7.3±3.1b | 0.64±0.25d | 0.57±0.02f | 4.6±0.7h | |||
| F值 | 133.39 | 103.92 | 117.66 | 106.46 | ||||
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | ||||
| 注:与健康志愿者血清组同类方法NETs释放细胞表达水平比较,aP < 0.01;与脓毒症患者血清组同类方法NETs释放细胞表达水平比较,bP < 0.01;与健康志愿者血清组同类方法循环DNA表达水平比较,cP < 0.01;与脓毒症患者血清组同类方法循环DNA表达水平比较,dP < 0.01;与健康志愿者血清组同类方法TF相对表达水平比较,eP < 0.01;与脓毒症患者血清组同类方法TF相对表达水平比较,fP < 0.05;与健康志愿者血清组同类方法TAT复合物表达水平比较,gP < 0.01;与脓毒症患者血清组同类方法TAT复合物表达水平比较,hP < 0.01 | ||||||||
|
| TF(绿色)和DAPI标记DNA(蓝色),原始放大倍数600倍,标尺:5μm 图 1 共聚焦显微镜分析脓毒症患者血清C5a诱导的PMNs上TF表达的NETs释放 Fig 1 Detection of the release of NETs expressed by TF on PMNs of healthy volunteers induced by serum-derived C5a of sepsis patients under confocal microscopy |
|
|
|
| 图 2 免疫印迹分析抗CD88抗体、IL-29对脓毒症患者血清C5a处理的PMNs上TF表达作用 Fig 2 Western blot analysis of the effects of anti-CD88 antibodies and IL-29 on TF expression from PMNs of healthy volunteers after stimulation with serum-derived C5a of sepsis patients |
|
|
在脓毒症血栓形成炎症环境中血清C5a诱导PMNs上出现TF的细胞内累积和NETs的释放,IL-29作为细胞因子具有一定的免疫调节作用,因此研究IL-29是否有抑制NETs形成作用的能力。结果表明,与未经IL-29处理的脓毒症血清C5a诱导PMNs上TF相对表达水平相比,用IL-29预处理的PMNs细胞内TF相对表达的显著减少(0.52±0.03)%(q=3.44,P < 0.05)。并且IL-29预处理消除了由脓毒症血清C5a诱导的PMNs上表达TF的NETS形成,免疫荧光表达NETs释放水平明显降低(5.0±1.5)%,与脓毒症血清C5a诱导的PMNs上表达TF的NETs释放水平相比(20.5±3.7)%,差异有统计学意义(q=9.23,P < 0.01)。同时,与未经IL-29处理的脓毒症血清C5a诱导PMNs上清液中循环DNA表达水平相比(3.40±1.11)μg/mL,IL-29预处理也降低了在分离的NETs结构上清液中循环DNA的水平(0.44±0.19)μg/mL(q=11.24,P < 0.01),见表 1和图 1~2。
2.3 IL-29抑制血栓形成的脓毒症患者血清C5a诱导的PMNs上NETs相关的凝血酶生成为研究脓毒症患者血清C5a对通过源自PMNs释放的NETs是否能诱导凝血酶产生的能力,且NETs依赖性凝血酶生成是否由脓毒症血清的特定组分诱导,本研究进行了凝血酶生成测定,通过检测脓毒症患者血清C5a诱导的PMNs的上清液中TAT复合物生成能力加以确认。结果显示,用脓毒症患者血清C5a诱导的PMNs上清液中TAT复合物水平显著升高(7.8±0.7)ng/mL,当与抗CD88抗体预孵育阻断PMNs上C5a受体,降低了上清液中TAT复合物水平(4.6±0.7)ng/mL,差异有统计学意义(q=5.27,P < 0.01)。之前结果显示,IL-29既可作为PMNs表达TF的调节剂,又可作为NETs的抑制剂,因此,本研究测试IL-29对NETs相关的凝血酶形成活性的影响,发现与未经IL-29处理的脓毒症血清C5a诱导的PMNs上清液中的TAT复合物水平相比,IL-29的处理减弱由脓毒症血清C5a刺激的PMNs上NETs相关的凝血酶形成信号,TAT复合物表达水平为(3.3±0.4)ng/mL,差异有统计学意义(q=6.77,P < 0.01)。以上结果提示,补体C5a对NETs相关的凝血酶生成具有重要的作用,但其可被免疫细胞因子IL-29和C5a受体阻滞剂所消除,见表 1。
3 讨论近年来,免疫调节、炎症反应、血栓形成之间潜在的相互作用一直是研究的热点和探讨的方向,补体和PMNs是先天免疫和急性炎症的关键组成部分,在脓毒症炎症过程中,C5a通过外周补体的激活而过量产生,PMNs被C5a激活发挥免疫防御作用,除了能够吞噬消灭病原体、脱颗粒释放抗菌物质外,PMNs也能通过一种由颗粒蛋白和DNA构成的NETs来捕获病原体。前期研究表明,补体过敏毒素C5a上调了急性呼吸窘迫综合征患者肺泡内中性粒细胞上TF的表达[7],C5a又可促进血液透析患者相关血栓形成[8],对抗磷脂综合征(antiphospholipid syndrome,APS)患者血栓形成的中纤维蛋白凝块成分研究发现,凝块中含有包括血液凝固成分之外的一些NETs形成相关蛋白的存在,如髓过氧化物酶(myeloperoxidase,MPO),组蛋白等[9],表明NETs可能参与血栓形成并影响其性质,这些研究也暗示了C5a、NETs、血栓形成三者之间存在着某种关联。本研究显示,用脓毒症患者血清C5a刺激健康志愿者PMNs,导致PMNs细胞内TF的累积,携带TF表达的NETs释放增多,及其相关的TAT复合物水平的升高,表明补体C5a诱导的PMNs上表达TF的NETs释放可激活随后的凝血级联反应并产生凝血酶。在用C5a受体拮抗剂抗CD88单抗处理后,导致NETs释放的减少和NETs相关凝血酶生成的降低,说明了C5a和NETs在脓毒症患者血栓形成机制中的可能作用,以及它们作为新治疗靶标的潜在用途。
一些针对NETs形成的抗血栓治疗策略已成功应用于小鼠模型中,例如用肽酰基精氨酸脱亚氨酶(PAD4)抑制剂、NETs分解剂、DNase酶等药物来靶向治疗NETosis——一种中性粒细胞特殊的死亡程序[10]。但是这些NETs抑制剂具有一定的局限性,已有文献报道这些靶向药物在抗血栓治疗中有出血风险,因而寻求新型、安全的NETs抑制剂刻不容缓。之前有研究表明IL-29通过抑制中性粒细胞浸润和IL-1β的产生以发挥抗炎作用[11],而且,IL-29基本不影响正常的止血功能[12],本研究探讨了IL-29通过调节中性粒细胞信号通路以减少血栓形成的炎症。本研究结果表明,IL-29抑制了血清C5a诱导的PMNs上TF的累积和NETs的释放,以及NETs相关的凝血酶的生成。以上结果证明,在血栓形成的脓毒症炎症环境中,IL-29对PMNs调节起着重要作用,同时它作为抗凝血能力的调节因子,用于治疗NETs相关的血栓形成,可以实现很好的抗血栓效果。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Brill A, Fuchs TA, Savchenko AS, et al. Neutrophil extracellular traps promote deep vein thrombosis in mice[J]. J Thromb Haemost, 2012, 10(1): 136-144. DOI:10.1111/j.1538-7836.2011.04544.x |
| [2] | Kambas K, Mitroulis I, Apostolidou E, et al. Autophagy mediates the delivery of thrombogenic tissue factor to neutrophil extracellular traps in human sepsis[J]. PLoS One, 2012, 7(9): e45427. DOI:10.1371/journal.pone.0045427 |
| [3] | Koltsida O, Hausding M, Stavropoulos A, et al. IL-28A (IFN-λ2) modulates lung DC function to promote Th1 immune skewing and suppress allergic airway disease[J]. EMBO Mol Med, 2011, 3(6): 348-361. DOI:10.1002/emmm.201100142 |
| [4] | Galani IE, Triantafyllia V, Eleminiadou EE, et al. Interferon-λ mediates non-redundant front-line antiviral protection against influenza virus infection without compromising host fitness[J]. Immunity, 2017, 46(5): 875-890. DOI:10.1016/j.immuni.2017.04.025 |
| [5] | Kambas K, Chrysanthopoulou A, Vassilopoulos D, et al. Tissue factor expression in neutrophil extracellular traps and neutrophil derived microparticles in antineutrophil cytoplasmic antibody associated vasculitis may promote thrombo inflammation and the thrombophilic state associated with the disease[J]. Ann Rheum Dis, 2014, 73(10): 1854-1863. DOI:10.1136/annrheumdis-2013-203430 |
| [6] | van Montfoort ML, Stephan F, Lauw MN, et al. Circulating nucleosomes and neutrophil activation as risk factors for deep vein thrombosis[J]. Arterioscler Thromb Vasc Biol, 2013, 33(1): 147-151. DOI:10.1161/atvbaha.112.300498 |
| [7] | Kambas K, Markiewski MM, Pneumatikos IA, et al. C5a and TNF-α up-regulate the expression of tissue factor in intra-alveolar neutrophils of patients with the acute respiratory distress syndrome[J]. J Immunol, 2008, 180(11): 7368-7375. DOI:10.4049/jimmunol.180.11.7368 |
| [8] | Kourtzelis I, Markiewski MM, Doumas M, et al. Complement anaphylatoxin C5a contributes to hemodialysis-associated thrombosis[J]. Blood, 2010, 116(4): 631-639. DOI:10.1182/blood-2010-01-264051 |
| [9] | Stachowicz A, Zabczyk M, Natorska J, et al. Differences in plasma fibrin clot composition in patients with thrombotic antiphospholipid syndrome compared with venous thromboembolism[J]. Sci Rep, 2018, 8: 17301. DOI:10.1038/s41598-018-35034-x |
| [10] | Swystun LL, Liaw PC. The role of leukocytes in thrombosis[J]. Blood, 2016, 128(6): 753-762. DOI:10.1182/blood-2016-05-718114 |
| [11] | Blazek K, Eames HL, Weiss M, et al. IFN-λ resolves inflammation via suppression of neutrophil infiltration and IL-1β production[J]. J Exp Med, 2015, 212(6): 845-853. DOI:10.1084/jem.20140995 |
| [12] | Muir AJ, Shiffman ML, Zaman A, et al. Phase 1b study of pegylated interferon lambda 1 with or without ribavirin in patients with chronic genotype 1 hepatitis C virus infection[J]. Hepatology, 2010, 52(3): 822-832. DOI:10.1002/hep.23743 |
 2020, Vol. 29
2020, Vol. 29




