2 浙江省湖州市中心医院ICU 313000
脓毒症是一种常见的临床急危重症,其特点是感染引起的全身炎症反应、免疫紊乱、高代谢状态及器官功能损伤[1],发病后由于毛细血管渗漏增加、白蛋白合成减少、丢失增多等原因,导致低白蛋白血症的出现[2-3]。目前认为血清白蛋白浓度 < 30 g/L,可以诊断为低白蛋白血症。脓毒症患者低白蛋白血症发生率30%~50%[4],一项Meta分析发现重症患者白蛋白水平每下降10 g/L,病死率增加87%,住院天数增加71%[5],血清白蛋白浓度下降是脓毒症及脓毒性休克患者预后不良的独立预测因素[6]。临床上除使用白蛋白作为胶体液在急性期进行液体复苏外(急性期液体复苏的终点选择乳酸水平正常或乳酸清除率达到30%以上[7]),还会使用白蛋白纠正脓毒症患者的低白蛋白血症,即白蛋白替代治疗。在脓毒症及脓毒性休克液体复苏后期存在组织间隙液体过负荷,补充外源性白蛋白能提高血浆胶体渗透压,加快组织间隙液体回流入毛细血管,减轻组织水肿[8]。此外,补充白蛋白纠正低蛋白血症,能够发挥维持药物、胆红素等物质的正常运输以及内环境稳定的作用。目前针对白蛋白替代治疗纠正低白蛋白血症是否有利于改善脓毒症患者预后尚不清楚。本研究旨在明确白蛋白替代治疗纠正脓毒症患者低白蛋白血症对预后的影响。
1 资料与方法 1.1 一般资料回顾性纳入2016年1月至2018年11月所有因脓毒症收治入浙江大学医学院附属邵逸夫医院ICU的患者电子病例信息(n=266)。纳入标准:ICU住院期间存在低白蛋白血症(白蛋白 < 30 g/L);排除标准:合并肝硬化、肝脏恶性肿瘤及慢性肾脏疾病。使用医院内电子信息系统以及重症监护系统,收集记录患者入ICU时的基本信息、APACHE Ⅱ评分、SOFA评分、实验室指标等。本研究经医院伦理委员会审核批准(编号:20200129-32)。
1.2 分组方法本研究中,20%白蛋白用于替代治疗纠正低白蛋白血症(有别于5%白蛋白作为胶体液用于急性期液体复苏)。临床上自患者出现低白蛋白血症后开始使用白蛋白替代治疗,低白蛋白血症纠正后(血清白蛋白≥30 g/L)停止补充白蛋白。从电子病例系统中统计患者ICU期间使用的20%白蛋白总量,根据白蛋白总量将患者分为两组:低剂量组(< 200 g)和高剂量组(≥200 g)(真实临床事件中对于低白蛋白血症,医生均会酌情进行替代治疗,因而本研究纳入的患者仅有少数未补充白蛋白,分组时无法分为对照组与治疗组)。
1.3 研究内容鉴于两组患者病情严重度差别较大,通过倾向性评分匹配(年龄,性别,体质量指数,APACHEⅡ评分,SOFA评分,高血压病,糖尿病,入院血清白蛋白水平)筛选病情匹配、入院白蛋白水平相近的患者,然后比较两组患者补充白蛋白后及出ICU时血清白蛋白水平,以及两组患者住院期间ICU病死率、ICU天数、新发器官功能障碍的差异。
1.4 统计学方法使用SPSS 22.0软件及Graphpad Prism 6.0软件进行统计分析。计数资料用频数(百分比)表示,使用卡方检验进行比较;计量资料符合正态分布者用均数±标准差(Mean±SD)表示,使用独立样本t检验进行比较;计量资料不符合正态分布者用中位数(四分位数)[M(QL, QU)]表示,使用Mann-Whitney U检验进行比较。选用PSM模块根据Logstic回归计算的倾向值按1:1最近邻匹配法进行倾向性评分匹配。以P < 0.05为差异有统计学意义。
2 结果 2.1 基线资料最终纳入135例患者,其中低剂量组71例,ICU住院期间白蛋白替代治疗量均数为106.9 g;高剂量组64例,白蛋白替代治疗量均数为531.3 g(P < 0.01)。两组患者基线资料比较见表 1,两组患者APACHEⅡ评分、高血压病患病率、糖尿病患病率分布不均衡,差异有统计学意义(P < 0.05)。
| 指标 | 低剂量组 (n=71) |
高剂量组 (n=64) |
统计值 | P值 |
| 年龄(岁)a | 65.0 (54.0, 79.0) | 68.0 (60.0, 79.0) | 1.241 | 0.239 |
| 男性(例,%) | 40(56.3) | 44(68.8) | 2.206 | 0.137 |
| 体质量指数(kg/m2)a | 22.3 (19.5, 24.5) | 21.9 (19.6, 24.5) | 0.155 | 0.935 |
| APACHEⅡ评分a | 23.0 (18.0, 31.0) | 27.5 (24.0, 33.0) | 1.609 | 0.024 |
| SOFA评分a | 6.0 (9.0, 11.0) | 10.0 (7.0, 12.0) | 0.952 | 0.256 |
| 高血压病(例,%) | 20(28.2) | 32(50.0) | 6.774 | 0.009 |
| 糖尿病(例,%) | 11(15.5) | 19(29.7) | 3.924 | 0.048 |
| 白蛋白(g/L)a | 26.1 (23.2, 29.6) | 25.2 (22.0, 27.9) | 1.573 | 0.158 |
| 注:a为M(QL, QU) | ||||
为降低混杂偏倚,以低剂量组为基准进行倾向性评分匹配,共44对匹配成功。匹配后,APACHEⅡ评分、高血压病、糖尿病患病率在两组间分布平衡,差异均无统计学意义(表 2)。此外,两组患者感染来源、入院生命体征及实验室检查结果差异无统计学意义,提示经匹配后两组患者的入ICU病情严重程度、炎症反应、肝脏功能(谷丙转氨酶、谷草转氨酶、总胆红素、凝血酶原时间)组间具有可比性。
| 指标 | 低剂量组 (n=44) |
高剂量组 (n=44) |
统计值 | P值 |
| 年龄(岁)a | 65.0 (53.5, 78.5) | 65.5 (56.3, 78.5) | 0.338 | 0.773 |
| 男性(例,%) | 26(59.1) | 28(63.6) | 0.192 | 0.661 |
| APACHEⅡ评分a | 25.5 (21.0, 34.8) | 27.5 (24.0, 32.3) | 1.353 | 0.894 |
| SOFA评分a | 10.0 (6.0, 12.8) | 10.0 (7.3, 12.8) | 0.383 | 0.424 |
| 体质量指数(kg/m2)a | 22.7 (19.5, 24.6) | 21.0 (18.7, 23.8) | 0.346 | 0.178 |
| 高血压(例,%) | 17(38.6) | 17(38.6) | 0.000 | 1.000 |
| 糖尿病(例,%) | 10(22.7) | 11(25.0) | 0.063 | 0.803 |
| 吸烟(例,%) | 6(13.6) | 6(13.6) | 0.000 | 1.000 |
| 饮酒(例,%) | 10(22.7) | 7(15.9) | 1.013 | 0.418 |
| 感染来源(例,%) | 6.202 | 0.185 | ||
| 腹部感染 | 21(47.7) | 28(63.6) | ||
| 呼吸系统 | 7(15.9) | 7(15.9) | ||
| 泌尿系统 | 5(11.4) | 4(9.1) | ||
| 血源性 | 5(11.4) | 0(0) | ||
| 其他 | 6(13.6) | 5(11.4) | ||
| 入院生命体征 | ||||
| 呼吸(次/min)a | 25.0 (20.2, 31.0) | 23.5 (17.3, 30.8) | 0.863 | 0.289 |
| 心率(次/min)a | 114.5 (94.0, 142.3) | 117.0 (99.3, 132.8) | 0.011 | 0.877 |
| 平均动脉压(mmHg)a | 67.0 (56.3, 82.8) | 67.0 (62.3, 81.0) | 0.263 | 0.894 |
| 体温(℃)a | 37.3 (36.0, 38.6) | 37.0 (35.4, 38.4) | 0.998 | 0.343 |
| 实验室检查 | ||||
| C反应蛋白(mg/L)a | 107.7 (41.3, 219.2) | 154.6 (107.6, 234.6) | 1.674 | 0.058 |
| 降钙素原(ng/mL)a | 12.5 (3.1, 40.8) | 20.1 (5.2, 80.5) | 1.638 | 0.222 |
| 白细胞计数(×109)a | 9.9 (3.5, 16.8) | 13.6 (6.1, 21.4) | 1.189 | 0.112 |
| 乳酸(mmol/L)a | 3.2 (2.0, 5.6) | 3.3 (1.7, 7.3) | 1.037 | 0.428 |
| 凝血酶原时间(s)a | 17.5 (16.1, 22.7) | 18.1 (16.8, 20.0) | 0.996 | 0.900 |
| 血红蛋白(g/L)a | 98.0 (74.0, 110.8) | 94.0 (78.3, 112.5) | 0.246 | 0.967 |
| 谷丙转氨酶(U/L)a | 52.0 (36.2, 73.0) | 63.2 (45.1, 80.2) | 1.724 | 0.564 |
| 谷草转氨酶(U/L)a | 48.3 (29.1, 66.9) | 47.5 (23.9, 77.4) | 0.839 | 0.237 |
| 总胆红素(μmmol/L)a | 25.0 (13.6, 48.3) | 28.3 (12.4, 68.2) | 1.500 | 0.628 |
| 注:a为M(QL, QU);1 mmHg=0.133 kPa | ||||
两组患者入院时血清白蛋白水平(g/L)差异无统计学意义(低剂量组vs高剂量组:24.1±3.0 vs 23.6±3.2,P=0.477)。ICU住院期间低剂量组平均补充白蛋白121.7 g,高剂量组平均补充白蛋白486.7 g(P < 0.01)。补充白蛋白后两组白蛋白水平均显著升高,高剂量组白蛋白水平(g/L)更高(低剂量组vs高剂量组:30.4±5.3 vs 33.8±5.3,P=0.003),出ICU时两组患者白蛋白水平(g/L)差异无统计学意义(低剂量组vs高剂量组:31.9±6.1 vs 33.1±6.2,P=0.388)(图 1)。
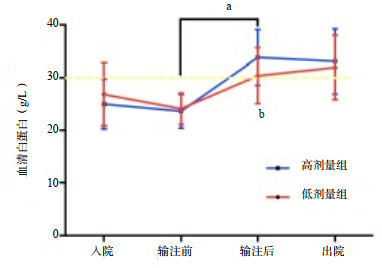
|
| aP < 0.05(治疗前vs治疗后); bP < 0.05(低剂量组vs高剂量组) 图 1 入ICU后血清白蛋白变化曲线图 |
|
|
如表 3所示,比较两组患者入ICU后新发器官功能障碍,发现两组呼吸衰竭、急性肝损伤新发率差异无统计学意义(P > 0.05),但高剂量组新发急性肾损伤比例显著低于低剂量组(22.7% vs 33.6%, P=0.040),连续肾脏替代治疗比例显著低于低剂量组(25.1% vs 45.0%,P=0.032)。高剂量组患者ICU病死率(29.5%)略低于低剂量组(47.7%),但差异无统计学意义(P=0.080),高剂量组患者ICU天数及住院天数显著低于低剂量组(P < 0.01),医疗费用两组差异无统计学意义(P=0.054)。
| 指标 | 低剂量组 (n=44) |
高剂量组 (n=44) |
统计值 | P值 |
| 新发器官功能障碍(例,%) | ||||
| 呼吸衰竭 | 10(22.7) | 11(25.7) | 0.604 | 0.440 |
| 急性肾损伤 | 15(33.6) | 10(22.7) | 5.238 | 0.040 |
| 急性肝损伤 | 5(11.3) | 6(12.9) | 1.640 | 0.567 |
| 住院接受的治疗(例,%) | ||||
| 连续肾脏替代治疗 | 20(45.0) | 11(25.1) | 6.600 | 0.032 |
| 机械通气 | 30(69.3) | 32(72.4) | 7.311 | 0.442 |
| 病死率(例,%) | 21(47.7) | 13(29.5) | 3.068 | 0.080 |
| ICU天数a | 18.0 (9.3, 27.8) | 10.0 (8.0, 12.8) | 7.560 | < 0.01 |
| 住院天数a | 27.0 (18.0, 48.5) | 16.0 (6.3, 26.5) | 3.251 | 0.001 |
| 住院费用(元)a | 74 199 (48 118, 111 735) | 71 377 (102 498, 302 248) | 5.165 | 0.054 |
| 注:a为M(QL, QU) | ||||
低白蛋白血症对脓毒症患者有诸多不良影响,包括胶体渗透压下降导致有效循环血量不足、结合与运输物质能力下降、抗氧化作用减弱、凝血功能紊乱等[4]。临床实践中,白蛋白替代治疗常用于纠正患者低白蛋白血症,维持物质运输能力及内环境稳态等[4]。本研究中使用20%白蛋白进行替代治疗,统计患者ICU期间使用的20%白蛋白总量,评估白蛋白替代治疗是否有利于改善患者预后。本研究发现,患者开始白蛋白替代治疗时白蛋白水平低于入ICU白蛋白水平,提示患者合成代谢减退,白蛋白代谢紊乱,消耗大于合成,外源性补充白蛋白可以有效改善低白蛋白血症。
近年来大部分临床研究关注白蛋白用于脓毒症患者早期液体复苏的效果,几项RCT研究显示白蛋白用于脓毒症患者液体复苏并不能改善预后[9-11],但是目前关于白蛋白替代治疗对合并低白蛋白血症的脓毒症患者预后影响的研究较少。Sort等[12]发现,白蛋白联合头孢噻肟治疗肝硬化并发自发性腹膜炎患者,替代治疗组肾脏损伤发生率减少(P=0.002),住院及3个月病死率均显著下降(P=0.01)。近期一项关于肝硬化合并感染患者的RCT研究发现,白蛋白替代治疗可显著改善患者预后[13]。一项纳入16个RCT的Meta分析发现白蛋白替代治疗可显著降低肝硬化患者病死率(OR=0.46;95%CI:0.25~0.86)及肾脏损伤发生率(OR=0.34;95%CI:0.15~0.75)[14]。一项前瞻性研究比较低剂量(1 g/kg)及高剂量(1.5 g/kg)白蛋白替代治疗在失代偿性肝硬化患者的治疗作用,结果发现高剂量治疗组患者血清IL-6、IL-1等细胞因子水平降低[15]。
本研究发现高剂量白蛋白替代治疗可显著降低新发急性肾损伤比例,减少CRRT使用并缩短ICU及住院时间。脓毒症发病后机体交感神经、肾素-血管紧张素-醛固酮系统激活,肾脏血流动力学发生改变,肾脏血流量和肾小球滤过率下降;此外在内毒素等毒性物质的作用下,全身炎症反应广泛激活、大量内源性炎症介质及自由基释放,造成肾脏损伤[16]。本研究中白蛋白高剂量组新发急性肾损伤比例显著低于低剂量组,这可能与白蛋白一方面提高了血浆胶体渗透压,增加循环血容量,改善肾脏灌注;另一方面可能与白蛋白发挥了抗炎及抗氧化作用有关[17]。白蛋白是血浆中最丰富的蛋白质,可维持约80%血浆有效胶体渗透压,同时其表面带有负电荷,可以吸引钠离子,维持血浆胶体及晶体渗透压,外源性补充白蛋白可能通过维持有效肾脏灌注,发挥保护肾功能作用。此外,白蛋白具有强大的配体结合能力,并发挥运输药物、维生素、胆红素等物质的功能,动物实验发现白蛋白具有一定的抗氧化、维持体内酸碱平衡及凝血功能等作用[18]。脓毒症时产生大量自由基诱导细胞发生氧化应激,可加重肾小管上皮细胞及肾小球损伤,低白蛋白血症时,机体对自由基清除能力下降,延缓了肾脏细胞正常功能的恢复,外源性补充白蛋白可能具有减轻肾脏应激的作用[19]。作为蛋白酸根的主要成分,白蛋白可在血浆阴离子间隙发生变化时发挥调节体液酸碱平衡的作用,有效保护肾脏微循环,从而减轻肾脏损伤。
本研究仍存在一些不足之处,首先为一项单中心回顾性研究,患者数量较少,为进一步明确白蛋白替代治疗对于脓毒症患者预后的影响,有待多中心前瞻性研究的证实。其次,本研究缺乏患者长期随访结果,仅评估了替代治疗对于短期预后的影响,有待对长期预后进行进一步评估。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Berg D, Gerlach H. Recent advances in understanding and managing sepsis[J]. F1000Res, 2018, 7: 1570. DOI:10.12688/f1000research.15758.1 |
| [2] | Pecker M, Adams M, Graham W. The systemic capillary leak syndrome[J]. Ann Intern Med, 2011, 155(5): 335-336. DOI:10.7326/0003-4819-155-5-201109060-00016 |
| [3] | Nunnally ME, Patel A. Sepsis-What's new in 2019?[J]. Curr Opin Anaesthesiol, 2019, 32(2): 163-168. DOI:10.1097/aco.0000000000000707 |
| [4] | 韩涛, 邓秋明, 万献尧. 脓毒症患者低白蛋白血症研究进展[J]. 中华医学杂志, 2017, 97(3): 228-231. DOI:10.3760/cma.j.issn.0376-2491.2017.03.015 |
| [5] | Vincent JL, Dubois MJ, Navickis RJ, et al. Hypoalbuminemia in acute illness:is there a rationale for intervention? A meta-analysis of cohort studies and controlled trials[J]. Ann Surg, 2003, 237(3): 319-334. DOI:10.1097/01.sla.0000055547.93484.87 |
| [6] | Arnau-Barres I, Guerri-Fernandez R, Luque S, et al. Serum albumin is a strong predictorof sepsis outcome in elderly patients[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(4): 743-746. DOI:10.1007/s10096-019-03478-2 |
| [7] | 季兵, 朱建良, 马丽梅, 等. 早期集束化治疗对脓毒症及脓毒性休克患者预后的影响[J]. 中华急诊医学杂志, 2019, 28(2): 170-174. DOI:10.3760/cma.j,issn.1671-0282.2019.02.008 |
| [8] | 潘涛涛.白蛋白联合连续肾脏替代疗法治疗毛细血管渗漏综合征研究[J/CD].中华临床医师杂志(电子版), 2017, 11(5): 748-752. DOI: 10.3877/cma.j.issn.1674-0785.2017.05.009. |
| [9] | Finfer S, Bellomo R, Boyce N, et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit[J]. N Engl J Med, 2004, 350(22): 2247-2256. DOI:10.1056/NEJMoa040232 |
| [10] | Maitland K, Kiguli S, Opoka RO, et al. Mortality after fluid bolus in African children with severe infection[J]. N Engl J Med, 2011, 364(26): 2483-2495. DOI:10.1056/NEJMoa1101549 |
| [11] | Annane D, Siami S, Jaber S, et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock:the CRISTAL randomized trial[J]. JAMA, 2013, 310(17): 1809-1817. DOI:10.1001/jama.2013.280502 |
| [12] | Sort P, Navasa M, Arroyo V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis[J]. N Engl J Med, 1999, 341(6): 403-409. DOI:10.1056/nejm199908053410603 |
| [13] | Guevara M, Terra C, Nazar A, et al. Albumin for bacterial infections other than spontaneous bacterial peritonitis in cirrhosis.A randomized, controlled study[J]. J Hepatol, 2012, 57(4): 759-765. DOI:10.1016/j.jhep.2012.06.013 |
| [14] | Kwok CS, Krupa L, Mahtani A, et al. Albumin reduces paracentesis-induced circulatory dysfunction and reduces death and renal impairment among patients with cirrhosis and infection:a systematic review and meta-analysis[J]. Biomed Res Int, 2013, 2013: 295153. DOI:10.1155/2013/295153 |
| [15] | Fernandez J, Claria J, Amoros A, et al. Effects of albumin treatment on systemic and portal hemodynamics and systemic inflammation in patients with decompensated cirrhosis[J]. Gastroenterology, 2019, 157(1): 149-162. DOI:10.1053/j.gastro.2019.03.021 |
| [16] | Prowle JR. Sepsis-associated AKI[J]. Clin J Am Soc Nephrol, 2018, 13(2): 339-342. DOI:10.2215/cjn.07310717 |
| [17] | Ferrer R, Mateu X, Maseda E, et al. Non-oncotic properties of albumin.A multidisciplinary vision about the implications for critically ill patients[J]. Expert Rev Clin Pharmacol, 2018, 11(2): 125-137. DOI:10.1080/17512433.2018.1412827 |
| [18] | Das UN. Albumin infusion for the critically ill-is it beneficial and, if so, why and how?[J]. Crit Care, 2015, 19: 156. DOI:10.1186/s13054-015-0862-4 |
| [19] | 张卉, 冯永文, 姚咏明. 自噬在脓毒症免疫反应中的潜在作用与意义[J]. 中华急诊医学杂志, 2019, 28(2): 131-134. DOI:10.3760/cma.j.issn.1671-0282.2019.02.001 |
 2020, Vol. 29
2020, Vol. 29




