2 浙江大学医学院附属第二医院放射科,杭州 310009;
3 浙江大学医学院附属第二医院神经外科,杭州 310009
颅内动脉瘤破裂是引起蛛网膜下腔出血(subarachnoid hemorrhage, SAH)的首要病因,约占SAH的80%[1]。动脉瘤一旦破裂出血,12%的患者在到达医院前死亡,40%的患者出血后1个月内因各种并发症死亡,剩余的患者中越有1/3会继续出现进一步明显的神经功能缺失,危害极重[2]。因此,临床上对此类患者早期、及时、准确地做出诊断有重要意义。与颅内前循环动脉相比,后循环动脉易受颅底骨质伪影干扰,对于靠近颅底的动脉瘤难以显示;且颅内后循环夹层动脉瘤较前循环多见,动脉瘤及其血管壁的搏动可使剥离的内膜显示不完全[3],这为三维CT血管造影(three-dimensional computed tomographic angiography, 3D-CTA)诊断的准确率提出了更大的挑战。目前三维数字减影血管造影(three-dimensional digital substraction angiography, 3D-DSA)检查是评价脑血管及其病变的金标准,然而,由于其风险相对较大,操作时间长,对操作经验要求高,对怀疑有动脉瘤的患者行DSA检查约0.07%~0.5%的患者有永久神经并发症[4],本文旨在探讨3D-CTA对颅内后循环出血性动脉瘤早期诊断的价值。
1 资料与方法 1.1 一般资料对2015年12月至2017年12月在浙江大学医学院附属第二医院急诊行螺旋CT、CTA、常规DSA及三维旋转DSA检查的连续227例确诊为颅内后循环出血性动脉瘤的患者进行回顾性分析,其中男性124例,女性103例;年龄13~83岁,(52±9)岁。临床表现为头痛、恶心、呕吐等症状,并伴有不同程度的意识障碍,按Hunt-Hess分级法Ⅰ~Ⅱ级92例(40.5%),Ⅲ级84例(37.0%),Ⅳ~Ⅴ级51例(22.5%)。本研究符合医学伦理学标准,并经医院伦理委员会审批,审批号:(2019)伦审研第(369)号,所得影像资料均可免除患者或家属的知情同意。
1.2 入选标准(1) 急性起病,急诊头颅CT提示SAH、脑室积血和(或)脑内血肿等;(2)以3D-DSA结果显示颅内后循环动脉瘤作为参考标准。当出现颅内多发动脉瘤或微小动脉瘤难以诊断时,根据CT上积血部位及分布情况,DSA上动脉瘤显示的形态,来判定责任动脉瘤位于后循环动脉上;(3)要求所有患者必须均在本院行CTA和DSA检查,两检查的间隔时间不超过2 d(平均间隔时间1 d)。以上三条必须同时满足方可作为本研究评价颅内后循环出血性动脉瘤的入选标准。
1.3 排除标准CTA和(或)DSA图像伪影重及既往曾行颅内后循环动脉瘤血管内治疗或开颅夹闭治疗的患者。
1.4 检查设备及条件仪器与对比剂:CTA检查使用Siemens公司螺旋CT机(Somatom Definition AS 40);20 G套管针;对比剂:欧乃派克[Omnipaque®(Iohexol)350 mgI/mL: Nycomed Amersham Buckinghamshire, 英国]。荷兰Philips公司Integris Allura Flat Detector 20型DSA机及美国Tyco Illunena高压注射器。
CT影像一次采集40层图像。由高压注射器通过高压连接管和20 G套管针以速度4 mL/s经肘静脉注射非离子型对比剂欧乃派克100 mL;采用CT机配备的团注跟踪技术,同时对主动脉弓CT值进行动态监测,CT值≥80 HU后自动开始扫描。扫描参数:120 kV,220 Eff · mAs,层厚1 mm。重建间隔0.6 mm,螺距0.75 mm,视野180~210 mm。扫描范围自第1颈椎下缘水平至侧脑室体部水平。重建方法采用多平面重建(multiplanar reconstruction,MPR)、最大密度投影(maximum intensity projection,MIP)和容积重建(volume rendering,VR)。
DSA检查通过股动脉Seldinger技术穿刺、插管,选择性分导至双侧颈内动脉及双侧椎动脉,采用非离子型对比剂欧乃派克,颈内动脉流率3 mL/s,总量6 mL;椎动脉流率2 mL/s,总量5 mL,摄取正、侧位片。三维旋转造影选用Neuro 3D C臂旋转200°,每秒采集47帧图像,矩阵512 × 512,颈内动脉流率3 mL/s,总量12 mL;椎动脉流率2.5 mL/s,总量10 mL,延迟时间1~3 s。将三维旋转造影图像传至工作站,运用Philips Release 4.2工作站进行重建,90 s后重建出3D-DSA图像。三维图像包括MIP、VR。
1.5 图像分析227例研究对象的CTA和DSA图像后处理均由高年资主治医生来完成。为了评价观察者内和观察者间对3D-CTA、3D-DSA诊断颅内后循环出血性动脉瘤是否具有一致性,先从中随机选取50例3D-CTA、3D-DSA图像由两位有多年神经影像诊断经验的放射科医生(分别有25年和9年的阅片经验)进行独立阅片。然后由上述两位医生采用双盲法分别对3D-CTA、3D-DSA图像读片分析,并记录下诊断结果,当意见相左时,如颅内多发动脉瘤中哪个为破裂的动脉瘤,不确定破裂动脉瘤的部位或大小等,则通过讨论得出一致结果。以3D-DSA的诊断结果作为参考标准,评价3D-CTA对不同部位、大小的后循环出血性动脉瘤的诊断价值,并研究分析其误诊及漏诊的原因。
1.6 统计学方法采用SPSS 19.0进行统计分析,分别计算3D-CTA对颅内后循环各部位及不同直径的出血性动脉瘤诊断的敏感度、特异度以及准确率,采用χ2检验比较3D-CTA与3D-DSA对动脉瘤的检出率的差异。使用Kappa统计量评价观察者内和观察者间对随机抽样的50例3D-CTA、3D-DSA诊断结果是否有一致性,并评价两种影像检查方法之间的一致性程度。以P < 0.05为差异有统计学意义。
2 结果 2.1 3D-DSA诊断结果227例临床怀疑或确诊的颅内后循环出血性动脉瘤中,183例(80.6%)3D-DSA显示有颅内后循环动脉瘤破裂(表 1)。另外44例(19.4%)中有2例小脑动静脉畸形合并小脑前下动脉动脉瘤形成,42例DSA检查阴性,其中15例后颅窝单纯血肿破入蛛网膜下腔和(或)脑室系统,27例SAH原因不明。
| 部位 | 性别(例,%) | 年龄(岁,Mean±SD) | 瘤体直径(例) | ||||
| 男 | 女 | ≤3 mm | (3 mm, 5 mm] | (5 mm, 10 mm] | > 10 mm | ||
| VA | 52(28.4) | 21(11.5) | 51±9 | 24 | 35 | 12 | 2 |
| PICA | 16(8.8) | 28(15.3) | 55±9 | 23 | 16 | 5 | 0 |
| AICA | 5(2.7) | 7(3.8) | 50±11 | 6 | 5 | 1 | 0 |
| SCA | 5(2.7) | 5(2.7) | 54±7 | 4 | 4 | 2 | 0 |
| BA | 11(6.0) | 16(8.8) | 54±12 | 4 | 8 | 10 | 5 |
| PCA | 8(4.4) | 9(4.9) | 52±8 | 1 | 4 | 8 | 4 |
| 总计 | 97(53.0) | 86(47.0) | 52±9 | 62 | 72 | 38 | 11 |
| 注:VA,椎动脉V4段;PICA,小脑后下动脉;AICA,小脑前下动脉;SCA,小脑上动脉;BA,基底动脉;PCA,大脑后动脉 | |||||||
与3D-DSA结果对照,3D-CTA准确地检出179例,其中真阳性141例,真阴性38例;另有假阳性6例,假阴性42例。总体敏感度、特异度及准确率分别为77.0%(141/183)、86.4%(38/44)和78.9%(179/227)。
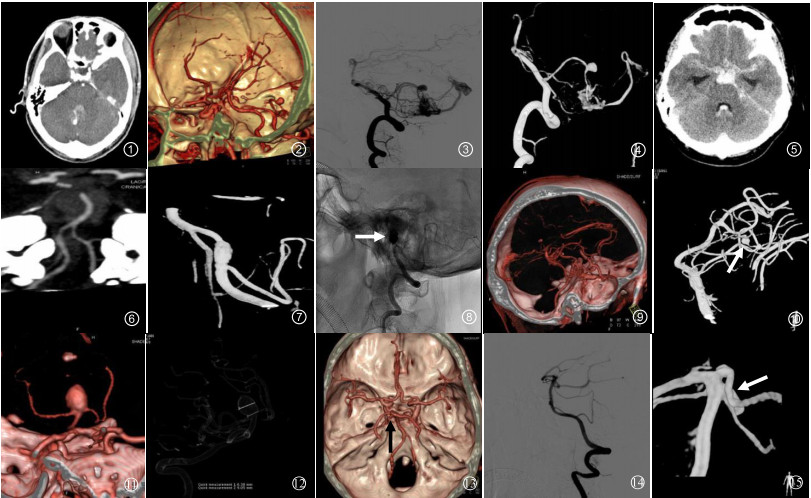
6例3D-CTA假阳性结果中,3例(50.0%)椎动脉V4段完全血栓机化CTA误诊为动脉瘤,1例(16.7%)小脑下动脉复合体误诊为小脑后下动脉瘤,2例(33.3%)小脑动静脉畸形合并小脑前下动脉动脉瘤漏诊为单纯囊状动脉瘤。5例(83.3%)动脉瘤直径≤5 mm,1例(16.7%)动脉瘤直径 > 5 mm,见图 1~4。
|
|
图 1 图 1~4 病例1:男,40岁,突发头痛伴呕吐1 d余。CTA原始轴位图像(图 1)示第四脑室后方囊袋状对比剂充盈影,周围见高密度出血,结合3D-CTA VR图像(图 2)考虑右侧小脑前下动脉出血性动脉瘤。2D-DSA及3D-DSA均可见动脉期有静脉早显现象,小脑前下动脉囊状动脉瘤的后方伴有畸形血管团和增粗的引流静脉,提示小脑动静脉畸形合并小脑前下动脉动脉瘤形成(图 3~4) 图 5~8 病例2:男,48岁,突发剧烈头痛、呕吐1 d。查头颅CT提示SAH、脑室积血(图 5)。MIP图像见左侧椎动脉颅内段局部血管痉挛改变,未见明确动脉瘤(图 6)。DSA显示左侧椎动脉V4段(小脑后下动脉分叉处以远)串珠征及双腔征改变,提示夹层动脉瘤(图 7 3D-DSA;图 8急诊栓塞后DSA,白箭头示弹簧圈) 图 9~10 病例3:女,43岁,突发头疼2 d。自发性SAH患者,3D-CTA检查均未见动脉瘤(图 9)。3D-DSA清晰可见左侧小脑上动脉远段分支小囊状染色,诊断为左侧小脑上动脉远段小动脉瘤破裂(图 10, 白箭头示) 图 11~12 病例4:男,58岁,突发头痛伴恶心、呕吐1 d。3D-CTA和3D-DSA均可清楚地显示基底动脉尖直径9 mm动脉瘤,并具有更直观的3D效果,真实显示了瘤体形态、瘤颈及动脉瘤与载瘤动脉的空间关系(图 11 CTA VR图像;图 12 DSA三维透明法) 图 13~15 病例5:女,54岁,突发意识障碍伴头痛、呕吐2 d。3D-CTA考虑左侧大脑后动脉起始部动脉瘤(图 13, 黑箭头示)。12 h后行常规DSA及3D-DSA检查(图 14~15)。因注入的对比剂量增加,对细节的显示更清楚,DSA准确显示动脉瘤位于左侧小脑上动脉近段(图 15, 白箭头示) |
|
|
42例3D-CTA假阴性结果中,12例(28.6%)椎动脉V4段,18例(42.9%)小脑后下动脉,6例(14.3%)小脑前下动脉,3例(7.1%)小脑上动脉以及2例(4.8%)基底动脉动脉瘤未诊断,1例(2.4%)小脑上动脉动脉瘤表现为同侧大脑后动脉动脉瘤。37例(88.1%)动脉瘤直径≤5 mm,其中24例(57.1%)动脉瘤直径≤3 mm,13例(31.0%)动脉瘤直径 > 3 mm且≤5 mm,另外5例(11.9%)动脉瘤直径 > 5 mm,图 5~10。
2.2.2 各部位3D-CTA准确性3D-CTA显示椎动脉V4段动脉瘤64例,小脑后下动脉动脉瘤27例,小脑前下动脉动脉瘤8例,小脑上动脉动脉瘤6例,基底动脉动脉瘤25例及大脑后动脉动脉瘤17例。其敏感度分别为83.6%(61/73)、59.1%(26/44)、50.0%(6/12)、66.7%(6/9)、92.6%(25/27)和94.4%(17/18),特异度分别为92.7%(38/41)、97.4%(38/39)、95.0%(38/40)、100%(38/38)、100%(38/38)和100%(38/38),以及准确率分别为86.8%(99/114)、77.1%(64/83)、84.6%(44/52)、93.6%(44/47)、96.9%(63/65)和98.2%(55/56),差异有统计学意义(P < 0.01),见表 2。
| 部位 | 阳性(例) | 阴性(例) | 假阳性(例) | 假阴性(例) | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 | 准确率 | P值 |
| 总体 | 141 | 38 | 6 | 42 | 77.0(141/183) | 86.4(38/44) | 95.9(141/147) | 47.5(38/80) | 78.9(179/227) | < 0.01 |
| VA | 61 | 38 | 3 | 12 | 83.6(61/73) | 92.7(38/41) | 95.3(61/64) | 76.0(38/50) | 86.8(99/114) | < 0.01 |
| PICA | 26 | 38 | 1 | 18 | 59.1(26/44) | 97.4(38/39) | 96.3(26/27) | 67.9(38/56) | 77.1(64/83) | < 0.01 |
| AICA | 6 | 38 | 2 | 6 | 50.0(6/12) | 95.0(38/40) | 75.0(6/8) | 86.4(38/44) | 84.6(44/52) | 0.001 |
| SCA | 6 | 38 | 0 | 3 | 66.7(6/9) | 100(38/38) | 100(6/6) | 92.7(38/41) | 93.6(44/47) | < 0.01 |
| BA | 25 | 38 | 0 | 2 | 92.6(25/27) | 100(38/38) | 100(25/25) | 95.0(38/40) | 96.9(63/65) | < 0.01 |
| PCA | 17 | 38 | 0 | 1 | 94.4(17/18) | 100(38/38) | 100(17/17) | 97.4 (38/39) | 98.2(55/56) | < 0.01 |
| 注:VA,椎动脉V4段;PICA,小脑后下动脉;AICA,小脑前下动脉;SCA,小脑上动脉;BA,基底动脉;PCA,大脑后动脉 | ||||||||||
3D-CTA检出直径≤3 mm动脉瘤40例,直径 > 3 mm且≤5 mm动脉瘤62例,直径 > 5 mm且≤10 mm动脉瘤34例,以及直径 > 10 mm动脉瘤11例。其敏感度分别为61.3%(38/62)、81.9%(59/72)、86.8%(33/38)和100%(11/11),特异度分别为95.0%(38/40)、92.7%(38/41)、97.4%(38/39)和100%(38/38),以及准确率分别为74.5%(76/102)、85.8%(97/113)、92.2%(71/77)和100%(49/49)。对直径≤5 mm检出的敏感度为72.4%,特异度为88.4%,准确率为76.3%,见表 3。
| 瘤体直径 | 阳性(例) | 阴性(例) | 假阳性(例) | 假阴性(例) | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 | 准确率 | P值 |
| ≤3 mm | 38 | 38 | 2 | 24 | 61.3(38/62) | 95.0(38/40) | 95.0(38/40) | 61.3(38/62) | 74.5(76/102) | < 0.01 |
| (3 mm, 5 mm] | 59 | 38 | 3 | 13 | 81.9(59/72) | 92.7(38/41) | 95.2(59/62) | 74.5(38/51) | 85.8(97/113) | < 0.01 |
| (5 mm, 10 mm] | 33 | 38 | 1 | 5 | 86.8(33/38) | 97.4(38/39) | 97.1(33/34) | 88.4(38/43) | 92.2(71/77) | < 0.01 |
| > 10 mm | 11 | 38 | 0 | 0 | 100(11/11) | 100(38/38) | 100(11/11) | 100(38/38) | 100(49/49) | < 0.01 |
根据Kappa系数参考判断标准,随机选取的50例研究对象3D-CTA诊断结果观察者内和观察者间具有极强的一致性,κ值分别为0.911、0.802(P < 0.05);3D-DSA诊断结果观察者内和观察者间具有极强的一致性,κ值分别为0.951、0.854(P < 0.05)。此外,3D-CTA与3D-DSA对颅内后循环出血性动脉瘤诊断的一致性强度为中度,κ值为0.484。
3 讨论颅内动脉瘤破裂后约有14%~44%的患者会发生动脉瘤再次破裂出血,再次出血病死率高达70%~90%,再次出血的高峰期为4~9 d[5]。国际未破裂动脉瘤研究小组(ISUIA)报道颅内后循环动脉瘤相对于其他部位的动脉瘤易于破裂,位于基底动脉末端的未破裂动脉瘤破裂的相对危险度为13.8,椎-基底动脉动脉瘤或大脑后动脉动脉瘤的相对危险度为13.6,而颈内-后交通动脉动脉瘤的相对危险度仅为8.0[6]。由此可见,颅内后循环动脉瘤破裂出血后,早期检查,及时、准确诊断至关重要。目前国内外专家学者不乏对颅内动脉瘤CTA或3D-CTA与常规DSA、3D-DSA的比较研究[7-10],但是,对颅内后循环出血性动脉瘤早期诊断的价值研究非常少。
3D-CTA对颅内动脉瘤尤其是后循环动脉瘤的诊断价值目前存在争议。由于仪器设备、重建方法、样本量等主客观因素的影响,国内外同行对颅内后循环出血性动脉瘤的研究结论也不尽相同。有些研究者认为3D-CTA可完全替代DSA用于动脉瘤性SAH患者的术前评价[11-13],其主要基于CTA快捷,一般只需15~20 min,无创、经济;不受颅外血管条件限制,不需选择性插管;风险相对小,患者在检查过程中所受的放射线剂量少于DSA检查;能显示动脉管壁的钙化、血管与周围骨质的空间关系;可对原始图像进行旋转、切割,进行多方位的立体观察等。Lu等[1]对171例颅内后循环动脉瘤3D-CTA与3D-DSA的大样本量、临床对照研究显示3D-CTA对于不同大小和部位的动脉瘤均有很高的敏感度和特异度,3D-CTA作为一种快速、无创、准确的检查方法可用于对急性SAH患者颅内动脉瘤的检测。Tipper等[14]发现3D-CTA对颅内动脉瘤诊断的敏感度、特异度分别为96.2%和100%,其结果中53例颅内动脉瘤正确诊断出51例。然而,本研究通过对2年连续性227例颅内后循环出血性动脉瘤3D-CTA与3D-DSA对照研究,结果显示3D-CTA检出颅内后循环出血性动脉瘤的总体特异度较高,而总体敏感度和总体准确率偏低,均小于80%。
国内外文献报道3D-CTA对颅内不同直径的出血性动脉瘤检出的敏感度存在差异,特异度相当。Wang等[15]将52例自发性SAH怀疑颅内动脉瘤破裂的患者320排3D-CTA和DSA诊断结果与术中结果进行对照研究,两者的总敏感度分别是96.3%、98.1%,直径 < 3 mm动脉瘤的敏感度分别是81.8%和90.9%,特异度均为100%。Yoon等[16]通过16层螺旋CT对71例SAH患者进行扫描,发现CTA对动脉瘤诊断的总体敏感度、特异度及准确率分别为92.5%、93.3%和92.6%,而对直径 < 3 mm动脉瘤两位阅片者的敏感度分别为74.1%和77.8%。White等[17]研究表明CTA对颅内动脉瘤诊断的敏感度为92%,特异度为94%,并且认为对直径 > 3 mm动脉瘤诊断的敏感度明显高于3 mm以下的动脉瘤(96% vs 61%)。然而,Donmez等[18]报道3D-CTA对颅内动脉瘤诊断的总敏感度、特异度及准确率分别为95.1%、94.1%和95.0%,而对直径 < 3 mm动脉瘤的敏感度、特异度及诊断准确率分别为86.1%、94.1%和88.6%。本研究中,3D-CTA对后循环直径 > 5 mm的出血性动脉瘤检出敏感度达89.8%,而对直径≤5 mm动脉瘤的敏感度约72.4%,尤其是对直径≤3 mm动脉瘤的敏感度仅为61.3%;对不同直径动脉瘤显示的特异度均达到92%以上。
本研究发现3D-CTA显示颅内后循环各部位的出血性动脉瘤均有很高的特异度,对基底动脉动脉瘤、大脑后动脉动脉瘤诊断的敏感度和准确率较高(图 11~12病例4),但是,显示椎动脉V4段动脉瘤、小脑后下动脉动脉瘤、小脑前下动脉动脉瘤及小脑上动脉动脉瘤的敏感度均低于85%。笔者认为这可能是由于椎动脉V4段动脉瘤、小脑后下动脉动脉瘤、小脑前下动脉动脉瘤及小脑上动脉动脉瘤靠近颅底,CTA图像易受颅底骨质伪影干扰;部分载瘤动脉血管较细,血流相对较少,特别是二级以下分支血管,注入的对比剂经血流稀释后显影不清;也可能是由于动脉瘤破裂出血后,周围的氧合血红蛋白对血管壁的刺激,加之红细胞在其降解过程中一些分解产物和神经递质释放的影响,引起载瘤动脉血管痉挛改变,使CTA检出困难。
与3D-DSA结果进行对照研究,发现存在一些假阳性和假阴性的结果值得进一步讨论。本研究中,3例CTA显示假阳性直径均 < 5 mm的椎动脉V4段动脉瘤最后被证实为完全血栓闭塞性动脉瘤,1例小脑下动脉复合体由于走行迂曲、成襻,CTA显示为小脑后下动脉动脉瘤样表现,2例小脑动静脉畸形合并小脑前下动脉动脉瘤漏诊为单纯小脑前下动脉囊状动脉瘤。因此,对于颅内后循环动脉尤其是椎动脉内CT平扫呈高密度且CTA显示瘤样膨隆的病变,应考虑到动脉瘤完全血栓机化的可能。而对于后循环血管变异或合并有其他血管畸形时,应注意在CTA后处理过程中多方位、多角度观察,仔细辨别是否存在假象,避免造成误诊的可能。
由于存在重叠的骨性结构和复杂的血管解剖,使动脉瘤因颅底骨质伪影、血管扭曲或大血管遮挡,导致CTA对于靠近颅底的小动脉瘤显示较困难。在假阴性结果中,绝大多数动脉瘤直径小于5 mm,约占88.1%。这些漏诊的动脉瘤主要位于椎动脉、小脑后下动脉、小脑前下动脉及小脑上动脉,特别是位于上述动脉远段分支处的动脉瘤,3D-CTA难以显示清晰。另外,颅内动脉瘤及其血管壁的搏动可使血管表面重建时血管壁显示不完全,动脉瘤早期破裂出血会引起载瘤动脉及其近端血管痉挛改变,对于直径 < 5 mm动脉瘤和夹层动脉瘤有漏诊的可能。本研究中夹层动脉瘤70例,均位于椎动脉V4段,其中12例(占17.14%)3D-CTA诊断时被忽略,未见文献报道的串珠征、线样征或双腔征改变。因此,对于颅内后循环动脉邻近颅底的、直径 < 5 mm的远段分支处动脉瘤及夹层动脉瘤,急诊CTA检查容易漏诊。
本研究中1例小脑上动脉近段动脉瘤误诊为同侧大脑后动脉动脉瘤(图 13~15病例5),与3D-DSA对照分析,发现此例患者3D-CTA图像上左侧大脑后动脉未显影。笔者认为这可能与CTA检查时靶血管的对比剂浓度较低或血流动力学影响有关。由于DSA超选至双侧椎动脉对颅内后循环动脉进行检查,而CTA是从外周静脉注入对比剂经肺循环后对靶血管薄层扫描。因此,与DSA相比,CTA流入靶血管的对比剂浓度低,对血流动力学影响轻微,故对侧支循环情况显示不如DSA。
综上所述,3D-CTA对颅内后循环不同部位和大小的出血性动脉瘤早期诊断的敏感度存在差异,但特异度均较高。对于SAH患者怀疑是颅内后循环动脉瘤破裂,应在CTA不能确定责任动脉瘤的情况下,急诊行DSA检查以明确诊断,3D-DSA仍然是颅内后循环出血性动脉瘤诊断的金标准。但是,3D-CTA显示颅内后循环各部位、大小的出血性动脉瘤的特异度高,3D-CTA在诊断动脉瘤的周围组织结构上优于DSA,能了解动脉瘤与周围骨性标记的距离,有助于指导外科手术入路的选择。因此,从这个角度来说,CTA对于DSA是一种积极的补充,而不是替代。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Lu L, Zhang LJ, Poon CS, et al. Digital subtraction CT angiography for detection of intracranial aneurysms: comparison with three-dimensional digital subtraction angiography[J]. Radiology, 2012, 262(2): 605-612. DOI:10.1148/radiol.11110486 |
| [2] | Huang ZQ, Meng ZH, Hou ZJ, et al. Geometric parameter analysis of ruptured and unruptured aneurysms in patients with symmetric bilateral intracranial aneurysms: a multicenter CT angiography study[J]. AJNR Am J Neuroradiol, 2016, 37(8): 1413-1417. DOI:10.3174/ajnr.A4764 |
| [3] | Adeeb N, Griessenauer CJ, Dmytriw AA, et al. Risk of branch occlusion and ischemic complications with the pipeline embolization device in the treatment of posterior circulation aneurysms[J]. AJNR Am J Neuroradiol, 2018, 39(7): 1303-1309. DOI:10.3174/ajnr.A5696 |
| [4] | Willinsky RA, Taylor SM, Ter Brugge K, et al. Neurologic complications of cerebral angiography: prospective analysis of 2, 899 procedures and review of the literature[J]. Radiology, 2003, 227(2): 522-528. DOI:10.1148/radiol.2272012071 |
| [5] | Rosenørn J, Eskesen V, Schmidt K, et al. The risk of rebleeding from ruptured intracranial aneurysms[J]. J Neurosurg, 1987, 67(3): 329-332. DOI:10.3171/jns.1987.67.3.0329 |
| [6] | The International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured intracranial aneurysms-risk of rupture and risks of surgical intervention[J]. N Engl J Med, 1998, 339(24): 1725-1733. DOI:10.1056/NEJM199812103392401 |
| [7] | Bechan RS, van Rooij SB, Sprengers ME, et al. CT angiography versus 3D rotational angiography in patients with subarachnoid hemorrhage[J]. Neuroradiology, 2015, 57(12): 1239-1246. DOI:10.1007/s00234-015-1590-9 |
| [8] | Philipp LR, McCracken DJ, McCracken CE, et al. Comparison between CTA and digital subtraction angiography in the diagnosis of ruptured aneurysms[J]. Neurosurgery, 2017, 80(5): 769-777. DOI:10.1093/neuros/nyw113 |
| [9] | 沈建国, 郁龚杰, 周海航, 等. 3D-CTA在自发性蛛网膜下腔出血中早期筛查的意义[J]. 中华急诊医学杂志, 2017, 26(12): 1394-1396. DOI:10.3760/cma.j.issn.1671-0282.2017.12.012 |
| [10] | 尹广明, 吕俊锋, 穆兴国, 等. 3D-CTA与3D-DSA诊断颅内动脉瘤的对比研究[J]. 中华神经外科杂志, 2013, 29(10): 1045-1047. DOI:10.3760/cma.j.issn.1001-2346.2013.10.025 |
| [11] | Westeriaan HE, van Dijk JM, Jansen-van der Weide MC, et al. Intracranial aneurysms in patients with subarachnoid hemorrhage: CT angiography as a primary examination tool for diagnosis-systematic review and meta-analysis[J]. Radiology, 2011, 258(1): 134-145. DOI:10.1148/radiol.10092373 |
| [12] | Ramgren B, Siemund R, Nilsson OG, et al. CT angiography in non-traumatic subarachnoid hemorrhage: the importance of arterial attenuation for the detection of intracranial aneurysms[J]. Acta Radilo, 2015, 56(10): 1248-1255. DOI:10.1177/0284185114551976 |
| [13] | Chen GZ, Luo S, Zhou CS, et al. Digital subtraction CT angiography for the detection of posterior inferior cerebellar artery aneurysms: comparison with digital subtraction angiography[J]. Eur Radiol, 2017, 27(9): 3744-3751. DOI:10.1007/s00330-017-4771-6 |
| [14] | Tipper G, U-King-im JM, Price SJ, et al. Detection and evaluation of intracranial aneurysms with 16-row multislice CT angiography[J]. Clin Radiol, 2005, 60(5): 565-572. DOI:10.1016/j.crad.2004.09.012 |
| [15] | Wang H, Li W, He H, et al. 320-Detector row CT angiography for detection and evaluation of intracranial aneurysms: Comparison with conventional digital subtraction angiography[J]. Clin Radiol, 2013, 68(1): e15-e20. DOI:10.1016/j.crad.2012.09.001 |
| [16] | Yoon DY, Lim KJ, Choi CS, et al. Detection and characterization of intracranial aneurysms with 16-channel multidetector row CT angiography: a prospective comparison of volume-rendered images and digital subtraction angiography[J]. AJNR Am J Neuroradiol, 2007, 28(1): 60-67. DOI:10.1007/978-3-540-45456-4_43 |
| [17] | White PM, Wardlaw JM, Easton V. Can noninvasive imaging accurately depict intracranial aneurysms? A systematic review[J]. Radiology, 2000, 217(2): 361-370. DOI:10.1148/radiology.217.2.r00nv06361 |
| [18] | Donmez H, Serifov E, Kahriman G, et al. Comparison of 16-row multislice CT angiography with conventional angiography for detection and evaluation of intracranial aneurysms[J]. Eur J Radiol, 2011, 80(2): 455-461. DOI:10.1016/j.ejrad.2010.07.012 |
 2020, Vol. 29
2020, Vol. 29




