HMG-CoA还原酶抑制剂(他汀类药物)是史上使用最广泛,销量最多的药物之一[1]。除了对冠脉疾病具有常规的降脂效应外,他汀类药物还具抗炎效应、诱导一氧化氮合酶(inducible nitric oxide synthase, i NOS)和影响白细胞黏附移位等效应[2-4], 因此可以涉及到很多的炎症反应疾病,例如自身免疫功能紊乱、多发性硬化、慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)和脓毒症[5-7]。此外,他汀类药物还具有抗菌特性,可以对脓毒症患者产生额外有益的治疗效应[8-9]。
尽管近年来不断有新的关于他汀类药物对于脓毒症预后影响的研究,结果多数都认为他汀类药物未能对脓毒症预后产生影响[10-12],然而2018年CHEST杂志发表的编者案指出由于大部分研究人群的均质性未能明确,且多为回顾性研究,不能较好地进行随机,而且因为存在不同品规的他汀制剂,表现结果似乎更不相同[13]。Lee等[14]研究显示,阿托伐他汀和辛伐他汀可能会对预后产生较好的保护作用。脓毒症中出现的血管渗漏是脓毒症疾病恶化的病理生理基础,因为血管损伤导致的病理改变如同开启了全身脏器损伤的阀门,尤其是内皮屏障损伤与不良预后密切相关,他汀类药物在脓毒症中的价值尚未明确,需要从内皮细胞屏障功能保护角度,明确他汀类非降脂效应可能的获益机制。目前他汀类药物在危重患者中仅仅只有胃肠道制剂,尚无静脉制剂,原因在于他汀类药物水溶性差,脂溶性强。而纳米粒是一种新型的载药系统,它的粒径通常在10 ~100 nm,是一种理想的静脉注射的药物载体, 因此希望进行相关的制剂改良后,甚至通过脂质纳米粒的被动靶向血管的效应[15],增强辛伐他汀在脓毒症血管内皮保护中的使用价值。因此,本研究着力比较辛伐他汀脂质纳米粒在离体和在体脓毒症模型中对脓毒症血管内皮的影响。
1 材料与方法 1.1 试剂与药品辛伐他汀原料药(浙江医药股份有限公司新昌药厂);硬脂酸、泊洛沙姆(上海化学试剂采购供应站);脂多糖(LPS,Escherichia coli 0111:B4,美国Sigma公司);PVDF膜(美国Bio-rad公司);ECL试剂(美国Santa Cruz Biotechnology公司)、抗iNOS和eNOS抗体(美国abcam公司);抗GADPH抗体(中国谷歌生物有限公司); 人IL-6 ELISA及人TNF-α ELISA试剂盒(杭州联科生物科技公司)。
1.2 制剂配置辛伐他汀静脉制剂配制:精密称取41.8 mg辛伐他汀粉剂及4 mg氢氧化钠,溶于10 mL无水乙醇中,稀释后用稀盐酸调节pH至7.2,最终配制成浓度为10 mmol/L母液,滤过除菌后分装,-20℃保存,细胞用药浓度为1 μmol/L,动物给药浓度为1 mg/kg。
辛伐他汀纳米粒制剂配制:精密称取辛伐他汀12 mg和单硬脂酸甘油酯228 mg,将药物和脂质置于丙酮6 mL和无水乙醇6 mL组成的有机相中,水浴50 ℃使完全溶解。以0.2% PVA(w / v)溶液为分散相,置冰浴或70 ℃水浴中。在400 r/min机械搅拌条件下,将有机相倒入120 mL分散相中,继续搅拌5 min,制备得到辛伐他汀纳米粒。纳米粒需现配现用。细胞用药浓度为1 μmol/L,动物给药浓度为1 mg/kg [16]。
1.3 细胞培养原代人脐静脉内皮细胞(HUVEC)购于美国Sciencell公司。正常培养传代至第4代子代细胞后,分为对照组(Ctrl组),脓毒症组(LPS组,建立终浓度100 μg/mL的LPS干预组,给予24 h处理),脓毒症+他汀静脉制剂组(LPS+SV组, 建立终浓度100 μg/mL的LPS+1 μmol/L辛伐他汀静脉制剂24 h处理),脓毒症+他汀纳米粒制剂组(LPS+NP组, 建立终浓度100 μg/mL的LPS+1 μmol/L辛伐他汀纳米粒制剂24 h处理)。
1.4 细胞凋亡检测收集各组细胞,并进行重悬、洗涤、离心、孵育等处理后,使用流式细胞仪分析,激发光波长488 nm,用一波长为515 nm的滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI荧光。
1.5 细胞因子IL-6及TNF-α的测定各组内皮细胞处理后,培养24 h后收集上清液,存放于-80℃冰箱,避免样品重复冻融。按照试剂盒说明书进行ELISA实验。
1.6 Western blot各组细胞经不同处理药物刺激24 h后,加入RIPA裂解液冰上裂解,4℃离心取上清液,BCA蛋白定量后调整蛋白浓度,加入上样缓冲液后100℃加热10 min。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭1 h,兔来源iNOS、eNOS抗体(1 : 1 000稀释)、抗GAPDH抗体(1 : 2 000稀释)4℃孵育过夜,TBST缓冲液洗涤,HRP标记羊抗兔二抗(1 : 5 000稀释)室温孵育1 h,TBST洗涤后加入ECL发光液,暗室中胶片曝光,显影成像,以目的蛋白与内参蛋白GAPDH条带灰度值比值作为目的蛋白相对表达量。
1.7 实验动物分组本研究动物实验过程符合动物实验伦理要求。SPF级C57/BL6小鼠30只,8周龄,体质量18~22 g,购自上海南方模式生物科技公司,检疫合格证号[SCXK(沪)2010-0010],用于24 h时间点标本采集(分4组,每组6只):假手术对照组(Shame组);盲肠结扎组(CLP组);盲肠结扎+辛伐他汀静脉制剂尾静脉注射组(CLP+SV组);盲肠结扎+辛伐他汀纳米粒制剂尾静脉注射组(CLP+NP组)。
1.8 CLP模型建立腹部常规消毒,纵向正中切口约1.5 cm,逐层分离入腹腔,寻找到游离盲肠,结扎于盲肠游离端1/2长度处,18 G针头在结扎端中点沿肠系膜纵轴方向贯通穿刺1次,挤出肠内容物后,结肠回纳腹腔,并逐层缝合关腹。假手术组仅开腹后,探查取出盲肠后再行回纳。
1.9 免疫组化法观察小鼠腹主动脉iNOS和eNOS的变化取小鼠腹主动脉应用免疫组织化学法检测iNOS和eNOS的表达水平。石蜡切片脱蜡和水化后等处理后,在玻片组织上滴加iNOS和eNOS一抗50 μL(1 : 50稀释), 放入4℃冰箱过夜。次日早晨取出玻片,滴加相应二抗,处理后光镜下DAB显色,最后脱水,用中性树脂封片,晾干后光镜下拍照分析。
1.10 统计学方法采用SPSS 22.0软件进行统计分析。计量资料以均数±标准差(Mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间比较符合方差齐性用SKN- q检验;不符合方差齐性,则用Tamhane T2检验,利用Graphpad prism 7.0作图,以P < 0.05为差异有统计学意义。
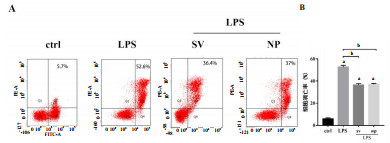
2 结果 2.1 辛伐他汀不同剂型对脓毒症内皮细胞凋亡的影响LPS处理内皮细胞24 h后,应用流式细胞仪检测凋亡情况,结果显示,较对照组,LPS组凋亡细胞数百分比从5.7%±1.1%增加到52.6%±1.6%(图 1A),而SV组与NP组能够减轻由LPS所引起的细胞凋亡,差异有统计学意义;但两组间差异无统计学意义(图 1B)。
|
| A:流式细胞术检测LPS及辛伐他汀不同剂型处理的HUVEC凋亡率;B:各组HUVEC凋亡率比较;与对照组比较,a P < 0.05,b P < 0.05;与LPS处理组比较,c P < 0.05, d P < 0.01 图 1 LPS及辛伐他汀不同剂型处理的人脐静脉内皮细胞(HUVEC)凋亡率比较 |
|
|
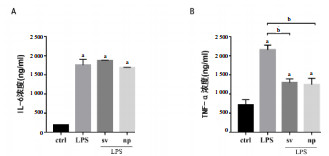
培养的内皮细胞中,炎性因子IL-6在对照组中表达较低,经LPS刺激24 h后,IL-6表达显著增高,而SV及NP组中,IL-6水平较对照组也明显增加,与LPS组间差异无统计学意义(图 2A)。与对照组相比,LPS组TNF-α表达升高,经辛伐他汀处理后,TNF-α含量较LPS组明显降低, 但SV组与NP组间差异无统计学意义(图 2B)。
|
| A:ELISA检测LPS及辛伐他汀不同剂型处理HUVEC培养液上清液IL-6含量;B:ELISA检测LPS及辛伐他汀不同剂型处理HUVEC培养液上清液TNF-α含量; 与对照组比较,a P < 0.01;与LPS处理组比较,b P < 0.01 图 2 LPS及辛伐他汀不同剂型处理的HUVEC培养液上清液中炎症因子含量 |
|
|
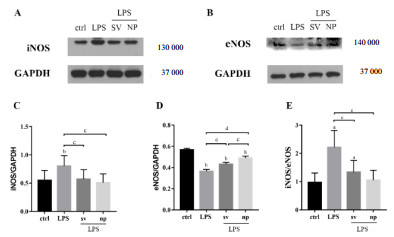
LPS处理HUVEC细胞,脓毒症细胞模型造模。用SV及NP处理细胞后,提取细胞蛋白,Western bolt法检测iNOS和eNOS含量。结果发现LPS刺激后,iNOS表达明显升高,辛伐他汀处理后可下调HUVEC中iNOS的表达,NP组较SV组存在iNOS水平水平的改善,但组间差异无统计学意义,eNOS在LPS刺激后表达则显著降低,辛伐他汀可恢复eNOS在HUVEC中的表达,NP组对于eNOS的恢复效应要明显高于SV组,组间差异有统计学意义;iNOS/eNOS比值在LPS组显著升高,不同剂型辛伐他汀处理后明显降低,均有统计学意义,而在SV组和NP组间差异无统计学意义。见图 3。
|
| A, C:Western blot检测LPS及辛伐他汀不同剂型处理的HUVEC中iNOS蛋白表达水平;B, D:Western blot检测LPS及辛伐他汀不同剂型处理的HUVEC中eNOS蛋白表达水平;E:LPS及辛伐他汀不同剂型处理的HUVEC中iNOS/eNOS比值变化;与对照组比较,a P < 0.05,b P < 0.05;与LPS处理组比较,c P < 0.05, d P < 0.01 图 3 LPS及辛伐他汀不同剂型处理的HUVEC中iNOS/eNOS表达 |
|
|
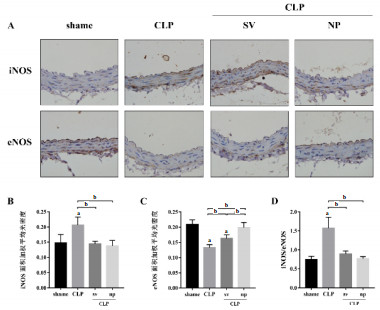
免疫组化结果(图 4)显示,与假手术组(shame)相比,CLP组eNOS蛋白的半定量表达明显降低(图 4A、C),而iNOS的半定量表达明显增高;SV和NP均有提高eNOS蛋白水平的效应,且NP较SV更有助于eNOS浓度的改善,差异有统计学意义;SV组和NP组中iNOS水平较CLP组逐渐下降,差异有统计学意义,SV组和NP组之间趋势有降低表现,差异无统计学意义;iNOS/eNOS的比值在CLP组显著升高,不同剂型辛伐他汀处理后明显降低,差异均有统计学意义,而在S V组和NP组间差异无统计学意义。
|
| A:免疫组化检测脓毒症小鼠腹主动脉iNOS和eNOS含量,400X光学显微镜下拍照分析;B:辛伐他汀不同剂型治疗的脓毒症小鼠腹主动脉iNOS吸光度值变化;C:辛伐他汀不同剂型治疗的脓毒症小鼠腹主动脉eNOS吸光度值变化;D:辛伐他汀不同剂型治疗的脓毒症小鼠腹主动脉iNOS/eNOS吸光度比值变化。与对照组比较,a P < 0.01;与脓毒症组比较,b P < 0.01 图 4 脓毒症小鼠腹主动脉iNOS/eNOS免疫组化分析 |
|
|
在临床实际工作中,口服制剂在危重症患者中往往受到了制约,比如不能吞咽或外科手术程序的患者。即便是进行了口服治疗,是否具有较好的生物利用度,均会影响药物的实际功效和应有的临床效应。目前虽然尚无他汀类药物的静脉制剂,但他汀类药物具有水溶性差,脂溶性强的特性,很适合进行纳米粒包载,将其转化为理想的静脉注射制剂,有可能解决以上临床难题,让他汀类药物可以真正合理地走入临床脓毒症治疗实践中。基于目前临床上对于脓毒症疾病发生的病理生理的理解,脓毒症中内皮细胞的核心特征是通透性增加及屏障功能丧失。既往研究认为,革兰阴性细菌的内毒素是细胞因子(IL-6)和肿瘤坏死因子(TNF-α)合成和释放的有效诱导剂[17]。一旦损伤因素始动,内皮细胞和巨噬细胞被诱导释放IL-1,然后通过激活一种转录因子NF-IL6刺激释放IL-6。此外,体内及体外研究也已证实TNF-α能增加内皮细胞的通透性。在体外条件下,凝血酶也能增加内皮细胞的通透性,并且和TNF-α协同作用使得内皮细胞屏障功能降低。既往研究显示他汀类药物影响炎症介质表达,可能产生对脓毒症有利的效应[18]。所以本研究选择IL-6和TNF-α两种炎症因子作为对于他汀药物影响脓毒症的可能作用环节。本研究结果反映出辛伐他汀静脉制剂和纳米粒制剂虽然不能抑制LPS刺激增加的IL-6水平,但是可以降低培养的内皮细胞中由LPS诱导产生的TNF-α释放量,并且NP组较SV组抑制作用更佳,同时发现显示随着辛伐他汀对这些炎症物质水平的抑制,伴有血管内皮细胞凋亡的保护效应。
已有研究显示,他汀类药物能在脓毒症中发挥有益作用的可能机制是通过调整iNOS与eNOS之间的平衡,保护内皮功能,避免了脓毒症时因广泛内皮功能损伤而引发的一系列严重的病理生理变化。因为iNOS可以通过TNF-α、干扰素-γ等刺激细胞,经由细胞内核转录因子κB(NF-κB)系统和信号转导因子和转录激活因子信号转导通路调控合成,所以如果他汀类药物对于TNF- α的影响,可能会改变iNOS的表达,从而下调NO合成,从而阻止毛细血管渗漏,改善脓毒症预后。同样既往研究显示,他汀类药物能通过抑制小g蛋白rho和影响小窝蛋白功能而调节eNOS的表达[19]。提示他汀类药物可以一方面增加eNOS表达水平,一方面抑制iNOS活性,所以在脓毒症时评价药物对iNOS与eNOS比例失衡状态的调节,可能是评价脓毒症内皮细胞保护,或内皮功能保护的重要机制[20]。本研究结果显示,应用Western blot测定内皮细胞中eNOS和iNOS蛋白表达,eNOS表达在LPS组降低明显,NP组对于eNOS的恢复效应要明显高于SV组;iNOS在LPS组表达则明显升高,辛伐他汀处理后可下调HUVEC中iNOS的表达,NP组较SV组存在iNOS水平的改善,但组间差异无统计学意义;iNOS/eNOS的比值在LPS组显著升高,不同剂型辛伐他汀处理后明显降低,差异均有统计学意义,而在SV组和NP组间差异无统计学意义。动物腹主动脉免疫组化显示出相同的趋势。CLP组eNOS蛋白半定量表达明显降低,而iNOS蛋白的半定量表达则明显增高;辛伐他汀不同制剂均可提高eNOS蛋白水平,且NP组较SV组更有助于eNOS水平的升高;而用辛伐他汀则同时可以使iNOS水平较CLP组明显下降,差异有统计学意义,而SV组和NP组之间虽有降低趋势,差异无统计学意义;iNOS/eNOS的比值在CLP组显著升高,不同剂型辛伐他汀处理后明显降低,均有统计学意义,而在SV组和NP组间差异无统计学意义。本研究结果提示iNOS/eNOS的平衡确实涉及了他汀类药物对于脓毒症血管内皮屏障功能的保护效应,尽管研究中仅有eNOS的表达在NP组与SV组差异有统计学意义,笔者推测可能是因为纳米粒辛伐他汀制剂存在一定的被动靶向效应,正如近年来体外和体内研究表明纳米粒对内皮细胞具有一定的靶向性。已有研究将匹伐他汀制备成纳米粒后, 体外实验显示纳米粒对内皮细胞的亲和力明显高于对比的骨骼肌细胞, 将纳米粒进行肌注后, 纳米粒可选择性靶向动静脉血管内皮细胞,并可在局部维持药物疗效达14 d [15, 21]。而近年来更多出现的主动靶向血管内皮的纳米粒制剂,确实带来了更多的展望,所以进一步改良纳米粒制剂,建立主动靶向的纳米粒剂型,明确其有益效应,可能是今后研究的方向。
综上所述,辛伐他汀可以抑制血管内皮细胞中TNF-α炎性因子的释放,阻遏内皮细胞的凋亡,可能涉及对iNOS/eNOS失衡的调节。纳米粒制剂与静脉制剂在保护效应上略有差异,可能需要进一步优化制剂,改良为主动靶向的纳米粒,并进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Jackevicius CA, Chou MM, Ross JS, et al. Generic atorvastatin and health care costs[J]. N Engl J Med, 2012, 366(3): 201-204. DOI:10.1056/NEJMp1113112 |
| [2] | Mermis JD, Simpson SQ. HMG-CoA reductase inhibitors for prevention and treatment of severe sepsis[J]. Curr Infect Dis Rep, 2012, 14(5): 484-492. DOI:10.1007/s11908-012-0277-1 |
| [3] | Ma S, Ma CC. Recent developments in the effects of nitric oxide-donating statins on cardiovascular disease through regulation of tetrahydrobiopterin and nitric oxide[J]. Vascul Pharmacol, 2014, 63(2): 63-70. DOI:10.1016/j.vph.2014.08.001 |
| [4] | Bi XY, He X, Zhao M, et al. Role of endothelial nitric oxide synthase and vagal activity in the endothelial protection of atorvastatin in ischemia/reperfusion injury[J]. J Cardiovasc Pharmacol, 2013, 61(5): 391-400. DOI:10.1097/fjc.0b013e318286baf3 |
| [5] | Smeeth L, Douglas I, Hall AJ, et al. Effect of statins on a wide range of health outcomes: a cohort study validated by comparison with randomized trials[J]. Br J Clin Pharmacol, 2009, 67(1): 99-109. DOI:10.1111/j.1365-2125.2008.03308.x |
| [6] | Feng Y. Efficacy of statin therapy in patients with acute respiratory distress syndrome/acute lung injury: a systematic review and meta-analysis[J]. Eur Rev Med Pharmacol Sci, 2018, 22(10): 3190-3198. DOI:10.26355/eurrev_201805_15080 |
| [7] | Lee MG, Lee CC, Lai CC, et al. Preadmission statin use improves the outcome of less severe sepsis patients - a population-based propensity score matched cohort study[J]. Br J Anaesth, 2017, 119(4): 645-654. DOI:10.1093/bja/aex294 |
| [8] | Masadeh M, Mhaidat N, Alzoubi K, et al. Antibacterial activity of statins: a comparative study of atorvastatin, simvastatin, and rosuvastatin[J]. Ann Clin Microbiol Antimicrob, 2012, 11: 13. DOI:10.1186/1476-0711-11-13 |
| [9] | Caffrey AR, Timbrook TT, Noh E, et al. Evidence to support continuation of statin therapy in patients with staphylococcus aureus bacteremia[J]. Antimicrob Agents Chemother, 2017, 61(3): pii: e02228-16. DOI:10.1128/AAC.02228-16 |
| [10] | Deshpande A, Pasupuleti V, Rothberg MB. Statin therapy and mortality from sepsis: a meta-analysis of randomized trials[J]. Am J Med, 2015, 128(4): 410-417. DOI:10.1016/j.amjmed.2014.10.057 |
| [11] | Kruger PS, Venkatesh B. Are there any benefits from statin treatment for the septic patient?[J]. Curr Atheroscler Rep, 2014, 16(1): 378. DOI:10.1007/s11883-013-0378-9 |
| [12] | Tralhão AF, Cés de Souza-Dantas V, Salluh J, et al. Impact of statins in outcomes of septic patients: a systematic review[J]. Postgrad Med, 2014, 126(7): 45-58. DOI:10.3810/pgm.2014.11.2832 |
| [13] | Mermis JD, Simpson SQ. Statin effect on sepsis mortality[J]. Chest, 2018, 153(4): 769-770. DOI:10.1016/j.chest.2017.12.004 |
| [14] | Lee CC, Lee MG, Hsu TC, et al. A population-based cohort study on the drug-speci?c effect of statins on sepsis outcome[J]. Chest, 2018, 153(4): 805-815. DOI:10.1016/j.chest.2017.09.024 |
| [15] | Oda S, Nagahama R, Nakano K, et al. Nanoparticle-mediated endothelial cell-selective delivery of pitavastatin induces functional collateral arteries (therapeutic arteriogenesis) in a rabbit model of chronic hind limb ischemia[J]. J Vasc Surg, 2010, 52(2): 412-420. DOI:10.1016/j.jvs.2010.03.020 |
| [16] | 汪日红, 郑霞, 姜赛平, 等. 辛伐他汀纳米粒降低脂多糖诱导人脐静脉内皮细胞损伤的初步研究[J]. 中华急诊医学杂志, 2013, 22(10): 1123-1127. DOI:10.3760/cma.j.issn.1671-0282.2013.10.012 |
| [17] | Song R, Kim J, Yu D, et al. Kinetics of IL-6 and TNF-α changes in a canine model of sepsis induced by endotoxin[J]. Vet Immunol Immunopathol, 2012, 146(2): 143-149. DOI:10.1016/j.vetimm.2012.02.008 |
| [18] | Gornik I. The effects of statins in sepsis and acuteinflammatory response[J]. Acta Med Croatica, 2015, 69(3): 197-201. |
| [19] | Balakumar P, Kathuria S, Taneja G, et al. Is targeting eNOS a key mechanistic insight of cardiovascular defensive potentials of statins?[J]. J Mol Cell Cardiol, 2012, 52(1): 83-92. DOI:10.1016/j.yjmcc.2011.09.014 |
| [20] | Subramani J, Kathirvel K, Leo MD, et al. Atorvastatin restores the impaired vascular endothelium-dependent relaxations mediated by nitric oxide and endothelium-derived hyperpolarizing factors but not hypotension in sepsis[J]. J Cardiovasc Pharmacol, 2009, 54(6): 526-534. DOI:10.1097/fjc.0b013e3181bfafd6 |
| [21] | Kubo M, Egashira K, Inoue T, et al. Therapeutic neovascularization by nanotechnology -mediated cell-selective delivery of pitavastatin into the vascular endothelium[J]. Arterioscler Thromb Vasc Biol, 2009, 29(6): 796-801. DOI:10.1161/atvbaha.108.182584 |
 2020, Vol. 29
2020, Vol. 29




