2 山东省临沂市中心医院重症医学科 276400
2 Departmentof Critical Care Medicine, Linyi Central Hospital, Linyi 276400, China
雌激素受体相关受体(estrogen-related receptors, ERRs)作为能量稳态的中枢调节因子,可能与2型糖尿病和代谢综合征等代谢紊乱性疾病的病因有关[1],具有治疗代谢性疾病和癌症的潜力[2-4]。近期有研究发现,ERRα基因敲除小鼠对脂多糖刺激呈现加剧的系统性炎症反应,血清和组织器官促炎性因子表达升高,动物病死率增加[5]。本课题组前期的研究表明,ERRα抑制剂XCT790明显增加脓毒症大鼠肺组织损伤程度,增加肺组织的渗透性[6],因此笔者推测ERR α是脓毒症急性肺损伤时炎症反应的关键调节因子。本研究拟通过重组慢病毒介导的ERRα基因(shERRα)转染大鼠肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs),观察沉默ERRα基因对LPS诱导的细胞内炎症反应的影响,探讨ERRα在脓毒症急性肺损伤中对炎症的调节机制。
1 材料与方法 1.1 实验材料与试剂大鼠PMVECs细胞购买于北京北纳创联生物技术研究院;重组慢病毒shERRα的构建、包装、扩增、鉴定和纯化,及滴度为9.59×108 TU/mL的shERRα1(靶序列shERRα1:5’- ACTCTGACTCCGTGCACATTGCTC -3’; shERRα2:5’-AGGCAAAGTCCTGGCCCATTTCTC -3’)和慢病毒空白载体由武汉锐博生物科技有限公司完成。DMEM/F12培养基、胎牛血清(FBS)和胰酶购买于美国Gibco公司,T25细胞培养瓶、六孔板购买于美国Corning公司,Escherichia coli O26:B6 LPS购买于美国Sigma公司,并溶解于无菌PBS中。
1.2 PMVECs培养使用含0.25% EDTA的胰酶消化细胞至含有10%FBS的DMEM/F12培养基的培养皿中,置于37 ℃、含5% CO2的细胞培养箱,待细胞生长至80%~90%进行消化传代,取对数生长期细胞用于实验。
1.3 重组慢病毒感染PMVECs消化培养皿中的细胞,按照每孔3×105个将细胞接种在6孔板中,培养过夜后待细胞融合至50%左右,按照MOI(感染复数)值=10计算感染所需要的病毒量,每孔换为1 mL新鲜培养基并加入最适MOI的病毒体积,12 h后观察细胞状态并换液。感染48、72 h后荧光显微镜下观察感染效果,72 h后加入10 μg/mL的嘌呤霉素筛选稳定低表达的细胞株,筛选3代后使用5 μg/mL的嘌呤霉素持续培养。
1.4 实验分组正常细胞和基因敲低组细胞分别都设有LPS(20 μg/mL)处理组和无LPS处理组。待T25培养瓶中细胞密度到达90%~95%后,使用含0.25%EDTA的胰酶消化细胞,1 000 r/min离心5 min后用完全培养基重悬细胞,将细胞分为四组,分别为正常对照组(Ctr组)、正常细胞+LPS处理组(Ctr+LPS组)、shERRα1基因敲低组(shERRα1组)和shERRα1基因敲低组+LPS处理组(shERRα1+LPS组),将细胞接种于6孔板或96孔板中,每组3~5个副孔用于后续实验。
1.5 细胞活性测定将PMVECs细胞(每孔4 000个细胞)按分组接种到96孔板中,每组5个副孔,加入100 μL完全培养基,培养过夜使其充分贴壁。然后加入含有20 μg/mL LPS的无血清培养基处理6、12、24 h。处理后,向每个孔中加入10 μL cell counting kit-8(cck-8,中国碧云天,C0038),并将96孔板在37℃下孵育1 h。使用Perkin Elmer酶标仪测量570 nm处的吸光度。
1.6 细胞内炎性因子浓度检测四组细胞经过不同处理后,分别在6、12、18 h收集细胞及培养上清液,4 ℃离心15 min,取上清液于-20℃保存。采用酶联免疫吸附(ELISA, 中国碧云天,PT516、PI303)实验检测细胞培养上清液中TNF-α、IL-1β水平,按照试剂盒说明书操作。
1.7 Western blot蛋白检测细胞分组处理完成后,各组加入适量R IPA裂解液及蛋白酶抑制剂(PMSF、coctail、磷酸酶抑制剂混合物)提取细胞总蛋白,进行BCA蛋白浓度测定后,加入等量蛋白进行聚丙烯酰凝胶电泳,蛋白充分分离后将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,加入抗大鼠ERRα(Cell Signaling Technology,美国,13826S,1 : 1 000)、NF-κB p65(Abcam,英国,ab15502,1 : 1 500)、IkBα(Santa Cruz,SC-1643美国,1 : 500)、p-NF-κB p65(Cell Signaling Technology,3033S,1 : 1 000)、p-IkBα(Cell Signaling Technology,2859S,1 : 1 000),GAPDH(Abcam,ab181602,1 : 10 000)抗体,4℃孵育过夜后,加入羊抗兔多克隆二抗,室温孵育1 h后,Odyssey双色红外激光扫描成像系统扫描分析蛋白条带,以目的蛋白条带与内参条带的灰度值比值反映目的蛋白表达水平。
1.8 统计学方法使用GraphPad Prism 6.0软件分析数据。对计量资料进行正态性检验,正态分布的计量资料以均数±标准差(Mean±SD)表示,两组变量比较采用独立样本t检验,多组变量比较采用单因素方差分析,方差不齐时则用秩转换的非参数检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 PMVECs感染效率正常大鼠PMVECs形态呈梭形或多边形(图 1A、C),以MOI=10感染PMVECs细胞,荧光显微镜下观察绿色荧光蛋白的表达量(图 1B、D),发现shERRα1组(图 1A、B)及shERRα 2组(图 1C、D)绿色荧光蛋白表达量均大于80%。运用Western Blot检测ERRα的表达量,与正常组及shRNA组比较,shERRα1组及shERRα2组ERRα的表达量均明显下降,shERRα1组下降更为明显(图 1E、F)。
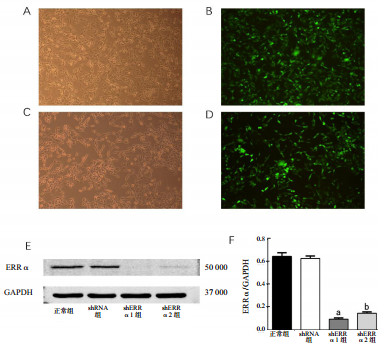
|
| shERRα1组为正常细胞感染shERRα1序列;shERRα2组为正常细胞感染shERRα2序列。正常大鼠PMVECs的细胞形态(A、C)以及感染72 h后,倒置荧光显微镜下观察的绿色荧光蛋白GFP的表达量(B、D)(×100);Western Blot检测四组细胞内ERRα的表达量(E、F);与正常组及shRNA组比较,a P < 0.01;与正常组及shRNA组比较,b P < 0.01 图 1 大鼠PMVECs的形态及感染效率 Fig 1 Infection efficiency and morphology of rat PMVECs |
|
|
为了研究ERRα对LPS刺激后的细胞活性的影响,用20 μg/mL的LPS刺激对照组(Ctr)组和shERRα1组细胞6、12和24 h,利用CCK-8试剂盒检测各组细胞的增殖活性。如图 2所示,与Ctr及shERRα1组比较,Ctr+LPS组细胞活性明显下降(P < 0.01),在LPS刺激12 h后细胞活性最低,并且shERRα1+LPS组细胞活性明显下降较Ctr+LPS组更为明显(P < 0.05)。结果表明,ERRα基因沉默将降低经过LPS刺激后细胞的增殖活性。
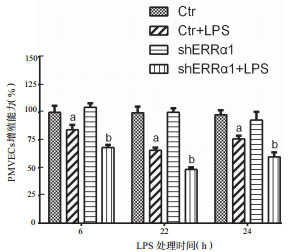
|
| Ctr+LPS组与shERRα1+LPS组细胞经过20 μg/mL LPS处理6、12和24 h处理后,用CCK-8试剂盒测量四组细胞的增殖能力。与Ctr及shERRα1组比较,a P < 0.05,与Ctr+LPS组比较,b P < 0.05 图 2 ERRα基因沉默对细胞增殖能力的影响 Fig 2 Effect of ERRα gene silencing on cell proliferation |
|
|
为进一步研究ERRα对LPS刺激后细胞内炎症因子水平的影响。Ctr+LPS和shERRα1+LPS组细胞经过20 μg/mL LPS刺激6、12和24 h后,应用ELISA检测四组细胞内TNF-α及IL-1β的浓度。如表 1所示,经过LPS刺激后,与Ctr组及shERRα1组比较,Ctr+LPS组细胞内TNF-α、IL-1β的浓度明显上升(P < 0.05),并于12 h时上升最为明显,24 h后开始下降;同时与Ctr+LPS组比较,shERRα1+LPS组细胞内TNF-α、IL-1β的浓度明显上升更为明显(P < 0.05)。因此推测ERRα基因沉默将增加LPS刺激后细胞内炎症因子的水平。
| 组别 | 样本数(孔) | IL-1β(ng/L) | TNF-α(ng/L) | |||||
| 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | |||
| Ctr组 | 3 | 13.52±4.08 | 14.41±3.86 | 14.48±1.62 | 15.26±1.02 | 15.76±3.38 | 16.96±2.58 | |
| Ctr+LPS组 | 3 | 616.72±47.71 a | 2 457.25±246.01 a | 1 202.81±133.46 a | 1 301.38±159.65 a | 2 875.64±100.06 a | 2 137.17±123.14 a | |
| shERRα1组 | 3 | 15.27±1.74 | 17.25±0.40 | 15.90±2.09 | 19.03±1.58 | 14.83±2.91 | 15.52±2.26 | |
| shERRα1+LPS组 | 3 | 2 704.84±225.07 b | 6 014.92±277.33 b | 3 087.56±368.87 b | 4 082.47±233.59 b | 5 498.91±367.95 b | 2 907.91±141.30 b | |
| 注:与Ctr及shERRα1组比较,a P < 0.05;与Ctr+LPS组比较,b P < 0.05 | ||||||||
为探索ERRα对细胞内LPS诱导的炎症反应的影响及相关机制,本研究通过Western blot检测NF-κB通路相关蛋白的表达水平,如图 3所示,经过20 μg/mL的LPS刺激1 2 h后,与Ctr组及shERRα1组比较,Ctr+LPS组p-p65、p-IKBα表达量明显升高,而IKBα的表达量明显降低(P < 0.05);而与Ctr+LPS组比较,shERRα1+LPS组变化趋势更为明显(P < 0.05)。结果表明,ERRα通过负性调节NF-κB通路的活性,而加剧LPS诱导的炎症反应。
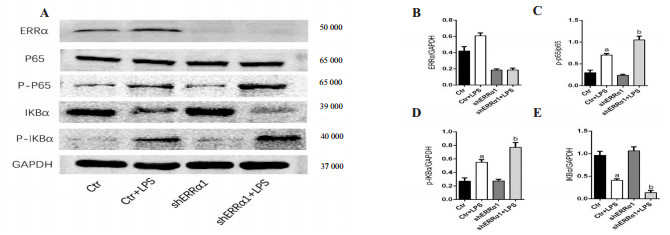
|
| NF-κB通路相关蛋白在四组细胞内的表达水平。A为代表性Western blot技术检测四组细胞中ERRα、p 65, p-p65、P-IKBα、IKBα蛋白的表达水平;B~E为ERRα、p-p65、P-IKBα、IKBα蛋白的定量分析; 与Ctr及shERRα1组比较,a P < 0.05;与Ctr+LPS组比较,b P < 0.05 图 3 ERRα对NF-κB炎症通路的影响 Fig 3 Effect of ERRα on NF-κB inflammatory pathway |
|
|
脓毒症和感染性休克的第三次国际共识定义“Sepsis 3.0”指出,脓毒症是宿主对感染产生的失控性反应,并出现危及生命的器官功能障碍之临床综合征[7]。肺是脓毒症时最易受损伤的靶器官,脓毒症病程早期可出现急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[8]。脓毒症急性肺损伤时,其主要病理特征为肺泡上皮细胞及毛细血管内皮细胞损伤,通透性增高,大量炎症细胞因子及富含蛋白质的液体大量渗出,造成弥漫性肺泡及肺间质水肿,进而透明膜形成,肺泡毛细血管扩散功能障碍[9]。因此,增强内皮细胞的稳定性或减轻局部炎性因子释放的疗法可以降低肺损伤的严重程度并改善患者预后[10]。
LPS作为革兰阴性菌的主要致病成分,通过激活核因子-κB(NF-κB)信号通路诱发肺组织产生大量促炎性因子,如TNF-α、IL-1β和IL-6,启动炎症级联反应,诱导炎症细胞浸润,改变肺泡内皮和上皮的通透,导致富含蛋白的水肿液渗出聚集在肺泡腔内,形成肺水肿,造成肺损伤[11-13]。LPS已成为了建立动物、细胞炎症反应的经典药物。本研究中,利用CCK8试剂盒对四组细胞的细胞活性进行检测,结果表明LPS明确降低了细胞增殖活性,而沉默ERR α基因能进一步降低细胞活性,反向证明ERRα对细胞的保护效应;同时细胞培养上清液中TNF-α、IL-1β经过LPS刺激后有所升高,缺乏ERRα时,TNF-α、IL-1β浓度进一步升高,表明ERRα能够负向调控细胞内的炎症反应,从而调节TNF-α、IL-1β的表达。
NF-κB是一个转录因子蛋白家族,在许多细胞刺激介导的转录调控中起核心作用,参与多种基因的表达和调控,在细胞炎症反应、免疫应答、凋亡和增殖等多种细胞活动中发挥重要作用。在正常情况下,NF-κB与细胞质中的抑制蛋白IκB相结合,抑制转录因子的核转位,在急性肺损伤时,IκB被IκB激酶α/β(IKKα/β)磷酸化,导致IκB蛋白酶体依赖性的降解,游离的NF-κB被磷酸化并异位至细胞核激活靶基因的表达[14]。NF-κB p65能够激活下游基因TNF-α、IL-1β和IL-6的表达,这些基因能够诱导白细胞浸润和细胞因子分泌,进一步促进炎症反应[15]。本实验通过Western bolt表明,沉默大鼠肺微血管内皮细胞ERRα的表达,能够进一步激活LPS诱导胞内NF-κB通路活性,而正常情况下基因沉默ERRα对NF-κB通路活性没有影响,说明ERRα能够负性调控NF-κB通路活性。其机制可能为ERRα基因能够调节编码NF-κB抑制蛋白IκB的NFκBia基因的转录[16]且通过维持NAD+水平和sirtuin1的活化来控制p65乙酰化来调节NF-κB信号传导[5]。
综上所述,本研究证明了ERRα基因通过抑制NF-κB信号通路激活,减轻系统性炎症反应,从而缓解LPS诱导的急性肺损伤。因此,通过正向调节ERRα的活性能够治疗包括ALI在内的炎症相关性疾病。这为临床治疗脓毒症急性肺损伤提供了新的靶点和理论依据。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Audet-Walsh E, Giguere V. The multiple universes of estrogen-related receptor alpha and gamma in metabolic control and related diseases[J]. Acta Pharmacol Sin, 2015, 36(1): 51-61. DOI:10.1038/aps.2014.121 |
| [2] | Ariazi EA, Jordan VC. Estrogen-related receptors as emerging targets in cancer and metabolic disorders[J]. Curr Top Med Chem, 2006, 6(3): 203-215. DOI:10.2174/1568026610606030203 |
| [3] | Deblois G, Giguere V. Functional and physiological genomics of estrogen-related receptors (ERRs) in health and disease[J]. Biochim Biophys Acta, 2011, 1812(8): 1032-1040. DOI:10.1016/j.bbadis.2010.12.009 |
| [4] | Deblois G, Giguere V. Oestrogen-related receptors in breast cancer: control of cellular metabolism and beyond[J]. Nat Rev Cancer, 2013, 13(1): 27-36. DOI:10.1038/nrc3396 |
| [5] | Yuk JM, Kim TS, Kim SY, et al. Orphan nuclear receptor erralpha controls macrophage metabolic signaling and A20 expression to negatively regulate TLR-induced inflammation[J]. Immunity, 2015, 43(1): 80-91. DOI:10.1016/j.immuni.2015.07.003 |
| [6] | 夏文芳, 张桓铭, 潘舟, 等. 雌激素相关受体α对脓毒症大鼠肺损伤的影响[J]. 中华危重病急救医学, 2019, 31(6): 699-703. DOI:10.3760/cma.j.issn.2095-4352.2019.06.008 |
| [7] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [8] | Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome: a clinical review[J]. Lancet, 2007, 369(9572): 1553-1564. DOI:10.1016/s0140-6736(07)60604-7 |
| [9] | Fan E, Brodie D, Slutsky AS. Acute respiratory distress syndrome: advances in diagnosis and treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [10] | Zhou Y, Li P, Goodwin AJ, et al. Exosomes from endothelial progenitor cells improve outcomes of the lipopolysaccharide-induced acute lung injury[J]. Crit Care, 2019, 23(1): 44. DOI:10.1186/s13054-019-2339-3 |
| [11] | Zhang K, Wang P, Huang S, et al. Different mechanism of LPS-induced calcium increase in human lung epithelial cell and microvascular endothelial cell: a cell culture study in a model for ARDS[J]. Mol Biol Rep, 2014, 41(7): 4253-4259. DOI:10.1007/s11033-014-3296-1 |
| [12] | Ghosh S, Hayden MS. New regulators of NF-kappaB in inflammation[J]. Nat Rev Immunol, 2008, 8(11): 837-848. DOI:10.1038/nri2423 |
| [13] | Jin LY, Li CF, Zhu GF, et al. Effect of siRNA against NF-kappaB on sepsisinduced acute lung injury in a mouse model[J]. Mol Med Rep, 2014, 10(2): 631-637. DOI:10.3892/mmr.2014.2299 |
| [14] | Wan C, Jin F, Du Y, et al. Genistein improves schistosomiasis liver granuloma and fibrosis via dampening NF-kB signaling in mice[J]. Parasitol Res, 2017, 116(4): 1165-1174. DOI:10.1007/s00436-017-5392-3 |
| [15] | Kanagasundaram NS. Pathophysiology of ischaemic acute kidney injury[J]. Ann Clin Biochem, 2015, 52(Pt2): 193-205. DOI:10.1177/0004563214556820 |
| [16] | Hong EJ, Levasseur MP, Dufour CR, et al. Loss of estrogen-related receptor alpha promotes hepatocarcinogenesis development via metabolic and inflammatory disturbances[J]. Proc Natl Acad Sci U S A, 2013, 110(44): 17975-17980. DOI:10.1073/pnas.1315319110 |
 2020, Vol. 29
2020, Vol. 29




