2 浙江省台州医院急诊科 317000
过去的十年里,高流量氧疗(HFOT)被广泛用于临床治疗各种原因引起的低氧血症。2010年发表的一项应用HFOT的观察性研究,比较了20例低氧血症性ARF患者应用HFOT与标准氧疗比较的临床疗效[1]。作者发现,与标准氧疗相比应用HFOT的患者具有更好的舒适性,呼吸频率和血液氧合明显改善。HFOT的有益效果可通过其良好的耐受性和生理学特征来解释,后者包括准确的吸入氧气体积分数(FiO2)、一定水平的呼气末正压(PEEP)效应及连续死腔冲刷以降低呼气末及动脉血CO2水平,减少呼吸功等[2-5]。目前的研究多集中在经鼻高流量氧疗(NHFO),通过气管切开导管进行高流量氧疗(THFO)是否具有相同的PEEP效应有待进一步研究。重型颅脑损伤患者气管切开后很大程度需要长期保留人工气道以维持气道通畅,这类患者的气道湿化与氧疗是临床的一大难点。重型颅脑损伤患者经气切导管给予高流量给氧是否产生同样的呼气末正压(PEEP)效应,是否对患者生命体征、氧合和气体交换产生有利影响,值得进一步研究。
1 资料与方法 1.1 研究对象选取浙江大学医学院附属邵逸夫医院急诊监护室自2018年7月1日到12月31日因颅脑损伤入院行气管切开术后的患者。纳入标准:年龄18~70岁;GCS≤8;成功脱机超过24 h;生命体征平稳;P/F > 200。排除标准:既往有心、肺疾病史,包括各种心脏病、COPD、哮喘等;不适宜做电阻抗断层成像(EIT)(例如有植入式除颤器、EIT皮带定位处有伤口敷料或胸部引流管的患者等)。
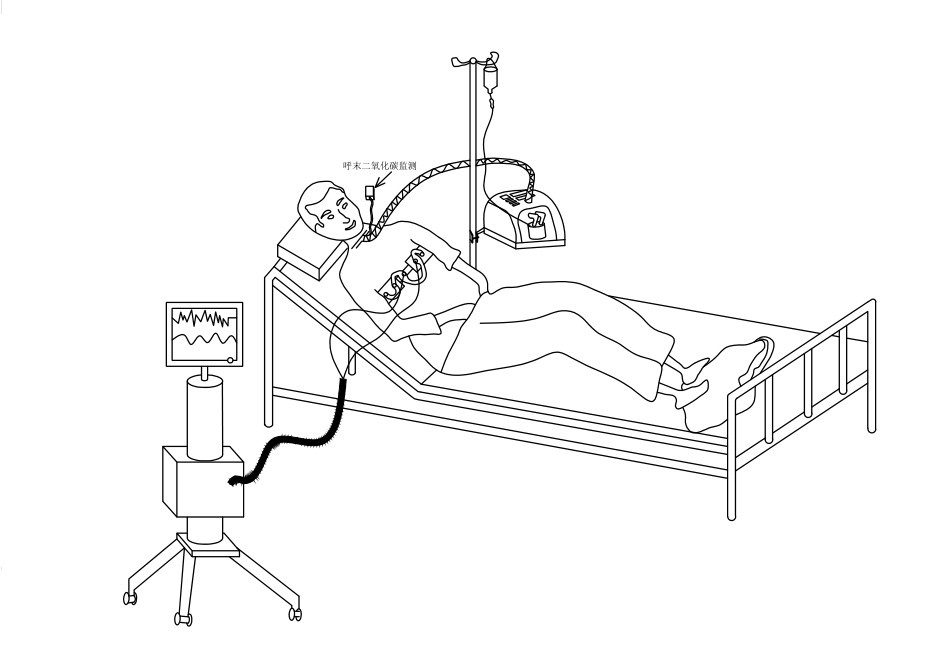
1.2 研究方法患者保持半卧位(床头摇高30°~45°),使用EIT皮带缠绕患者胸部的第五或第六肋间隙,皮带位置上下缘做标记,连接EIT(PulmoVista®500; DrägerMedicalGmbH,德国吕贝克)。气管切开口监测呼气末二氧化碳值(PECO2)。给文丘里气切面罩氧疗保持患者SpO2在95%以上。30 min后选择相应的连接装置(图 1),改成经气切管高流量氧疗(AIRVO,Fisher and Paykel Healthcare,新西兰奥克兰),设置流量自30 L/min、45 L/min到60 L/min,氧浓度设置维持SpO2在95%以上,各个流量分别持续30 min。文丘里面罩氧疗(MO)30 min后;THFO 30 L/min、THFO 45 L/min及THFO 60 L/min各30 min后,记录EIT数据。EIT数据将通过软件导出分析,数据包括整肺呼气末容积变化(ΔEELI glob)及重力依赖区肺部呼气末容积变化(ΔEELI dep)。患者在呼吸过程中出现的潮气电阻值代替患者潮气量(VT)。记录患者呼吸频率、心率、血压、PECO2及动脉血气变化。研究采用自身前后对照试验,在整个研究过程中周围环境保持安静,停止翻身、体位更换等其他影响EIT监测的护理操作。
|
| 图 1 实验连接示意图 |
|
|
EIT数据存储后先通过专用软件进行离线分析(DrägerEIT数据分析工具和EITdiag; DrägerMedicalGmbH)[6]。之后所有数据应用SPSS 17.0统计软件进行分析,正态分布变量用均数±标准差(Mean±SD)表示,非正态分布变量用中位数表示。各研究阶段所得的不同THFO流量变量之间的差异,采用重复测量的单向方差分析(ANOVA)进行检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料20例(12例为男性)GCS平均7分的重型颅脑损伤患者纳入研究,整体平均年龄50岁。患者脱机时平均已接受机械通气5 d,氧合指数P/F(261±36)mmHg(1 mmHg=0.133 kPa)。实验当天简化急性生理学分数(SAPS Ⅱ)(23±5)分,序贯器官衰竭评分(SOFA)(6±2)分,格拉斯哥昏迷评分(GCS) 7分。
2.2 经气切管高流量氧疗时的PEEP效应使用THFO时ΔEELI glob和MO状态下比较,出现了明显的下降(P < 0.05)。肺容积的下降主要表现在非重力依赖区肺,ΔEELI dep也出现了相应的下降,但其变化差异无统计学意义(P=0.356)。根据潮气电阻值替代的潮气量在MO和THFO时数值平稳,并没有出现明显变化。
2.3 THFO对生命体征的改变患者呼吸频率在THFO时出现了明显的下降,和MO比较差异具有统计学意义(P < 0.05),但THFO流量的增加,RR并没有出现统计学意义的下降。患者动脉血气氧分压及P/F较MO时出现了非常明显提高(P < 0.01),但THFO流量增加并没有使氧合出现进一步的增加,差异无统计学意义(P > 0.05)。PECO2和PaCO2在THFO时出现了明显的下降,而且随着THFO流量的增加,PECO2和PaCO2的数值进一步下降(P值< 0.05),但是血二氧化碳分压的下降,并没有使患者血pH出现统计学意义的升高。其余潮气量、血压和心率在THFO和MO时并没有明显变化(表 1)。
| 项目 | MO组 | THFO 30 L/min组 | THFO 45 L/min组 | THFO 60 L/min组 | P1值 | P2值 |
| ΔEELI glob | - | 17±5 | 12±6 | 4±7 | - | <0.05 |
| ΔEELI dep | - | 7±9 | 5±7 | 2±5 | - | 0.356 |
| VT | - | 2±5 | 1±2 | 1±1 | - | 0.879 |
| SBP (mmHg) | 131±20 | 129±24 | 120±14 | 125±29 | 0.059 | 0.679 |
| MAP (mmHg) | 90±8 | 94±10 | 86±6 | 92±11 | 0.645 | 0.764 |
| HR (次/min) | 90±20 | 89±19 | 87±15 | 85±17 | 0.446 | 0.355 |
| RR (次/min) | 28±10 | 26±7 | 23±7 | 24±8 | <0.05 | 0.554 |
| pH | 7.40±0.03 | 7.43±0.03 | 7.42±0.04 | 7.43±0.05 | 0.298 | 0.234 |
| PaO2 (mmHg) | 80±18 | 92±26 | 95±20 | 96±23 | <0.01 | 0.148 |
| P/F(mmHg) | 261±36 | 298±25 | 292±30 | 289±29 | <0.01 | 0.234 |
| PECO2 (mmHg) | 34±8 | 32±8 | 31±6 | 28±6 | <0.05 | <0.05 |
| PaCO2 (mmHg) | 42±8 | 38±6 | 36±4 | 34±4 | <0.05 | <0.05 |
| 注:MO,普通氧疗;THFO,经气管切开管高流量;ΔEELI glob,整肺呼气末肺容积变化;ΔEELI dep,重力依赖区肺容积变化;VT,由潮气电阻值替代的潮气量;SBP,收缩期动脉血压;MAP,平均动脉压;HR,心率;RR,呼吸频率;pH,酸碱度;PaO2,动脉血氧分压;PECO2,气切口呼气末二氧化碳分压;PaCO2,动脉血二氧化碳分压;P1值,M及不同THFO流量比较时的P值;P2值,THFO三种不同流量时的P值比较 | ||||||
高流量氧疗使用安全且禁忌证很少,近年来在各ICU、急诊室及相关呼吸重症病房应用越来越广泛。HFOT提供的上呼吸道内高速恒定气流可提供高吸入氧浓度、PEEP效应和死腔冲刷排除CO2等特定生理效果。高速气流产生的PEEP被认为是HFOT改善患者氧合非常重要的一个原因。Parke等[7]测量外科术后患者应用不同流量水平HFOT时的鼻咽部压力时发现,患者自主呼吸时鼻咽部压力与气体流量线性相关,且闭口呼吸时鼻咽部压力显著增加[(气体流量为50 L/min时闭口呼吸压力会 > 3 cmH2O(1 cmH2O=0.098 kPa),而张口呼吸时压力 < 2 cmH2O)]。
EIT是一种非侵入性、无辐射、功能性的成像技术。它利用肺组织生物阻抗的变化,在呼吸循环期间提供通气分布、肺容量和区域肺力学信息[8]。EIT已被成功证明了与其他几种成像和测量方式相对应的线性相关性[9-10]。2011年Corley等[11]使用电阻抗扫描发现与标准氧疗相比,应用经鼻高流量的心脏外科术后患者呼气末肺容量(EELI)增加了25.6%(P < 0.01)。2017年意大利Mauri等[5]使用德尔格公司电阻抗法断层扫描(EIT)评估低氧血症性ARF患者肺容量的生理学研究发现,患者整体EELI比普通面罩出现明显增加(P < 0.01),而且肺重力依赖区和肺非重力依赖区变化接近,这提示肺泡复张可能是PEEP的效应。研究采用的都是经鼻高流量,对于气管切开的患者使用高流量是否也能产生一定的PEEP效应需要进一步研究。
重型颅脑损伤患者由于自身气道保护能力的下降,最终选择气切的概率很高。气管切开后使用高流量氧疗30 L/min,患者的EELI相较于气切面罩氧疗下降了(17±5)%,随着流量的进一步增加,EELI继续下降,虽然幅度在减少,但整体的下降趋势呈现统计学变化(P < 0.05),这一现象与之前经鼻高流量结果是相反的。可能的原因包括:(1)经鼻高流量时,鼻腔开口容积相对较小,高流量下经鼻呼气时,会产生明显的呼气阻力,即PEEP效应。但当患者张口呼吸时,大量气体从口部泄漏会导致PEEP水平明显下降。而经气管切开口进行呼气时,由于气管切开口孔径相对偏大,HFOT时PEEP效应不明显。(2)低氧血症的患者进行高流量时,一定水平的压力可以开放塌陷的肺泡,使肺容积增加。但是,呼气相的阻力(PEEP)同样会引起患者呼气肌做功,使自身的肺容积回复到原本的功能残气量位。有关于呼气肌的综述中明确提到:PEEP会导致呼气肌做功增加,腹腔内压增加,患者EELI下降[12]。同时呼气肌做功会增加胸腔内压力,使跨肺压下降,膈肌也会处于相对的功能位,最终导致患者肺应力下降,吸气肌做功下降。本研究发现EELI随着THFO流量变化虽然整体上出现了下降,但是肺EELI下降的区域主要表现在肺的非重力依赖区,重力依赖区肺并没有明显的表现(P=0.356),有的甚至还出现了轻微的升高。而低氧血症“肺塌陷”主要表现在重力依赖区。因此,我们猜测,THFO会使呼气相阻力增加,导致患者呼气肌做功,从而使监测的EELI数值下降。目前可以通过超声监测腹部肌肉(主要包括腹横肌)在呼气相增厚来评估呼气肌做功,但呼气肌具体增厚多少是呼气肌做功增加并没有统一的标准,笔者将在后续的研究中去探查THFO时EELI的下降是否因为呼气肌做功引起,并尝试探讨呼气肌做功的阳性标准。(3)在吸气相时,高流量可克服气道做功,改善通气和氧合,而且患者根据潮气电阻值替代的潮气量在THFO和MO状态下并没有变化,呼吸频率在THFO时甚至比MO状态下更低,提示患者EELI的下降并不是肺不张的发生原因。有关气切高流量下膈肌及呼气肌做功变化有待进一步研究。
本研究患者为颅脑损伤且伴或不伴轻度低氧血症(P/F为261±36 mmHg),但在应用THFO后患者P/F明显提高(P < 0.01),呼吸频率也有明显的下降(P < 0.05),虽然进一步增加THFO流量并没有出现统计学意义的变化,但THFO给患者带来了氧合的改善。我国最新的关于《成人经鼻高流量湿化氧疗临床规范应用专家共识》推荐外科手术后脱机序贯应用HFNC可以提高患者的舒适度,改善轻度低氧血症患者的氧合[13]。另外,随着流量的增加PECO2下降,血PaCO2也随之下降(P < 0.05),高流量可以冲刷上气道的CO2[14],但是二氧化碳分压的变化,并没有引起动脉血pH产生统计学意义的变化,这可能和患者自身的代谢性因素代偿性变化有关。随着流量的增加,血二氧化碳进一步减少能引起吸气驱动改善,这被认为可以改善肺力学[15-17],这和先前的研究结论是相似的。但是,患者氧合功能的改善、CO2水平的下降,并没有使患者出现潮气量、血pH、血压及心率的改变。这可能因为颅脑损伤患者本身并没有明显的肺部病变,因此通气功能的进一步提高并没有出现生命体征明显的变化。
本研究存在一定的局限性。首先,每个氧疗阶段研究时间只有30 min。根据以前的研究,30 min应该是足够长的时间来获得对吸气努力、肺容量和气体交换的稳定性的影响,但是仍不能排除更长时间的氧疗可能有不一样PEEP效应。其次,EIT图像显示大约为一半的肺部区域,因此不能用于测量肺体积沿垂直轴变化,无法标识背侧肺与腹侧肺在这一过程中的变化。第三,本研究样本量小,而且集中在颅脑损伤的患者,在本研究中,它被设计为PEEP效应的研究,但THFO带来的具有潜力的信息,有可能改变临床对气管切开颅脑损伤患者氧疗方式的选择。第四,并没有衡量患者使用THFO的不良反应并发症,而只是评估了患者呼吸系统相关的生理指标。
综上所述,在气管切开的颅脑损伤患者中,高流量氧疗并没有发现PEEP效应,相反呼气末肺容积(非重力依赖区肺容积)会随着流量的增加而减小。与文丘里气切面罩相比,经气切导管高流量氧疗能显著改善患者的氧合、血二氧化碳浓度及呼吸频率。但本研究样本量有限,需要进行进一步研究探讨呼气末肺容积下降的原因。
| [1] | Roca O, Riera J, Torres F, et al. High-flow oxygen therapy in acute respiratory failure[J]. Respir Care, 2010, 55(4): 408-413. |
| [2] | Frat JP, Thille AW, Mercat A, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure[J]. N Engl J Med, 2015, 372(23): 2185-2196. DOI:10.1056/NEJMoa1503326 |
| [3] | Ste Phan F, Barrucand B, Petit P, et al. High-flow nasal oxygen vs noninvasive positive airway pressure in hypoxemic patients after cardiothoracic surgery: a randomized clinical trial[J]. JAMA, 2015, 313(23): 2331-2339. DOI:10.1001/jama.2015.5213 |
| [4] | Moller W, Celik G, Feng S, et al. Nasal high flow clears anatomical dead space in upper airway models[J]. J APPl Physiol, 2015, 118(12): 1525-1532. DOI:10.1152/japplphysiol.00934.2014 |
| [5] | Mauri T, Turrini C, Eronia N, et al. Physiologic effects of high-flow nasal cannula in acute hypoxemic respiratory failure[J]. Am J Respir Crit Care Med, 2017, 195(9): 1207-1215. DOI:10.1164/rccm.201605-0916OC |
| [6] | Mauri T, Eronia N, Abbruzzese C, et al. Effects of sigh on regional lung strain and ventilation heterogeneity in acute respiratory failure patients undergoing assisted mechanical ventilation[J]. Crit Care Med, 2015, 43(9): 1823-1831. DOI:10.1097/CCM.0000000000001083 |
| [7] | Parke RL, Eccleston ML, McGuinness SP, et al. The effects of flow on airway pressure during nasal high-flow oxygen therapy[J]. Respir Care, 2011, 56: 1151-1155. DOI:10.4187/respcare.01106 |
| [8] | Kobylianskii J, Murray A, Brace D, et al. Electrical impedance tomography in adult patients undergoing mechanical ventilation: a systematic review[J]. J Crit Care, 2016, 35: 33-50. DOI:10.1016/j.jcrc.2016.04.028 |
| [9] | Van der Burg PS, Miedema M, de Jongh FH, et al. Cross-sectional changes in lung volume measured by electrical impedance tomography are representative for the whole lung in ventilated preterm infants[J]. Crit Care Med, 2014, 42(6): 1524-1530. DOI:10.1097/CCM.0000000000000230 |
| [10] | Mauri T, Eronia N, Turrini C, et al. Bedside assessment of the effects of positive end-expiratory pressure on lung inflation and recruitment by the helium dilution technique and electrical impedance tomography[J]. Intensive Care Med, 2016, 42(10): 1576-1587. |
| [11] | Corley A, Caruana LR, Barnett AG, et al. Oxygen delivery through high-flow nasal cannulae increase end-expiratory lung volume and reduce respiratory rate in post-cardiac surgical patients[J]. Br J Anaesth, 2011, 107: 998-1004. DOI:10.1093/bja/aer265 |
| [12] | Shi ZH, Jonkman A, de Vries H, et al. Expiratory muscle dysfunction in critically ill patients: towards improved understanding[J]. Intensive Care Med, 2019, 45(8): 1061-1071. DOI:10.1007/s00134-019-05664-4 |
| [13] | 中华医学会呼吸病学分会呼吸危重症医学学组, 中国医师协会呼吸医师分会危重症医学工作委员会. 成人经鼻高流量湿化氧疗临床规范应用专家共识[J]. 中华结核和呼吸杂志, 2019, 42(2): 83-91. DOI:10.3760/cma.j.issn.1001-0939.2019.02.003 |
| [14] | Onodera Y, Akimoto R, Suzuki H, et al. A high-flow nasal cannula system set at relatively low flow effectively washes out CO2 from the anatomical dead space of a respiratory-system model[J]. Korean J Anesthesiol, 2017, 70(1): 105-106. DOI:10.4097/kjae.2017.70.1.105 |
| [15] | Möller W, Feng S, Domanski U, et al. Nasal high flow reduces dead space[J]. J Appl Physiol, 2017, 122(1): 191-197. DOI:10.1152/japplphysiol.00584.2016 |
| [16] | Vargas F, Saint-Leger M, Boyer A, et al. Physiologic effects of high-flow nasal cannula oxygen in critical care subjects[J]. Respir Care, 2015, 60(10): 1369-1376. |
| [17] | Mundel T, Feng S, Tatkov S, et al. Mechanisms of nasal high flow on ventilation during wakefulness and sleep[J]. J Appl Physiol, 2013, 114(8): 1050-1065. |
 2019, Vol. 28
2019, Vol. 28




