2 江苏省连云港市第一人民医院急诊医学科 222000
2 Department of Emergency Medicine, Hospital of Lianyungang Affiliated to Xuzhou Medical University, Lianyungang 222000, China
肺复张(recruitment maneuver, RM)是急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的重要肺保护性治疗策略之一[1]。肺复张潜能评估对于改善通气,减少呼吸机相关性肺损伤具有重要价值[2]。目前评估肺复张潜能的方法主要有影像学评估、床边超声评估及功能性评估(如氧合指数)等[3],但各种方法临床操作实施均有利弊。如何从机械通气自身角度寻找一种可靠的力学能量指标用于评估肺复张潜能,对指导临床肺复张策略的精确实施具有重要价值[4]。近3年,机械功(mechanical power, MP)的概念在ARDS肺保护通气策略的研究中开始提出并被重视[5]。机械功指机械通气过程呼吸机一分钟内对整个呼吸系统所做的功,它涵盖了多种力学因素如潮气量、肺顺应性、气道峰压、驱动压、气道阻力、流速、PEEP及呼吸频率等对肺脏的综合作用结果[6]。Gattinoni等[7-8]通过动物及临床研究证实机械功可以更好用于判断及评估ARDS肺通气状态及肺组织损伤的严重程度。本研究拟通过监测中重度ARDS患者肺复张前后机械功的变化,以探讨其对ARDS患者肺复张潜能的评估价值及对患者28 d生存状态的预测价值。
1 资料与方法 1.1 研究对象依次选择2017年4月至2019年4月本院ICU需要有创机械通气治疗的中重度ARDS患者。
1.1.1 纳入标准年龄≥18周岁,符合2012年ARDS柏林定义对中重度ARDS诊断标准,P/F≤200 mmHg (1 mmHg=0.133 kPa),行机械通气治疗超过24 h。
1.1.2 排除标准年龄<18岁;妊娠;气胸;胸部外伤及胸壁辅料包扎;严重血流动力学异常;严重心功能不全及急性冠脉综合征;存在肺大泡病史等。
1.1.3 剔除标准自动退出或因RM过程严重血流动力学障碍。
1.2 伦理审查本研究经医院伦理委员会批准,审批号LCYJ20170326001,所有患者入组均取得患者家属同意并签署知情同意书。
1.3 研究方法 1.3.1 对ARDS患者行肺复张治疗根据标准流程实施肺保护性通气策略,设置潮气量为6 mL/kg,平台压 < 30 cmH2O (1 cmH2O=0.098 kPa),初始根据PEEP-FiO2表格法设置高/低PEEP水平,调节PEEP和FiO2维持氧合目标:SpO2 88%~95%和PaO2 55~80 mmHg[9]。根据病情给予RM治疗,RM前充分镇静,必要时肌松。采用压力控制模式(PCV)进行复张,设PC 15~20 cmH2O,PEEP 25~30 cmH2O,R 10~20次/min,I:E为1:1,持续60~90 s,视复张压力与循环状态而定,保持FiO2在RM前原有水平,通过观察SpO2的变化评价RM效果。RM之后PEEP设置方法为最初将PEEP设置为20 cmH2O,维持SpO2 92%~95%, 每10 min降低PEEP 2 cmH2O,直至患者SpO2显著下降,确认氧合下降前的PEEP水平为最佳PEEP,此时需重复肺复张操作, 然后把PEEP重新设置在上述水平。中重度ARDS每日进行一至两次RM治疗或根据病情而定。
1.3.2 监测ARDS患者肺复张前后MP监测患者24 h内首次RM前及RM后1 h机械通气力学参数,包括驱动压DP,呼吸频率RR,气道峰压Ppeak,潮气量VT,呼气末正压PEEP,胸廓顺应性CCW、肺顺应性CCL。根据所得驱动压、气道峰压、呼吸频率及潮气量等呼吸机力学参数,由此计算并监测机械功,单位J/min,MP =0.098×RR×VT×(Ppeak-1/2DP)[6]。记录患者肺复张治疗前及治疗后1 h的MP,均测量3次取平均值。计算RM前后机械功变异ΔMP。
1.3.3 监测ARDS患者肺复张前后LUS评分采用美国Sonosite公司Edge超声诊断系统进行肺部超声评分(lung ultrasound score, LUS)。分别记录患者RM治疗前及治疗后1 h超声评分。超声影像定义[10]:①正常通气区(N):肺滑动征伴A线或少于2个单独的B线;②中度肺通气减少区(B1线):多发、典型B线;③重度肺通气减少区(B2线):多发融合的B线;④肺实变区(C):组织影像伴典型的支气管充气征。每个区域以最严重的表现评分:N为0分,B1线为1分,B2线为2分,C为3分。LUS评分为每个区域评分的总和,分值在0~36分。为评估肺部各区域通气状态的变化,将在RM前后测量LUS评分改变(ΔLUS)定义为肺部再通气评分变异(aeration score variation ASV),用于判断肺部通气状态的改变[11]。
1.3.4 监测ARDS患者肺复张前后氧合指数及死腔容积所有患者在肺复张治疗前及治疗后1 h行血气分析,计算患者肺复张前后氧合指数(PaO2/FiO2即P/F)及氧合指数变化(ΔP/F);监测患者呼气末二氧化碳分压PetCO2,根据波尔方程Vd/Vt=(PaCO2-PetCO2)/PaCO2计算患者死腔容积比率Vd/Vt[11]及RM前后死腔比率变异(ΔVd/Vt)
1.4 统计学方法采用Graphpad Prism 6.0及SPSS 22.0软件进行数据处理及作图。计量资料用均数±标准差(Mean±SD)表示,两组间差异比较使用两独立样本t检验,计数资料比较采用χ2检验,P < 0.05为差异有统计学意义。将患者RM治疗后ΔLUS≥5分定义为肺复张潜能阳性组(recruitment maneuver potential-positive,RMP-P组),其余为肺复张潜能阴性组(recruitment maneuver potential-negative,RMP-N组),比较两组患者分别在肺复张前及复张后1 h的机械功差异。对ΔMP与ΔLUS,ΔP/F及ΔVd/Vt进行Pearson相关性分析。采用受试者工作特征曲线(ROC)分析ΔMP对ARDS患者肺复张潜能及28 d生存状态的预测价值。
2 结果 2.1 一般临床资料的比较依次筛选112例中重度ARDS患者,其中21例符合排除标准,入组91例,因严重循环障碍剔除8例,最终纳入83例,男性53例,女性30例。RMP-P组与RMP-N组两组间在性别、年龄、体质量、体质量指数、基础病史、氧合指数、血乳酸水平、APACHEⅡ评分、SOFA评分等基线水平比较,差异无统计学意义(均P > 0.05),以及肺复张治疗前LUS评分、机械功及其他机械通气力学参数比较,差异无统计学意义(均P > 0.05),见表 1。
| 指标 | RMP-P组(n=45) | RMP-N组(n=38) | t/χ2值 | P值 |
| 年龄(岁) | 58.75±15.57 | 62.42±15.62 | 1.068 | 0.289 |
| 女/男(例) | 17/28 | 13/25 | 0.337 | 0.736 |
| 体重(kg) | 62.36±10.21 | 61.63±12.54 | 0.292 | 0.771 |
| BMI(kg/m2) | 23.64±4.21 | 25.47±5.31 | 1.751 | 0.084 |
| SOFA(分) | 9.42±3.32 | 10.31±3.53 | 1.182 | 0.241 |
| APACHEⅡ(分) | 19.35±7.67 | 20.75±9.67 | 0.735 | 0.464 |
| Lac(mmol/L) | 6.84±3.23 | 7.23±3.24 | 0.547 | 0.588 |
| 基础病史(例) | 20/45 | 16/38 | 0.214 | 0.830 |
| PaO2/FiO2(mmHg) | 119.58±31.43 | 127.05±38.71 | 0.970 | 0.335 |
| MP(J/min) | 27.09±5.09 | 25.97±5.59 | 0.955 | 0.343 |
| LUS(分) | 20.65±3.75 | 19.79±4.29 | 0.975 | 0.332 |
| VT (mL) | 358.56±51.33 | 364.23±42.32 | 0.543 | 0.589 |
| PEEP(cmH2O) | 11.12±4.33 | 12.42±3.31 | 1.514 | 0.134 |
| DP(cmH2O) | 16.58±3.23 | 17.54±3.78 | 1.248 | 0.216 |
| PPlat(cmH2O) | 25.34±6.39 | 27.67±5.34 | 1.782 | 0.074 |
| FiO2 (%) | 65.34±22.14 | 63.65±24.53 | 0.330 | 0.742 |
| 注:基础病史包括高血压、糖尿病、冠心病、外伤手术史等;ARDS为急性呼吸窘迫综合征,BMI为体质量指数,SOFA为序贯器官衰竭评分,APACHEⅡ为急性生理学与慢性健康状况评分Ⅱ,PaO2/FiO2为氧合指数,Lac为血乳酸,MP为机械功,LUS为肺部超声评分,VT为潮气量,PEEP为呼气末正压,DP为驱动压,PPlat为平台压,FiO2为吸入氧体积分数 | ||||
RM前两组患者组间MP、LUS、P/F及Vd/Vt比较,差异无统计学意义(均P > 0.05);RM后1 h两组患者组内自身前后对照比较,MP、LUS及Vd/Vt均显著下降,P/F显著升高,差异有统计学意义(P均 < 0.05),RM后组间比较RMP-P组MP、LUS及Vd/Vt均显著低于RMP-N组,差异有统计学意义(P值分别为0.019,0.0002,0.018),而RM后两组间P/F比较,差异无统计学意义(P > 0.05),见表 2;此外,RMP-P组RM后ΔMP、ΔLUS及ΔVd/Vt显著高于RMP-N组(均P < 0.05),两组间ΔP/F比较,差异无统计学意义(P > 0.05),见表 3。
| 组别 | MP(J/min) | LUS(分) | P/F(mmHg) | Vd/Vt(%) |
| RMP-P组(n=45) | ||||
| RM前 | 27.09±5.09 | 20.65±3.75 | 119.58±31.43 | 24.60±3.53 |
| RM后 | 20.09±3.72a | 14.60±3.51a | 145.78±32.97a | 18.58±3.07a |
| RMP-N组(n=38) | ||||
| RM前 | 25.97±5.59 | 19.79±4.29 | 127.05±38.71 | 24.18±4.12 |
| RM后 | 22.34±4.89a, b | 17.63±3.56a, b | 143.79±31.36a, b | 20.95±3.62a, b |
| 注:MP为机械功,LUS为肺部超声评分,P/F为氧合指数,Vd/Vt为死腔容积比率,RM为肺复张;两组患者RM后自身前后比较,aP < 0.01;两组患者间同期比较,bP < 0.05 | ||||
| 组别 | 例数(例) | ΔMP(J/min) | ΔLUS(分) | ΔP/F(mmHg) | ΔVd/Vt(%) |
| RMP-P组 | 45 | 7.47±2.74 | 6.20±1.36 | 27.16±12.74 | 6.04±2.76 |
| RMP-N组 | 38 | 3.79±2.32 | 2.56±1.29 | 25.97±13.32 | 3.16±2.07 |
| t值 | 6.533 | 12.443 | 0.415 | 5.295 | |
| P值 | <0.01 | <0.01 | 0.679 | <0.01 | |
| 注:ΔMP为RM前后机械功变化,ΔLUS为肺部超声评分变化,ΔP/F为氧合指数变化,ΔVd/Vt为死腔容积比率变化,RM为肺复张 | |||||
所有患者RM前后ΔMP与ΔLUS、ΔP/F及ΔVd/Vt相关性分析显示,ΔMP与ΔLUS及ΔVd/Vt呈显著正相关(均P < 0.05,图 1A、B),与ΔP/F无明显相关性(P > 0.05,图 1C),而ΔLUS与ΔVd/Vt呈显著正相关(P < 0.05,图 1D)。
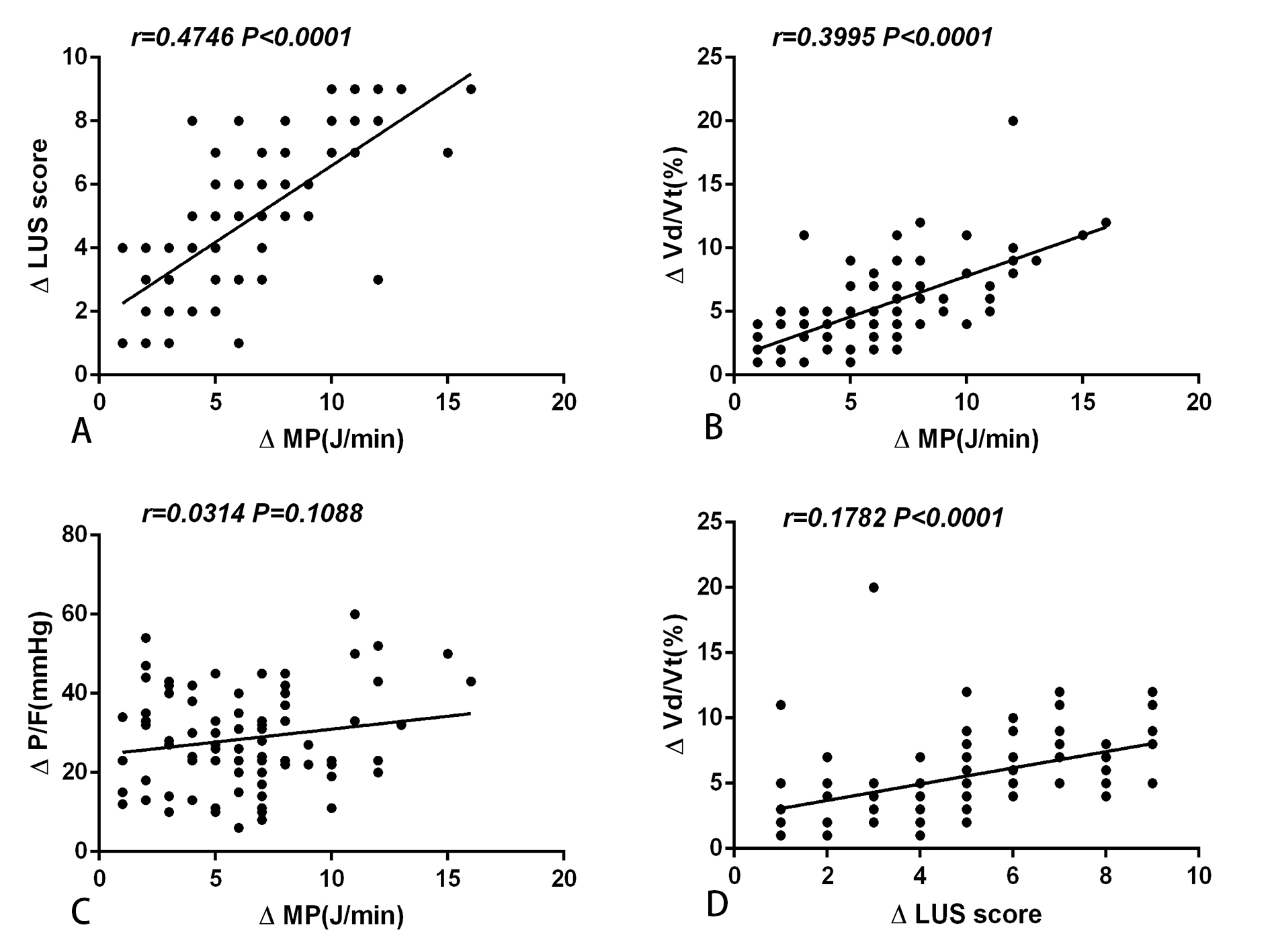
|
| 图 1 患者RM治疗后ΔMP与ΔLUS、ΔP/F及Vd/Vt相关性分析 Fig 1 Correlation analysis between ΔMP and ΔLUS, ΔP/F, Vd/Vt after RM in patients with ARDS |
|
|
根据肺部超声评分变化ΔLUS进行分组,采用ROC曲线分析患者RM前后ΔMP对ARDS患者肺复张潜能预测价值:ΔMP曲线下面积(AUC)0.856,最佳截断值为5.5 J/min时,敏感度为91.1%,特异度为63.2%;见图 2A。
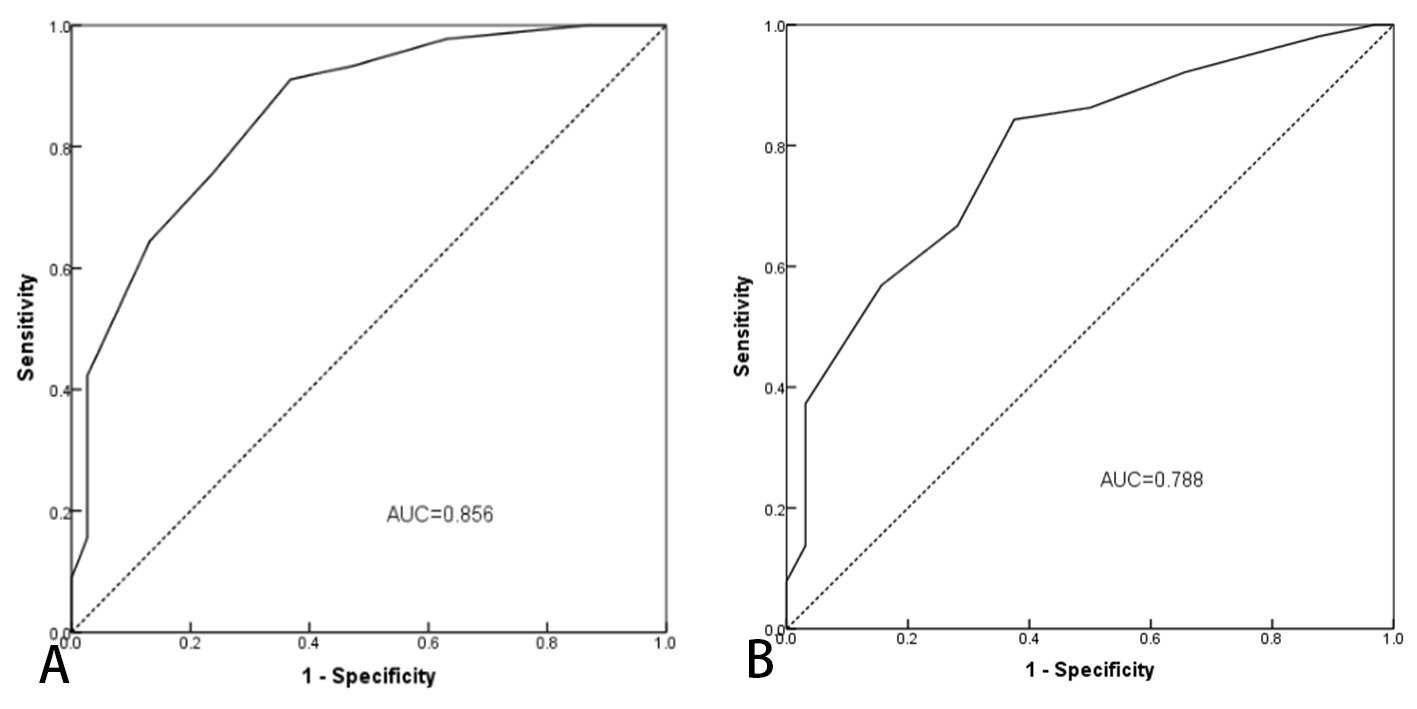
|
| 图 2 ΔMP对ARDS患者肺复张潜能及28天生存状态预测分析的ROC曲线 Fig 2 ROC of ΔMP in predicting the potential of RM and assessing prognosis in patients with ARDS |
|
|
根据患者28 d生存率情况,将患者分为存活组(51例)和死亡组(32例),总病死率为38.6%;ΔMP对ARDS患者预后评估的ROC曲线显示,ΔMP的曲线下面积为0.788,最佳截断值为4.5 J/min时,敏感度为84.3%,特异度为62.5%(P < 0.05),见图 2B。
3 讨论肺复张是指通过短暂地增加肺泡压和跨肺压以复张萎陷肺泡,从而达到显著改善氧合的一种方法,是目前中重度ARDS患者治疗中重要的策略之一[12]。在机械通气时,对每个患者肺复张潜能进行评估,并据此选择恰当的PEEP水平,精准干预,既可以使得肺泡得到充分复张,又可以减少广泛应用高PEEP引起的呼吸机相关性肺损伤,具有重要的临床意义[13]。尽管目前CT法仍被认为是评价肺复张潜能的金标准,但它需要将患者转运至ICU外,并会使患者遭受更多剂量的辐射,不能常规应用而且难以及时重复,限制了其应用。
目前,在ARDS患者中,肺部超声评分可有效地评估肺脏组织存在的肺泡塌陷,肺不张,肺脏水肿甚至肺实变情况[14],肺部超声的再通气评分已经被应用于评估ARDS患者肺可复张性,并且与CT结果之间存在显著相关性[15]。所以本项研究,根据患者肺复张前后再通气评分变异情况进行分组,虽然精确度没有CT法高,但临床可操作性更强。经过肺复张治疗后RMP-P组机械功及死腔比率均显著低于RMP-N组,而ΔMP、ΔVd/Vt显著高于RMP-N组,说明经过肺复张治疗后RMP-P组的萎缩塌陷的肺组织得到更加充分的复张,从而肺部通气面积及肺水肿状态改善更加显著,死腔容积减少更为明显,并在一定的时间窗内能够有效的改善了肺组织的顺应性,降低了气道整体阻力[16],从而降低了机械通气过程中呼吸机做功量。为维持患者氧合状态,保障对肺通气量的基本要求,对于存在更多肺泡塌陷、肺不张、顺应性差的肺组织,在行机械通气的过程中,必然需要更大的呼吸机做功,即需要更大的机械功,当顺应性及气道阻力得到改善后,所需开放及维持肺脏通气状态的机械做功必然降低[17]。本研究同时发现,两组患者在肺复张前后ΔMP与ΔLUS呈现显著正相关,两者同时又与死腔比率变异ΔVd/Vt具有显著相关性。进一步证明机械功与肺部超声评分在反映ARDS患者肺脏病理生理改变的基础上存在着一定的内在联系,两者均能较好地反映患者经肺复张治疗后生理死腔减小,通气状态改善。在氧合方面,两组患者在复张后氧合指数虽然较前均有改善,但组间比较并差异无统计学意义(P > 0.05),说明通气的改善仅为氧合改善的因素之一,患者氧合状态由于受到更多因素的影响,包括给氧浓度水平、肺换气功能等[18],因此其改善的程度与ΔMP无显著相关性。
本研究采用ROC曲线分析ARDS患者肺复张前后ΔMP对肺复张潜能的预测价值显示,ΔMP改变越大时,肺复张潜能越高。不同患者肺复张潜能差异很大,并且与肺损伤的整体严重程度以及不同的ARDS病因相关[19]。因此,笔者认为在调整最佳PEEP时,通过监测患者机械功对患者肺可复张性进行评价非常重要。对于病变局限的肺内源性ARDS的患者,肺复张治疗后肺脏顺应性及气道阻力改善可能不显著[20],肺复张潜能有限,多数患者机械功改变偏小,应设定较低的PEEP以减少呼吸性相关肺损伤;而对于弥漫性病变,复张治疗后机械功改变较大,说明肺复张潜能大,可在监测下设定较高的PEEP以改善肺的通气。本研究同时发现,ΔMP对ARDS患者预后评估有一定提示价值,其预测ARDS患者28 d生存状态的AUC为0.788,最佳截断值为4.5 J/min。说明当患者行肺复张治疗前后机械功变异较大时预示着患者可能有更高的存活率。
本研究探索机械功对肺复张潜能的评估价值,该方法的缺点为不能提供肺过度膨胀的信息,并且需要患者处于深度镇静甚至肌松状态。第二,采用LUS法进行肺复张潜能分组,其效价可能低于目前公认的“金标准”CT法。此外,本研究为单中心的小样本试验,病例数偏少,需要进一步的多中心的大样本的临床研究确认机械功在评价肺复张潜能的价值。
综上所述,中重度ARDS患者肺复张前后机械功监测对评估肺复张潜能具有一定的临床价值,对ARDS患者28 d生存具有一定预测价值。为进一步指导肺复张治疗及早期制定临床干预策略可提供有效依据。
| [1] | Mercado P, Maizel J, Kontar I. Moderate and severe acute respiratory distress syndrome: hemodynamic and cardiac eeffects of an open lung strategy with recruitment maneuver analyzed using echocardiography[J]. Crit Care Med, 2018, 46(10): 1608-1616. DOI:10.1097/CCM.0000000000003287 |
| [2] | Constantin JM, Godet T, Jabaudon M, et al. Recruitment maneuvers in acute respiratory distress syndrome[J]. Ann Transl Med, 2017, 5(14): 290. DOI:10.21037/atm.2017.07.09 |
| [3] | Beitler JRR, Majumdar R, Hubmayr RD. Volume delivered during recruitment maneuver predicts lung stress in acute respiratory distress syndrome[J]. Crit Care Med, 2016, 44(1): 91-99. DOI:10.1097/CCM.0000000000001355 |
| [4] | Acosta C M, Sara T, Carpinella M, et al. Lung recruitment prevents collapse during laparoscopy in children: A randomised controlled trial[J]. Eur J Anaesthesiol, 2018, 35(8): 573-580. DOI:10.1097/EJA.0000000000000761 |
| [5] | Gattinoni L, Quintel M. How ARDS should be treated[J]. Crit Care, 2016, 20: 86. DOI:10.1186/s13054-016-1268-7 |
| [6] | Wang GN, Chen XF, Zhang G, et al. A case of thyroid emergency with cardiac arrest supported by extracorporeal membrane oxygenation[J]. World J Emerg Med, 2018, 9(4): 288-290. DOI:10.5847/wjem.j.1920-8642.2018.04.009 |
| [7] | Gattinoni L, Marini JJ, Collino F, et al. The future of mechanical ventilation: lessons from the present and the past[J]. Crit Care, 2017, 21(1): 183. DOI:10.1186/s13054-017-1750-x |
| [8] | Gattinoni L, Tonetti T, Cressoni M, et al. Ventilator-related causes of lung injury: the mechanical power[J]. Intensive Care Med, 2016, 42(10): 1567-1575. DOI:10.1007/s00134-016-4505-2 |
| [9] | 中华医学会呼吸病学分会呼吸危重症医学学组. 急性呼吸窘迫综合征患者机械通气指南(试行)[J]. 中华医学杂志, 2016, 96(6): 404-424. DOI:10.3760/cma.j.issn.0376-2491.2016.06.002 |
| [10] | 李莲花, 杨倩, 李黎明, 等. 肺部超声评分评估急性呼吸窘迫综合征患者病情严重程度及预后的价值[J]. 中华危重病急救医学, 2015, 27(7): 579-584. DOI:10.3760/cma.j.issn.2095-4352.2015.07.008 |
| [11] | Wang XT, Ding X, Zhang HM, et al. Lung ultrasound can be used to predict the potential of prone positioning and assess prognosis in patients with acute respiratory distress syndrome[J]. Crit Care, 2016, 20(1): 385. DOI:10.1186/s13054-016-1558-0 |
| [12] | Kang H, Yang H, Tong Z. Recruitment manoeuvres for adults with acute respiratory distress syndrome receiving mechanical ventilation: a systematic review and meta-analysis[J]. J Crit Care, 2019, 50: 1-10. DOI:10.1016/j.jcrc.2018.10.033 |
| [13] | Xing XZ, Gao Y, Wang H J, et al. Effect of sedation on short-term and long-term outcomes of critically ill patients with acute respiratory insufficiency[J]. World J Emerg Med, 2015, 6(2): 147-152. DOI:10.5847/wjem.j.1920-8642.2015.02.011 |
| [14] | 床旁超声在急危重症临床应用专家共识组. 床旁超声在急危重症临床应用的专家共识[J]. 中华急诊医学杂志, 2016, 25(1): 10-21. DOI:10.3760/cma.j.issn.1671-0282.2016.01.005 |
| [15] | Bello G, Blanco P. Lung ultrasonography for assessing lung aeration in acute respiratory distress syndrome: a narrative review[J]. J Ultrasound Med, 2019, 38(1): 27-37. DOI:10.1002/jum.14671 |
| [16] | 刘志伟, 米玉红, 赵斌. 压力控制通气与容量控制通气在急性呼吸窘迫综合征治疗中的优劣[J]. 中华急诊医学杂志, 2018, 27(4): 349-352. DOI:10.3760/cma.j.issn.1671-0282.2018.04.001 |
| [17] | Xie Y, Qian Y, Liu K, et al. Correlation analysis between mechanical power and lung ultrasound score and their evaluation of prognosis in patients with acute respiratory distress syndrome[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2019, 31(6): 704-708. DOI:10.3760/cma.j.issn.2095-4352.2019.06.009 |
| [18] | Fan E, Brodie D, Slutsky AS. Acute respiratory distress syndrome: advances in diagnosis and treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [19] | Zampieri FG, Costa EL, Iwashyna TJ, et al. Heterogeneous effects of alveolar recruitment in acute respiratory distress syndrome: a machine learning reanalysis of the alveolar Recruitment for Acute Respiratory Distress Syndrome Trial[J]. Br J Anaesth, 2019, 123(1): 88-95. DOI:10.1016/j.bja.2019.02.026 |
| [20] | Chiumello D, Marino A, Brioni M, et al. Lung recruitment assessed by respiratory mechanics and computed tomography in patients with acute respiratory distress syndrome. what is the relationship?[J]. Am J Respir Crit Care Med, 2016, 193(11): 1254-1263. DOI:10.1164/rccm.201507-1413OC |
 2019, Vol. 28
2019, Vol. 28




