2 北京市大兴区中西医结合医院重症医学科 100076;
3 解放军总医院第五医学中心急诊科,北京 100071
百草枯中毒(paraquat, PQ)是继有机磷农药中毒后位于第2位但绝对病死率位于第1位的农药中毒。近10年来我国百草枯中毒人数逐渐增加,而治愈率仅有21.12%[1]。在人体,百草枯的致死剂量极小,仅为20~40 mg/kg,且中毒机制不明,目前公认的中毒机制为脂质过氧化(为暴发型中毒患者的主要死亡原因)和肺泡上皮细胞内百草枯氧化-还原循环(为中-重型中毒患者发生肺纤维化的主要原因),临床上,百草枯中毒患者的预后与服毒量呈线性关系[2],因此,明确百草枯在体内的代谢特点,了解百草枯进入机体后毒物代谢动力学,有助于百草枯中毒临床救治方案的改进。
1 材料与方法 1.1 实验材料高效液相色谱系统采用Waters 600E HPLC色谱仪、色谱工作站等(美国Waters公司),色谱柱CAPCELL PAK C18 AQ S5 (日本SHISEIDO公司),PQ标准品(美国Sigma公司),乙腈(美国JTBaker公司),三乙胺(美国JTBaker公司),三氟乙酸(赛默飞世尔科技有限公司),十二烷基硫酸钠(国药集团化学试剂有限公司),蒸馏水(实验室自制三蒸水)。
1.2 实验动物及分组SPF级成年健康雄性Wistar大鼠72只,体重在160~200 g,军事医学科学院实验动物中心提供[动物许可证号为SCXK(军)2007-004]。随机分成百草枯灌胃组(200 mg/kg)及百草枯腹腔注射组(35 mg/kg),其中,百草枯灌胃组30只,百草枯腹腔注射组42只,均采用单次给药方式染毒。百草枯灌胃组分别在染毒后0.5、1、2、4、6、8、24、48 h取血检测血浆中PQ浓度,并在染毒后8、24、48 h放血处死大鼠检测肺组织中PQ浓度。百草枯腹腔注射组分别在染毒后0.5、2、8、24、48、72及120 h后处死大鼠并取肺组织及血浆检测PQ浓度。
1.3 血及肺组织样品处理于大鼠眼眶静脉丛采血1 mL左右,加到含有20 mL肝素管中,离心(8 000 r/min,10 min),分离血浆,取血浆样品100 mL,加200 mL乙腈,涡旋混合3 min后,离心(14 000 r/min,30 min),取上清液100 mL,进样20 mL。留取的肺脏加入3倍蒸馏水制备肺脏匀浆样品,取肺脏匀浆样品100 mL,加200 mL乙腈,涡旋混合3 min后,离心(14 000 r/min,30 min),取上清液100 mL,进样20 mL。
1.4 色谱条件色谱柱:CAPCELL PAK C18 AQ S5(4.6mml.D.×150 mm,5 um)及保护柱(3.9 mm×20 mm);流动相CH3CN:H2O(0.1%甲酸)=50:50;流速0.5 mL/min;进样量10 mL;柱温:25 ℃;检测波长:259 nm。
1.5 统计学方法大鼠毒物代谢动力学参数采用统计矩方法计算:AUC0-t(mg•L-1•h)=Σ(Ci+Ci-1)×Δt/2,AUMC0-t(mg•L-1•h2)=Σ(tiCi+ti-1Ci-1)×Δt/2;MRT0-t(h)=AUMC/AUC。使用计算机程序Microsoft Office Excel和Microcal Origin进行数据处理和作图。
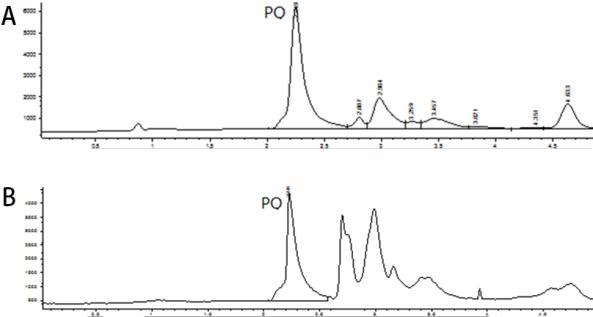
2 结果 2.1 方法专属性本实验的色谱条件下,血浆和肺组织中的百草枯峰形良好完整,百草枯分离完全,无杂质干扰。血浆和肺组织匀浆百草枯保留时间分别为2.25 min和2.2 min,本实验具有良好的专属性。
2.2 检测范围百草枯在血浆和肺组织中标准曲线回归方程见表 1,说明,百草枯在0.5~100 μg/mL范围内线性良好,本方法检测下限为0.5 μg/mL。
|
| A:血浆;B:肺组织 图 1 百草枯高效液相色谱图 |
|
|
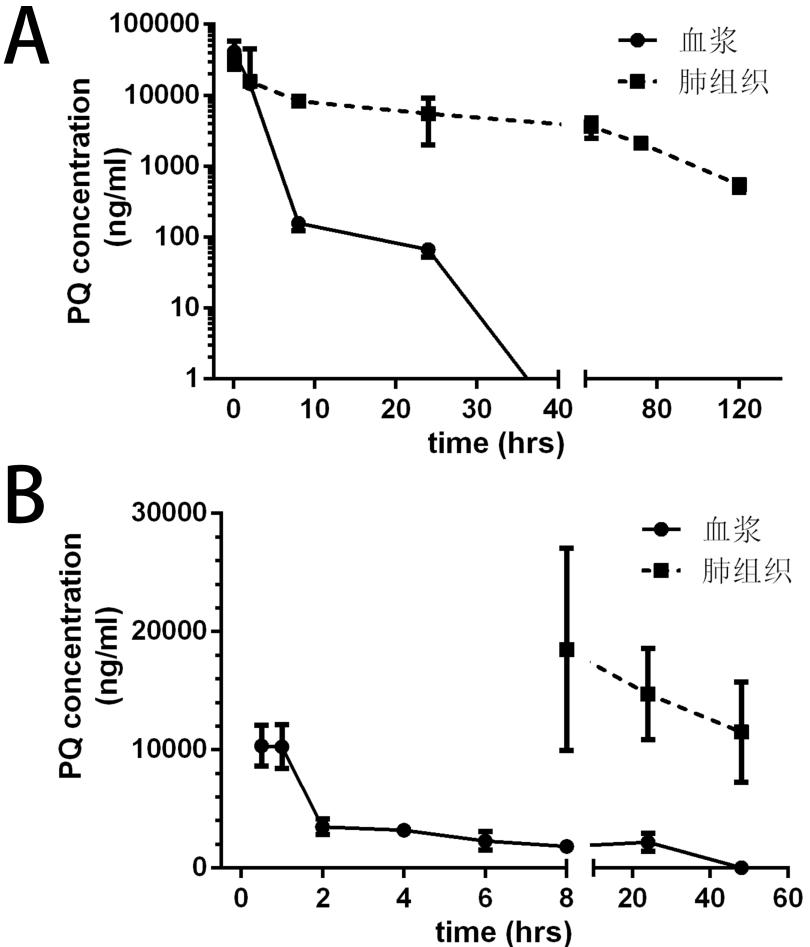
百草枯经腹腔注射及经灌胃给药途径给药后,平均血浆浓度如图 2所示。腹腔注射时,百草枯无论在血浆还在是肺组织中,血浆毒物浓度在给药后5 min后即可达到峰值,随后百草枯在血浆中迅速下降,以染毒后8 h内下降最为迅速,并于染毒后48 h血浆中检测不出;而百草枯在肺组织中的浓度下降缓慢,染毒后120 h仍能检测到百草枯。经灌胃给药时,血浆中百草枯浓度在给药后0.5 h同样达到高峰,维持半小时即快速下降,至染毒2 h时,血浆百草枯浓度下降率95%,以后逐渐下降,同样在染毒后48 h血浆中检测不出;而经腹腔注射给药时,染毒2 h时百草枯在肺组织中的浓度是血浆中的6.9倍,至染毒24 h时可达83倍,且同样下降缓慢,染毒后48 h仍能在肺组织内检测到较高浓度的百草枯。腹腔注射与灌胃两种染毒方式下,肺组织的百草枯浓度均显著高于血浆中,同时清除半衰期更长,清除率更低(表 2)。
|
| 图 2 百草枯经腹腔注射(图A)及经灌胃(图B)给药后平均血药浓度-时间曲线 |
|
|
| 参数 | T1/2(h) | Tmax(h) | Cmax (ng/mL) |
AUC0-t (h·ng/mL) |
AUC0-C (h·ng/mL) |
V/F (L/kg) |
CL/F (mL·h-1·kg-1) |
| 灌胃(血) | 35.1 | 0.83 | 15.2 | 57.9 | 157.2 | 58.3 | 254.1 |
| 灌胃(肺) | 55.1 | 20 | 21.6 | 512.9 | - | - | - |
| 腹腔注射(血) | 13.9 | 0.72 | 15.1 | 24.8 | 298.4 | 18.6 | 883.4 |
| 腹腔注射(肺) | 39.4 | 4 | 27.6 | 412.4 | 533.9 | 34.7 | 68.3 |
绝大多数百草枯中毒均是经消化道途径导致,百草枯被摄入体内后主要在小肠上段被吸收[3]。笔者及课题组成员选择两种不同的模型分别验证百草枯进入机体后,模拟百草枯在体内的毒物代谢动力学。在本实验中,染毒后大鼠精神萎靡、蜷缩少动、厌食,呼吸急促,腹腔注射与灌胃给药两种模型中分别有5只及3只大鼠在3 d内死亡,其余大鼠均成活7 d以上,因此,本实验所选用动物模型完全符合实验要求。百草枯依赖载体介导的转运系统(carrier-mediated transport system)的主动吸收[4],因此百草枯进入机体后可迅速被吸收,且很快达到峰浓度。本研究结果显示,无论是灌胃还是经腹腔注射给药,大鼠体内在5 min时即可达到峰浓度,而且肺组织百草枯水平也相应地快速达到高峰。结果显示,腹腔注射给药峰浓度更高,这可能与百草枯直接与肠道接触,导致百草枯直接损伤上皮细胞,使上皮通透性增加,从而吸收更多百草枯[3]。而且百草枯经口吸收,生物利用度极低,文献报道在口服6 h内仅有1%~5%被吸收[5],百草枯在兔体内生物利用度为14.66%左右,而在大鼠体内仅有12%左右[6]。研究表明,大鼠血浆百草枯浓度在染毒后能稳定持续达30 h之久,同时,肺组织中百草枯也快速积聚并达数倍于血浆水平[7-8],从本研究结果来看,染毒后48 h时血浆中已检测不到百草枯,且血浆百草枯水平在染毒8 h之内呈快速下降趋势,而肺组织中百草枯浓度自染毒开始就达高水平,并持续存在,下降极其缓慢,至120 h时仍能检测到且浓度仍高达544 ng/mL左右。
虽然有学者认为百草枯在体内代谢呈时间依赖型的“二室模型”[9],但多数学者认为“三室模型”更符合百草枯在体内代谢特点,即第一室即中央室为血液,浅室为肾、心脏、肝等组织,第三室为肺[10]。百草枯进入体内后,快速进入血液,并向组织中分布,同时Ⅰ型、Ⅱ型肺泡上皮细胞及Clara细胞膜上的多胺摄取系统主动摄取百草枯,从而使肺中百草枯浓度明显高于血液中6~10倍[11],而组织中的百草枯能持续不断的被肺上皮细胞摄取,从而导致百草枯在肺组织中能持续极长时间。
总之,笔者及课题组成员用两种不同给药方式对Wistar大鼠进行染毒,结果均发现,血浆和肺组织中百草枯浓度快速达到峰浓度,而且肺组织中百草枯持续时间极久,且腹腔注射吸收更迅速完全,肺组织中长期持续存在高浓度的百草枯,从而导致临床上百草枯治疗效果不佳。因此,早期尽快阻断或减少百草枯的胃肠道吸收对百草枯治疗至关重要。
| [1] | Yin Y, Guo X, Zhang SL, et al. Analysis of paraquat intoxication epidemic (2002-2011) within China[J]. Biomed Environ Sci, 2013, 26(6): 509-512. DOI:10.3967/0895-3988.2013.06.014 |
| [2] | Jones AL, Elton R, Flanagan R. Multiple logistic regression analysis of plasma paraquat concentrations as a predictor of outcome in 375 cases of paraquat poisoning[J]. QJM, 1999, 92(10): 573-578. DOI:10.1093/qjmed/92.10.573 |
| [3] | Heylings JR. Gastrointestinal absorption of paraquat in the isolated mucosa of the rat[J]. Toxicol Appl Pharmacol, 1991, 107(3): 482-493. DOI:10.1016/0041-008x(91)90311-2 |
| [4] | Shadnia S, Zamani N, Hassanian-Moghaddam H, et al. Prognostic value of cortisol and thyroid function tests in poisoned patients admitted to toxicology ICU[J]. World J Emerg Med, 2018, 9(1): 51-55. DOI:10.5847/wjem.j.1920-8642.2018.01.008 |
| [5] | Houzé P, Baud FJ, Mouy R, et al. Toxicokinetics of paraquat in humans[J]. Hum Exp Toxicol, 1990, 9(1): 5-12. DOI:10.1177/096032719000900103 |
| [6] | 阚歆, 张潇云, 董洁, 等. 百草枯在兔体内的毒物代谢动力学[J]. 中华劳动卫生职业病杂志, 2010, 28(10): 756-759. DOI:10.3760/cma.j.issn.1001-9391.2010.10.014 |
| [7] | Xu JJ, Zhen JT, Tang L, et al. Intravenous injection of Xuebijing attenuates acute kidney injury in rats with paraquat intoxication[J]. World J Emerg Med, 2017, 8(1): 61-64. DOI:10.5847/wjem.j.1920-8642.2017.01.011 |
| [8] | Dinis-Oliveira RJ, Duarte JA, Sánchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [9] | Pond SM, Rivory LP, Hampson EC, et al. Kinetics of toxic doses of paraquat and the effects of hemoperfusion in the dog[J]. J Toxicol Clin Toxicol, 1993, 31(2): 229-246. DOI:10.3109/15563659309000391 |
| [10] | Murray RE, Gibson JE. A comparative study of paraquat intoxication in rats, guinea pigs and monkeys[J]. Exp Mol Pathol, 1972, 17(3): 317-325. DOI:10.1016/0014-4800(72)90044-5 |
| [11] | Yoon SC. Clinical outcome of paraquat poisoning[J]. Korean J Intern Med, 2009, 24(2): 93-94. DOI:10.3904/kjim.2009.24.2.93 |
 2019, Vol. 28
2019, Vol. 28




