2 浙江大学医学院附属杭州市第一人民医院儿科 310001
2 Department of Pediatrics, Affiliated the First Hospital, School of Medicine, Zhejiang University, Hangzhou 310001, China
机械通气是治疗呼吸衰竭及危重患者呼吸支持最为有效的治疗手段,但机械通气在使用过程中也可能诱发或加重肺损伤,即机械通气所致肺损伤(ventilator- induced lung injury, VILI),是机械通气常见的严重并发症[1-2]。目前越来越多的研究证据表明,炎症免疫反应在VILI发病机制中的作用和相关分子靶点及其干预措施已经成为当前研究的重要方向[3-5]。活化血管紧张素Ⅱ-2型受体(AT2R)及其信号通过抑制炎症和促进损伤修复在疾病进展中发挥保护性作用[6-8]。新型非肽类高选择性AT2R激动剂C21在亲和力、生物利用度、半衰期等方面都比传统AT2R激动剂具有显著优势。肺泡巨噬细胞(AMϕ)作为肺损伤的效应细胞,其极化、功能异常在VILI病程进展、转归中发挥重要作用[9]。目前,尚无直接证据表明VILI大鼠BALF中M1/M2型AMϕ发生怎样的动态变化。活化AT2R能否诱导保护性M2型AMϕ进而缓解肺损伤,本研究将对此展开研究。
1 材料与方法 1.1 材料 1.1.1 实验动物64只雄性SD大鼠,体质量为250~280 g,SPF级,购自上海斯莱克有限责任公司,许可证号:SCXK(沪)2017-0005,合格证号:0348580。所有动物饲养在温度为(24±1)℃,12 h光暗循环和相对湿度为40%~80%的房间中。动物自由饮水进食。所有实验方案均经过动物伦理委员会审批通过。
1.1.2 实验仪器和试剂动物呼吸机(成都泰盟,HX101);病理组织漂烘仪(Tec 2500型,常州市郝思琳仪器设备有限公司);显微镜(BX43型,OLYMPUS公司);隔水式恒温培养箱(PYX-DHS500BS-Ⅱ型,上海跃进医疗器械有限公司)。流式细胞仪(Accμri C6,BD公司)。全波长酶标仪(SpectraMax Plus 384型,美国MD)。AT2R激动剂(MCE),苏木精、伊红(SIGMA),CD68-PE抗体(Miltenyi Biotec);iNOS抗体(abcam);Arg-1抗体(Novus);Donkey anti-rabbit IgG Secondary Antibody(Alexa Fluor® 488)/Donkey anti-goat IgG Secondary Antibody(Alexa Fluor® 647)(Thermo Fisher);BCA蛋白浓度测定试剂(和后面提到的“考马斯亮蓝染色法”不一致),(碧云天);其余试剂均为国产分析纯。
1.2 造模及实验分组64只雄性SD大鼠,随机(随机数字法)分为8组,为正常对照组,VILI模型组,VILI模型+AT2R激动剂组。其中VILI模型组分为2 h、4 h、6 h、8 h四个亚组和VILI模型+AT2R激动剂组又分别为4 h、6 h、8 h三个亚组,每组8只。大鼠于实验前12 h禁食,自由饮水。VILI模型+AT2R激动剂组术前30 min腹腔注射C21(1 mg/kg),手术暴露气管,(对照组只进行气管切开不进行机械通气)均采用16G留置针置入气管,充当气管插管,连接小动物呼吸机进行机械通气。调节呼吸机参数,RR=40次/min,I:E=I:2,PEEP =0,吸入氧体积分数(FiO2)=21%,大潮气量Vt=40 mL/kg。分别在通气2、4、6、8 h时取材进行检测。
1.3 观察指标与测定方法 1.3.1 肺组织病理学改变右上叶肺组织用4%甲醛固定,经石蜡包埋切片、苏木精-伊红(HE)染色后,光镜观察病理学改变。
1.3.2 肺组织湿/干质量比值(W/D)取大鼠右肺中叶组织,称湿质量(W)后于干燥箱中80 ℃烤至恒质量并称干质量(D),计算肺W/D。
1.3.3 支气管肺泡灌洗液(BALF)中WBC计数和总蛋白含量测定左肺行肺灌洗,回收后800 r/min离心10 min,沉淀物用PBS稀释后行瑞氏染色,光镜下行白细胞计数。BALF中总蛋白的测定采用BCA法。
1.3.4 ELISA检测BALF中炎性介质分泌水平选取机械通气4 h的动物组为模型组,体内给予VILI大鼠C21(1 mg/kg)预处理为给药组,取各组BALF离心后,按照ELISA检测试剂盒说明书操作,用双夹心ELISA对各组TNF-α、IL-1β和IL-6等炎性因子进行定量分析。
1.3.5 巨噬细胞极性测定取出的肺泡灌洗液2 000 r/min平离心6 min,去除上清液;每管加入1 mL DMEM培养基重悬,转移到1.5 mL EP管中,1 500 r/min离心5 min,去除上清,收集沉淀。进行抗体孵育和检测:每管加入500 μL固定破膜液,4 ℃过夜;第二天每管样品加入1×permeabilization buffer 1 mL重悬,1 500 r/min,离心5 min,去除上清液;沉淀100 μL staning buffer重悬,每管加入CD68-PE抗体1 μL,Arg1抗体0.1 μL,iNOS抗体0.1 μL,另设单染管和空白管,37 ℃避光孵育30 min。然后每管依次加入1 mL DMEM培养基,1 500 r/min离心5 min,去除上清液,再加入100 μL DMEM培养基重悬,加入兔-488二抗0.25 μL,山羊-647二抗0.25 μL,37 ℃避光孵育30 min;每管加入1 mL DMEM培养基1 500 r/min离心5 min,200 μL DMEM培养基重悬,上机检测。
1.4 统计学方法实验数据以均值±标准差(Mean±SD)表示,方差分析和统计学检验采用孙瑞元等:GraphPad Prism统计软件中多组均数分析。先对数据进行方差齐性检验,若方差齐,采用单因素方差分析进行总体比较,用多个剂量组与一个对照组均数间均数的两两比较方法进行统计;对非正态或方差不齐的数据改用秩和检验进行统计以P < 0.05差异具有统计学意义。
2 结果 2.1 一般性描述各组动物在术中无死亡情况发生,存活率100%。机械通气2、4、6、8 h后各组大鼠均无死亡,大潮气量组大鼠肺可见出血点和肺水肿,4 h、6 h、8 h的AT2R激动剂组出血点和肺水肿有降低。
2.2 各组大鼠肺湿/干重比例实验结果显示,机械通气2 h、4 h湿/干重比较对照组升高,并在4 h达到峰值,存在显著性差异(P < 0.05);6 h和8 h组的湿/干重比也高于对照组,但与4 h组相比随时间延长而变小;4、6、8 h模型预先给予AT2R激动剂(C21)干预后,其湿/干重比较未给予AT2R激动剂的4 h、6h、8h模型均降低,肺含水量减少差异有统计学意义(P < 0.05)。见表 1。
| 组别 | 细胞计数(104/mL) | 蛋白浓度(mg/mL) | 干湿肺重 | 病理评分 |
| CK | 1.07±0.07 | 0.14±0.02 | 5.05±0.17 | 0.22±0.44 |
| 2 h | 1.69±0.16b | 0.14±0.03a | 1.92±2.69b | 2.63±3.25b |
| 4 h | 2.35±0.22b | 0.14±0.02b | 5.10±7.21b | 11.24±11.79b |
| 6 h | 2.34±0.14b | 0.11±0.02b | 4.03±5.70b | 8.46±8.66b |
| 8 h | 2.13±0.21b | 0.11±0.02b | 2.38±3.35b | 5.40±5.74b |
| 4 h+C21 | 1.96±0.17b | 0.06±0.01b | 2.40±3.35bd | 5.27±7.99b |
| 6 h+C21 | 1.67±0.19bc | 0.10±0.02b | 2.71±3.14bd | 4.11±4.40b |
| 8 h+C21 | 1.65±0.25a | 0.15±0.02b | 2.04±2.63bc | 3.13±3.61bd |
| 注:各组vs正常对照组组,aP < 0.05, bP < 0.01;各时间点给药组组vs各时间点模型组,cP < 0.05,dP < 0.01;其中细胞计数,bP < 0.01(t值分别为5.985,9.411,14.23,8.263,8.207,5.098,3.767),cP < 0.05(t值分别为2.373,4.985,2.528);蛋白浓度,aP < 0.05, bP < 0.01(t值分别为3.817,10.19,8.067,4.749,7.142,5.845,5.579);大鼠肺干湿重比,bP < 0.01(t值分别为6.688,23.52, 17.3, 11.44, 20.68, 11.6, 9.222),cP < 0.05,dP < 0.01(t值分别为8.752,4.114,2.415);肺损伤病理评分(评分标准采用Smith评分方法对肺水肿、肺泡及间质炎症、肺泡及间质出血、肺不张和透明膜形成分别进行0~4分的半定量分析:无损伤0分,病变范围 < 25%为1分,病变范围占25%~50%为2分,50% < 病变范围 < 75%为3分,病变满视野为4分,总肺损伤评分为上述各项之和);bP < 0.01各时间点给药组(t值分别为9.604, 9.656, 8.913, 12.29, 7.845, 5.838),vs各时间点模型组,cP < 0.05(t值分别为1.715, 1.874, 3.244) | ||||
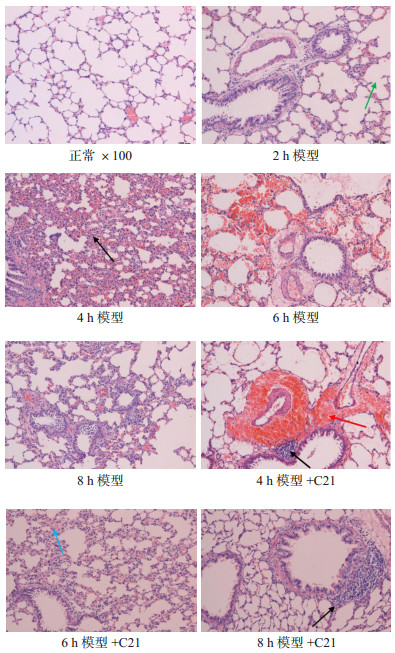
正常组未见明显病变;通气2 h模型血管周围水肿,血管或气管周围可见炎细胞浸润,局部可见肺泡腔扩张;通气4 h模型肺泡腔内可见出血明显,肺泡和间质内有炎症细胞浸润,肺泡腔内有红细胞,并有水肿和炎细胞浸润,肺泡腔扩大;通气6~8 h模型血管周围水肿,炎细胞浸润明显,肺泡腔扩大较小。腔内部分少量红细胞,部分可见透明膜的形成,肺泡腔内有水肿液。相对于4 h损伤组,水肿程度减少。4 h模型+C21、6 h模型+ C21、8 h模型+ C21组,肺泡和间质内的水肿和出血相对于模型组相应时间段损伤组均有不同程度减轻,炎症细胞浸润减少,水肿液吸收,但仍可见肺泡扩张现象。见图 1,并进行肺损伤病理评分,见表 1。
|
| 黑色箭头示炎细胞浸润;红色箭头示出血和积血;蓝色箭头示水肿;绿色箭头示肺泡过度扩张 图 1 各组病理图片 Fig 1 Pathological pictures of each group |
|
|
通气2 h和4 h模型组中细胞数较对照组显著升高,4 h模型组细胞数最高达到峰值;6 h和8 h组的细胞数也高于对照组,但与4 h组相比随时间延长而减少;4、6、8 h模型预先给予AT2R激动剂C21干预后,其细胞数较未给予AT2R激动剂C21的模型均降低。见表 1。
2.5 肺泡灌洗液中总蛋白浓度通气2 h和4 h模型组中蛋白浓度较对照组显著升高,4 h模型组蛋白浓度最高提到峰值;6 h和8 h组的蛋白浓度也高于对照组,但与4 h组相比随时间延长而降低;4、6、8 h模型预先给予AT2R激动剂干预后,其蛋白浓度较未给予AT2R激动剂的4、6、8 h模型组均降低(表 1)。
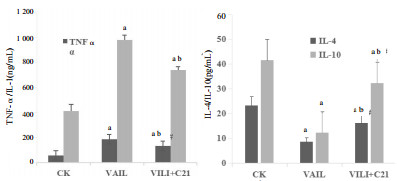
2.5 肺泡灌洗液中炎症因子水平选取机械通气4 h的动物组为模型组,体内给予VILI大鼠C21(1 mg/kg)预处理,结果表明,通气4 h模型组BALF中促炎因子水平TNF-α、IL水平显著升高,抗炎因子IL-4、IL-10水平显著降低(P < 0.01)。而给予C21预处理组,可显著降低BALF中促炎因子水平TNF-α、IL-1水平, 升高BALF中抗炎因子IL-4、IL-10水平,与模型组相比差异具有统计学意义(P < 0.01)。见图 2。
|
| 与正常组相比,aP < 0.01;与VILI组相比,bP < 0.01 图 2 AT2R激动剂C21预处理对BALF中促炎因子TNF-α、IL-1水平的影响 Fig 2 Effects of pretreatment with AT2R agonist C21 on pro-inflammatory cytokines TNF-α, IL-1 in BALF |
|
|
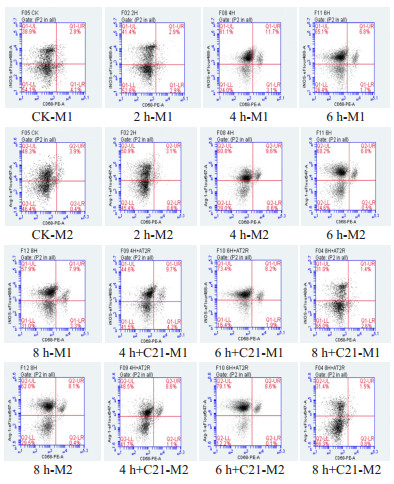
2 h和4 h模型组中M1/M2比值较对照组显著升高,4 h模型组M1/M2比值最高,说明造模后2~4 h巨噬细胞先向M1型极化,并在4 h达到峰值;6 h和8 h组的M1/M2比值也高于对照组,但与4 h组相比随时间延长而变小,与对照组相比差异有统计学意义(P < 0.01)。4、6、8 h模型预先给予AT2R激动剂C21干预后,其M1/M2比值较未给予AT2R激动剂C21的4、6、8 h模型组均降低,其中4 h组差异有统计学意义(P < 0.05),提示AT2R激动剂C21可促进巨噬细胞向M2型极化。见图 3。
|
| 图 3 各组肺泡灌洗液巨噬细胞不同类型的分化程度(n=8) Fig 3 The differention proportion of different type of peritoneal macrophage(n=8) |
|
|
VILI是机械通气常见的严重并发症[1-2]。研究发现VILI机制除力学牵张外,还包括由力学牵张引起的生物性肺损伤[10-11]。炎症免疫反应在VILI发病机制中的作用和相关分子靶点及其干预措施已经成为当前研究的重要方向。本实验以40 mL/kg潮气量致大鼠VILI模型,通过动态观察通气不同时间点大鼠肺组织的组织病理学、湿干比、BALF中细胞计数和总蛋白水平,证实了机械通气4 h能够成功诱导VILI,与既往研究报道相同,但机械通气4 h后各炎症损伤指标研究报道较少。本研究发现机械通气2 h和4 h模型组中病理学评分、湿/干比、BALF中细胞计数和总蛋白水平较对照组显著升高,4 h模型组蛋白浓度达峰值;6 h和8 h组的各数值也高于对照组,BALF中细胞计数和总蛋白水平通气6 h和4 h组基本相同,但与4 h组相比随时间延长各炎症和损伤指标均有下降。
肺泡巨噬细胞(AMϕ)作为肺损伤的效应细胞,其极化、功能异常在VILI病程进展、转归中发挥重要作用。目前,M1/M2平衡在急性肺损伤不同时期的转化方向及其机制,M1/M2平衡时相关的信号转导通路以及肺内其他罕见巨噬细胞亚群对ALI的潜在影响,研究较少。
本研究发现,机械通气2 h和4 h模型组中M1/M2比值较对照组显著升高,机械通气4 h模型组M1/M2比值最高,提示造模后2~4 h巨噬细胞先向M1型极化,并在4 h达到峰值;机械通气6 h和8 h组的M1/M2比值也高于对照组,但与4 h组相比随时间延长而变小,说明巨噬细胞开始由M1向M2型极化;其动态变化过程与肺损伤病理学评分、湿/干比、BALF中细胞计数和总蛋白水平相似。Curley等[14]和Villar等[15]研究认为大鼠肺组织在持续通气数小时后即可产生纤维增生反应,与本研究结果相符合。本研究也验证了VILI大鼠(通气4 h模型组)BALF中促炎因子水平TNF-α、IL-1水平较对照组显著升高,抗炎因子IL-4、IL-10水平较对照组显著降低(P < 0.01),提示显著增高的TNF-α、IL-1、iNOS等促炎介质可能主要是由M1型AMϕ释放的,而显著降低的IL-10、IL-4、TGF-β等抗炎介质则是由M2型AMϕ产生,间接提示了AMϕ极化异常可能参与VILI病程进展。与已有研究相同[16-17]。提示在高通气致大鼠VILI模型中,机械通气4 h时,机体可能通过激活M1经典活化巨噬细胞,启动Th1细胞的免疫应答,由脂多糖(LPS)、IFN-γ或TNF-α诱导具有极强的吞噬功能,并表达高水平诱导型一氧化碳合酶(iNOS)、IL-6、IL-12、IL-1β等促炎性细胞因子,以更快、更有效的杀灭病原体及异常细胞,此时炎症损伤达峰值,其后则可能通过激活M2替代活化巨噬细胞,启动Th2细胞的免疫应答,由IL-4、IL-13等诱导分化而成,分泌诸如IL-10、TGF-β1、IGF-1等抑炎性的细胞因子,因而在机械通气6~8 h时后炎症反应逐渐减弱。
血管紧张素Ⅱ可以成功诱导ALI动物模型[18],血管紧张素Ⅱ与AT1R相互作用促进炎症免疫损伤进而参与VILI的发生、发展,而活化血管紧张素Ⅱ-2型受体(AT2R)及其信号通过抑制炎症和促进损伤修复在疾病进展中发挥保护性作用[6-8]。相较于空白对照组,高潮气量通气引起的VILI大鼠和博来霉素诱导肺损伤大鼠的损伤肺组织中AT2R的表达均显著升高[19]。在小鼠酸吸入诱导肺损伤模型中,相较于野生型小鼠,AT2R基因缺失的Agtr2(-/y)小鼠的肺损伤病情显著加重,病死率显著增高,提示AT2R可能在ALI中发挥保护性作用[20]。AT2R拮抗剂PD123319可以阻止AT2R激动剂LP2-3对肺损伤的保护效应[21],提示活化AT2R及其信号在肺损伤中具有抗炎、损伤修复的保护性作用。新型非肽类高选择性AT2R激动剂C21在亲和力、生物利用度、半衰期等方面都比传统AT2R激动剂具有显著优势。但是,关于AT2R激动剂C21对VILI大鼠治疗作用的具体机制尚不清楚,目前对活化AT2R及其信号在调控巨噬细胞异常极化、功能中的作用知之甚少,尚无AT2R及其信号通路调控VILI中M1/M2型AMϕ分型的研究报道。
本研究发现机械通气4、6、8 h模型预先给予AT2R激动剂C21干预后,其病理学评分、湿干比、BALF中细胞计数和总蛋白水平较未给予AT2R激动剂的通气4、6、8 h模型组均降低。AT2R激动剂C21预干预VILI大鼠通气4 h模型组,BALF中促炎因子水平TNF-α、IL-1水平较对照模型组显著降低(P < 0.05),抗炎因子IL-4、IL-10水平较对照模型各时间点组升高(P < 0.05)。同时4、6、8 h模型预先给予AT2R激动剂C21干预后,其M1/M2比值较未给予AT2R激动剂C21的4、6、8 h模型组均降低,说明AT2R激动剂C21可促进巨噬细胞向M2型极化。这与Dhande等[22]报道相符合,其研究表明,体外条件下给予AT2R激动剂C21预处理LPS活化的THP-1巨噬细胞,活化AT2R及其信号传导可以上调巨噬细胞抗炎因子IL-10的表达,抑制促炎因子TNF-α和IL-6的产生。
因此笔者推测,活化AT2R可能通过诱导保护性M2型AMϕ进而缓解肺损伤。活化AT2R下调异常M1型AMϕ比例,促进保护性M2型AMϕ极化,进而缓解VILI炎症、免疫损伤。具体机制和信号通路有待进一步研究。
| [1] | Slutsky AS, Ranieri VM. Ventilator-induced lung injury[J]. N Engl J Med, 2014, 370(10): 980. |
| [2] | Liu YY, Chiang CH, Chuang CH. Spillover of cytokines and reactive oxygen species in ventilator- induced lung injury associated with inflammation and apoptosis in distal organs[J]. Respir Care, 2014, 59(9): 1422-1432. DOI:10.4187/respcare.0299 |
| [3] | Terragni P, Ranieri VM, Brazzi L. Novel approaches to minimize ventilator-induced lung injury[J]. Curr Opin Crit Care, 2015, 21(1): 20-2. DOI:10.1186/1741-7015-11-85 |
| [4] | Sutherasan Y, D'Antini D, Pelosi P. Advances in ventilator-associated lung injury: prevention is the target[J]. Expert Rev Respir Med, 2014, 8(2): 233-2. DOI:10.1586/17476348.2014.890519 |
| [5] | Hoegl S, Zwissler B, Eltzschig HK. Acute respiratory distress syndrome following cardiovascular surgery: current concepts and novel therapeutic approaches[J]. Curr Opin Anaesthesiol, 2016, 29(1): 94-100. DOI:10.1097/ACO.0000000000000283 |
| [6] | Foulquier S, Steckelings UM, Unger T. Perspective: a tale of two receptors[J]. Nature, 2013, 493(7434): S9. DOI:10.1038/493S9a |
| [7] | Qi Y, Katovich MJ. Is angiotensin Ⅱ type 2 receptor a new therapeutic target for cardiovascular disease?[J]. Exp Physiol, 2014, 99(7): 933-934. DOI:10.1113/expphysiol.2014.080705 |
| [8] | Lauer D, Slavic S, Sommerfeld M, et al. Angiotensin type 2 receptor stimulation ameliorates left ventricular fibrosis and dysfunction via regulation of tissue inhibitor of matrix metalloproteinase 1/matrix metalloproteinase 9 axis and transforming growth factor β1 in the rat heart[J]. Hypertension, 2014, 63(3): e60-67. DOI:10.1161/HYPERTENSIONAHA.113.02522 |
| [9] | Misharin AV, Morales-Nebreda L, Mutlu GM, et al. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung[J]. Am J Respir Cell Mol Biol, 2013, 49(4): 503-510. DOI:10.1165/rcmb.2013-0086MA |
| [10] | Nieman GF, Satalin J, Kollisch-Singule M. Physiology in Medicine: Understanding dynamic alveolar physiology to minimize ventilator-induced lung injury[J]. J Appl Physiol, 2017, 122(6): 1516-1522. DOI:10.1152/japplphysiol.00123.2017 |
| [11] | Curley GF, Laffey JG, Zhang H, et al. Biotrauma and Ventilator induced lung injury: Clinical implications[J]. Chest, 2016, 150(5): 1109-1117. DOI:10.1016/j.chest.2016.07.019 |
| [12] | Tong J, Zhou XD, Kolosov VP, et al. Role of the JNK pathway on the expression of inflammatory factors in alveolar macrophages under mechanical ventilation[J]. Int Immunopharmacol, 2013, 17(3): 821-827. DOI:10.1016/j.intimp.2013.09.002 |
| [13] | Grailer JJ, Canning BA, Kalbitz M, et al. Critical role for the NLRP3 inflammasome during acute lung injury[J]. J Immunol, 2014, 192(12): 5974-5983. DOI:10.4049/jimmunol.1400368 |
| [14] | Curley GF, Contrers M, Higgins B, et al. Evolution of the inflammatory and fibroproliferative responses during resolution and repair after ventilator induced lung injury in the rat[J]. Anesthesiology, 2011, 115(5): 1022-1032. DOI:10.1097/ALN.0b013e31823422c9 |
| [15] | Cheung WYS, Cheung WK, Lam CH, et al. Intravenous fluid selection rationales in acute clinical management[J]. World J Emerg Med, 2018, 9(1): 13-19. DOI:10.5847/wjem.j.1920-8642.2018.01.002 |
| [16] | Festuccia WT, Pouliot P, Bakan I, et al. Myeloid-specific Rictor deletion induces M1 macrophage polarization and potentiates in vivo pro- inflammatory response to lipopolysaccharide[J]. PLoS One, 2014, 9(4): e95432. DOI:10.1371/journal.pone.0095432 |
| [17] | Fernando MR, Reyes JL, Iannuzzi J, et al. The pro-inflammatory cytokine, interleukin-6, enhances the polarization of alternatively activated macrophages[J]. PLoS One, 2014, 9(4): e94188. DOI:10.1371/journal.pone.0094188 |
| [18] | 杨家来. 维生素D对脂多糖致急性肺损伤大鼠肺组织血管紧张素转化酶2和维生素D受体表达水平的影响[J]. 中华急诊医学杂志, 2016, 25(12): 1284-1289. DOI:10.3760/cma.j.issn.1671-0282.2016.12.016 |
| [19] | Waseda Y, Yasui M, Nishizawa Y, et al. Angiotensin Ⅱ type 2 receptor antagonist reduces bleomycin- induced pulmonary fibrosis in mice[J]. Respir Res, 2008, 9(1): 43. DOI:10.1186/1465-9921-9-43 |
| [20] | Wu Z, Ruan Y, Chang J, et al. Angiotensin Ⅱ is related to the acute aortic dissection complicated with lung injury through mediating the release of MMP9 from macrophages[J]. Am J Transl Res, 2016, 8(3): 1426-1436. |
| [21] | Wagenaar GT, Sengers RM, Laghmani el H, et al. Angiotensin Ⅱ type 2 receptor ligand PD123319 attenuates hyperoxia- induced lung and heart injury at a low dose in newborn rats[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(3): L261-272. DOI:10.1152/ajplung.00345.2013 |
| [22] | Dhande I, Ma W, Hussain T. Angiotensin AT2 receptor stimulation is anti- inflammatory in lipopolysaccharide-activated THP-1 macrophages via increased interleukin-10 production[J]. Hypertens Res, 2015, 38(1): 21-29. DOI:10.1038/hr.2014.132 |
 2019, Vol. 28
2019, Vol. 28




