2 消化系统疾病湖北省重点实验室,武汉 430060
2 Key Laboratory of Hubei Province for Digestive System Disease, Wuhan 430060, China
高甘油三酯血症(hypertriglyceridemia,HTG)是急性胰腺炎(acute pancreatitis,AP)的第三大病因,其发病率仅次于胆源性和酒精性急性胰腺炎。随着生活质量的改善和饮食结构的变化,高脂血症性急性胰腺炎(acute hypertriglyceridemic pancreatitis,HTGP)发病率日趋升高。有研究报道,HTGP患者症状更重, 病死率更高[1-3],与其他病因导致的AP相比,HTGP更容易进展为重症急性胰腺炎(severe acute pancreatitis, SAP),病死率显著升高[4]。Alberici等[5]发现,HTG大鼠NADPH氧化酶(NOX)显著升高,而NOX是机体活性氧簇(reactive oxygen species, ROS)的主要生产者,可通过调节ROS的产生调控下游信号通路的激活,参与胰腺炎的发生发展[6-7]。NOX在HTGP病程中的作用及机制目前尚不完全明确,因此本实验构建了HTGP大鼠模型并给予NOX抑制剂Apocynin预处理,以探讨NOX在HTGP中的作用及其作用机制。
1 材料与方法 1.1 实验动物与模型制备30只SPF级SD大鼠(体质量250~300 g,湖南斯莱克实验动物有限公司),动物实验均经武汉大学人民医院实验动物福利伦理审查委员会审查通过(编号:WDRM20171019)。随机数字法分为5组(n=6):(1)N组, 正常饲养14 d,不做其他处理;(2)NLAP组, 正常饲养14 d后,腹腔注射20%的L-Arg(Sigma,美国)两次(2.5 g/kg,间隔1 h)诱导AP模型;(3)H组, 腹腔注射P-407(Sigma,美国)14 d(0.25 g/kg,1次/d)诱导高甘油三酯血症模型;(4)HLAP组, 给予P-407诱导HTG模型后,腹腔注射20% L-Arg两次(2.5 g/kg,间隔1 h)诱导胰腺炎;(5)HAPO组, 造模同HLAP组,仅在腹腔注射L-Arg前30 min皮下给予NOX抑制剂Apocynin(50 mg/kg)。
1.2 标本采集大鼠造模后24 h处死,下腔静脉采血3 mL,离心后分离血清,并分装成3份于1.5 mL离心管中,冻存备用。切取适量胰头组织于2.5%戊二醛中充分固定后制片并于电镜下观察,另取胰头组织于4%多聚甲醛中固定,石蜡包埋切片后行苏木精-伊红(HE)染色及免疫组织化学、免疫荧光检测。
1.3 血清指标检测采用全自动生化分析仪(日本奥林巴斯2700)检测血清中AMY、TG、TC、FFA的水平。试剂盒(碧云天,上海)检测血清MDA、SOD、LDH、IL-1β、TNF-α水平。
1.4 胰腺组织病理变化及超微结构改变石蜡包埋的胰腺组织切片后行HE染色,光镜下观察,按照Schmidt等[8]提出的方法,对胰腺病理损伤进行评分。具体的评分标准如下:(1)胰腺水肿情况无水肿计0分,水肿局限在小叶间计1分,弥漫性分布于小叶间计2分,腺泡张力高分隔小叶计3分,全部小叶分隔计4分;(2)坏死情况无坏死计0分,弥漫发生1~4个坏死细胞/HPF计1分,弥漫发生5~10个坏死细胞/HPF计2分,弥漫发生11~16个坏死细胞/HPF计3分,> 16个坏死细胞/HPF计4分;(3)出血及脂肪坏死情况无出血及脂肪坏死计0分,存在1处计0.5分,存在2处计1分,存在3处计1.5分,存在4处计2分,存在5处计2.5分,存在6处计3分,存在7处计3.5分,≥8处计4分;(4)炎症浸润情况0~1个白细胞/HPF计0分,2~5个白细胞/HPF计0.5分,6~10个白细胞/HPF计1分,11~15个白细胞/HPF计1.5分,16~20个白细胞/HPF计2分,21~25个白细胞/HPF计2.5分,26~30个白细胞/HPF计3分,> 30个白细胞/HPF或局限形成小脓肿计3.5分,> 35个白细胞/HPF或小脓肿汇聚计4分。将经2.5%戊二醛固定的胰腺组织标本进行包埋、固定、切片,透射电镜镜检,观察胰腺腺泡细胞的超微病理改变。
1.5 免疫荧光法检测胰腺组织NOX4、p-Akt、GSK-3β的表达水平胰腺石蜡切片经脱蜡、水化、抗原修复后冷却至室温,0.2% Triton-X100破膜处理45 min,10%驴血清封闭1 h,一抗使用NOX4(1:400,GB11347,武汉塞维尔生物)、p-Akt(1:100,4 060 s,美国CST)、GSK-3β(1:200,ab32391,美国abcam)孵育4 ℃过夜,荧光二抗(ab150073,美国abcam)孵育1 h后以含DAPI的封片树脂(ab104139,美国abcam)封片。全自动荧光显微镜观察并拍照,采用Image Pro-Plus 6.0软件统计阳性荧光信号累计吸光度值,并进行分析。
1.6 免疫组化法检测胰腺组织TNF-α、NF-κB胰腺石蜡切片经脱蜡、水化、抗原修复后冷却至室温,3%过氧化氢灭活内源性过氧化物酶,一抗使用TNF-α(1:200,ab6671,美国abcam)、NF-κB(1:200,8 242 s,美国CST)孵育4 ℃过夜,经DAB显色,苏木精染色,盐酸乙醇分化后脱水、封片。光学显微镜下仔细观察并拍照,采用Image Pro-Plus 6.0软件进行累计吸光度值测量,并进行分析。
1.7 统计学方法采用Graphpad 8.0软件进行数据分析处理资料以均数±标准差(Mean±SD)表示,多组间均数比较单因素方差分析,组间两两比较采用SNK-q法,以P < 0.05为差异有统计学意义。
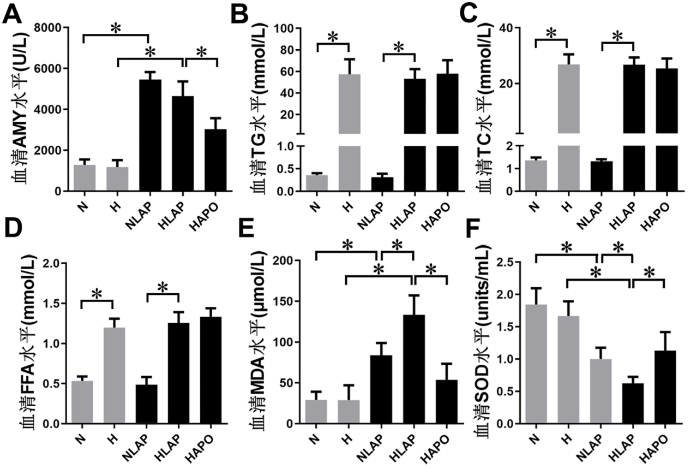
2 结果 2.1 血清AMY、TG、TC、FFA、MDA和SOD水平如图 1A-1D所示,N组与H组大鼠血清AMY水平无明显差异(P > 0.05),NLAP组与HLAP组血清AMY水平较N组和H组显著上升(P < 0.05)。应用Apocynin后,HAPO组AMY水平较HLAP组显著降低(P < 0.05)。与N组、NLAP组相比,H组、HLAP组、HAPO组TG、TC、FFA水平显著升高(P < 0.05)。
|
| A:血清AMY水平,B:血清TG水平,C:血清TC水平,D:血清FFA水平,E:血清MDA水平,F:血清SOD水平;aP < 0.05为差异具有统计学意义 图 1 血清AMY、TG、TC、FFA水平MDA和SOD Fig 1 Serum levels of AMY, TG, TC, FFA, MDA and SOD |
|
|
|
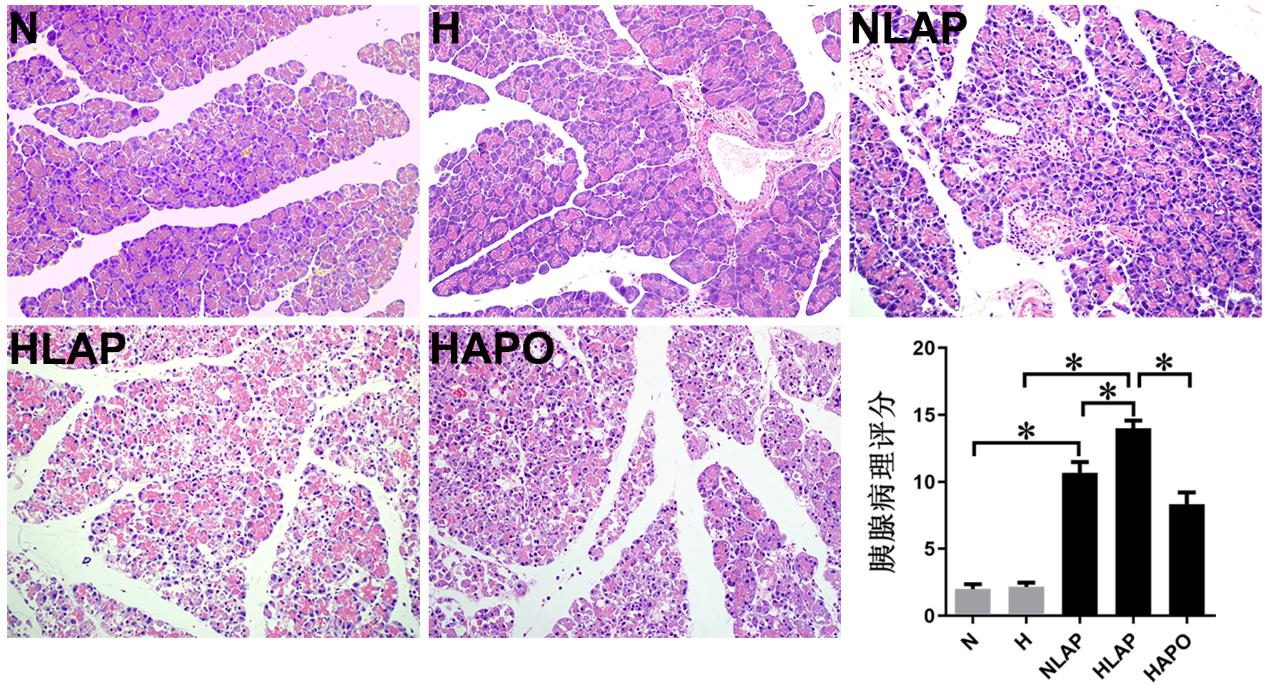
| aP < 0.05 图 2 胰腺组织病理改变及病理评分(HE染色,×200) Fig 2 Histopathological changes and pathological scores of the pancreas(HE, ×200) |
|
|
|
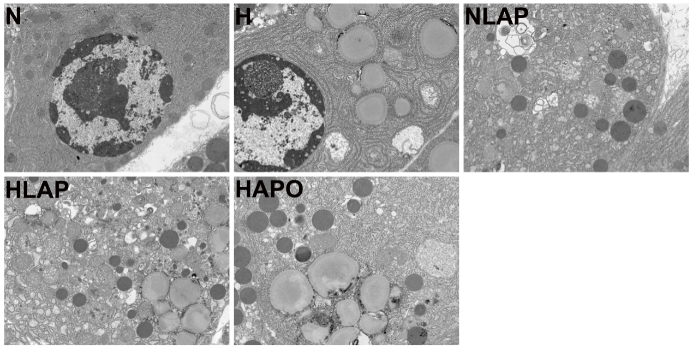
| 图 3 胰腺超微结构改变(×5 000) Fig 3 Ultrastructural changes of pancreas(×5 000) |
|
|
如图 1E、1F所示,N组与H组大鼠血清MDA、SOD水平差异无统计学意义(P > 0.05),NLAP组和HLAP组血清MDA水平显著上升(P < 0.05),SOD水平显著下降(P < 0.05),HLAP组血清MDA水平高于NLAP组,SOD水平低于NLAP组(P < 0.05)。应用NOX抑制剂Apocynin后,HAPO组血清MDA水平较HLAP组显著降低,SOD水平较HLAP组显著升高(P < 0.05)。
2.2 胰腺病理改变及病理评分N组大鼠胰腺结构完整,小叶结构清晰。H组大鼠胰腺小叶间隔稍增宽,间质少许充血、水肿。NLAP组合HLAP组大鼠胰腺组织可见细胞片状坏死,间质出血,周围大量炎性细胞浸润等损伤表现,且HLAP组胰腺损伤更为严重,病理评分更高(P < 0.05)。HAPO组胰腺组织可见部分腺泡细胞水肿、坏死,周围少量炎性浸润,损伤减轻,病理评分降低(P < 0.05)。
2.3 胰腺超微结构改变电镜下对胰腺组织超微结构进行观察,N组大鼠胰腺腺泡细胞中的细胞核、内质网和线粒体等细胞器结构清晰完整;H组大鼠胰腺腺泡细胞可见线粒体轻度肿胀和脂滴形成;AP造模后,NLAP组和HLAP组部分腺泡细胞出现核固缩、胞浆固缩,线粒体明显肿胀变形,严重者可见细胞器结构消失,细胞膜降解等现象,提示腺泡细胞坏死严重。应用Apocynin后,HAPO组的大鼠胰腺腺泡细胞线粒体和内质网肿胀、扩张明显减轻,细胞坏死减少。
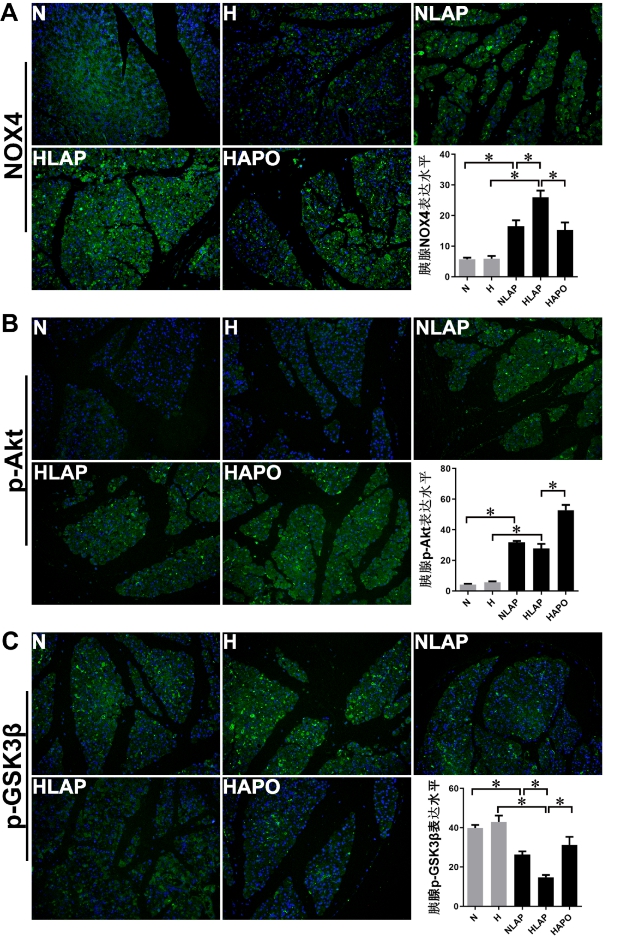
2.4 胰腺组织NOX4、p-Akt、p-GSK3β表达水平如图 4A所示,N组及H组大鼠胰腺NOX4表达水平较低,组间差异无统计学意义(P > 0.05);NLAP组和HLAP组大鼠胰腺NOX4表达水平分别较N组和H组显著上升(P < 0.05),HLAP组胰腺NOX4表达水平显著高于NLAP组(P < 0.05);HAPO组大鼠NOX4表达水平显著降低(P < 0.05)。
|
| A:胰腺组织NOX4表达水平;B:胰腺组织p-Akt表达水平;C:胰腺组织p-GSK3β表达水平;aP < 0.05为差异具有统计学意义 图 4 胰腺组织NOX4、p-Akt、p-GSK3β表达水平(免疫荧光染色,×200) Fig 4 Expression levels of NOX4, p-Akt and p-AGSK3β in rat pancreatic tissue(IF, ×200) |
|
|
如图 4B,N组及H组大鼠胰腺p-Akt表达水平较低,组间无显著差异(P > 0.05);诱导AP模型后,NLAP组和HLAP组大鼠胰腺p-Akt表达水平均有所升高(P < 0.05),HAPO组胰腺p-Akt表达水平显著升高(P < 0.05)。
p-GSK3β是GSK3β的失活形式,如图 4C所示,N组及H组大鼠胰腺中p-GSK3β表达较多,组间无明显差异(P > 0.05);NLAP组和HLAP组大鼠胰腺p-GSK3β表达较N组和H组显著减少(P < 0.05),且HLAP组胰腺p-GSK3β表达水平低于NLAP组(P < 0.05);HAPO组大鼠胰腺组织p-GSK3β水平较HLAP组显著上升(P < 0.05)。
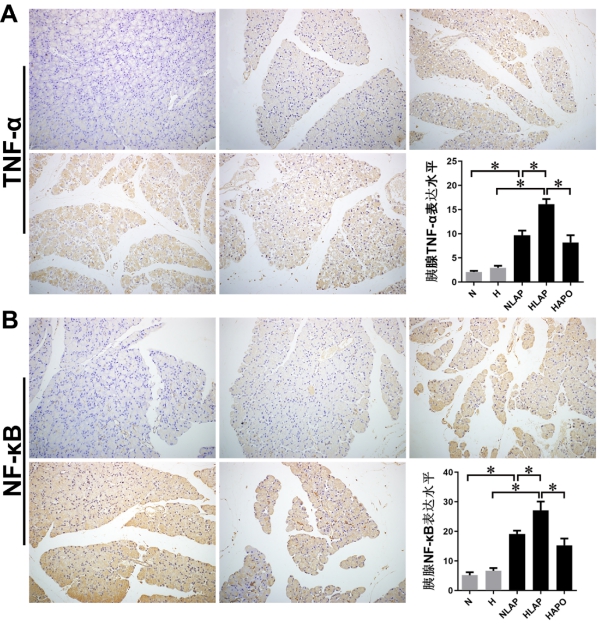
2.5 胰腺组织TNF-α及NF-κB的表达水平如图 5所示,N组和H组大鼠胰腺中仅有少量TNF-α、NF-κB阳性表达。AP造模后,NLAP组和HLAP组大鼠胰腺中可见大量的TNF-α、NF-κB阳性表达,总体阳性率较N组、H组明显上升(P < 0.05),且HLAP组更高(P < 0.05);应用Apocynin后大鼠胰腺TNF-α、NF-κB阳性表达水平较HLAP组减少(P < 0.05)。
|
| A:胰腺组织TNF-α表达水平;B:胰腺组织NF-κB表达水平;aP < 0.05作为差异具有统计学意义 图 5 胰腺组织TNF-α、NF-κB表达水平(免疫组化染色,×200) Fig 5 Expression levels of TNF-α and NF-κB in rat pancreatic tissue(IHC, ×200) |
|
|
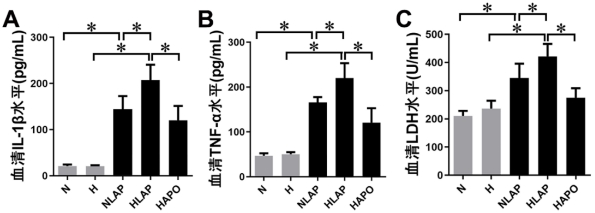
如图 6A、6B所示,N组与H组大鼠血清IL-1β、TNF-α水平较低,组间无显著差异(P > 0.05);NLAP组与HLAP组大鼠血清IL-1β、TNF-α水平显著上升(P < 0.05),且HLAP组大鼠IL-1β、TNF-α水平更高(P < 0.05);HAPO组大鼠血清IL-1β、TNF-α水平较HLAP组显著降低(P < 0.05)。
|
| A:血清IL-1β水平; B:血清TNF-α水平; C:血清LDH水平;aP < 0.05为差异具有统计学意义 图 6 血清IL-1β、TNF-α、LDH水平 Fig 6 Serum levels of IL-1β, TNF-α and LDH |
|
|
为分析细胞坏死情况,我们检测了大鼠血清乳酸脱氢酶(LDH)水平,结果如图 10C所示,N组与H组大鼠血清LDH水平较低,组间差异无统计学意义(P > 0.05);NLAP组与HLAP组大鼠血清LDH水平较N组和H组显著上升(P < 0.05),且HLAP组大鼠血清LDH水平高于NLAP组(P < 0.05)。应用Apocynin后,HAPO组大鼠血清LDH水平较HLAP组显著降低(P < 0.05)。
3 讨论AP是常见的炎症性疾病,随着近年来HTG的发病率上升,HTGP的发病率也逐渐增高[12]。研究表明,HTGP占AP总发病率的4%~10%[13-15],特别是在中国,甚至高达10%~25.6%[16],HTG成为继胆源性和酒精性之后AP的第三大病因[17]。与其他病因引起的AP相比,HTGP患者的病情更重,并发症发生率更高,器官衰竭及病死率更高[1, 18],因此越来越受到研究者的重视。
HTG诱发AP的具体机制仍不十分明确,HTG患者血中过多的TG以富含TG的脂蛋白的形式运输到胰腺的血管床并被水解, 释放大量游离脂肪酸(FFA), 超过血浆蛋白的结合能力, 未结合的FFA相互凝集, 形成具有细胞毒性的胶束结构, 对血小板、血管内皮细胞和胰腺腺泡细胞造成损伤,导致酸中毒和胰腺缺血[19]。同时血中乳糜微粒的增多可引起血浆粘稠度增高,导致微循环障碍,从而加重酸中毒,最终诱发AP。P-407可直接抑制脂蛋白脂酶和肝脂肪酶的活性,也可间接增加胆固醇酯转移酶和卵磷脂-胆固醇酰基转移酶的生物学活性,从而升高血脂水平。腹腔注射P-407后,小鼠血清甘油三酯水平可上升到4 000 mg/dL,且无明显肝肾毒性[21-22]。本研究对大鼠联合使用了P-407和L-Arg,检测相关指标发现联合使用P-407和L-Arg后,大鼠血清TG、TC、FFA、AMY水平显著升高,同时胰腺组织出现腺泡细胞坏死、间质组织出血、炎性细胞浸润等损伤表现,提示P-407和L-Arg联合使用成功诱导了大鼠HTGP模型。
NOX是体内ROS的主要产生者之一,在天然免疫、细胞凋亡、血管生成等方面发挥着关键作用。HTGP时,过量的FFA可激活胰腺组织内的NOX,产生大量ROS,进而参与胰腺组织的损伤。一方面,过度释放的ROS可激活NF-κB信号通路,促进NF-κB的核转位,促进细胞凋亡[23]。另一方面,有研究发现,NOX与Akt/GSK-3β通路的激活间存在密切联系[24]。Akt/GSK-3β信号通路是许多生命活动中的关键信号,在细胞生存、增殖、分化、迁移等过程中发挥重要作用,有研究证实它可作为机体应对各种有害刺激的一种重要补偿保护机制[25],在胰腺炎中发挥重要作用[26]。在本研究中,我们检测了各组大鼠胰腺组织NOX4的水平,发现与非高脂血症性急性胰腺炎相比,HLAP组大鼠胰腺组织中NOX4表达水平更高,但是HLAP组大鼠的p-Akt水平反而增高,可能是机体在炎症状态下的一种保护性措施,这与既往的研究报道相一致。过度激活的NOX,产生大量ROS影响胰腺组织中的Akt/GSK-3β信号通路的激活状态,抑制GSK-3β的磷酸化失活过程,使GSK-3β活性增强,进而促进NF-κB的核转位及TNF-α、IL-1β等的释放,引发炎症级联反应,加重腺泡细胞坏死,促进胰腺损伤。使用NOX抑制剂Apocynin后,胰腺组织中的NOX4表达水平降低,Akt活化增加,促进下游GSK-3β磷酸化失活,抑制炎症介质的释放,胰腺组织病理损伤及超微结构的损伤都得到显著改善。这些结果提示在HTGP大鼠模型中,胰腺组织的NOX呈过度激活状态,通过抑制Akt/GSK-3β信号通路,加重了HTGP大鼠胰腺损伤。应用NOX抑制剂后可进一步激活Akt/GSK-3β信号通路,在HTGP大鼠胰腺损伤中发挥保护作用。
综上所述,高甘油三酯血症可明显加重AP患者的胰腺氧化应激水平和炎症反应,导致更严重的损伤,NOX介导的Akt/GSK-3β通路可能在其中发挥了重要作用。NOX抑制剂Apocynin可显著减轻胰腺组织氧化应激水平,减少炎症因子的释放,在HTGP胰腺损伤中发挥保护作用。
| [1] | Nawaz H, Koutroumpakis E, Easler J, et al. Elevated serum triglycerides are independently associated with persistent organ failure in acute pancreatitis[J]. Am J Gastroenterol, 2015, 110(10): 1497-1503. DOI:10.1038/ajg.2015.261 |
| [2] | Carr RA, Rejowski BJ, Cote GA, et al. Systematic review of hypertriglyceridemia-induced acute pancreatitis: A more virulent etiology?[J]. Pancreatology, 2016, 16(4): 469-476. DOI:10.1016/j.pan.2016.02.011 |
| [3] | Simons-Linares CR, Jang S, Sanaka M, et al. The triad of diabetes ketoacidosis, hypertriglyceridemia and acute pancreatitis. How does it affect mortality and morbidity? A 10-year analysis of the National Inpatient Sample[J]. Medicine (Baltimore), 2019, 98(7): e14378. DOI:10.1097/MD.0000000000014378 |
| [4] | 王春耀, 杜斌. 重症急性胰腺炎诊治进展[J]. 中华急诊医学杂志, 2014, 23(10): 1073-1075. DOI:10.3760/cma.j.issn.1671-0282.2014.10.001 |
| [5] | Alberici LC, Oliveira HC, Paim BA, et al. Mitochondrial ATP-sensitive K(+) channels as redox signals to liver mitochondria in response to hypertriglyceridemia[J]. Free Radic Biol Med, 2009, 47(10): 1432-1439. DOI:10.1016/j.freeradbiomed.2009.08.013 |
| [6] | Wen Y, Liu R, Lin N, et al. Nadph oxidase hyperactivity contributes to cardiac dysfunction and apoptosis in rats with severe experimental pancreatitis through ros-mediated mapk signaling pathway[J]. Oxid Med Cell Longev, 2019, 2019: 4578175. DOI:10.1155/2019/4578175 |
| [7] | Deng W, Abliz A, Xu S, et al. Severity of pancreatitis associated intestinal mucosal barrier injury is reduced following treatment with the NADPH oxidase inhibitor apocynin[J]. Mol Med Rep, 2016, 14(4): 3525-3534. DOI:10.3892/mmr.2016.5678 |
| [8] | Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Ann Surg, 1992, 215(1): 44-56. DOI:10.1097/00000658-199201000-00007 |
| [9] | Karr S. Epidemiology and management of hyperlipidemia[J]. Am J Manag Care, 2017, 23(9 Suppl): S139-S148. |
| [10] | Valdivielso P, Ramirez-Bueno A, Ewald N. Current knowledge of hypertriglyceridemic pancreatitis[J]. Eur J Intern Med, 2014, 25(8): 689-694. DOI:10.1016/j.ejim.2014.08.008 |
| [11] | de Pretis N, Amodio A, Frulloni L. Hypertriglyceridemic pancreatitis: Epidemiology, pathophysiology and clinical management[J]. United European Gastroenterol J, 2018, 6(5): 649-655. DOI:10.1177/2050640618755002 |
| [12] | Scherer J, Singh VP, Pitchumoni CS, et al. Issues in hypertriglyceridemic pancreatitis: an update[J]. J Clin Gastroenterol, 2014, 48(3): 195-203. DOI:10.1097/01.mcg.0000436438.60145.5a |
| [13] | Yin G, Cang X, Yu G, et al. Different clinical presentations of hyperlipidemic acute pancreatitis: a retrospective study[J]. Pancreas, 2015, 44(7): 1105-1110. DOI:10.1097/MPA.0000000000000403 |
| [14] | Valdivielso P, Ramirez-Bueno A, Ewald N. Current knowledge of hypertriglyceridemic pancreatitis[J]. Eur J Intern Med, 2014, 25(8): 689-694. DOI:10.1016/j.ejim.2014.08.008 |
| [15] | Xie H, Zhou ZG, Jin W, et al. Ventilator management for acute respiratory distress syndrome associated with avian influenza A (H7N9) virus infection: A case series[J]. World J Emerg Med, 2018, 9(2): 118-124. DOI:10.5847/wjem.j.1920-8642.2018.02.006 |
| [16] | Guo YY, Li HX, Zhang Y, et al. Hypertriglyceridemia-induced acute pancreatitis: progress on disease mechanisms and treatment modalities[J]. Discov Med, 2019, 27(147): 101-109. |
| [17] | Saja MF, Baudino L, Jackson WD, et al. Triglyceride-Rich Lipoproteins Modulate the Distribution and Extravasation of Ly6C/Gr1(low) Monocytes[J]. Cell Rep, 2015, 12(11): 1802-1815. DOI:10.1016/j.celrep.2015.08.020 |
| [18] | Sharyo S, Kumagai K, Yokota-Ikeda N, et al. Amelioration of renal ischemia-reperfusion injury by inhibition of IL-6 production in the poloxamer 407-induced mouse model of hyperlipidemia[J]. J Pharmacol Sci, 2009, 110(1): 47-54. |
| [19] | Cao WL, Xiang XH, Chen K, et al. Potential role of NADPH oxidase in pathogenesis of pancreatitis[J]. World J Gastrointest Pathophysiol, 2014, 5(3): 169-177. DOI:10.4291/wjgp.v5.i3.169 |
| [20] | Dong Y, Wang H, Chen Z. alpha-lipoic acid attenuates cerebral ischemia and reperfusion injury via insulin receptor and pi3k/akt-dependent inhibition of nadph axidase[J]. Int J Endocrinol, 2015, 2015: 903186. DOI:10.1155/2015/903186 |
| [21] | Qi D, Wang D, Zhang C, et al. Vaspin protects against LPSinduced ARDS by inhibiting inflammation, apoptosis and reactive oxygen species generation in pulmonary endothelial cells via the Akt/GSK3beta pathway[J]. Int J Mol Med, 2017, 40(6): 1803-1817. DOI:10.3892/ijmm.2017.3176 |
| [22] | Wei M, Gong YJ, Tu L, et al. Expression of phosphatidylinositol-3 kinase and effects of inhibitor Wortmannin on expression of tumor necrosis factor-alpha in severe acute pancreatitis associated with acute lung injury[J]. World J Emerg Med, 2015, 6(4): 299-304. DOI:10.5847/wjem.j.1920-8642.2015.04.009 |
| [23] | Liu T, Fang Y, Liu S, et al. Limb ischemic preconditioning protects against contrast-induced acute kidney injury in rats via phosphorylation of GSK-3beta[J]. Free Radic Biol Med, 2015, 81: 170-182. DOI:10.1016/j.freeradbiomed.2014.10.509 |
| [24] | Zhang J, Wang C, Yu S, et al. Sevoflurane postconditioning protects rat hearts against ischemia-reperfusion injury via the activation of PI3K/AKT/mTOR signaling[J]. Sci Rep, 2014, 4: 7317. DOI:10.1038/srep07317 |
| [25] | Wang X, Chu L, Liu C, et al. Therapeutic effects of Saussurea involucrata injection against severe acute pancreatitis- induced brain injury in rats[J]. Biomed Pharmacother, 2018, 100: 564-574. DOI:10.1016/j.biopha.2018.02.044 |
| [26] | Franke TF. PI3K/Akt: getting it right matters[J]. Oncogene, 2008, 27(50): 6473-6488. DOI:10.1038/onc.2008.313 |
 2019, Vol. 28
2019, Vol. 28




