神经组织的精细结构及相互之间复杂联系,常常使医学研究者感觉大脑就像一个有着坚硬外壳的坚果(a tough nut)[1],无法完全阐述清楚内在的奥秘,也让神经创伤的临床救治面临各种难题。一方面神经系统的特殊性决定了神经创伤救治的难度,另一方面对颅内神经细胞外环境的研究较少也是其中的原因之一。
目前认为颅内神经组织是由三个部分构成:神经细胞(包括神经元和神经胶质细胞), 血管系统, 间质系统(interstitial system,ISS) [2],分别占脑组织容量的70%~80%、3%~5%、15%~20%[3]。ISS包括包含间质液(interstitial fluid,ISF)和细胞外基质(extracellular matrix,ECM)[4]。脑脊液(cerebrospinal fluid,CSF)和ISF之间存在着密切的联系,约有20%的CSF来源于ISF[5]。文献[6-7]还证实了脑内淋巴系统的存在。此外文献[8]报道在神经细胞之间存在着缝隙连接(gap junction),其实质是作为相连的两个细胞之间的物质交流的一种膜通道。还有一种说法是将CSF和ISF合称为神经细胞的细胞外液(extracelluar fluid, ECF),其主要作用是接受和清除脑组织的代谢产物。
神经创伤的相关研究大多聚焦在神经细胞和血管,很容易忽略了颅内神经组织外环境(包括ISS、CSF、脑内淋巴系统及缝隙联系)在神经创伤发病机制中的重要地位。
1 缝隙连接缝隙连接在机体其他部位也广泛存在,被认为是两个细胞之间信息交换和物质交流的直接通道[8]。对于存在于中枢神经系统的缝隙连接,近年来的相关研究结论提出:(1)缝隙连接不仅仅只是非选择性的小分子(1 kDa)交换的通道,可能还具备电突触功能,同时还与髓鞘的产生以及维持有关[9],并可能参与癫痫的发生机制[10];(2)缝隙连接不仅仅只存在于同种胶质细胞内,还存在神经元之间以及神经元与胶质细胞之间;(3)缝隙连接是以膜蛋白聚集的形式形成的,其中有九种在神经系统中大量表达,包括Cx 26、Cx32、Cx33、Cx36、Cx37、Cx40、Cx43、Cx45在神经系统中大量表达。这些膜蛋白具有不同的功能性质,对小分子物质通透性也不一样。临床研究表明这些膜蛋白在神经损伤中的表达也不一致,例如,在颅脑损伤患者中,疾病严重程度与Cx40、Cx43水平有关[11]。目前对于缝隙连接的研究还存在许多需要拓展的地方,例如缝隙蛋白的调控方式,缝隙连接的形态学证据等。
2 脑内淋巴系统传统的观点认为颅内不存在淋巴系统,大脑属于免疫豁免器官,但近年来的研究结果推翻了上述结论。2012年Jeffrey等[6]应用双光子技术证实了脑胶质-淋巴途径的存在,命名为“Glymphatic Pathway”(GP)。GP参与了CSF和ISF之间的物质引流与交换,其中水通道蛋白(aquaporin-4)起到了关键的作用。2015年Louveau等[7]通过脑膜染色的方法证实脑内存在(脑膜)淋巴引流体系,并具有清除功能。对于两者之间的关系,目前假设的观点认为部分神经细胞代谢产物可能在通过GP排出后直接进入脑膜淋巴管进入到外周淋巴系统[7, 12]。
颅脑创伤后患者往往会出现认知水平的下降,导致外伤后痴呆的发生。目前的观点认为其发生机制可能与阿尔茨海默病(Alzheimer's disease, AD)相似,在于淋巴系统对于局部β-淀粉样蛋白(amyloid β-protein, Aβ)清除能力下降而导致过度聚集所致[9]。早期的研究还认为淋巴系统的引流与颅内压有关[13]。
3 脑脊液人类医学对于脑脊液的认识最早见于公元前17世纪古埃及的Edwin Smith Papyrus。目前认为脑脊液在维持中枢神经系统的稳态中有着重要的作用,功能包括:给脑组织、脊髓及神经提供支撑;调节颅腔内容积;营养运输的通路;通过渗透机制调节脑容量;缓冲外力,保护神经组织;免疫作用;消除代谢产物及降温作用等[14]。对于脑脊液研究主要集中在寻找脑脊液中生物标记物,其中涉及各种酶、特种蛋白、激素及microRNA等。研究提示脑脊液中的Tau蛋白、S-100、神经元特异性烯醇化酶(neuron-specific enolase,NSE)等水平变化于神经创伤患者预后或病情具有一定的预测价值[15-17]。由于神经细胞损伤后,细胞内的酶会进入脑脊液中,因此有研究者提出测定脑脊液中的各种酶,如丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)等可以作为评估急性颅脑损伤等疾病的指标[18]。而Feng等[19]则发现脑脊液中的α-黑素细胞刺激素在TBI患者出现逐步增高。虽然,关于脑脊液中生物标记物的研究较多,但目前来看,尚缺乏特异性和敏感性很高的理想的生物标记物。技术的进展还使脑脊液分子级别项目检测,如游离DNA、microRNA等成为可能。You等[20]认为颅脑创伤后脑脊液中microRNA水平可能与患者意识受损,长期昏迷有关,其中涉及单核苷酸多态性(single nucleotide polymorphisms,SNPs)。此外,脑组织是机体耗能较多的器官,脑能量代谢障碍是颅脑创伤后重要的病理生理改变,并且是继发性脑损伤的损害机制之一[21]。Weng等[22]通过研究发现侧脑室内脑脊液的温度第一个12 h的温度变化与患者的预后相关。根据Monroe-Kellie学说,脑脊液的容积改变是颅腔顺应性发挥作用的重要环节,Long等[23]应用影像技术,发现脑脊液流速和颅内压有关。理论上说,当存在更多的CSF容量时,大脑就有更大的可代偿空间,降低脑疝的形成。Minnerup等[24]通过影像技术,发现颅内CSF容量与颅内容量(intracranial volume, ICV)的比值(CSF/ICV)与恶性大脑中动脉梗死是否发生有关。
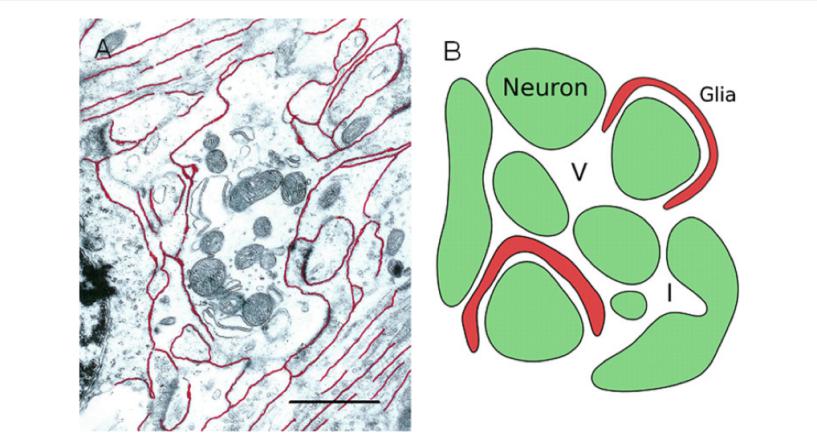
4 脑间质系统(ISS)ISS包括ISF和ECM[4]。ECM是一个不规则的空间,位于神经细胞和脑细血管之间,宽度仅20~60 nm,结构如图 1所示[4]。
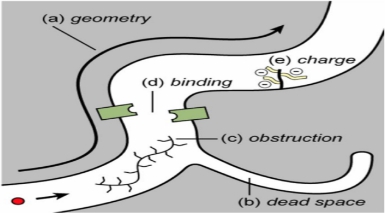
ECM主要成分包括弹性蛋白、胶原蛋白、糖胺聚糖(GAGs)、蛋白聚糖等。整体来看,神经细胞浸润在ISF中。ISF的组成则包括了蛋白多糖、透明质酸、胶原蛋白等。不同的成分具有不同的功能,例如透明质酸HA通过与细胞表面受体肌腱蛋白的相互作用促进细胞的运动和增殖,与树突生长、突触可塑性、细胞附着和迁移有关[25-26]。基质金属蛋白酶(matrix metallopeptidases,MMPs)和透明质酸还负责ECM蛋白的降解和重构[26-27]。MMPs是在神经元和小胶质细胞中合成,再分泌到ISF中。研究表明,MMPs可能与神经创伤后学习及记忆能力的损害有关[28]。ISF为神经细胞供营养,是神经细胞废物的转运及相互之间的信号传导的中介场所[29]。各种影响ISF物质转运及信号传导的因素,可能导致神经细胞受损后释放大量有害因子(如谷氨酸、促凋亡因子、促炎性因子、自由基等)的积累,从而进一步加剧了(继发)神经损伤损害(图 2)[3, 30]:(1)影响ECM的几何结构,如神经创伤后,因血脑屏障的破坏以及能量代谢的障碍导致细胞毒性水肿,细胞体的肿胀导致ISS空间受压变小,而ISS几何结构的改变阻断了ISF的引流途径[31];(2)死腔(dead-space)的出现;(3)出现堵塞;(4)结合位点的问题;(5)局部负电荷影响带电分子扩散。
微透析(microdialysis,MD)技术其实质是神经细胞代谢的监测技术,通过测定局部代谢物质,如葡萄糖,乳酸,丙酮酸、谷氨酸及甘油等浓度从而预测颅脑损伤患者的预后[32-33]。借助微透析的手段,局部乳酸和丙酮酸的比值(lactate/ pyruvate ratio,LPR) > 40且葡萄糖水平 < 0.2 mmol /L可以作为脑组织缺血的指标之一[34]。还有一项小样本的MD临床研究表明,局部LPR及甘油水平可作为预测神经创伤后ICP升高的指标[35]。但MD存在着信息片面性可能带来评估上的不准确以及因为侵入性操作带来出血及感染的风险,有待于进一步的研究和完善。Gulati等[36]注意到,由于血脑屏障的通透性改变及病理情况下ISS的变化,导致药物在颅内的分布扩散可能出现异常,影响药物的疗效。因此,了解药物在ISF引流系统中的动态分布可能有助于进一步提高药物的疗效,同时可能为局部给药技术的优化提供有价值的参考。
未来对于神经细胞外环境,可能从以下几个方向进一步拓展:(1)开展神经细胞外环境构成部分微结构的研究,进一步阐明各自的功能以及相互之间的信息传递,最终揭示神经细胞及结构在创伤中变化的机制。研究表明神经损伤后能激活机体内源性神经干细胞/祖细胞(neural stem/progenitor cell,NSPCs) [37-38],使其增殖、迁移到损伤区域并进一步分化,替代受损的神经细胞,重塑神经组织,从而可能恢复受损的神经功能;研究表明缝隙连接相关蛋白Cx43与促进颅脑外伤后NSPCs的增殖和迁移有关,而动物实验也证明了针对Cx43表达的选择性抑制药物使用后可诱导神经细胞凋亡以及抑制NSPCs的迁移[39]。(2)鉴于神经细胞外环境的不同组成部分相互之间关系的复杂性,合理建模是研究的基础,这需要开发新技术和新手段,例如神经影像技术;Taoka和Naganawa[40]尝试应用示踪剂结合MRI形象展示Glymphatic Pathway在代谢废物清除上的作用,并认为这种非侵袭的手段有助于研究结果向临床的转化。(3)蛋白组学和代谢组学的研究:神经细胞外环境的组成部分由于和神经细胞的直接接触,因此能及时反映出疾病的特异性变化,但取样的侵入性和获取量的缺陷,使临床检验不能像血液样本一样便捷; 为从有限的样本中获取更多的信息,需要发现更多的分析方法或应用各种分析方法相互组合,如蛋白组学和代谢组学的结合(co-extraction for metabolomics and proteomics)[41]。(4)注重研究与神经细胞及血管的结合:研究目的是提高临床对于神经创伤后的相关病理机制的理解,最终改善神经细胞及血管损伤后的恢复,因此必须关注颅内神经组织各个组成部分之间在神经疾病发生发展中的联动因素。例如Gautam等[42]发现,脑血管的基底膜是脑类淋巴系统的一个重要结构,基底膜的缺陷会影响CSF/ISF的流动,影响颅内代谢产物的排出,而动物实验也表明周细胞特异性的层粘连蛋白缺失会导致血脑屏障的破坏。
从这个角度出发,保持对神经细胞及其周围环境相关研究的热情(go nuts for brain),更好了解这些组成部分之间的相互作用,无疑将会有助于增强我们对于神经创伤后神经功能损害机制的理解,从而改变目前临床对于神经创伤救治理念及水平。随着科技的进步和理念的提升,我们总有一天会彻底敲开大脑这个有着“坚硬外壳的坚果”[1]。
| [1] | Joshua LM, Lichtman JW. Why not connectomics?[J]. Nature Methods, 2013, 10(6): 494-500. DOI:10.1038/nmeth.2480 |
| [2] | Fumagalli S, Ortolano F, De Simoni MG. A close look at brain dynamics: cells and vascular system seen by in vivo two-photon microscopy[J]. Prog Neurobiol, 2014, 121: 36-54. DOI:10.1016/j.pneurobio.2014.06.005 |
| [3] | Sykova E, Nicholson C. Diffusion in brain extracellular space[J]. Physiol Rev, 2008, 88(4): 1277-1340. DOI:10.1152/physrev.00027.2007 |
| [4] | Nicholson C, Kamali-Zare P, Tao L. Brain extracellular space as a diffusion barrier[J]. Comput Vis Sci, 2011, 14(7): 309-325. DOI:10.1007/s00791-012-0185-9 |
| [5] | Edsbagge M, Tisell M, Jacobsson L, et al. Spinal CSF absorption in healthy individuals[J]. Am J Physiol Regul Integr Comp Physiol, 287, R1450–1455. DOI: 10.1152/ajpregu.00215.2004. https://www.ncbi.nlm.nih.gov/pubmed/15308484 |
| [6] | Jeffrey J lliff, Wang M, Liao Y, et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β[J]. Sci Transl Med, 2012, 4(147): 147ra111. DOI:10.1126/scitranslmed.3003748 |
| [7] | Louveau A, Smirnov I, Keyes TJ, et a1. Structural and functional features of central nervous system lymphatic vessels[J]. Nature, 2015, 523(7560): 337-341. DOI:10.1038/naturel4432 |
| [8] | Kumar NM, Gilula NB. The gap junction communication channel[J]. Cell, 1996, 84(3): 381-388. DOI:10.1016/s0092-8674(00)81282-9 |
| [9] | Harrison IF, Machhada A, Colgan N, et al. Glymphatic clearance impaired in a mouse model of tauopathy:captured using contrast-enhanced MRI[J]. Alzheimers Dement, 2015, 11: P107. DOI:10.1016/j.jalz.2015.06.183 |
| [10] | Samoilova M, Li J, Pelletier MR, et a1. Epileptiform activity in hippocampal slice cultures exposed chronically to bicuculline: increased gap junctional function and expression[J]. J Neurochem, 2003, 86(3): 687-99. DOI:10.1046/j.1471-4159.2003.01893.x |
| [11] | Chen B, Sun L, Wu X, et a1. Correlation between connexin and traumatic brain injury in patients[J]. Brain Behav, 2017, 7(9): e00770. DOI:10.1002/brb3.770 |
| [12] | Simon MJ, Jeffrey J lliff. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease[J]. Biochim Biophys Acta, 2016, 1862(3): 442-451. DOI:10.1016/j.bbadis.2015.10.014 |
| [13] | Boulton M, Flessner M, Armstrong D, et al. Lymphatic drainage of the CNS: effects of lymphatic diversion/ligation on CSF protein transport to plasma[J]. Am J Physiol, 1997, 272(5 Pt 2): R1613. DOI:10.1046/j.1365-201X.1997.00050.x |
| [14] | Mae MM, Osamu O, Ma AH, et a1. Research into the physiology of cerebrospinal fluid reaches a new horizon: intimate exchange between cerebrospinal fluid and interstitial fluid may contribute to maintenance of homeostasis in the central nervous system[J]. Neurol Med Chir (Tokyo), 2016, 56: 416-441. DOI:10.2176/nmc.ra.2016-0020 |
| [15] | Bagnato S, Andriolo M, Boccagni C, et al. Dissociation of cerebrospinal fluid amyloid-β and tau levels in patients with prolonged posttraumatic disorders of consciousness[J]. Brain Inj, 2018, 32(8): 1056-1060. DOI:10.1080/02699052.2018 |
| [16] | Kirchhoff C, Buhmann S, Braunstein V, et al. Cerebrospinal s100-B: a potential marker for progressive intracranial hemorrhage in patients with severe traumatic brain injury[J]. Eur J Med Res, 2008, 13(11): 511-516. |
| [17] | Ondruschka B, Pohlers D, Sommer G, et al. S100B and NSE as useful postmortem biochemical markers of traumatic brain injury in autopsy cases[J]. J Neurotrauma, 2013, 30(22): 1862-1871. DOI:10.1089/neu.2013.2895 |
| [18] | Lenzlinger PM, Hans VH, Trentz O, et al. Markers for cell-mediated immune response are elevated in cerebrospinal fluid and serum after severe traumatic brain injury in humans[J]. J Neurotrauma, 2001, 18(5): 479-489. DOI:10.1089/089771501300227288 |
| [19] | Feng G, Feng J, Zhang S, et al. Altered levels of α-melanocyte stimulating hormone in cerebrospinal fluid and plasma of patients with traumatic brain injury[J]. Brain Res, 2018, 1696: 22-30. DOI:10.1016/j.brainres.2018.05.044 |
| [20] | You WD, Tang QL, Wang L, et al. Alteration of microRNA expression in cerebrospinal fluid of unconscious patients after traumatic brain injury and a bioinformatic analysis of related single nucleotide polymorphisms[J]. Chinese Journal of Traumatology, 2018, 19(1): 11-15. DOI:10.1016/j.cjtee.2016.01.004 |
| [21] | Brooks GA, Martin NA. Cerebral metabolism following traumatic brain injury: new discoveries with implications for treatment[J]. Front Neurosci, 2014, 8: 408. DOI:10.3389/fnins.2014.00408 |
| [22] | Weng WJ, Yang C, Huang XJ, et al. Effects of brain temperature on the outcome of patients with traumatic brain injury: a prospective observational study[J]. J Neurotrauma, 2019, 36(7): 1168-1174. DOI:10.1089/neu.2018.5881 |
| [23] | Long J, Lin H, Cao G, et al. Relationship between intracranial pressure and phase-contrast cine MRI-derived measures of cerebrospinal fluid parameters in communicating hydrocephalus[J]. Quant Imaging Med Surg, 2019, 9(8): 1413-1420. DOI:10.21037/qims.2019.08.04 |
| [24] | Minnerup J, Wersching H, Ringelstein EB, et al. Prediction of malignant middle cerebral artery infarction using computed tomography-based intracranial volume reserve measurements[J]. Stroke, 2011, 42(12): 3403-3409. DOI:10.1161/STROKEAHA.111.619734 |
| [25] | Bandtlow CE, Zimmermann DR. Proteoglycans in the developing brain: new conceptual insights for old proteins[J]. Physiol Rev, 2000, 80(4): 1267-1290. DOI:10.1152/physrev.2000.80.4.1267 |
| [26] | Hopkins AM, DeSimone E, Chwalek K, et al. 3D in vitro modeling of the central nervous system[J]. Prog Neurobiol, 2015, 125: 1-25. DOI:10.1016/j.pneurobio.2014.11.003 |
| [27] | Lo EH, Wang X, Cuzner ML. Extracellular proteolysis in brain injury and inflammation: role for plasminogen activators and matrix metalloproteinases[J]. J Neurosci Res, 2002, 69(1): 1-9. DOI:10.1002/jnr.10270 |
| [28] | Valadkhani S, Radmard AR, Saeedi M, et al. Toxoplasma encephalitis and AIDS in a patient with seizure and altered mental status: A case report[J]. World J Emerg Med, 2017, 8(1): 65-67. DOI:10.5847/wjem.j.1920-8642.2017.01.012 |
| [29] | Howell MD, Gottschall PE. Lectican proteoglycans, their cleaving metalloprotei-nases, and plasticity in the central nervous system extracellular micro-environment[J]. Neuroscience, 2012, 217: 6-18. DOI:10.1016/j.neuroscience.2012.05.034 |
| [30] | Hrabetova S, Hrabe J, Nicholson C. Dead-space microdomains hinder extracellular diffusion in rat neocortex during ischemia[J]. J Neurosci, 2003, 23(23): 8351-8359. DOI:10.1523/JNEUROSCI.23-23-08351.2003 |
| [31] | Hobohm C, Gunther A, Grosche J, et al. Decomposition and long-lasting down regulation of extracellular matrix in perineuronal nets induced by focal cerebral ischemia in rats[J]. J Neurosci Res, 2005, 80(4): 539-548. DOI:10.1002/jnr.20459 |
| [32] | Low D, Kuralmani V, Ng SK, et al. Prediction of outcome utilizing both physiological and biochemical parameters in severe head injury[J]. J Neurotrauma, 2009, 26(8): 1177-1182. DOI:10.1089/neu.2008-0841 |
| [33] | Yokobori S, Watanabe A, Matsumoto G, et al. Time course of recovery from cerebral vulnerability after severe traumatic brain injury: a microdialysis study[J]. J Trauma, 2011, 71(5): 1235-1240. DOI:10.1097/TA.0b013e3182140dd7 |
| [34] | Reis C, Wang YE, Akyol O, et al. What's new in traumatic brain injury: update on tracking, monitoring and treatment[J]. Int J Mol Sci, 2015, 16: 11903. DOI:10.3390/ijms160611903 |
| [35] | Belli A, Sen J, Petzold A, et al. Metabolic failure precedes intracranial pressure rises in traumatic brain injury: a microdialysis study[J]. Acta Neurochirurgica, 2008, 150(5): 461-470. DOI:10.1007/s00701-008-1580-3 |
| [36] | Gulati K, Aw MS, Losic D. Nanoengineered drug-releasing Ti wires as an alternative for local delivery of chemotherapeutics in the brain[J]. Int J Nanomed, 2012, 7: 2069-2076. DOI:10.2147/IJN.S29917 |
| [37] | Shibuya S, Yamamoto T, Itano T. Glial and axonal regeneration following spinal cord injury[J]. Cell Adh Migr, 2009, 3(1): 99-106. DOI:10.4161/cam.3.1.7372 |
| [38] | Soulaidopoulos S, Sinakos E, Dimopoulou D, et al. Anticholinergic syndrome induced by toxic plants[J]. World J Emerg Med, 2017, 8(4): 297-301. DOI:10.5847/wjem.j.1920-8642.2017.04.009 |
| [39] | Greer K, Chen J, Brickler T, et al. Modulation of gap junction-associated Cx43 in neural stem/progenitor cells following traumatic brain injury[J]. Brain Res Bull, 2017, 134: 38-46. DOI:10.1016/j.brainresbull.2017.06.016 |
| [40] | Taoka T, Naganawa S. Glymphatic imaging using MRI[J]. J Magn Reson Imaging, 2019 Aug 18. DOI: 10.1002/jmri.26892. |
| [41] | Hörmann P, Barkovits K, Marcus K, et al. Co-extraction for metabolomics and proteomics from a single CSF sample[J]. Methods Mol Biol, 2019, 2044: 337-342. DOI:10.1007/978-1-4939-9706-0_21 |
| [42] | Gautam J, Zhang X, Yao Y. The role of pericytic laminin in blood brain barrier integrity maintenance[J]. Sci Rep, 2016, 6: 36450. DOI:10.1038/srep36450 |
 2019, Vol. 28
2019, Vol. 28