百草枯(paraquat,PQ)因自服或误服引起的急性中毒病例多见,由于缺乏有效的解毒药物和治疗手段,已成为我国农药中毒致死事件的常见病因[1]。PQ毒性累及全身多个脏器,其中肺是主要靶器官,肺中的浓度可比血浆中高6~10倍[2],早期表现为急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),后期则出现肺纤维化(pulmonary fibrosis,PF),是PQ中毒患者致死的主要原因,为了研究PQ中毒尤其是早期肺损伤的发病机制,需要建立PQ致肺损伤的动物模型。国内外研究者曾以灌胃、腹腔注射以及经鼻给药等方式建立PQ致ALI/PF模型[3-5],但在给药剂量及给药时间等研究细节尚未统一,研究结果的可重复性仍存在一定争议。本课题组在前期工作中发现:单次大剂量或间断中等剂量腹腔注射作为PQ全身性给药的方法之一,可以成功诱导出早期小鼠急性肺损伤,但早期病死率较高[6],因此仍有必要进一步探讨和优化PQ致肺损伤模型。经气道给药是建立经典的ALI/ARDS(脂多糖[7]或油酸[8-9])及PF(博来霉素[10])模型的方法。本研究通过单次气道内雾化给药的方式建立PQ致ALI的模型,为更好地探讨PQ致ALI的发病机制及治疗方法打下基础。
1 材料与方法 1.1 材料SPF级雄性C57BL/6J小鼠30只,8~10周龄,体质量20~26 g,购于北京维通利华实验动物有限公司; 实验地点南京医科大学实验动物中心。百草枯购于Sigma公司(美国),溶于0.9%生理盐水(大冢制药,中国),配置终浓度为0.4 mg/mL,分装并放置-20℃冻存。每管分装液仅使用一次。本试验获得南京医科大学动物伦理批准(伦理编号:IACUC-1712010)。
1.2 方法 1.2.1 实验分组将30只小鼠按随机数字表法分为2组:模型组和对照组,每组15只。
1.2.2 动物模型建立小鼠饲养在动物中心恒温恒湿鼠笼中,昼夜交替12 h/12 h,自由进食进水。实验前饲养1周,使小鼠适应环境。小鼠予以七氟烷吸入麻醉,模型组给予0.4 mg/mL百草枯水溶液50 μL经气管微型喷雾器(Model IA-IC microsprayer,Penn-Century,美国)连接气道内雾化给药针(High Pressure Syringe Model FMJ-250, Penn-Century,美国)给药,对照组同步骤给予等量生理盐水(大冢制药,中国)。于造模后的72 h处死小鼠并收获标本。
1.2.3 小鼠一般情况监测每日测量小鼠的体质量变化,并观察小鼠活动状态、毛色、呼吸情况等变化。若有小鼠死亡,记录死亡日期。
1.2.4 肺功能测量小鼠予1%戊巴比妥腹腔注射麻醉后,剥离颈部皮肤皮下组织,气管切开并留置导管,连接Buxco(美国)小动物肺功能仪,监测压力-容积曲线获得肺阻力及肺静态顺应性结果。
1.2.5 支气管肺泡灌洗小鼠心脏取血后,打开胸腔暴露双侧肺部,夹闭左侧主支气管,右肺予0.5 mL支气管肺泡灌洗(bronchoalveolar lavage,BAL),共3次(灌洗液成份:50 mL PBS+5 mmol/L EDTA)。支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)经红细胞裂解液(Sigma,美国)处理后予以1 200 r/min,离心10 min,留取上清液做酶联免疫吸附测定(ELISA),细胞沉淀PBS重悬后取10 μL于显微镜下细胞计数,剩余行瑞士-吉姆萨改良染色法分类计数。
1.2.6 细胞因子测定小鼠血离心后取血清,同BALF上清液分别以ELISA试剂盒(R & D,美国)测定细胞因子(TNF-α,IL-1β,IL-6)水平。实验中设置空白对照孔和标准品孔,选择450 nm波长检测吸光度(570 nm波长校正),并根据标准品的吸光度值及相应的浓度值,制作标准曲线。根据标准曲线计算出待测样品的浓度值。
1.2.7 髓过氧化物酶(myeloperoxidase,MPO)测定BALF上清液按MPO试剂盒(南京建成,中国)方法在460 nm处通过比色测定产物的生成量从而推算出MPO的活性。
1.2.8 BALF总蛋白浓度测定BALF上清液以BCA法(Thermo,美国)测定蛋白浓度。96孔板加入浓度梯度标准品蛋白及样本,再加入BCA工作液,37℃孵育30 min,于570 nm处测吸光度值,计算标准曲线,根据标准曲线计算每个样本蛋白浓度。
1.2.9 肺组织病理学观察4%多聚甲醛灌注固定左肺24 h,沿横截面将肺叶切成6~8片,每片厚度1.5 mm,石蜡包埋,切片后行苏木精-伊红(HE)染色,肺损伤病理学评分方法参考美国胸科学会(American Thoracic Society, ATS)标准[11]。
1.3 统计学方法计量资料以均数±标准差(Mean±SD)表示,SPSS 17.0软件进行统计学分析、Graphpad Prism 5软件作图。两组间比较选用成组t检验。以P<0.05为差异有统计学意义。
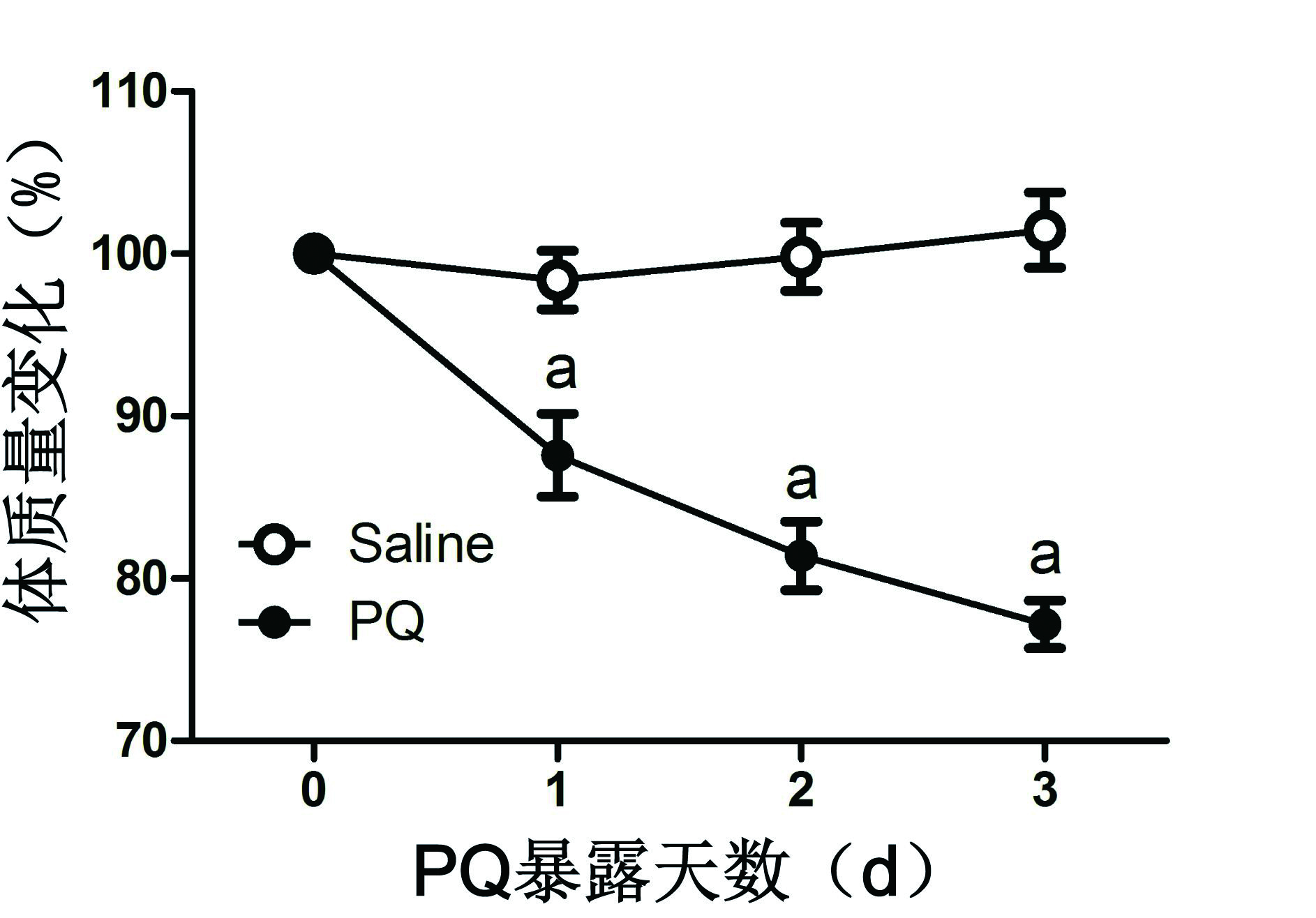
2 结果 2.1 一般情况两组小鼠给药后72 h内均无死亡。对照组小鼠体质量无明显变化,活动度佳,毛发光泽,呼吸未见异常; 模型组小鼠给药24 h后出现毛发松散、呼吸急促、活动减少及体质量下降等表现,72 h以上表现进一步加重。图 1示造模开始不同时间点两组小鼠的体质量变化,可见造模小鼠在接受PQ气道给药后第一个24小时即有明显体质量下降,72 h进一步下降,而对照组体质量略有上升。
|
| 与对照组比较,aP<0.01 图 1 小鼠体质量变化 Fig 1 Body mass change in mice |
|
|
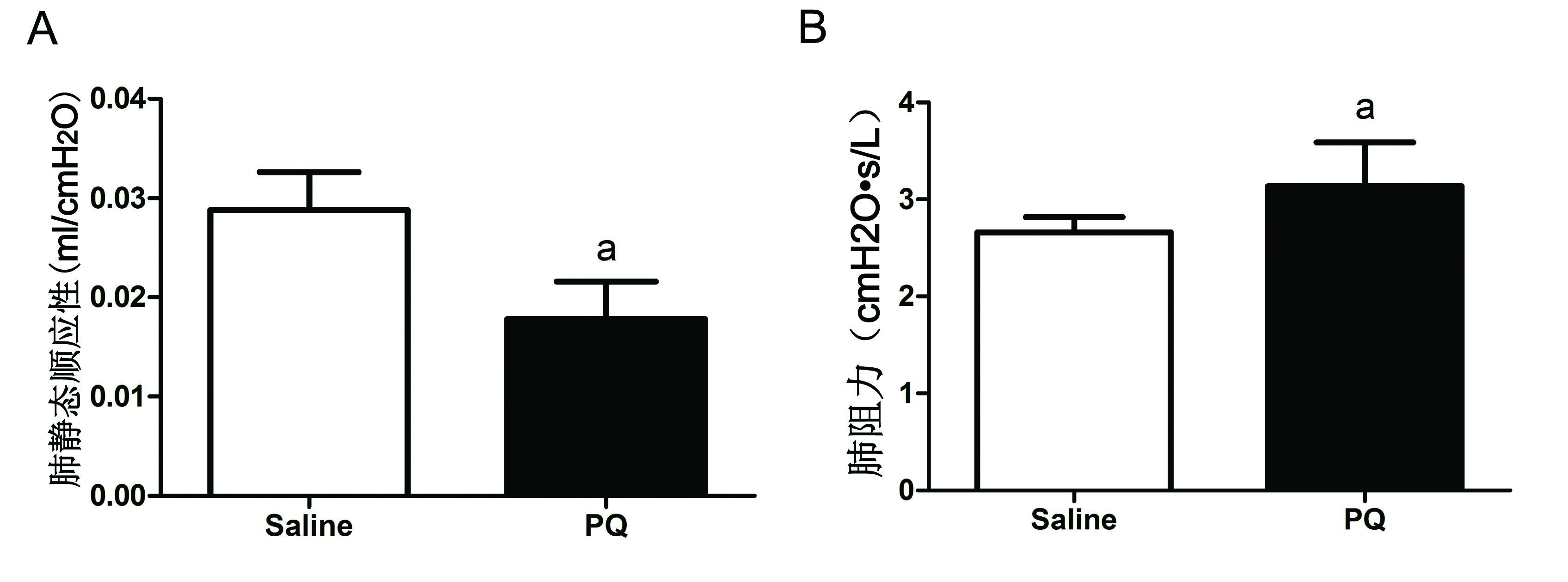
如图 2所示,与对照组比较,PQ给药后72 h小鼠肺静态顺应性(Cstatic)明显下降(P<0.01),而肺阻力(Rl)升高(P<0.01)。
|
| A:肺静态顺应性; B:肺阻力; 与对照组比较,aP<0.01 图 2 小鼠肺功能 Fig 2 Pulmonary function of mice |
|
|
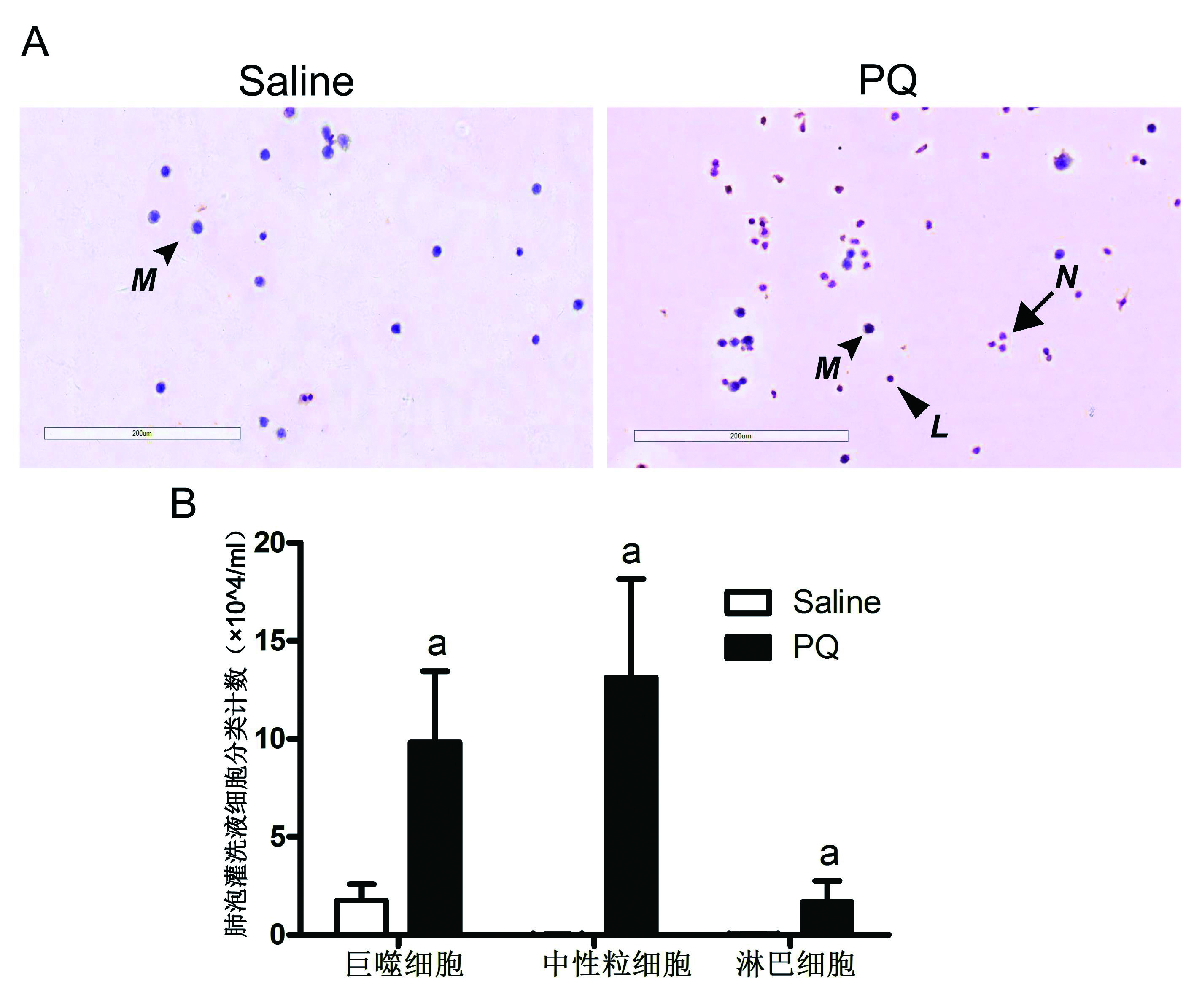
镜下观察BALF涂片(图 3),对照组BALF中主要为肺泡巨噬细胞和少量上皮细胞,PQ造模后72 h小鼠BALF中炎症细胞明显增多,以中性粒细胞和巨噬细胞为主,并有少量淋巴细胞,各细胞种类数量较对照组均明显升高(均P<0.01)。
|
| A:BALF细胞涂片瑞士-吉姆萨染色(×200),M-巨噬细胞,N-中性粒细胞,L-淋巴细胞; B:BALF细胞分类计数; 与对照组比较,aP<0.01 图 3 BALF中细胞分类计数 Fig 3 Cell counting and classification of BALF. |
|
|
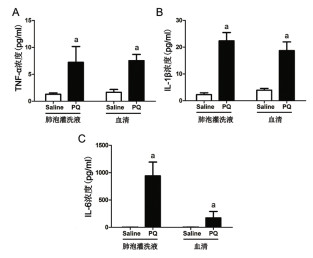
如图 4所示,与对照组比较,PQ造模组小鼠BALF和血清中促炎细胞因子TNF-α,IL-1β,IL-6水平均显著升高(均P<0.01)。
|
| A:TNF-α浓度; B:IL-1β浓度; C:IL-6浓度; 与对照组比较,aP<0.01 图 4 BALF和血清中炎症因子水平 Fig 4 Proinflammatory cytokines in BALF and serum |
|
|
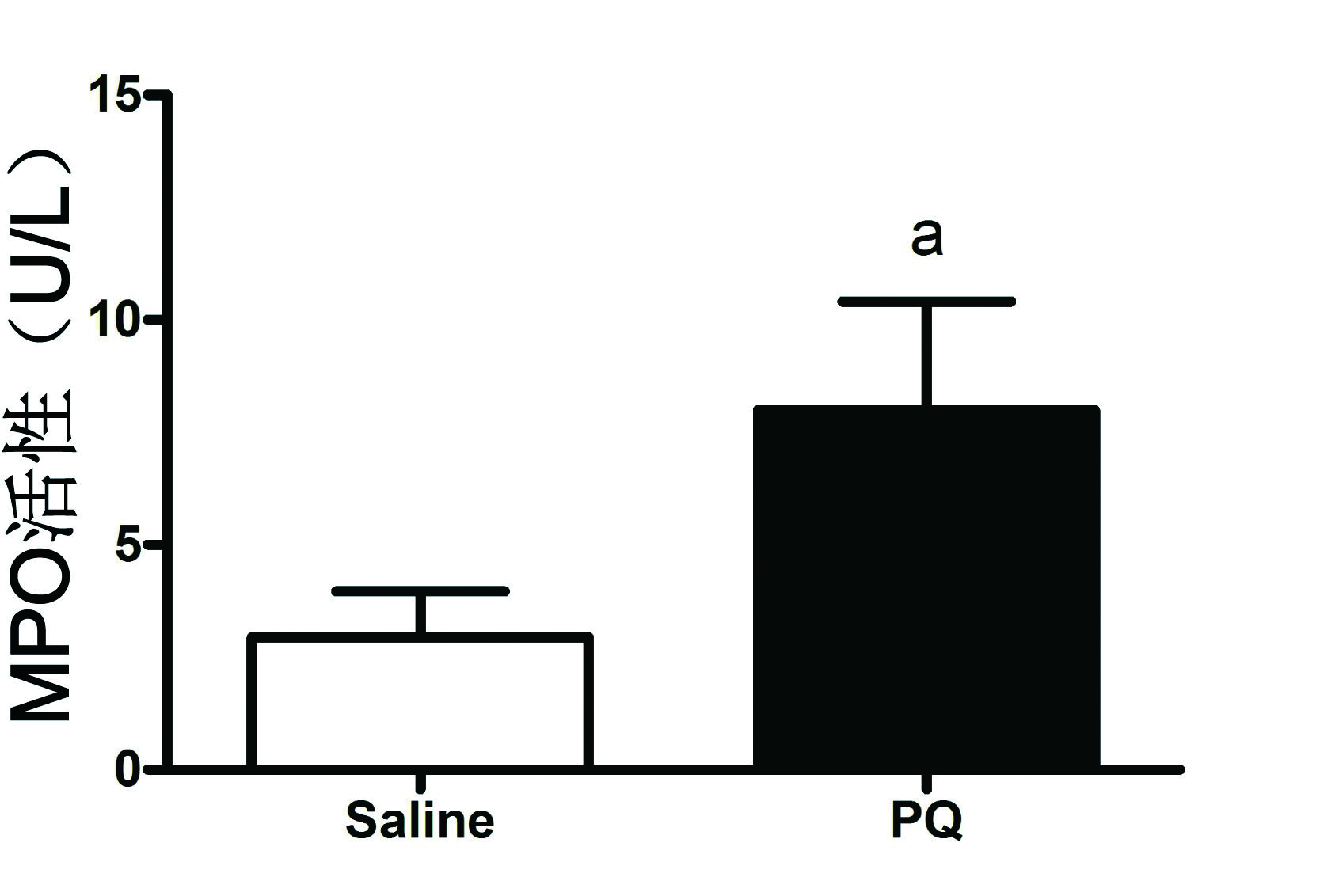
BALF中MPO活性反映中性粒细胞浸润程度,图 5示PQ气道给药后72 h BALF中MPO活性明显上升(P<0.01)。
|
| 与对照组比较,aP<0.01 图 5 BALF中髓过氧化物酶(MPO)活性 Fig 5 MPO activity in BALF |
|
|
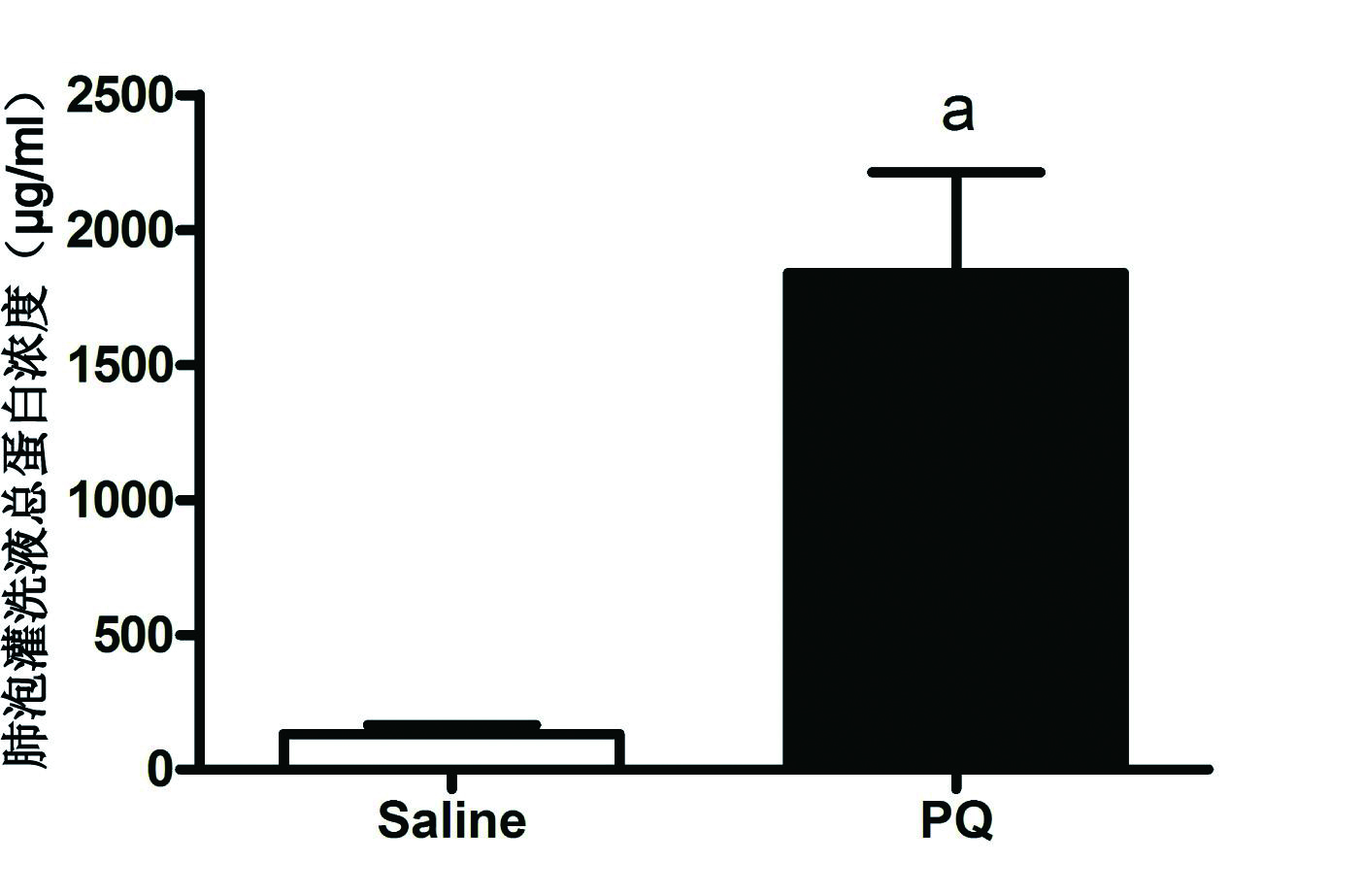
BALF总蛋白浓度反映了肺泡-毛细血管通透性,如图 6所示,健康对照组小鼠BALF中蛋白含量极低,PQ气道造模后72 h可见BALF中蛋白浓度显著升高(P<0.01),提示肺泡-毛细血管通透性增加。
|
| 与对照组比较,aP<0.01 图 6 BALF总蛋白浓度 Fig 6 Total protein concentration of BALF |
|
|
对照组小鼠肺组织标本外观呈粉红色,弹性好; HE染色(图 7)见肺组织结构清晰,间质血管无扩张,无炎性细胞浸润,肺泡腔洁净,无红细胞渗出,肺泡壁薄,支气管黏膜上皮完整。PQ模型组小鼠肺组织标本肿胀变大,局部充血实变; HE染色示肺间质及肺泡腔内大量炎性细胞浸润,以中性粒细胞为主,伴弥漫性肺出血、肺泡塌陷、透明膜形成和广泛的肺泡间隔增厚。肺损伤病理学评分PQ组显著高于对照组(P<0.01)。

|
| A:肺组织切片HE染色(×200,×400); B:肺损伤病理学评分; 与对照组比较,aP<0.01 图 7 肺组织HE染色及病理学评分 Fig 7 HE staining and pathology scores of lung tissue |
|
|
PQ致肺损伤的发病机制尚未完全阐明,而动物模型可以较好地模拟疾病的发生发展过程。目前常用于研究PQ致肺损伤的动物种类包括大鼠、小鼠等。尤其是近交系小鼠因其遗传背景一致,实验重复性好而被广泛使用。以往研究PQ致肺损伤模型主要采用腹腔注射或灌胃的方法,但这些研究在给药剂量等方面没有统一方案,PQ经全身吸收后到达肺部造成的肺损伤也轻重各异,并且,PQ剂量大时小鼠出现多器官损伤,病死率较高,剂量h不易诱发出肺损伤,不符合模型条件[6]。气道内雾化给药是较合理的肺内给药方式,无需气管切开或穿刺,药物在小动物喉镜引导下经高压雾化器形成极小雾滴直接喷射入肺组织,能够在肺内均匀分布,具有操作迅速、给药准确、创伤小以及感染风险低等优点[12]。气道内雾化时高压雾化器可将溶液分散为体积更小的液滴,在气流的推动下,分散的液滴能进入各肺叶并到达细支气管以下结构[13]。
本研究通过PQ气道内单次雾化给药的方式诱导C57BL/6 J小鼠发生ALI,并进行效果评价。结果发现经气道单次雾化给药0.02 mg/只可诱导小鼠发生ALI,主要表现为:给药72 h内体质量进行性下降,呼吸急促,活动减少; 72 h的肺功能静态顺应性降低,肺阻力增加,提示存在生理学功能障碍; BALF中中性粒细胞、巨噬细胞等炎症细胞数量明显高于对照组,BALF及血清中促炎细胞因子TNF-α、IL-1β、IL-6水平明显升高,BALF中MPO活性明显升高,以上均提示肺部存在典型炎症反应; BALF总蛋白浓度明显升高,提示肺泡-毛细血管通透性增加,血管内蛋白漏入肺泡中; 肺组织病理学观察可见大量炎性细胞浸润,伴肺出血、肺泡塌陷、透明膜形成和肺泡间隔增厚,肺损伤评分显著升高。依据美国胸科协会(ATS)的标准,ALI动物模型需符合快速发生(24 h以内)及以下特征:组织损伤的组织学证据、肺泡-毛细血管屏障的改变、炎症反应以及生理学功能障碍的证据,以上4项特征至少符合3项[11]。在本课题组的PQ气道内雾化给药模型中,以上4个特征均有实验证据,可认为PQ气道内单次雾化给药法可以成功建立小鼠ALI模型。
评价一个动物模型是否合格主要取决于它是否能较好地模拟该疾病的发生、发展过程,包括组织病理学和生理学变化。PQ致ALI主要病理学特征表现为肺泡Ⅰ/Ⅱ型上皮细胞及肺血管内皮细胞损伤、以中性粒细胞为主的炎性细胞浸润、肺出血及渗透性肺水肿的形成[2]。而本研究建立的小鼠ALI模型,表现出明显的肺功能损害(肺静态顺应性下降),并伴有典型的ALI改变如炎性细胞浸润、肺水肿、肺出血及肺血管淤血等,与人类PQ中毒引起的肺损伤表现一致。
目前ALI动物模型包括直接肺损伤模型:包括盐酸吸入模型、机械通气模型、油酸注射模型以及病毒感染模型等; 间接肺损伤模型:包括内毒素模型、烧伤/烟雾吸入模型、输血模型、缺血-再灌注模型及胰腺炎模型等; 以及二次打击致肺损伤模型[14]。其中比较常用的有内毒素模型、机械通气模型和二次打击模型[15]。由于PQ中毒的主要靶器官是肺,且引起的肺损伤表现与其他病因近似,所以PQ作为一种工具药建立ALI模型同样具有研究价值。
| [1] | 中国医师协会急诊医师分会. 急性百草枯中毒诊治专家共识(2013)[J]. 中国急救医学, 2013, 33(6): 484-489. DOI:10.3969/j.issn.1002-1949.2013.6.002 |
| [2] | Dinis-Oliveira RJ, Duarte JA, Sánchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [3] | 磨静佳, 赵晓琴, 邝晓聪, 等. 百草枯致急性肺损伤大鼠模型的建立[J]. 蛇志, 2009, 21(2): 101-102. DOI:10.3969/j.issn.1001-5639.2009.02.006 |
| [4] | 陈丽, 钱洁, 叶延, 等. 百草枯反复小剂量腹腔给药诱导小鼠肺纤维化模型[J]. 中华急诊医学杂志, 2011, 20(12): 1285-1289. DOI:10.3760/cma.j.issn.1671-0282.2011.12.016 |
| [5] | Tomita M, Okuyama T, Katsuyama H, et al. Mouse model of paraquat-poisoned lungs and its gene expression profile[J]. Toxicology, 2007, 231(2/3): 200-209. DOI:10.1016/j.tox.2006.12.005 |
| [6] | 孙昊, 张劲松, 康健, 等. 不同时段剂量腹腔注射百草枯致小鼠肺损伤及肺纤维化效果评价[J]. 中华急诊医学杂志, 2016, 25(11): 1386-1392. DOI:10.3760/cma.j.issn.1671-0282.2016.11.007 |
| [7] | Liu FF, Li WL, Pauluhn J, et al. Lipopolysaccharide-induced acute lung injury in rats: Comparative assessment of intratracheal instillation and aerosol inhalation[J]. Toxicology, 2013, 304: 158-166. DOI:10.1016/j.tox.2012.12.020 |
| [8] | Schuster P. ARDS: clinical lessons from the oleic acid model of acute lung injury[J]. Am J Respir Crit Care Med, 1994, 149(1). DOI:10.1164/ajrccm.149.1.8111590 |
| [9] | Gonçalves-De-albuquerque CF, Silva AR, Burth P, et al. Oleic acid induces lung injury in mice through activation of the ERK pathway[J]. Mediators Inflamm,, 2012, 2012: 1-11. DOI:10.1155/2012/956509 |
| [10] | Dong J, Yu XQ, Porter DW, et al. Common and distinct mechanisms of induced pulmonary fibrosis by particulate and soluble chemical fibrogenic agents[J]. Arch Toxicol, 2016, 90(2): 385-402. DOI:10.1007/s00204-015-1589-3 |
| [11] | Matute-Bello G, Downey G, Moore BB, et al. An official american thoracic society workshop report: features and measurements of experimental acute lung injury in animals[J]. Am J Respir Cell Mol Biol, 2011, 44(5): 725-738. DOI:10.1165/rcmb.2009-0210st |
| [12] | Bivasbenita M, Zwier R, Junginger H, et al. Non-invasive pulmonary aerosol delivery in mice by the endotracheal route[J]. Eur J Pharm Biopharm, 2005, 61(3): 214-218. DOI:10.1016/j.ejpb.2005.04.009 |
| [13] | 黄建华, 李理, 袁伟锋, 等. 脂多糖经不同给药方式致急性肺损伤小鼠模型的比较研究[J]. 中国呼吸与危重监护杂志, 2013, 12(3): 264-268. DOI:10.7507/1671-6205.20130063 |
| [14] | 陈超蕾, 陈成水, 马源, 等. 急性肺损伤/急性呼吸窘迫综合征鼠类模型研究进展[J]. 国际呼吸杂志, 2012, 32(22): 1731-1736. DOI:10.3760/cma.j.issn.1673-436X.2012.022.010 |
| [15] | 陈勇, 周继红, 欧阳瑶, 等. 急性肺损伤实验动物模型[J]. 创伤外科杂志, 2013, 15(5): 466-469. DOI:10.3969/j.issn.1009-4237.2013.05.033 |
 2019, Vol. 28
2019, Vol. 28




