体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)作为一种体外生命支持方式,能够部分或者完全替代严重心肺功能衰竭患者的心肺功能,让心脏和肺脏得到充分休息,并为原发疾病的治疗和心肺功能的恢复赢得宝贵时间[1-2]。尽管ECMO技术已经成为抢救急性心肺功能衰竭的有效手段,但是ECMO运行过程中,体外循环装置与患者血液长期接触容易激活炎症级联反应造成炎症因子释放[3]。如何辨别接受ECMO治疗患者是否为真正的细菌感染从而指导抗生素的规范使用,是临床医生所面临的一个难题。降钙素原(procalcitonin, PCT)已经被证实是细菌感染的一个特异性和敏感性的指标[4]。ECMO运行过程中,PCT是否能够准确反映细菌感染,仍然少有报道。本研究通过回顾性研究收入本院接受ECMO治疗患者的临床资料,评价PCT对ECMO患者细菌感染的诊断价值。
1 资料与方法 1.1 一般资料选择2016年8月至2018年1月收入武汉同济医院重症医学科接受ECMO支持的患者,包括了因急性呼吸衰竭而施行静脉-静脉ECMO(VV-ECMO),以及因急性心功能衰竭而施行的静脉-动脉ECMO(VA-ECMO)。排除标准:ECMO支持<48 h,未进行细菌培养,未进行血浆PCT或其他常规炎性指标检测的患者。ECMO装置使用德国迈柯唯Maquet公司生产的离心泵、氧合器和动静脉导管。患者或家属均签署了知情同意书。
1.2 观察指标收集以下资料:①患者一般资料:性别、年龄、体质量、病史、诊断等;②病原微生物学、急性生理与慢性健康状态评分(APACHE Ⅱ)、序贯器官衰竭评分(SOFA)、生理学指标、白细胞计数(WBC)、C反应蛋白(C reactive protein, CRP)、白介素6(interleukin-6, IL-6)、连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)情况等;③ECMO模式及时间、相关并发症、ICU住院时间、总体住院时间、28 d生存情况等。
1.3 研究方法每一位患者均至少进行了一次血浆PCT检查和微生物培养。培养标本包括了血液、尿液、支气管肺泡灌洗液(bronchoalveolar lavage, BAL)、痰液、脑脊液等。诊断细菌性肺部感染需要BAL细菌培养阳性,或者痰液培养阳性合并有白细胞增多、明显的胸部影像学改变、以及临床医生所确定的典型临床症状等。血液和尿液细菌感染则取决于培养结果。微生物培养后24 h内需要立即行血浆PCT和常规血液检查,获得的结果进行统计学分析。如果24 h内有多次PCT的检查结果,则选取最接近微生物学培养时间点的PCT检查结果进行分析。血浆标本收集后1 h内立即测定,血浆PCT浓度测定使用床边丹麦雷度米特AQT90 FLEX免疫分析仪测定。
1.4 统计学方法统计绘制受试者工作特征曲线(receiver operating characteristic curve, ROC)并计算曲线下面积(AUC)来评估各炎性指标对接受ECMO治疗患者细菌感染的诊断价值。将血浆PCT浓度初始判定临界值常规定为0.5 ng/mL、1.0 ng/mL、1.5 ng/mL、2.0 ng/mL和2.5 ng/mL等,统计分析各个PCT临界值对诊断ECMO患者细菌感染的敏感性和特异性。所有数据均采用SPSS 19.0统计软件处理,以P<0.05为差异有统计学意义。
2 结果 2.1 患者的基本临床资料共纳入17名接受ECMO治疗的患者(见表 1),其中男性15名(88.2%),年龄为(45.8±16.0)岁。行VV-ECMO的患者为13例(76.5%),而行VA-ECMO的患者为4例(23.5%)。所有患者APACHE Ⅱ评分为(24.2±4.7),SOFA评分为(12±2.5),15例患者接受了CRRT治疗(88.2%),ECMO支持时间为(5.2±2.8)d,总体ICU住院时间为(8.9±5.3)d,28 d生存率为47.1%。ECMO期间共有37人次细菌培养阳性,其中血液培养阳性9次(24.3%)、尿培养阳性3次(8.1%)、呼吸道培养阳性25次(67.6%)。ECMO过程中共有91次血浆PCT测定,平均每个患者监测PCT (5.7±1.2)次。
| 项目 | 数值 |
| 病例数 | 17 |
| 男性(n, %) | 15(88.2) |
| 年龄(岁) | 45.8±16.0 |
| 临床诊断 | |
| 呼吸衰竭(n, %) | 13(76.5) |
| 心功能衰竭(n, %) | 4(23.5) |
| ECMO模式 | |
| VV-ECMO(n, %) | 13(76.5) |
| VA-ECMO(n, %) | 4(23.5) |
| ECMO支持时间 | 5.2±2.8 |
| 细菌感染情况 | |
| 细菌培养阳性数 | 37 |
| 血液(n, %) | 9(24.3) |
| 尿液(n, %) | 3(8.1) |
| 呼吸道(n, %) | 25(67.6) |
| PCT测定次数 | 91 |
| 平均每个患者PCT次数 | 5.7±1.2 |
| 临床指标 | |
| APACHEII评分 | 24.2±4.7 |
| SOFA评分 | 12±2.5 |
| CRRT患者(n, %) | 15(88.2) |
| 机械通气时间(d) | 7.2±3.8 |
| ICU住院时间(d) | 8.9±5.3 |
| 28 d生存患者(n, %) | 8(47.1%) |
纳入研究的17名ECMO患者,新发细菌感染4例,实施ECMO前已经发生细菌感染8例,真菌培养阳性的患者4例。37人次阳性细菌培养中,主要为金黄色葡萄球菌(27%),其次为铜绿假单胞菌(16.2%)、凝固酶阴性和头状葡萄球菌(13.5%)、鲍曼不动杆菌(13.5%)、肺炎克雷伯(8.1%)、嗜麦芽窄食单胞菌(8.1%)等(见表 2)。
| 患者 | 性别 | 年龄 | 感染发生时期 | PCT次数 | 培养部位 | 微生物培养结果 |
| 1 | 男 | 46 | 新发 | 6 | BAL | 金黄色葡萄球菌铜绿假单胞菌白色念珠菌 |
| 2 | 男 | 17 | 新发 | 4 | 痰液 | 肺炎克雷伯菌嗜麦芽窄食单胞菌 |
| 3 | 男 | 49 | ECMO前 | 7 | 痰液 | 铜绿假单胞菌嗜麦芽窄食单胞菌 |
| 血液 | 凝固酶阴性葡萄球菌 | |||||
| 4 | 男 | 42 | 无 | 4 | ||
| 5 | 男 | 54 | 无 | 5 | ||
| 6 | 男 | 43 | ECMO前 | 6 | 血液 | 金黄色葡萄球菌 |
| 尿液 | 肠屎球菌 | |||||
| 7 | 女 | 67 | ECMO前 | 7 | 痰液 | 金黄色葡萄球菌铜绿假单胞菌 |
| 8 | 男 | 30 | 无 | 4 | ||
| 9 | 男 | 70 | ECMO前 | 4 | BAL | 金黄色葡萄球菌念珠菌 |
| 10 | 男 | 62 | ECMO前 | 6 | 痰液 | 金黄色葡萄球菌鲍曼不动杆菌念珠菌 |
| 11 | 男 | 49 | 新发 | 4 | 痰液 | 念珠菌 |
| 12 | 男 | 15 | ECMO前 | 6 | 痰液 | 金黄色葡萄球菌鲍曼不动杆菌 |
| 血液 | 金黄色葡萄球菌 | |||||
| 13 | 男 | 60 | 无 | 6 | ||
| 14 | 女 | 28 | ECMO前 | 4 | BAL | 金黄色葡萄球菌 |
| 血液 | 头状葡萄球菌 | |||||
| 15 | 男 | 52 | ECMO前 | 7 | BAL | 金黄色葡萄球菌烟曲霉 |
| 尿液 | 肠杆菌 | |||||
| 16 | 男 | 61 | 无 | 6 | ||
| 17 | 男 | 34 | 新发 | 5 | BAL | 铜绿假单胞菌 |
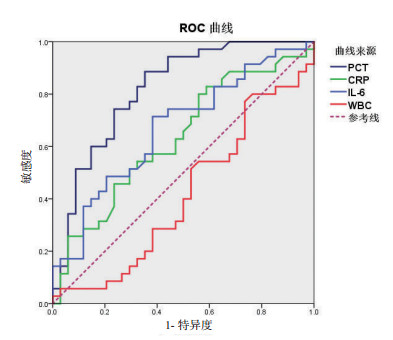
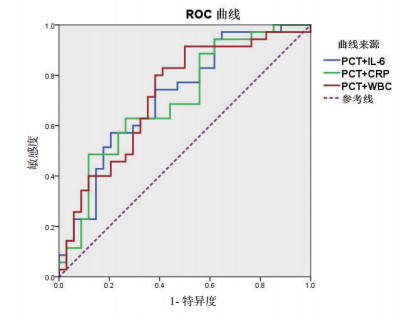
血浆PCT水平对于细菌感染的诊断具有显著临床意义(ROC曲线下面积0.818,P<0.001),而虽然IL-6也差异有统计学意义P=0.016,但是曲线下面积只有0.669,诊断价值较低。CRP和WBC均差异无统计学意义(P>0.05),对于ECMO患者细菌感染无明确诊断意义(见图 1)。虽然PCT联合IL-6,PCT联合CRP,以及PCT联合WBC绘制ROC曲线也差异有统计学意义,但是曲线下面积只有0.716, 0.704,0.721,诊断价值不及PCT(见图 2,表 3)。当血浆PCT设定为1.0 ng/ml时,敏感度为0.88,特异度为0.62,能够很好诊断评估ECMO患者的细菌感染水平(见表 4)。
|
| 图 1 炎症指标诊断ECMO患者细菌感染的ROC曲线 Fig 1 ROC Curve of inflammatory markers for ECMO patients with bacterial infection |
|
|
|
| 图 2 炎症指标联合诊断ECMO患者细菌感染的ROC曲线 Fig 2 ROC Curve of combined inflammatory markers for ECMO patients with bacterial infection |
|
|
| 炎症指标 | 曲线下面积 | 标准误 | 面积(95%可信区间) | P值 |
| PCT | 0.818 | 0.051 | 0.717-0.919 | <0.001 |
| IL-6 | 0.669 | 0.065 | 0.541-0.797 | 0.016 |
| CRP | 0.632 | 0.067 | 0.499-0.764 | 0.060 |
| WBC | 0.415 | 0.069 | 0.279-0.551 | 0.225 |
| PCT+IL-6 | 0.716 | 0.062 | 0.595-0.837 | 0.002 |
| PCT+CRP | 0.704 | 0.063 | 0.581-0.828 | 0.004 |
| PCT+WBC | 0.721 | 0.062 | 0.599-0.843 | 0.002 |
| PCT(ng/mL) | 敏感度 | 特异度 |
| 0.5 | 0.94 | 0.44 |
| 1.0 | 0.88 | 0.62 |
| 1.5 | 0.83 | 0.65 |
| 2.0 | 0.75 | 0.74 |
| 2.5 | 0.74 | 0.76 |
| 3.0 | 0.68 | 0.76 |
| 3.5 | 0.60 | 0.79 |
急性呼吸或循环衰竭的患者在ECMO支持过程中,细菌感染会明显延长ECMO和机械通气的时间,增加并发症风险,从而明显增加ECMO患者的病死率[5]。2016年国际体外循环生命支持组织统计分析显示,ECMO进行呼吸支持的患者中约有5.8%的新生儿,16.9%的儿童和17.8%的成人并发了微生物感染。最常见的是血流感染,其次是外科感染、泌尿系感染和呼吸道感染[6]。Bizzaro等[7]报道了ECMO患者培养出的微生物为凝固酶阴性葡萄球菌(15.9%)、念珠菌(12.7%)、铜绿假单胞菌(10.5%)、金黄色葡萄球菌(9.4%)和大肠杆菌(3.9%)。本回顾性研究中,17例ECMO患者共有37次细菌培养阳性,主要为呼吸道培养和血液培养。培养出微生物主要为金黄色葡萄球菌(27%),其次为铜绿假单胞菌(16.2%)、凝固酶阴性和头状葡萄球菌(13.5%)、鲍曼不动杆菌(13.5%)等,与其他中心的数据有所差别。可能与研究所在中心的地域位置、微生物流行情况、患者自身感染、以及ECMO管理技术水平有关。
临床上常规使用WBC、CRP和IL-6等传统炎症指标来诊断并监测感染的发生[8]。然而患者在ECMO治疗过程中,由于体外循环装置与患者血液长期接触容易激活炎症级联反应造成炎症因子释放,可能会干扰临床医生对于微生物感染的判断[9]。PCT是降钙素的前体肽,在细菌内毒素等刺激下,血浆中PCT浓度会短时间内明显升高。不同于其他常规炎症指标,PCT对于细菌感染具有较高的特异性和敏感性,同时与细菌感染的严重程度有较好的相关性[10]。ECMO运行过程中PCT是否仍然能够准确诊断细菌感染,少有报道。Pieri等进行的一项病例对照研究中纳入了27例ECMO患者(主要为VA-ECMO患者),监测血浆PCT和CRP来评估细菌感染。结果显示血浆PCT的AUC为0.681,CRP的AUC为0.707[11]。而本研究中主要为呼吸支持VV-ECMO患者(76.5%),肺部感染并急性呼吸窘迫综合征的患者占多数,微生物培养中也有67.6%为呼吸道感染,所以数据及结论会有不同。本研究中血浆PCT的AUC达到了0.818,对于细菌感染的诊断价值较高。当血浆PCT设定为1.0 ng/ml或2.5 ng/ml时,约登指数均为0.5,对于ECMO患者细菌感染均具有很好的诊断价值。但是,为了更早期预警及发现ECMO患者的细菌感染,本研究选择了灵敏度稍高(0.88)的PCT临界值1.0 ng/ml。
本研究中WBC、CRP和IL-6等常规炎症指标并不能准确诊断评估ECMO患者细菌感染。原因可能是患者实施ECMO后,根据肺保护性通气策略,下调呼吸机参数以及缩短机械通气时间,导致IL-6和IL-8等炎症指标明显下降;而呼吸机参数仍然很高的ECMO患者炎症指标仍然会异常升高。可见ECMO运行过程中会明显影响常规炎症指标,可能降低对细菌感染诊断的特异性[12]。虽然WBC越高提示细菌感染的可能性越大,但是临床上重症细菌感染造成的WBC下降也较为常见[13]。本研究中有2例免疫抑制患者,确诊为严重细菌感染,但是WBC明显降低。所以WBC并不能准确反映ECMO患者的细菌感染,AUC只有0.415。由于接受ECMO治疗的患者病情极为危重,多数患者合并有急性肾损伤而需要行CRRT治疗[14],本研究中需要接受CRRT治疗的患者占到了总病例数的88.2%。而既往研究证实CRRT可以显著降低血液中炎症指标,同时血浆PCT也会有所下降[15],可能会影响各指标对细菌感染的诊断价值。但是如果去除未接受CRRT治疗的2例患者,再次统计显示血浆PCT的AUC仍然可以达到0.808,反映在ECMO和CRRT联合治疗过程中,血浆PCT对细菌感染仍然有较好的诊断价值。
| [1] | Wang GN, Chen XF, Qiao L, et al. Comparison of extracorporeal and conventional cardiopulmonary resuscitation: A meta-analysis of 2260 patients with cardiac arrest[J]. World J Emerg Med, 2017, 8(1): 5-11. DOI:10.5847/wjem.j.1920-8642.2017.01.001 |
| [2] | Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults[J]. N Engl J Med, 2011, 365(20): 1905-1914. DOI:10.1056/NEJMct1103720 |
| [3] | Shi JL, Chen QY, Yu WK, et al. Continuous renal replacement therapy reduces the systemic and pulmonary inflammation induced by venovenous extracorporeal membrane oxygenation in a porcine model[J]. Artif Organs, 2014, 38(3): 215-223. DOI:10.1111/aor.12154 |
| [4] | Anand D, Das S, Bhargava S, et al. Procalcitonin as a rapid diagnostic biomarker to differentiate between culture-negative bacterial sepsis and systemic inflammatory response syndrome: a prospective, observational, cohort study[J]. J Crit Care, 2015, 30(1): 218. DOI:10.1016/j.jcrc.2014.08.017 |
| [5] | Bull T, Corley A, Smyth DJ, et al. Extracorporeal membrane oxygenation line-associated complications: in vitro testing of cyanoacrylate tissue adhesive and securement devices to prevent infection and dislodgement[J]. Intensive Care Med Exp, 2018, 12, 6(1): 6. DOI:10.1186/s40635-018-0171-8 |
| [6] | Tan VE, Moore WS, Chopra A, et al. Association of procalcitonin values and bacterial infections in pediatric patients receiving extracorporeal membrane oxygenation[J]. Perfusion, 2018, 33(4): 278-282. DOI:10.1177/0267659117743806 |
| [7] | Bizzarro MJ, Conrad SA, Kaufman DA, et al. Infections acquired during extracorporeal membrane oxygenation in neonates, children, and adults[J]. Pediatr Crit Care Med, 2011, 12(3): 277-281. DOI:10.1097/PCC.0b013e3181e28894 |
| [8] | Ma L, Zhang H, Yin YL, et al. Role of interleukin-6 to differentiate sepsis from non-infectious systemic inflammatory response syndrome[J]. Cytokine, 2016, 88: 126-135. DOI:10.1016/j.cyto.2016.08.033 |
| [9] | McILwain RB, Timpa JG, Kurundkar AR, et al. Plasma concentrations of inflammatory cytokines rise rapidly during ECMO-related SIRS due to the release of preformed stores in the intestine[J]. Lab Invest, 2010, 90(1): 128-139. DOI:10.1038/labinvest.2009.119 |
| [10] | 陈淼, 林晓军, 张红璇, 等. 降钙素原和C反应蛋白在肺炎合并脓毒血症中的意义[J]. 中华急诊医学杂志, 2017, 26(7): 807-810. DOI:10.3760/cma.j.issn.1671-0282.2017.07.017 |
| [11] | Pieri M, Greco T, De Bonis M, et al. Diagnosis of infection in patients undergoing extracorporeal membrane oxygenation: a case-control study[J]. J Thorac Cardiovasc Surg, 2012, 143(6): 1411-1416. DOI:10.1016/j.jtcvs.2012.01.005 |
| [12] | Datzmann T, Träger K. What about prognostic outcome parameters in patients with acute respiratory distress syndrome (ARDS) treated with veno-venous extracorporeal membrane oxygenation (VV-ECMO)?[J]. J Thorac Dis, 2018, 10(Suppl 17): S2057-S2061. DOI:10.21037/jtd.2018.05.172 |
| [13] | Behnes M, Bertsch T, Lepiorz D, et al. Diagnostic and prognostic utility of soluble CD 14 subtype (presepsin) for severe sepsis and septic shock during the first week of intensive care treatment[J]. Crit Care, 2014, 18(5): 507. DOI:10.1186/s13054-014-0507-z |
| [14] | Chen H, Yu RG, Yin NN, et al. Combination of extracorporeal membrane oxygenation and continuous renal replacement therapy in critically ill patients: a systematic review[J]. Crit Care, 2014, 18(6): 675. DOI:10.1186/s13054-014-0675-x |
| [15] | Liu C, Li M, Cao S, et al. Effects of HV-CRRT on PCT, TNF-α, IL-4, IL-6, IL-8 and IL-10 in patients with pancreatitis complicated by acute renal failure[J]. Exp Ther Med, 2017, 14(4): 3093-3097. DOI:10.3892/etm.2017.4843 |
 2019, Vol. 28
2019, Vol. 28




