2 南京医科大学公共卫生学院卫生毒理系,现代毒理学教育部重点实验室, 211166
2 Key Lab of Modern Toxicology (NJMU), Ministry of Education. Department of Toxicology, School of Public Health, Nanjing Medical University, Nanjing, 211166, China
甲基苯丙胺(methamphetamine,METH),俗称冰毒。长期使用能够导致多脏器功能衰竭,短期大剂量使用可导致吸食者猝死[1-2]。神经系统是METH作用的经典靶组织,METH吸食后,通常表现出兴奋、偏执和暴力倾向等多种明显的行为异常[3]。目前,众多研究集中于甲基苯丙胺的神经毒性,包括神经细胞凋亡、小胶质细胞和星形胶质细胞活化及血脑屏障的破坏等[4-6]。研究显示METH能够诱导神经元细胞发生凋亡[7]。此外,METH亦能够诱导神经系统发生自噬[1-8]。
METH的心脏毒性作用包括心率加快和血压升高,可能导致心血管功能衰竭,甚至猝死。Leung等[4]报道,甲基苯丙胺暴露能够明显促进心肌细胞发生凋亡。研究显示,自噬过程与多种细胞损伤有关。作为一种常见的生理、病理机制,自噬能降解损伤的细胞器及蛋白,在应激条件下提供能量,尤其在饥饿(氨基酸和营养剥夺)、缺氧和代谢压力下,自噬将被激活。自噬过程是由一组进化上高度保守的自噬相关性蛋白(ATGs)调节,该过程中自噬体及相关蛋白表达量会发生明显变化[9]。因此推测METH在引起心肌细胞发生损伤的过程中,自噬程序也同时被激活。
在本研究借助小鼠心肌组织及心肌细胞系METH的染毒模型,观察和阐述METH对心脏自噬程序的诱导作用,以期为探讨METH暴露引起的心脏毒性的机制提供依据。
1 材料与方法 1.1 材料与试剂健康雄性SPF级6周龄C57小鼠60只,体质量(18±2)g(南京医科大学动物实验基地提供)。心肌细胞系H9C2(上海中乔新舟生物科技有限公司)。DMEM/ F-12培养基(Gibco, 美国),RIPA蛋白裂解液,cocktail蛋白酶抑制剂,BCA蛋白定量试剂盒(Thermo Scientific, 美国)。METH(中国食品药品检定研究所)。WB抗体:p62,Beclin-1, LC3B,GAPDH,β-actin(Cell Signaling Technology,美国)。山羊抗小鼠二抗,山羊抗兔二抗,LC3红色荧光二抗(Alexa Fluor® 488)(上海翊圣生物科技有限公司)。三硝基苯-多聚甲醛-戊二醛联合固定剂(PAPG液),METH溶液均由20 mg METH粉剂溶解于1 077 μL双蒸水配置而成。
1.2 体内实验健康雄性C57Bl/6J小鼠,SPF级,5~6周龄,体质量(18±2)g,由南京医科大学动物实验中心提供(动物实验伦理证号:20110521)。所有小鼠都饲养于光/暗周期为12 h/12 h,环境温度(22±2)℃,相对湿度40%~70%的条件下,自由获得饲料和饮水。适应性饲养1周后,利用随机数字表将60只小鼠随机(随机数字法)分为3组(每组20只)。为了探究甲基苯丙胺短期过量摄入致死的可能原因,根据已有的研究设置:3 d组模拟人类急性染毒模型(小鼠给予腹腔注射单次剂量15 mg/kg的METH溶液,2次/d,连续3 d);7 d组模拟人类亚急性染毒模型(腹腔注射单次剂量相同的METH溶液,2次/d,连续7 d),已知生理盐水对于自噬的激活并无影响,为了与造模组小鼠造成的多次刺激保持操作一致。参考文献[18]中的对照处理方法,选择单一对照组连续7 d在相同时间点给予腹腔注射0.9%生理盐水。各组分别在最后一次注射后的24 h,解剖小鼠,获取心脏组织,-80℃冰箱保存备后续实验使用。
1.3 体外实验心肌细胞系(H9C2),购自上海中乔新舟生物科技有限公司。细胞在37℃、5% CO2条件下,采用含15%胎牛血清的DMEM/F12培养基(美国Gibco公司)培养3 d收获,第1天细胞培养至铺满80%到90%按1:3比例传代;第2天细胞约铺满皿底60%加入METH干预;加药后24 h,第3天收获细胞提取总蛋白。
1.4 Western Blot检测相关蛋白表达体内实验:RIPA裂解小鼠心脏组织,超声匀浆,离心取上清液,用BCA法测定蛋白浓度,5×上样缓冲液定容稀释,100℃煮5 min,后-20℃冰箱保存样本,动物组织蛋白上样量为50 μg蛋白。体外实验:RIPA裂解,离心取上清液,用BCA法测定蛋白浓度,5×上样缓冲液定容稀释,100℃煮5 min,后-20℃冰箱保存样本,细胞蛋白上样量为20 μg蛋白。体内外实验均采用SDS聚丙烯酰胺凝胶电泳法分离不同相对分子质量蛋白,后用湿转法将蛋白转至PVDF膜。5%脱脂牛奶室温封闭2 h,用脱脂牛奶按1:1 000稀释一抗在4℃冰箱封闭摇晃过夜。TBST溶液洗膜,后孵育二抗稀释液,室温下封闭2 h。TBST洗膜后运用化学发光(ECL)仪器(Bio-rad, 美国)进行胶片曝光显影,利用Image J定量统计对应条带的强度。
1.5 免疫荧光检测LC3表达将心肌细胞种植于培养皿中,细胞贴壁后,根据不同分组处理细胞;予-20℃甲醇室温固定;免疫染色封闭液室温封闭1 h;加入稀释一抗(兔抗LC3B多克隆抗体1:200稀释),4℃孵育过夜;加入稀释二抗(山羊抗兔IgG1:1 000稀释),室温避光孵育1 h;弃二抗;DAPI室温避光孵育3 min,抗荧光淬灭封片剂封片;激光共聚焦显微镜(Zeiss LSM710)下拍片。
1.6 透射电子显微镜前准备细胞培养至80%时,用胰蛋白酶溶液将贴壁细胞处理后,1 000 r/min离心5 min后,弃去上清液,再次加入PBS溶液重悬细胞。此步骤重复两遍。最后一次离心后,使细胞在离心管底部形成松散的团块,沿离心管管壁缓慢加入固定液,保存完善后送入电镜室(JEOL-1010)观察。
1.7 统计学方法所有数据均以均数±标准差(Mean±SD)表示。利用SPSS19.0进行统计分析,多组定量资料比较采用one-way ANOVA(单因素方差分析)检验,两组之间数据比较采用LSD-t检验,所有柱状统计图均采用Prism 5.01版绘制。以P < 0.05为差异具有统计学意义。所有实验均通过3次重复的独立实验验证。
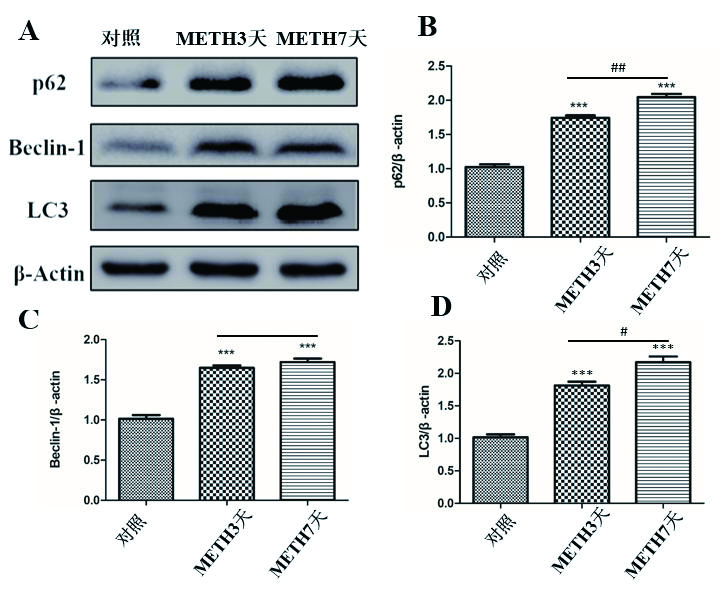
2 结果 2.1 甲基苯丙胺能增加小鼠心脏组织自噬相关蛋白的表达利用Western blot法检测小鼠心肌组织中自噬相关蛋白表达量变化。图 1A为动物实验结果,与对照组相比,METH处理组无论3 d组或7 d组均发现心肌细胞的自噬相关蛋白p62,Beclin-1和LC3的表达明显增高,说明METH增加了心肌细胞的自噬活性。与METH3 d组比较,METH7 d组中p62和LC3蛋白表达水平明显增高,而Beclin-1蛋白表达量差异无统计学意义。图 1B-D为1A的统计结果,差异具有统计学意义(n=20,P < 0.05)。
|
|
A-D:Western blot检测p62,Beclin-1,LC3,β-Actin的表达变化及统计图; 与对照组比较,aP < 0.05;METH7 d组与METH3 d组比较,bP < 0.05,cP < 0.01 图 1 Western blot检测METH暴露后小鼠心肌组织中自噬相关蛋白表达变化 Fig 1 Western blot was used to detect the expression of autophagy-related protein in myocardium of mice exposed to METH |
|
|
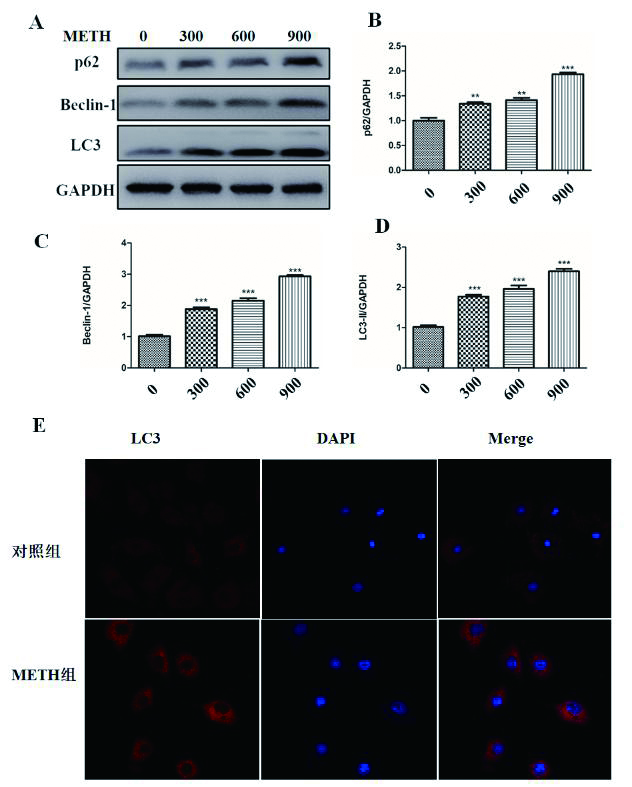
基于动物实验结果,进一步观察METH暴露对H9C2心脏细胞系自噬可能存在的影响。用Western blot和免疫荧光法对自噬相关蛋白表达量变化进行检测发现,H9C2细胞与300 mmol/mL、600 mmol/mL和900 mmol/mL的METH干预24 h后,细胞中自噬相关蛋白p62,Beclin-1和LC3的表达同样明显增高(图 2A-D),且各蛋白表达量与METH剂量有相关性(图 2B-D),差异具有统计学意义(n=3,P < 0.05)。图 2E示,900mmol/mL剂量METH干预H9C2细胞系后,与对照组相比,红色荧光显著增强,LC3蛋白表达明显增多。
|
| A-D:Western blot检测p62,Beclin-1,LC3,β-Actin的表达变化及统计图;E:免疫荧光法检测LC3蛋白表达变化;与对照组比较,aP < 0.05 图 2 透射电子显微镜观察冰毒干预后,H9C2细胞中自噬体数目的变化 Fig 2 The number of autophagosome in H9C2 cells was observed by transmission electron microscopy (TEM) |
|
|
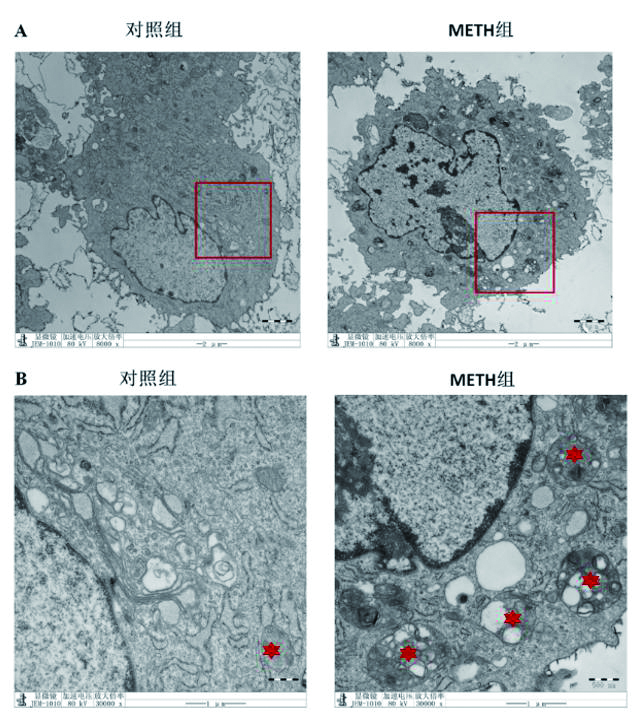
为了进一步观察METH对H9C2细胞系自噬程序的影响,通过电子显微镜下直接观察细胞形态学改变。如图 3所示,与对照组相比,900 mmol/mL浓度的METH干预后,H9C2细胞皱缩明显,细胞核内染色质浓缩,自噬体数量明显增加。
|
| A:8 000倍镜下细胞形态。B:将A图中红色矩形标记区域放大至30 000倍镜的细胞形态,典型自噬体采用星形标记。 图 3 透射电子显微镜观察冰毒干预后,H9C2细胞中自噬体数目的变化 Fig 3 The number of autophagosome in H9C2 cells was observed by transmission electron microscopy (TEM) |
|
|
甲基苯丙胺中毒最常见的是神经精神异常的表现,但有研究显示,对100例METH中毒后死亡患者进行法医学鉴定,其中有68%的患者直接死因为METH所导致的心脏毒性,病理检验表现为心肌纤维肥大、轻微、中度到重度动脉粥样硬化和点状变性或坏死[19]。已有研究表明,过度激活机体的自噬程序,是METH发挥毒理作用的重要方式[11]。自噬作用是机体高度保守的降解过程,可分为:巨自噬、微自噬和分子伴侣介导的自噬三种不同类型。其中目前对巨自噬的研究最为深入,而巨自噬的发生是由一组进化上高度保守的自噬相关性蛋白(ATGs)调节,通过形成胞质内双层膜囊泡的方式,将胞质内的物质转移到溶酶体中降解,是决定细胞生存或者死亡的重要调控者[13]。
目前已有研究显示,在神经系统中METH可以通过激活κ阿片受体上调Beclin-1和LC3两个重要的自噬标志蛋白[14, 17]。在自噬分子机制通路中Beclin-1位于LC3的上游,Beclin-1可与一些蛋白结合以复合物的形式存在,当自噬程序被激活,Beclin-1从复合物形态解聚转化为游离形态,调控自噬下游启动过程。LC3包括LC3-I和LC3-Ⅱ,前者是可溶性的,后者结合于自噬结构膜上。LC3-Ⅱ的表达与自噬结构的形成呈现正相关性。研究者常用LC3-Ⅱ蛋白作为自噬体的标志物,观察细胞的自噬活动[7, 15]。为了探究甲基苯丙胺短期过量摄入致死的原因,本研究建立模拟人类甲基苯丙胺急性中毒和亚急性中毒的动物模型。通过Western blot法检测了心肌组织和心肌细胞中Beclin-1和LC3-Ⅱ蛋白的表达,继而判断METH干预后细胞中自噬活动变化,发现与对照组相比,METH组中Beclin-1和LC3Ⅱ蛋白的表达明显增多,且亚急性动物模型的自噬蛋白LC3和p62表达水平均较急性中毒模型有明显提高,提示随着METH暴露时间的延长可能导致心肌细胞自噬流受阻,LC3蛋白在心肌细胞中逐渐累积;为进一步验证上述结果,将细胞中的LC3蛋白用红色荧光标记,通过比较对照组和METH组细胞中红色荧光强度的变化来判断LC3表达变化。结果显示,与对照组相比,METH组中被红色荧光标记的LC3表达明显增多,提示METH可激活心肌细胞中的自噬过程。另有研究表明,METH可以诱导泛素化蛋白质形成不溶性聚合物[14],而且这种不溶性聚合物的累积伴随p62蛋白质的增加。p62是一种选择性自噬受体蛋白,可降解泛素化底物,在自噬通路分子机制和自噬底物之间起调节作用,同时反映自噬通路的通畅性[15]。本文在动物实验和细胞实验中,从蛋白水平发现METH同样可以诱导心肌细胞中的p62蛋白表达增多。随着对自噬研究的深入,有研究发现自噬是对机体有保护作用的生物程序;但也有研究显示自噬能通过激活凋亡程序导致机体损伤[16-17]。本研究射电镜在8千倍和3万倍视野下观察细胞形态变化,发现甲基苯丙胺能够明显增加心肌细胞中的自噬体数量,且METH组细胞中出现细胞皱缩明显,细胞核内染色质浓缩的现象。
| [1] | Valsalan R, Varghese B, Soman D, et al. Multi-organ dysfunction due to bath salts: are we aware of this entity?[J]. Intern Med J, 2017, 47(1): 109-111. DOI:10.1111/imj.13307 |
| [2] | Mishra P, Ammanathan V, Manjithaya R. Chemical biology strategies to study autophagy[J]. Front Cell Dev Biol, 2018, 6: 160. DOI:10.3389/fcell.2018.00160 |
| [3] | Mori T, Sawaguchi T. Underlying mechanisms of methamphetamine-induced self-injurious behavior and lethal effects in mice[J]. Nippon Eiseigaku Zasshi (Japanese Journal of Hygiene), 2018, 73(1): 51-56. DOI:10.1265/jjh.73.51 |
| [4] | Leung LL, Lam SK, Li YY, et al. Tumour growth-suppressive effect of arsenic trioxide in squamous cell lung carcinoma[J]. Oncol Lett, 2017, 14(3): 3748-3754. DOI:10.3892/ol.2017.6646 |
| [5] | Li J, Wang WG, Tong PF, et al. Autophagy induction by HIV-tat and methamphetamine in primary midbrain neuronal cells of tree shrews via the mTOR signaling and ATG5/ATG7 pathway[J]. Front Neurosci, 2018, 12: 921. DOI:10.3389/fnins.2018.00921 |
| [6] | Darke S, Duflou J, Lappin J, et al. Clinical and autopsy characteristics of fatal methamphetamine toxicity in australia[J]. J Forensic Sci, 2018, 63(5): 1466-1471. DOI:10.1111/1556-4029.13710 |
| [7] | Zhao H, Yang MP, Zhao B. Beclin 1 and LC3 as predictive biomarkers for metastatic colorectal carcinoma[J]. Oncotarget, 2017, 8(35): 59058-59067. DOI:10.18632/oncotarget.19939 |
| [8] | Martini-Stoica H, Xu Y, Ballabio A, et al. The Autophagy–Lysosomal pathway in neurodegeneration: a TFEB perspective[J]. Trends in Neurosciences, 2016, 39(4): 221-234. DOI:10.1016/j.tins.2016.02.002 |
| [9] | Shibutani ST, Saitoh T, Nowag H, et al. Autophagy and autophagy-related proteins in the immune system[J]. Nat Immunol, 2015, 16(10): 1014-1024. DOI:10.1038/ni.3273 |
| [10] | Zhao H, Yang MP, Zhao B. Beclin 1 and LC3 as predictive biomarkers for metastatic colorectal carcinoma[J]. Oncotarget, 2017, 8(35): 59058-59067. DOI:10.18632/oncotarget.19939 |
| [11] | Kirkpatrick MG, Gunderson EW, Levin FR, et al. Acute and residual interactive effects of repeated administrations of oral methamphetamine and alcohol in humans[J]. Psychopharmacology, 2012, 219(1): 191-204. DOI:10.1007/s00213-011-2390-5 |
| [12] | Giordano S, Darley-Usmar V, Zhang JH. Autophagy as an essential cellular antioxidant pathway in neurodegenerative disease[J]. Redox Biology, 2014, 2: 82-90. DOI:10.1016/j.redox.2013.12.013 |
| [13] | Yu SB, Zhu L, Shen Q, et al. Recent advances in methamphetamine neurotoxicity mechanisms and its molecular pathophysiology[J]. Behav Neurol, 2015, 2015: 1-11. DOI:10.1155/2015/103969 |
| [14] | 蒋雷, 钱文溢, 张劲松, 等. 甲基苯丙胺急性暴露对小鼠神经元的损伤作用研究[J]. 中华急诊医学杂志, 2016, 25(11): 1393-1399. DOI:10.3760/cma.j.issn.1671-0282.2016.11.008 |
| [15] | Vandenbark AA, Meza-Romero R, Benedek G, et al. A novel neurotherapeutic for multiple sclerosis, ischemic injury, methamphetamine addiction, and traumatic brain injury[J]. J Neuroinflammation, 2019, 16: 14. DOI:10.1186/s12974-018-1393-0 |
| [16] | Park HYL, Kim JH, Park CK. Activation of autophagy induces retinal ganglion cell death in a chronic hypertensive glaucoma model[J]. Cell Death Dis, 2012, 3(4): e290. DOI:10.1038/cddis.2012.26 |
| [17] | Chen R, Wang B, Chen L, et al. DNA damage-inducible transcript 4 (DDIT4) mediates methamphetamine-induced autophagy and apoptosis through mTOR signaling pathway in cardiomyocytes[J]. Toxic Appl Pharm, 2016, 295: 1-11. DOI:10.1016/j.taap.2016.01.017 |
| [18] | Kobeissy FH, Mitzelfelt JD, Fishman I, et al. Methods in drug abuse models: comparison of different models of methamphetamine paradigms[J]. Methods Mol Biol, 2012, 829: 269-278. DOI:10.1007/978-1-61779-458-2_17 |
| [19] | Akhgari M, Mobaraki H, Etemadi-Aleagha A. Histopathological study of cardiac lesions in methamphetamine poisoning-related deaths[J]. DARU J Pharm Sci, 2017, 25: 5. DOI:10.1186/s40199-017-0170-4 |
 2019, Vol. 28
2019, Vol. 28




