出血导致的死亡人数约占创伤患者早期死亡人数的三分之一,是可以预防的主要死因[1, 2]。至少有四分之一的严重创伤患者出现凝血功能异常,称为创伤性凝血病(trauma-induced coagulopathy,TIC)[3-4]。TIC患者多器官功能衰竭的发生率、输血量、机械通气时间和住院时间均显著高于无TIC创伤患者[5-7]。针对TIC的治疗策略可以显著改善患者预后,但需早期识别TIC以便快速启动输血治疗[8, 9]。预测TIC靠临床表现和常规凝血功能检查(conventional coagulation tests,CCTs),但后者存在一定局限性,如检测时间较长、只能反映血浆中凝血因子活性或凝血体系中的某个片段[10-11]。目前TIC的治疗主要依赖于经验性输注血制品或血液替代品[12-13]。缺乏快速诊断导致TIC的治疗延迟,且输血不足造成预后较差,过度输血浪费宝贵资源、增加传染病可能,因此迫切需要一种快速准确诊断TIC的检测方法[14]。血栓弹力图(thrombelastography,TEG)是一种评估凝血过程所有阶段的检测方法,可以测量血液的黏弹性改变, 通过分析图形参数快速知晓凝血功能异常的问题所在,并为指导TIC的治疗提供依据[15-16]。本研究的主要目的是探究TEG对TIC的诊断价值,确定快速有价值的参数来识别TIC患者;其次,评估TEG各参数对TIC患者输血治疗的指导意义。
1 资料与方法 1.1 一般资料回顾性收集2018年2月1日至12月31日在本院急诊科重症监护室(emergency intensive care unit,EICU)伤后24 h内接受CCTs和TEG检查的所有创伤患者。排除标准:年龄在18岁以下或70岁以上;在到达急诊前已接受超过2000 mL静脉输液;入院24 h内死亡;孕妇;烧伤;颅脑创伤;有严重肝病或已知的凝血功能异常疾病;正在服用抗凝药物。详细记录患者的基本资料,包括性别,年龄,收缩压,受伤机制,创伤严重程度评分(injury severity score,ISS),住院时间和机械通气时间等。
1.2 常规凝血功能检查CCTs包括凝血酶原时间(prothrombin time,PT)、国际标准化比率(international normalized ratio,INR)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原浓度(fibrinogen,FIB)和血小板数量(platelet count,PLT)。将PT>18 s、INR>1.5、APTT>60 s或PLT<100×109/L作为TIC的诊断标准,基于伤后24 h内CCTs的检测结果,将所有创伤患者分为TIC组和非TIC组[17-19]。
1.3 血栓弹力图采用TEG5000血栓弹力图分析仪(Haemonetics Corp, Braintree, MA),参数包括:凝块反应时间(reaction time,R),代表最初的纤维蛋白聚合物的产生时间;凝块形成时间(clotting time,K),代表血凝块达到一定强度所需时间;凝固角(α),反映纤维蛋白交联反应的速率;血栓最大振幅(maximum amplitude,MA),反映血凝块能够达到的最大强度;凝血指数(coagulation index,CI)是反映凝血功能的综合指数,是由R、K、α和MA共同计算而成。
1.4 输血治疗记录所有创伤患者的输血量(特指输注的悬浮红细胞数量),包括入院24 h内输血量和住院期间总输血量,大量输血定义为24 h内输注的悬浮红细胞≥10 U。
1.5 统计学方法采用SPSS 22.0版本进行统计和分析。中位数(四分位数间距)表示连续变量,频率(百分比)表示分类变量,Mann-Whitney U检验进行组间比较。P<0.05为差异具有统计学意义。计算TEG参数的受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under the curve,AUC)探究TEG是否可用于诊断TIC,并计算各TEG参数的最佳临界值及灵敏度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)。采用多元回归模型评估TEG对TIC患者输血治疗的预测作用。在控制年龄、性别、受伤机制和ISS评分等因素后,通过逻辑回归分析TEG与大量输血的关系,通过线性回归分析TEG与输血量(入院24 h内输血量和住院期间总输血量)的关系。
2 结果共纳入242例创伤患者,男性占71.9%(n=174),年龄(47.31±13.40)岁。根据TIC诊断标准将所有患者分为两组:TIC组(n=62)和非TIC组(n=180)。
2.1 创伤患者基本资料242例创伤患者的基本资料见表 1。
| 观察指标 | 创伤患者(n=242) |
| 基本资料 | |
| 年龄(岁) | 47±13.40 |
| 男性(例,%) | 174 (71.9) |
| 收缩压(mmHg) | 122 (112, 130) |
| ISS评分 | 17 (13, 24) |
| ISS>15(例,%) | 146 (60.3%) |
| 受伤机制(例,%) | |
| 车祸伤 | 60 (24.8) |
| 坠落伤 | 26 (10.7) |
| 输血治疗 | |
| 大量输血(例,%) | 8 (3.3) |
| 入院24 h内输血量(U) | 0 (0, 1) |
| 住院期间总输血量, U | 2 (0, 5) |
| 住院时间(d) | 12 (9, 16) |
| 机械通气时间(d) | 0 (0, 1) |
| 注:ISS,创伤严重程度评分 | |
两组间TEG各参数比较,P < 0.05,差异均有统计学意义见表 2。
| TEG参数 | TIC组(n=62) | 非TIC组(n=180) | P值 |
| R | 5.4 (4.8, 6.2) | 5.1 (4.5, 5.8) | 0.002 |
| K | 2.8 (2.1, 4.0) | 1.8 (1.4, 2.3) | < 0.01 |
| α | 55.7 (48.4, 62.8) | 65.9 (59.9, 70.0) | < 0.01 |
| MA | 51.6 (43.6, 56.5) | 59.9 (55.3, 64.2) | < 0.01 |
| CI | -1.9 (-4.0, -0.4) | 0.6 (-0.9, 1.6) | < 0.01 |
| 注:TIC,创伤性凝血病;TEG,血栓弹力图 | |||
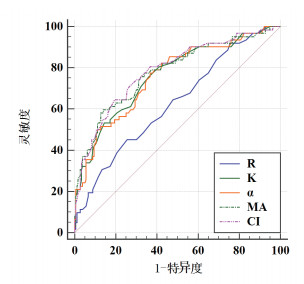
TEG的ROC曲线结果见图 1。CI评估TIC的AUC最大(AUC=0.786),MA结果与之相近(AUC=0.779),R面积最小(AUC=0.629)。
|
| TEG,血栓弹力图;TIC,创伤性凝血病;ROC曲线,受试者工作特征曲线;AUC,曲线下面积。AUC:R=0.629,P=0.002;K=0.763,P<0.01;α=0.758,P<0.01;MA=0.779,P<0.01;CI=0.786,P<0.01 图 1 TEG各参数诊断TIC的ROC曲线 Fig 1 ROC curve of TEG parameters and TIC |
|
|
TEG各参数的最佳临界值及相关指标见表 3。最佳临界值是R=5.8min,K=2.1 min,α=63.0 deg,MA=52.9 mm,CI=-1.0;灵敏度最高的两个参数是MA和CI,均大于80%,特异度约60%;所有TEG参数都为NPV显著高于PPV,其中MA和CI的NPV最高,均大于90%,PPV约40%;R的灵敏度、PPV和NPV最小。
| TEG参数 | 最佳临界值 | 灵敏度(%) | 特异度(%) | PPV(%) | NPV(%) |
| R | 5.8 | 45.2 | 74.4 | 37.8 | 79.8 |
| K | 2.1 | 75.8 | 63.9 | 42.0 | 88.5 |
| α | 63.0 | 63.3 | 77.4 | 49.1 | 86.0 |
| MA | 52.9 | 86.1 | 59.7 | 42.4 | 92.6 |
| CI | -1.0 | 80.6 | 64.5 | 43.9 | 90.6 |
| 注:TEG,血栓弹力图;TIC,创伤性凝血病;PPV,阳性预测值;NPV,阴性预测值 | |||||
TEG评估TIC患者大量输血的回归分析见表 4。在控制混杂因素后,所有TEG参数均是TIC患者入院24 h内大量输血的预测因子,其中R的比值比(odds ratio,OR)最大(OR=2.435,95%CI:1.133~5.233,P=0.023)。
| TEG参数 | OR | 95%CI | P值 |
| 入院24h内是否大量输血 | |||
| R | 2.435 | 1.133~5.233 | 0.023 |
| K | 1.493 | 1.084~2.056 | 0.014 |
| α | 0.912 | 0.840~0.989 | 0.026 |
| MA | 0.873 | 0.779~0.979 | 0.020 |
| CI | 0.686 | 0.520~0.905 | 0.008 |
| 注:TEG,血栓弹力图;TIC,创伤性凝血病;OR,比值比;95%CI,95%置信区间 | |||
TEG评估TIC患者输血量的回归分析见表 5。在控制相同的混杂因素后,所有TEG参数均是TIC患者入院24 h内输血量的预测因子,其中R的回归系数(regression coefficient,B)最大(B=1.104,95%CI:0.337~1.870,P=0.006)。除了R(P=0.438)以外,其他TEG参数均是TIC患者住院期间总输血量的预测因子,其中K的B最大。
| TEG参数 | B | 95%CI | P值 |
| 入院24 h内输血量 | |||
| R | 1.104 | 0.337, 1.870 | 0.006 |
| K | 0.801 | 0.517, 1.085 | < 0.001 |
| α | -0.126 | -0.209, -0.043 | 0.004 |
| MA | -0.168 | -0.266, -0.071 | 0.001 |
| CI | -0.603 | -0.863, -0.343 | < 0.001 |
| 住院期间总输血量 | |||
| R | 0.505 | -0.791, 1.801 | 0.438 |
| K | 0.943 | 0.438, 1.448 | < 0.001 |
| α | -0.143 | -0.280, -0.007 | 0.040 |
| MA | -0.176 | -0.340, -0.012 | 0.036 |
| CI | -0.611 | -1.068, -0.154 | 0.010 |
| 注:TEG,血栓弹力图;TIC,创伤性凝血病;B,回归系数;95%CI,95%置信区间;R- K- a- MA- CI- | |||
本研究发现,TEG检测可更全面地反映创伤患者的凝血功能状态,进而有针对性地指导TIC患者的输血治疗。其中,MA和CI诊断TIC的AUC最大,且灵敏度和NPV均为最高,表明这两个参数的诊断价值最大;R诊断TIC的AUC较小且灵敏度和预测值均为最低,但是其在大量输血分析中OR值最大且24 h内输血量分析中B最大,说明R诊断价值较低但输血指导意义可能较高。综合来说,TEG是一种比较理想的诊断TIC并指导患者输血治疗的检测方法。
TEG参数代表凝血功能的不同方面,有不同的预测和指导作用:K的计算需要TEG曲线振幅达到20 mm,对于凝血功能障碍严重的患者,其振幅可能达不到此标准而使其结果的准确性受到影响[20-21];α和MA主要受FIB和PLT的影响,对功能性凝血功能障碍的诊断很敏感[22-23];R易受可溶性凝血因子与细胞组分相互作用的影响,而PT和APTT在没有细胞成分的情况下就能被检测到,Agren等[24]和胡贵锋等[25]的试验均表明R对凝血因子异常检测的敏感性低于PT和APTT。但是R对患者的输血治疗,尤其是早期输血治疗可能具有指导意义[21]。
凝血功能障碍是临床的常见问题且对患者预后有影响,对其早期识别和干预十分关键。近年来,TEG越来越多应用于创伤早期凝血功能异常的诊断和输血治疗的指导[21, 26-28]。那TEG与CCTs谁更适合诊断TIC或指导治疗呢?
CCTs一直是TIC定义的基础,虽然可以识别凝血因子水平的降低,但无法评估整个凝血系统状况,对严重凝血功能障碍的治疗价值有限[29]。此外,创伤引发的纤溶异常,包括纤溶亢进和纤溶关闭(即纤溶能力降低)等,不会改变PT或INR的大小,并且TEG比PT/APTT更早发现凝血功能的改变[30]。再者,TEG在检测创伤性颅脑损伤、多发伤等多种创伤状态下的低凝性和高凝性方面均优于CCTs[31-32]。然而在现有证据背景下,关于TEG的观点也存在分歧。比如Kutcher等[33]和Chin等[34]的研究表明,PT/INR捕捉了最重要的会出现不良创伤预后的凝血病类型。另外,TEG并不能反映凝血液相与内皮细胞表面之间发生的相互作用,但这种作用对结果的影响很有限[21]。总之,在诊断TIC方面TEG具有较大优势但目前无法完全替代CCTs,两者结合可能更加有效。
CCTs出检测结果约需1 h以上而TEG仅需半个多小时,前者的延迟性限制了其实用性[24, 35]。研究表明TEG在创伤治疗中的最重要的临床应用是指导输血治疗和降低血液制品的使用率,如Johansson[36]研究发现,使用TEG监测的创伤和血管手术患者血液制品的使用量减少,预后明显改善。在最近一项临床试验中,研究者分别将患者随机分配到由TEG或CCTs指导的大量输血方案中,结果显示TEG组患者病死率较CCTs组明显降低(19% vs 36%);进一步研究发现两组间病死率的差异与TEG组患者早期出血性死亡较少密切相关[12]。本研究中,在TEG与TIC患者住院期间总输血量的回归分析中,所有参数虽然都P < 0.05,但其回归系数绝对值均小于1,表明TEG对住院总输血量有影响但影响较小,即TEG可能主要作用于减少早期输血量[11]。因此,使用TEG指导创伤患者,特别是TIC患者的输血治疗将有利于减少输血量,提高预后。
本研究存在以下局限。首先,本研究是观察性研究,可能有未知的因素影响分析结果。其次,入组病例均为EICU创伤患者,其结论可能不适用于一般创伤人群。第三,目前普遍使用的TEG仪器各项参数的参考范围是按照欧美标准设定的,可能并不适合亚洲人群。但是已有研究表明,种族差异对结果的影响是有限的[37-38]。最后,本研究样本量小,研究结果需要大样本量的前瞻性对照研究进一步证实。
TEG反映创伤患者凝血功能状态,可用于诊断TIC。其中,MA和CI的诊断价值最大,R诊断价值较小但输血指导意义较大。MA<52.9 mm、CI<-1.0可作为TEG诊断TIC的阈值。TEG可用于指导TIC患者的早期输血治疗,减少输血量,改善预后,优化管理。
| [1] | Mitra B, Cameron PA, Mori A, et al. Acute coagulopathy and early deaths post major trauma[J]. Injury, 2012, 43(1): 22-25. DOI:10.1016/j.injury.2010.10.015 |
| [2] | Gruen RL, Jurkovich GJ, McIntyre LK, et al. Patterns of errors contributing to trauma mortality[J]. Ann Surg, 2006, 124: 37-46. DOI:10.1097/01.sla.0000234655.83517.56 |
| [3] | Cardenas JC, Rahbar E, Pommerening MJ, et al. Measuring thrombin generation as a tool for predicting hemostatic potential and transfusion requirements following trauma[J]. J Trauma Acute Care Surg, 2014, 77(6): 839-845. DOI:10.1097/ta.0000000000000348 |
| [4] | Maegele M, Lefering R, Yucel N, et al. Early coagulopathy in multiple injury:An analysis from the German Trauma Registry on 8724 patients[J]. Injury, 2007, 38(3): 298-304. DOI:10.1016/j.injury.2006.10.003. |
| [5] | 王勇强, 姚芳超, 王兵. 多器官功能障碍综合征[J]. 中华急诊医学杂志, 2015, 24(8): 813-815. DOI:10.3760/cma.j.issn.1671-0282.2015.08.001 |
| [6] | Maegele M, Spinella PC, Schöchl H. The acute coagulopathy of trauma[J]. Shock, 2012, 38(5): 450-458. DOI:10.1097/shk.0b013e31826dbd23 |
| [7] | Stanworth SJ, Davenport R, Curry N, et al. Mortality from trauma haemorrhage and opportunities for improvement in transfusion practice[J]. Br J Surg, 2016, 103(4): 357-365. DOI:10.1002/bjs.10052 |
| [8] | Gunter OL, Jr., Au BK, Isbell JM, et al. Optimizing outcomes in damage control resuscitation:identifying blood product ratios associated with improved survival[J]. J Trauma, 2008, 65(3): 527-534. DOI:10.1097/ta.0b013e3181826ddf |
| [9] | Holcomb JB, Wade CE, Michalek JE, et al. Increased plasma and platelet to red blood cell ratios improves outcome in 466 massively transfused civilian trauma patients[J]. Ann Surg, 2008, 126: 97-108. DOI:10.1097/sla.0b013e318185a9ad |
| [10] | Chowdhury P, Saayman AG, Paulus U, et al. Efficacy of standard dose and 30 ml/kg fresh frozen plasma in correcting laboratory parameters of haemostasis in critically ill patients[J]. Br J Haematol, 2004, 125(1): 69-73. DOI:10.1111/j.1365-2141.2004.04868.x |
| [11] | Holcomb JB, Minei KM, Scerbo ML, et al. Admission rapid thrombelastography can replace conventional coagulation tests in the emergency department:experience with 1974 consecutive trauma patients[J]. Ann Surg, 2012, 256(3): 476-486. DOI:10.1097/sla.0b013e3182658180 |
| [12] | Gonzalez E, Moore EE, Moore HB, et al. Goal-directed hemostatic resuscitation of trauma-induced coagulopathy:a pragmatic randomized clinical trial comparing a viscoelastic assay to conventional coagulation assays[J]. Ann Surg, 2016, 263(6): 1051-1059. DOI:10.1097/SLA.0000000000001608 |
| [13] | Geeraedts LMG Jr, Demiral H, Schaap NP, et al. 'Blind' transfusion of blood products in exsanguinating trauma patients[J]. Resuscitation, 2007, 73(3): 382-388. DOI:10.1016/j.resuscitation.2006.10.005 |
| [14] | Gonzalez EA, Moore FA, Holcomb JB, et al. Fresh frozen plasma should be given earlier to patients requiring massive transfusion[J]. J Trauma, 2007, 62(1): 112-119. DOI:10.1097/01.ta.0000250497.08101.8b |
| [15] | Pezold M, Moore EE, Wohlauer M, et al. Viscoelastic clot strength predicts coagulation-related mortality within 15 minutes[J]. Surgery, 2012, 151(1): 48-54. DOI:10.1016/j.surg.2011.06.023 |
| [16] | Plotkin AJ, Wade CE, Jenkins DH, et al. A reduction in clot formation rate and strength assessed by thrombelastography is indicative of transfusion requirements in patients with penetrating injuries[J]. J Trauma, 2008, 64(2 Suppl): S64-S68. DOI:10.1097/ta.0b013e318160772d |
| [17] | Meledeo MA, Herzig MC, Bynum JA, et al. Acute traumatic coagulopathy[J]. J Trauma Acute Care Surg, 2017, 82(6S Suppl 1): S33-S40. DOI:10.1097/ta.0000000000001431 |
| [18] | 刘月高. 急性创伤性凝血病的最新研究进展[J]. 中国急救医学, 2016, 36(2): 186-190. DOI:10.3969/j.issn.1002-1949.2016.02.019. |
| [19] | Brohi K, Cohen MJ, Davenport RA. Acute coagulopathy of trauma:mechanism, identification and effect[J]. Curr Opin Crit Care, 2007, 13(6): 680-685. DOI:10.1097/mcc.0b013e3282f1e78f |
| [20] | 孙存杰, 赵晖. 血栓弹力图的临床应用进展[J]. 中华急诊医学杂志, 2016, 25(2): 245-250. DOI:10.3760/cma.j.issn.1671-0282.2016.02.024 |
| [21] | Gonzalez E, Moore EE, Moore HB. Management of Trauma-Induced Coagulopathy with Thrombelastography[J]. Crit Care Clin, 2017, 33(1): 119-134. DOI:10.1016/j.ccc.2016.09.002 |
| [22] | Harr JN, Moore EE, Ghasabyan A, et al. Functional fibrinogen assay indicates that fibrinogen is critical in correcting abnormal clot strength following trauma[J]. Shock, 2013, 39(1): 45-49. DOI:10.1097/shk.0b013e3182787122 |
| [23] | Haase N, Ostrowski SR, Wetterslev J, et al. Thromboelastography in patients with severe sepsis:a prospective cohort study[J]. Intensive Care Med, 2015, 41(1): 77-85. DOI:10.1007/s00134-014-3552-9 |
| [24] | Ågren A, Wikman AT, Holmström M, et al. Thromboelastography (TEG?) compared to conventional coagulation tests in surgical patients-a laboratory evaluation[J]. Scand J Clin Lab Invest, 2013, 73(3): 214-220. DOI:10.3109/00365513.2013.765960 |
| [25] | 胡贵锋, 李俊杰, 尹文. 急重症患者血栓弹力图与传统凝血检查对比研究[J]. 中华急诊医学杂志, 2017, 26(9): 1043-1049. DOI:10.3760/cma.j.issn.1671-0282.2017.09.013 |
| [26] | Lee TH, McCully BH, Underwood SJ, et al. Correlation of conventional thrombelastography and rapid thrombelastography in trauma[J]. Am J Surg, 2013, 205(5): 521-527. DOI:10.1016/j.amjsurg.2013.01.016 |
| [27] | Connelly CR, Van PY, Hart KD, et al. Thrombelastography-based dosing of enoxaparin for thromboprophylaxis in trauma and surgical patients[J]. JAMA Surg, 2016, 151(10): e162069. DOI:10.1001/jamasurg.2016.2069 |
| [28] | Baksaas-Aasen K, van Dieren S, Balvers K, et al. Data-driven development of ROTEM and TEG algorithms for the management of trauma hemorrhage[J]. Ann Sur, 2018: 1. DOI:10.1097/sla.0000000000002825 |
| [29] | Yuan S, Ferrell C, Chandler WL. Comparing the prothrombin time INR versus the APTT to evaluate the coagulopathy of acute trauma[J]. Thromb Res, 2007, 120(1): 29-37. DOI:10.1016/j.thromres.2006.07.002 |
| [30] | Noel P, Cashen S, Patel B. Trauma-induced coagulopathy:from biology to therapy[J]. Semin Hematol, 2013, 50(3): 259-269. DOI:10.1053/j.seminhematol.2013.06.009 |
| [31] | Tauber H, Innerhofer P, Breitkopf R, et al. Prevalence and impact of abnormal ROTEM? assays in severe blunt trauma: Results of the 'Diagnosis and Treatment of Trauma-Induced Coagulopathy (DIA-TRE-TIC) study'[J]. Br J Anaesth, 2011, 107(3): 378-387. DOI:10.1093/bja/aer158 |
| [32] | Woolley T, Midwinter M, Spencer P, et al. Utility of interim ROTEM? values of clot strength, A5 and A10, in predicting final assessment of coagulation status in severely injured battle patients[J]. Injury, 2013, 44(5): 593-599. DOI:10.1016/j.injury.2012.03.018 |
| [33] | Kutcher ME, Ferguson AR, Cohen MJ. A principal component analysis of coagulation after trauma[J]. J Trauma Acute Care Surg, 2013, 74(5): 1223-1230. DOI:10.1097/ta.0b013e31828b7fa1 |
| [34] | Chin TL, Moore EE, Moore HB, et al. A principal component analysis of postinjury viscoelastic assays:Clotting factor depletion versus fibrinolysis[J]. Surgery, 2014, 156(3): 570-577. DOI:10.1016/j.surg.2014.04.030. |
| [35] | Windelv NA, Welling KL, Ostrowski SR, et al. The prognostic value of thrombelastography in identifying neurosurgical patients with worse prognosis[J]. Blood Coagul Fibrinolysis, 2011, 22(5): 416-419. DOI:10.1097/mbc.0b013e3283464f53 |
| [36] | Johansson PI. Goal-directed hemostatic resuscitation for massively bleeding patients:The Copenhagen concept[J]. Transfus Apher Sci, 2010, 43(3): 401-405. DOI:10.1016/j.transci.2010.09.002 |
| [37] | 纪宏文, 马丽, 高旭蓉, 等. 中国北京地区健康人群血栓弹力图参考范围的建立[J]. 中华医学杂志, 2011, 91(14): 980-983. DOI:10.3760/cma.j.issn.0376-2491.2011.14.011 |
| [38] | 陆学军, 吴巍, 李传保, 等. 北京地区老年人血栓弹力图检测参考范围研究[J]. 中华老年医学杂志, 2016, 35(9): 986-989. DOI:10.3760/cma.j.issn.0254-9026.2016.09.016 |
 2019, Vol. 29
2019, Vol. 29




