2 广西医科大学第二附属医院急诊科, 南宁 530007
2 Department of Emergency, The Second Affiliated Hospital of Guangxi Medical University, Guangxi Zhuang Autonomous Region, Nanning 530007, China
百草枯(paraquat,PQ)是使用最为广泛的除草剂[1]。PQ中毒的病死率高达60%~80%[2]。PQ进入人体后在肺组织中大量聚集[3],PQ在肺组织中的浓度比在血液中高10至90倍[4]。因此,PQ中毒早期就可出现肺水肿、肺出血、肺不张并迅速发展成不可逆的肺纤维化[5]。然而,PQ并无有效的拮抗剂来治疗。目前,PQ中毒的治疗包括清除毒物,免疫抑制剂和抗氧化剂[6-7],但病死率仍然很高。所以,如何防治PQ中毒致急性肺损伤(acute lung injury,ALI)是研究的热点与难点之一。
甘草酸二铵(diammonium glycyrrhizinate,DG)是从中草药甘草(glycyrrhiza)中提取的一种有效成分单体[8],其结构与肾上腺皮质激素类似,具有广泛的抗炎、抗氧化、抗病毒、调节免疫、护肝及抗肿瘤等功效[9]。本课题组前期证实,PQ中毒致ALI的SD大鼠中,DG可抑制肺组织中TLR4及NF-κB P65的异常表达,具有较强的免疫调节和抗炎作用,进而改善大鼠预后[10]。在PQ中毒致急性肾损伤SD大鼠中,DG增强肾组织中IL-10的表达,并且抑制TLR4、Myd88、NF-κB P65及IL-17的异常表达,减轻肾损伤[11-12]。然而,DG调控TLR4、GR及炎症因子的机制尚不明确。
本研究采用糖皮质激素受体阻断剂RU486阻断GR,然后用DG进行预干预,以PQ诱导大鼠肺泡上皮细胞建立体外模型,通过ELISA和RT-PCR了解DG对ALI中GR、TLR4、NF-кB P65、Myd88及TNF-α表达的影响,探讨DG如何影响ALI时的肺泡上皮细胞的炎症因子表达,进而探讨其对ALI保护作用的可能机制,为临床防治ALI提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞大鼠Ⅱ型肺泡上皮细胞AEC(上海沪震实业,中国)。
1.1.2 药品及主要试剂胎牛血清(美国Gibco公司),RPMI1640(美国Gibco公司),百草枯(美国Sigma公司)(,甘草酸二铵(中国江苏正大天晴制药有限公司),米非司酮(RU486)(美国Sigma公司)以无水乙醇配制,MTT试剂(美国Sigma公司),TriPure总RNA抽取试剂盒(美国Roche公司),逆转录试剂盒(美国Roche公司),Fast Start Universal SYBR Green Master (ROX)(美国Roche公司),大鼠NF-кB P65、TLR-4、TNF-α、GR ELISA试剂盒(中国武汉华美生物工程有限公司),大鼠Myd88 ELISA试剂盒(中国北京冬歌)。
1.1.3 主要仪器CO2培养箱(美国Forma scientific Inc公司),正置显微镜(日本Olympus公司),酶标仪(美国BioTek Instruments),荧光定量PCR仪(美国Applied Biosystems StepOne)。
1.2 方法 1.2.1 细胞培养及分组AEC用含10%胎牛血清的RPMI 1640培养基培养,并加入青霉素100 U/mL,链霉素100 μg/L,置于37℃含5%CO2培养箱中培养。实验细胞分为分为6组:(1)空白对照组(NS组):未采用任何药物干预,培养24 h;(2)模型组(PQ组):以1 000 μmol/L PQ培养24 h;(3)DG预治疗组(DG组):先以0.6 mg/mL DG培养2 h,再以0.6 mg/mL DG+ 1 000 μmol/L PQ培养24 h;(4)模型受体阻断组(PR组)先以100 nmol RU486培养2 h,再以100 nmol RU486+ 1 000 μmol/L PQ培养24 h;(5)DG预治疗受体阻断组(PDR组)先以100 nmol RU486培养2 h再以100 nmol RU486+0.6 mg/mL DG培养2 h,最后以100 nmol RU486+0.6 mg/mL DG +1 000 μmol/L PQ培养24 h;(6)无水乙醇对照组(NE组)以0.33 μ/mL无水乙醇培养24 h。
1.2.2 MTT法测定细胞增殖抑制率取处于对数生长期的细胞用胰蛋白酶消化后,接种于96孔板,培养24 h,分别加入0、200、400、600、800、1 000、1 500、2 000 μmol/L浓度PQ,孵育24 h后加入10 μL MTT(5 mg/ mL),继续培养4 h后加入二甲基亚砜(DMSO)150 μL/孔,酶标仪570 nm测定吸光度(A值),计算细胞存活率。存活率(%)=用药组A值/对照组A值孵育×100%。
取处于对数生长期的细胞用胰蛋白酶消化后,接种于96孔板,培养24 h,分别加入0、0.2、0.4、0.6、0.8、1、2、4 mg/mL浓度DG孵育2 h,再以对应浓度的DG+1 000 μmol/L PQ孵育24 h后加入10 μL MTT(5 mg/ mL),继续培养4 h后加入二甲基亚砜(DMSO)150 μL/孔,酶标仪570 nm测定吸光度(A值),计算细胞存活率。存活率(%)=用药组A值/对照组A值孵育×100%。
1.2.3 ELISA检测取细胞培养物上清液,用大鼠NF-кB P65、TLR4、Myd88、TNF-α ELISA试剂盒检测各组NF-кB P65、TLR4及Myd88质量浓度,操作步骤按说明书进行。
取细胞裂解液,用大鼠GR ELISA试剂盒检测各组GR质量浓度,操作步骤按说明书进行。
1.2.4 实时荧光定量PCR(qPCR)测定取大鼠泡上皮细胞,用TriPure法提取总RNA,以逆转录试剂盒逆转录成cDNA,采用Fast Start Universal SYBR Green Master (ROX)试剂盒以已合成的cDNA为模板进行real-time PCR反应。TLR4、Myd88、NF-кB P65的引物序列见表 1。
| 目标物 | 上游引物 | 下游引物 |
| β-actin | 5'-TGTGCCCATCTATGAGGGTTAC-3' | 5'-ATGTCACGCACGATTTCCCT-3' |
| TLR4 | 5'-CCGCTCTGGCATCATCTTCA-3' | 5'-CCGCTCTGGCATCATCTTCA-3' |
| Myd88 | 5'-ATACCAACCCTTGCACCAAGTC-3' | 5'-TCAGGCTCCAAGTCAGCTCATC-3' |
| NF-κB P65 | 5'-GATCTGTTTCCCCTCATCTTTCC-3' | 5'-GTGCGTCTTAGTGGTATCTGTGCT-3' |
| GR | 5'-AGGCAGTATGACCATGGGATGAA-3' | 5'-ACCGGAATCTCAAGCTCCTGAA-3' |
| 注:PCR反应条件,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸60 s,扩增40个循环。PCR完成后,用ABI 7500软件分析基因的扩增情况,得到相应Ct值,以β-actin作为内参照,每组设3个复孔,基因相对表达量(RQ)采用2-△△Ct方法计算 | ||
应用SPSS 17.0软件进行统计学分析,正态分布计量资料以均数±标准差(Mean±SD)表示,多组数据比较采用单因素方差分析(one-way ANOVA),各组相互比较采用SNK-q检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 PQ和DG对肺泡上皮细胞增殖的影响PQ对肺泡上皮细胞具有明显的增殖抑制作用。PQ呈浓度依赖性降低细胞的存活率(图 1)。PQ剂量为200、400、600、800、1 000、1 500、2 000 μmol/L时其抑制率分别为(11.74±1.44)%、(18.76±1.30)%、(28.74±0.54)%、(40.30±0.55)%、(51.24±0.76)%、(68.19±1.10)%、(83.16±0.59)%。PQ作用大鼠肺泡上皮细胞24 h的IC 50值为927.045 μmol/L。
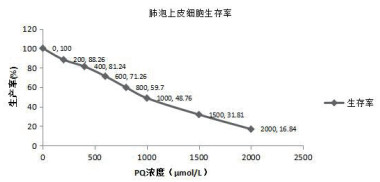
|
| 图 1 PQ对大鼠肺泡上皮细胞增殖的抑制作用 Fig 1 Inhibitory effect of PQ on proliferation of rat alveolar epithelial cells |
|
|
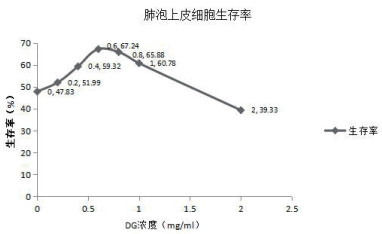
|
| 图 2 DG对1 000μmol/L PQ诱导的大鼠肺泡上皮细胞增殖的作用 Fig 2 Effect of DG on proliferation of rat alveolar epithelial cells induced by 1 000 μmol/L PQ |
|
|
在一定浓度范围内DG对PQ诱导的肺泡上皮细胞具有增殖促进作用(图3)。在1 000 μmol/LPQ诱导的细胞中,DG剂量为0.2、0.4、0.6、0.8、1、2 mg/mL时其抑制率分别为(48.01±1.37)%、(40.68±2.33)%、(32.76±4.11)%、(34.12±4.3)%、(39.22±2.23)%、(51.26±0.39)%。
2.2 ELISA定量检测PQ组、PR组、DG及PDR组组中TLR-4、Myd88、NF-кB P65、TNF-α的质量浓度较NS组均有不同程度的升高,差异有统计学意义(P < 0.01);DG组和PDR组升高程度低于PQ组,差异有统计学意义(P < 0.01)。PQ组及DG组中GR的质量浓度较NS组均有不同程度降低,差异有统计学意义(P < 0.01);并且DG组中GR的质量浓度大于PQ组,差异有统计学意义(P < 0.01)。NS组与NE组差异无统计学意义(P > 0.05), 见表 2。
| 组别 | TLR-4 (ng/mL) |
Myd88 (ng/mL) |
NF-кB P65 (pg/mL) |
TNF-α (pg/mL) |
GR (pg/mL) |
| NS组 | 0.893±0.025 | 2.128±0.009 | 2.678±0.086 | 15.201±0.428 | 59.140±1.037 |
| PQ组 | 2.348±0.023 | 7.643±0.015 | 8.246±0.119 | 56.003±0.562 | 23.031±0.804 |
| DG组 | 1.468±0.024 | 4.108±0.010 | 5.759±0.083 | 39.168±0.598 | 41.064±6.297 |
| PR组 | 2.348±0.022 | 7.644±0.016 | 8.258±0.099 | 56.333±0.622 | |
| PDR组 | 1.486±0.021 | 4.109±0.010 | 5.783±0.085 | 39.469±0.563 | |
| NE组 | 0.899±0.019 | 2.131±0.008 | 2.690±0.080 | 15.276±0.395 | |
| F值 | 8 380.669 | 454 505.70 | 7 229.185 | 11 837.808 | 236.363 |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
PQ组、PR组、DG组及PDR组中TLR-4、Myd88、NF-кB P65 mRNA的表达较NS组均有不同程度的升高,差异有统计学意义(P < 0.01);DG组及PDR组升高程度低于PQ组,差异有统计学意义(P < 0.01)。PQ组及DG组中GR的表达较NS组均有不同程度降低,差异有统计学意义(P < 0.01);并且DG组中GR的表达大于PQ组,差异有统计学意义(P < 0.01)。NS组与NE组差异无统计学意义(P > 0.05), 见表 3。
| 组别 | TLR-4 | Myd88 | NF-кB P65 | GR |
| NS组 | 1.000±0.000 | 1.000±0.000 | 1.000±0.000 | 1.000±0.000 |
| PQ组 | 4.059±0.091 | 2.360±0.326 | 2.513±0.175 | 0.669±0.056 |
| DG组 | 2.846±0.246 | 1.550±0.168 | 1.870±0.077 | 0.813±0.684 |
| PR组 | 4.182±0.058 | 2.430±0.395 | 2.534±0.159 | |
| PDR组 | 2.924±0.260 | 1.616±0.165 | 1.948±0.091 | |
| NE组 | 1.031±0.023 | 1.105±0.097 | 1.061±0.013 | |
| F值 | 251.659 | 20.244 | 115.984 | 31.526 |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
PQ中毒病死率很高,虽然关于PQ中毒研究报道有许多,但PQ中毒致肺损伤的发病机制尚未完全阐明并且尚未发现有效的疗法。
TLR-4是固有免疫系统细胞的跨膜受体,并且在急性感染引起的肺损伤中有模式识别受体的作用[13-15],对于细胞信号转导和细胞凋亡有重要意义。如革兰阴性菌的脂多糖等外源性配体[16, 18]和坏死细胞的热休克蛋白(HSP60和HSP70)[19]等内源性配体均可激活TLR-4。TLR-4的活化有髓样分化因子88(myeloid differentiation factor88,Myd88)依赖性和非依赖性两条信号途径;前者活化丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB信号通路,后者活化NF-κB和干扰素调节因子-3((IFN-regulated factor 3,IRF 3)[20-21]。有研究表明TLR-4可介导炎性细胞因子的产生,如肿瘤坏死因子α(TNF-α),白细胞介素-6(IL-6)和白细胞介素1β(IL-1β),并且参与炎症信号转导和促炎症反应[22]。已有研究报道,脂多糖诱导的急性肺损伤过程中TLR-4可通过MyD88依赖途径促进炎症介质的释放,导致肺损伤加重[23-24]。由TLR-4/Myd88/NF-кB信号通路激活的TNF-α作为促炎症因子,在机体炎症反应中最早出现,是具有始动性作用的细胞因子。它可产生IL- 1、IL- 2、IL- 6、IL- 8等因子引起全身炎症,还可以刺激单核细胞和巨噬细胞生成并释放IL- 1、IL- 8,导致炎症进一步发展扩大[25]。并且有研究证实,在ALI/ARDS等肺部疾病中TNF-α及其受体通过调节T细胞介导肺部炎症[26]。
在本实验中,PQ组中TLR-4、Myd88、NF-кB、TNF-α的水平均大于NS组,推测TLR-4作为炎症反应损伤的扳机点启动肺损伤的病理过程。因此,调控TLR-4/Myd88/NF-кB信号通路,抑制炎症反应,将成为治疗百草枯肺损伤一新的切入点。
也有研究表明在调节炎症反应中GR也起着重要作用[27]。一方面,GR可以通过抑制p38 MAPK的激活而阻止下游炎症因子的级联反应[28-30];另一方面,GR可通过破坏TLR4的下游产物IRF3,从而抑制功能相关的炎症反应基因。ALI/ARDS患者外周血单核白细胞上的GR表达水平是下降的,病情越重GR减少越明显,其减少程度与病情的严重程度平行,因此提出根据患者的GR水平及内源性糖皮质激素水平合理使用糖皮质激素治疗可以提高救治的成功率。ALI/ARDS动物模型实验中,肺组织中GR数目呈进行性下降,GR结合减少,表现为受体水平的糖皮质激素功能不全。在本实验中,PQ组中GR的基因表达和浓度小于NS组,可推测GR不足或活性低下引起炎症因子大量释放,加速肺损伤。
DG其结构与肾上腺皮质激素类似,具有类激素样细胞保护作用,其对激素受体和酪氨酸转氨酸(TAT)有良性效应,而TAT在肝细胞是激素作用的特异性标志物。甘草酸作为类激素免疫调节生物制剂,但并不影响激素受体数量,而减少HSP90和HSP90相关激素受体的表达,推测其可能通过两种途径而起作用:一方面,甘草酸可能通过抑制热休克蛋白90(HSP90)的表达,从而降低GR对激素反应的亲和力;另一方面,甘草酸通过增强激素诱导基因的表达,从而增强激素的药理效应。本研究中,经DG处理后GR mRNA和蛋白水平明显升高,而TLR-4及Myd88及TNF-α水平显著下降, 改善了肺损伤。说明DG对GR有上调作用,阻滞TLR-4信号传导途径,减少NF-κB、TNF-α炎症因子的过度表达,最终保护了肺泡上皮细胞。推测增加GR的表达及促进GR从胞浆向胞核移位可能是DG发挥抗炎及抗纤维化作用的机制之一。并且PDR组TLR4、Myd88、NF-кB、TNF-α水平均小于PQ组,说明给予糖皮质激素受体阻断剂RU486并未影响DG的抗炎作用。DG虽然具有类激素样抗炎作用,但其作用机制与激素并不相同。
| [1] | Serra A., Domingos F, Prata MM.. Paraquat intoxication[J]. Acta Med Port, 2003, 16(1): 25-32. |
| [2] | Bertolote JM, Fleischmann A, Eddleston M, et al. Deaths from pesticide poisoning:a global response[J]. Br J Psychiatry, 2006, 189: 201-203. DOI:10.1192/bjp.bp.105.020834 |
| [3] | Dinis-Oliveira RJ, Valle MJD., Bastos ML., et al. Kinetics of paraquat in the isolated rat lung:Influence of sodium depletion[J]. Xenobiotica, 2006, 36(8): 724-737. DOI:10.1080/00498250600790331 |
| [4] | Chen CM, Lua AC. Lung toxicity of paraquat in the rat[J]. J Toxicol Environ Health A, 2000, 60(7): 477-487. DOI:10.1080/00984100050079548 |
| [5] | Dinis-Oliveira RJ, Duarte JA, Sanchez-Navarro A, et al. Paraquat poisonings:Mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [6] | Kang MS, Gil HW, Yang JO, et al. Comparison between kidney and hemoperfusion for paraquat elimination[J]. J Korean Med Sci, 2009, 24: S156-S160. DOI:10.3346/jkms.2009.24.S1.S156 |
| [7] | Hong SY, Yang JO, Lee EY, et al. Effect of haemoperfusion on plasma paraquat concentration in vitro and in vivo[J]. Toxicology and Industrial Health, 2003, 19(1): 17-23. DOI:10.1191/0748233703th171oa |
| [8] | Wu P, Zhang Y, Liu Y, et al. Effects of glycyrrhizin on production of vascular aldosterone and corticosterone[J]. Horm Res, 1999, 51(4): 189-192. DOI:10.1159/000023356 |
| [9] | Asl MN, Hosseinzadeh H. Review of pharmacological effects of Glycyrrhiza sp[J]. Phytother Res, 2008, 22(6): 709-724. DOI:10.1002/ptr.2362 |
| [10] | 李浩, 张剑锋, 张伟, 等. 甘草酸二铵对百草枯中毒致急性肺损伤大鼠TLR-4表达的影响[J]. 蛇志, 2014, 26(1): 1-3,15. DOI:10.3969/j.issn.1001-5639.2014.01.001 |
| [11] | 张伟, 张剑锋, 李浩. 甘草酸二铵对百草枯致急性肾损伤大鼠IL-17表达的影响[J]. 蛇志, 2015, 27(2): 103-105,120. DOI:10.3969/j.issn.1001-5639.2005.02.003 |
| [12] | 张伟, 张剑锋, 李浩, 等. 甘草酸二铵对百草枯中毒大鼠肾组织TOLL样受体4表达的影响[J]. 中华急诊医学杂志, 2015, 24(11): 1214-1219. DOI:10.3760/cma.j.issn.1671-0282.2015.11.006 |
| [13] | Medzhitov R, Janeway CJ. Advances in immunology:Innate immunity[J]. N Engl J Med, 2000, 343(5): 338-344. DOI:10.1056/NEJM200008033430506 |
| [14] | Akira S. Mammalian Toll-like receptors[J]. Curr Opin Immunol, 2003, 15(1): 5-11. DOI:10.1016/S0952-7915(02)00013-4 |
| [15] | 王艳, 肖红丽, 王国兴, 等. 肾素血管紧张素系统与Toll样受体4通路的相关性研究进展[J]. 中华急诊医学杂志, 2017, 26(4): 468-469. DOI:10.3760/cma.j.issn.1671-0282.2017.04.025 |
| [16] | Poltorak A, He X, Smirnova I., et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice:mutations in Tlr4 gene[J]. Science, 1998, 282(5396): 2085-2088. DOI:10.1126/science.282.5396.2085 |
| [17] | Qureshi ST, Lariviere L, Leveque G, et al. Endotoxin-tolerant mice have mutations in Toll-like receptor 4(Tlr4)[J]. J Exp Med, 1999, 189(4): 615-625. DOI:10.1084/jem.189.4.615 |
| [18] | Laflamme N, Rivest S. Toll-like receptor 4:the missing link of the cerebral innate immune response triggered by circulating gram-negative bacterial cell wall components[J]. FASEB J, 2001, 15(1): 155-163. DOI:10.1096/fj.00-0339com |
| [19] | Ohashi K, Burkart V, Flohe S, et al. Heat shock protein 60 is a putative endogenous ligand of the toll-like receptor-4 complex[J]. J Immunol, 2000, 164(2): 558-561. DOI:10.4049/jimmunol.164.2.558 |
| [20] | Yan ZQ. Regulation of TLR4 expression is a tale about tail[J]. Arterioscler Thromb Vasc Biol, 2006, 26(12): 2582-2584. DOI:10.1161/01.ATV.0000250933.92917.dd |
| [21] | Akira S, Takeda K. Toll-like receptor signalling[J]. Nat Rev Immunol, 2004, 4(7): 499-511. DOI:10.1038/nri1391 |
| [22] | Zhou BC, ZhouH, Ling SC, et al. Activation of PAR2 or/and TLR4 promotes SW620 cell proliferation and migration via phosphorylation of ERK1/2[J]. Oncol Rep, 2011, 25(2): 503-511. DOI:10.3892/or.2010.1077 |
| [23] | Hoth JJ, Wells JD, Brownlee NA, et al. Toll-like receptor 4-dependent responses to lung injury in a murine model of pulmonary contusion[J]. Shock, 2009, 31(4): 376-381. DOI:10.1097/SHK.0b013e3181862279 |
| [24] | Villar J, Cabrera N, Casula M, et al. Mechanical ventilation modulates Toll-like receptor signaling pathway in a sepsis-induced lung injury model[J]. Intensive Care Med, 2010, 36(6): 1049-1057. DOI:10.1007/s00134-010-1799-3 |
| [25] | Li X, Wang JN, Huang JM, et al. Chrysin promotes tumor necrosis factor (TNF)-related apoptosis-inducing ligand (TRAIL) induced apoptosis in human cancer cell lines[J]. Toxicol In Vitro, 2011, 25(3): 630-635. DOI:10.1016/j.tiv.2010.12.013 |
| [26] | Matera MG, Calzetta L, CazzolaM. TNF-alpha inhibitors in asthma and COPD:we must not throw the baby out with the bath water[J]. Pulm Pharmacol Ther, 2010, 23(2): 121-128. DOI:10.1016/j.pupt.2009.10.007 |
| [27] | Kamiyama K, Matsuda N, Yamamoto S, et al. Modulation of glucocorticoid receptor expression, inflammation, and cell apoptosis in septic guinea pig lungs using methylprednisolone[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(6): L998-L1006. DOI:10.1152/ajplung.00459.2007 |
| [28] | Ayroldi E, Cannarile L, Migliorati G, et al. Mechanisms of the anti-inflammatory effects of glucocorticoids:genomic and nongenomic interference with MAPK signaling pathways[J]. FASEB J, 2012, 26(12): 4805-4820. DOI:10.1096/fj.12-216382 |
| [29] | Bhattacharyya S, Brown DE, Brewer JA, et al. Macrophage glucocorticoid receptors regulate toll-like receptor 4-mediated inflammatory responses by selective inhibition of p38 MAP kinase[J]. Blood, 2007, 109(10): 4313-4319. DOI:10.1182/blood-2006-10-048215 |
| [30] | Vollmer TR., Stockhausen A, Zhang JZ.. Anti-inflammatory effects of mapracorat, a novel selective glucocorticoid receptor agonist, is partially mediated by MAP kinase phosphatase-1(MKP-1)[J]. J Biol Chem, 2012, 287(42): 35212-35221. DOI:10.1074/jbc.M112.400671 |
| [31] | Reily MM, Pantoja C, Hu XY, et al. The GRIP1:IRF3 interaction as a target for glucocorticoid receptor-mediated immunosuppression[J]. Embo J, 2006, 25(1): 108-117. DOI:10.1038/sj.emboj.7600919 |
 2019, Vol. 28
2019, Vol. 28




