自噬是一种进化上高度保守的细胞过程,由双层膜包裹着入侵微生物,受损、衰老的细胞器或异常蛋白质形成自噬体,后与溶酶体融合形成自噬溶酶体,内容物被降解,有用的物质被重新用于合成代谢途径和能量产生[1-2]。自噬过程的完成需要诸多自噬相关分子参与完成,其中LC3蛋白和P62蛋白位置十分重要。当自噬体开始形成时,LC3-Ⅰ经剪切和泛素化加工修饰后与自噬体膜表面的磷脂酰乙醇胺(PE)偶联,成为膜结合形式的LC3-Ⅱ定位于自噬体内膜和外膜并且稳定地保留在其上直到与溶酶体融合,因此LC3Ⅱ被用作自噬体的标记分子反映细胞自噬的程度。P62蛋白作为自噬体膜形成的参与者同时也作为自噬底物其含量多少被广泛用来评价自噬的进程。
脓毒症是指感染引起的炎症应答失调所致的临床综合征,涉及到复杂的全身炎症网络效应、基因多态性、免疫功能障碍、凝血功能异常、组织损伤等多个方面[3],常常会诱发急性器官功能障碍[4]。据报道脓毒症全球病死率高达30%~70%[5],是急诊重症监护病房患者死亡的主要原因之一[6]。脓毒症时多个器官都会被诱导自噬,包括肝脏、心脏、脾脏、肺脏、肾脏和骨骼肌等[7-8]从而影响各器官功能。肝脏作为机体最大代谢器官在脓毒症抗感染免疫反应中起着重要作用[9],同时也是脓毒症诱发的多器官功能障碍综合征的脆弱器官之一[10]。但有关脓毒症时肝脏细胞自噬情况阐述甚少。
本实验通过观察LC3及P62表达及其规律,探讨LC3及P62与肝细胞自噬的关系,为脓毒症诱导自噬的机制提供新的思路和手段。
1 材料与方法 1.1 实验动物清洁级健康雄性ICR小鼠共50只,8~10周龄,体质量(25±2)g,由北京华阜康生物科技股份有限公司提供[实验动物生产许可证:SCXK(京)2014-0004];在中日友好临床医学研究所SPF级动物饲养室饲养[实验动物使用许可证:SYXK(京)2016-0043]。12 h光照周期,正常饮食,适应性喂养一周后开始实验。本实验中对动物所进行的所有操作均经中日友好临床医学研究所伦理委员会批准,批号[180102],所有动物操作均按照相关指南进行。
1.2 实验主要仪器电子显微镜(日本,JEM-1400Plus),BIO-RAD电泳仪(美国,型号042BR03674),BIO-RAD酶标仪(美国,型号:721BR16681)冰冻切片机(LEICA CM 1950),荧光显微镜(德国,Zeiss Axio Observer),多功能酶标仪(美国,MD公司),移液器(德国,Eppendorf)
1.3 实验主要试剂LC3B(Sigma公司,美国),P62(abcam公司,美国),β-actin(北京中杉金桥有限公司,中国),HRP标记二抗(Proteintech公司,美国),蛋白提取试剂盒、BCA法蛋白定量试剂盒、Tris-Tricine-SDS-PAGE凝胶制备试剂盒、电泳液、转膜液(solarbio公司,中国),脱脂奶粉(BD公司,美国),PVDF膜(Millipore公司,美国),PageRuler? Prestained Protein Ladder(Thermo,美国),荧光抗体(abcam公司,英国),TNF-α和IL-6的ELISA试剂盒(上海森雄)。
1.4 脓毒症小鼠模型腹腔注射4%水合氯醛(0.1 ml/10 g)将小鼠麻醉,固定在手术台上,检查麻醉深度。麻醉成功后,腹部剃毛,酒精消毒腹部皮肤,在小鼠腹中线左侧1 cm处纵向切开1 cm的切口。切开皮肤和腹膜,找到盲肠,用5-0丝线结扎盲肠50 %(结扎部位为盲肠末端到回盲瓣长度一半处),用21 G针贯通穿刺1次(避免损伤血管,穿刺部位为结扎处和盲肠末端的中点),轻轻挤出少量粪便,盲肠环纳腹腔,然后依次缝合腹部切口。手术过程中使用小动物手术加热毯来维持麻醉小鼠的正常体温,术后腹腔注射预热的生理盐水0.5 ml补充术中体液损失。在加热毯上苏醒后放回笼中,自由饮食饮水。对照组只进行开腹操作,并不进行盲肠的结扎和穿孔[12]。
模型成功标准:术后小鼠出现萎靡,腹泻,活动差,毛色暗黄失去光泽和肝功能受损等表现即可认为建模成功。
1.5 实验分组和标本收集处理50只6~8周龄清洁级雄性ICR小鼠按照随机数字表法平均分为5组:CLP 3 h组,CLP 6 h组,CLP 12 h组,CLP 24 h组和对照组,于术后相应时间点取材。采用心脏穿刺法取血,静置0.5 h后10 000 r/min离心10 min,收集血清冻存于-80 ℃冰箱。腹正中切口摘除肝脏,将其分为3部分:部分在2.5 %戊二醛中固定做电镜观察;部分立即做冰冻切片免疫荧光;部分保存于- 80℃冰箱之后做Western Blot检测。
1.6 ELISA检测IL-6和TNF-α实验前20 min从冰箱取出试剂盒,平衡至室温。严格按照试剂盒说明书步骤进行操作,检测IL-6和TNF-α含量。
1.7 Western Blot检测肝组织LC3蛋白和P62蛋白(1)取- 80℃冰箱保存的小鼠肝脏,加入高效组织裂解液RIPA(含1 % PMSF),匀浆,离心(12 000 r/min)取上清液。
(2)BCA蛋白浓度测定试剂盒测定蛋白浓度:用蛋白标准品制作浓度吸光度标准曲线,酶标仪检测肝组织上清液蛋白的吸光度值,据标准曲线得到相应浓度。
(3)电泳和转膜:浓缩胶4 %,分离胶14 %。电泳条件:先80 V恒压(约30 min),待跑至分离胶时电压转为120 V,直至跑到接近胶底部。电泳结束后湿法转膜,选择0.2 μm的PVDF膜,转膜条件为90 V, 70 min,注意降温。
(4)抗体孵育和显影:剪膜,5 %脱脂奶粉溶解于TBST制成封闭液,室温孵育2 h。分别加入一抗LC3、P62、β-actin(均1:1 000稀释)4℃孵育过夜,TBST洗膜10 min×3次。加入辣根过氧化物酶标记的二抗(1 : 5 000稀释)室温封闭1 h,洗膜。化学发光显色,BIO-RAD凝胶成像仪软件Image lab 5.2曝光并分析灰度值。
1.8 病理学检查(1)HE染色观察肝组织炎症状态。肝组织浸泡4 %多聚甲醛48 h,酒精梯度脱水,二甲苯透明,石蜡包埋切片,梯度脱蜡,苏木精、伊红染色,封片观察。
(2)透射电镜观察自噬体超微结构和数量。把肝组织切成3 mm×3 mm×3 mm,2.5%戊二醛4 ℃固定2 h以上,0.1 moL/L磷酸盐缓冲液过夜,1%锇酸固定1 h,水洗10 min×3次;丙酮梯度脱水;包埋剂和丙酮1 : 1半渗透2 h;在包埋板中摆好组织位置,纯树脂渗透,室温3 h;37 ℃,45 ℃,60 ℃每步聚合12 h;切片厚度70 min,铅铀双重染色,观察(由中日友好临床医学研究所电镜室提供操作步骤)。
(3)免疫荧光观察自噬体数量。取出肝组织冰冻切片恢复至室温,PBS浸洗3 min×3次;4%多聚甲醛固定15 min,PBS浸洗3 min×3次;0.2%TritonX-100室温通透20 min,浸洗玻片;吸水纸吸干PBS,滴加BSA封闭30 min;滴加足量稀释好的一抗放入湿盒室温孵育2 h;滴加足量稀释好的荧光二抗,避光室温孵育1 h;浸洗玻片,滴加含DAPI的抗荧光淬灭的封片剂封片,在荧光显微镜下观察。
1.9 统计学方法采用SPSS 21.0软件做统计学分析。计量资料以均数±标准差(Mean±SD)表示,对于正态分布,方差齐的数据,两组间比较采用两独立样本t检验,多组间的比较采用方差分析;不符合正态分布或方差不齐的数据,则采用非参数统计秩和检验。以P < 0.05为差异有统计学意义。
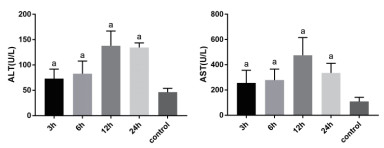
2 结果 2.1 各时间点小鼠肝功能改变ALT和AST在CLP术后明显升高,在12 h到达高峰,之后缓慢下降。对不同时间点组小鼠进行方差分析,分别为F=24.2,P < 0.05和F=11.87,P < 0.05。12 h时ALT(137.8 ± 11.94)U/L与对照组(46.17 ± 3.156)U/L相比,t=7.422,P < 0.05。12h时AST(475.3 ± 57.34)U/L与对照组(109 ± 13.55)U/L相比,t=6.218,P < 0.05, 见图 1。
|
| 各时间点组与对照组相比较,aP<0.05 图 1 CLP术后不同时间点小鼠ALT和AST的变化 Fig 1 The variation of ALT and AST after CLP between different mice groups |
|
|
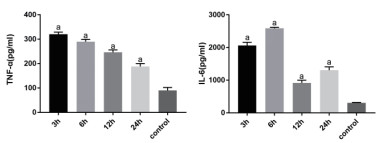
CLP术后时TNF-α于3 h达到最高,随时间延长呈逐渐下降趋势。3 h组(320.21±8.9)pg/ml与对照组(89.86±12.17)pg/ml相比较,t=26.47,P < 0.05。IL-6在6 h到达高峰随后下降,在12 h后又反升, 对不同时间点组小鼠进行方差分析,F=435,P < 0.01。6 h组(2 589.63±27.96)pg/ml与对照组(307.25±12.45)pg/ml相比较,t=129.2 P < 0.05,见图 2。
|
| 各时间点组与对照组相比较,aP<0.05 图 2 CLP术后不同时间点小鼠TNF-α和IL-6的变化 Fig 2 The variation of ALT and AST after CLP between different mice group |
|
|
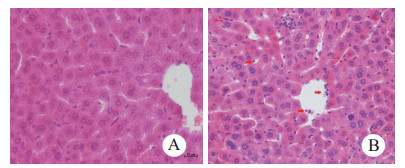
图 3A为对照组,肝组织结构清晰,肝细胞排列整齐。图 3B为CLP 6 h组,可见肝窦内肝库普弗细胞活化,数目增多。粒细胞边集,浸润。
|
| A:对照组, B:CLP 6h组 图 3 小鼠肝组织病理学改变(HE, ×400) Fig 3 Pathological changes in mouse liver tissue |
|
|
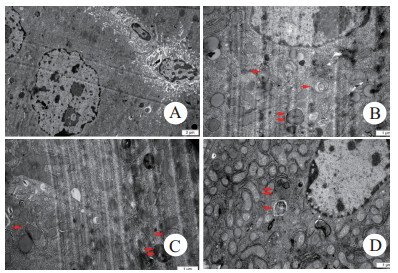
图 4A(×8 000)为对照组,肝细胞未见明显异常。图 4B.C.D均为CLP 6 h组,单箭头指示自噬体,双箭头指示自噬溶酶体。图 4B(×12 000)可见自噬体与自噬溶酶体。图 4C(×12 000)左侧可见新包裹的损伤线粒体的自噬体,右侧可见自噬体和溶酶体即将融合。图 4D(×12 000)可见自噬溶酶体内尚有未消化的细胞器,且自噬体即将与之融合。
|
| A为对照组(×8 000),B、C、D均为CLP 6 h组(×12 000) 图 4 小鼠肝组织自噬体和自噬溶酶体 Fig 4 The autophagosome and autolysosome in mouse liver tissue |
|
|
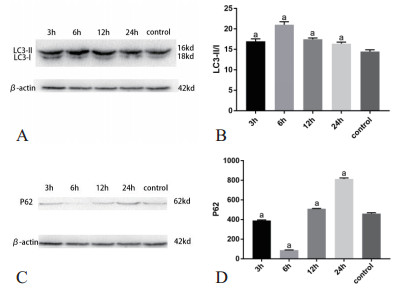
CLP术后代表自噬体形成数量的LC3Ⅱ/Ⅰ比值先升高,在6 h到达高峰,之后持续下降。CLP 6 h组(21.03 ± 0.4185)与对照组(14.46 ± 0.2593)相比,t=13.35, P < 0.05。自噬底物P62蛋白含量先下降,在6 h到达低谷之后回升,方差分析结果为F=3797,P < 0.05。CLP 6 h组(88.33 ± 1.202)与对照组(461 ± 5.508)相比,t=66.11,P < 0.05。见图 5。
|
| 各时间点组与对照组相比较,aP<0.05 图 5 小鼠肝脏自噬蛋白LC3Ⅱ/Ⅰ及P62的变化 Fig 5 The variation of LC3Ⅱ/Ⅰand P62 in mice liver tissue |
|
|
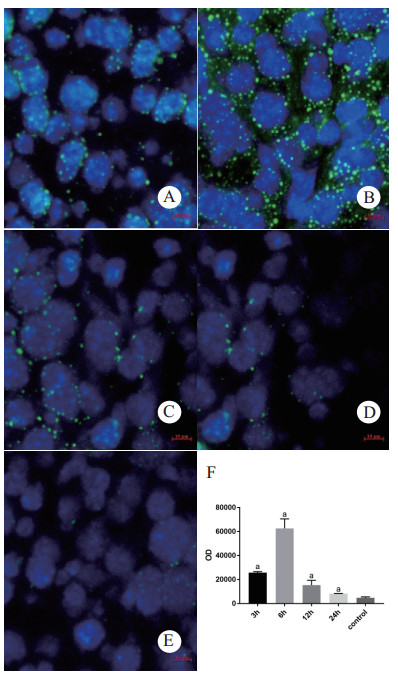
CLP术后,小鼠肝组织LC3Ⅱ蛋白荧光强度(吸光度值)先升高后下降,于术后6 h到达峰值,见图 6。6 h组(62 605 ± 4 596)与对照组(4 766 ± 459)相比,t=12.52,P < 0.05。视野随机选取保证代表性和组间可比性。
|
| A:3 h组B:6 h组C:12 h组D:24 h组E:control组F:各组蛋白荧光强度各时间点组与对照组相比较,aP<0.05 图 6 小鼠肝组织LC3Ⅱ蛋白荧光强度变化(×400) Fig 6 Fluorescence intensity changes of LC3Ⅱ protein in mouse liver tissue(×400) |
|
|
2016年,关于脓毒症和脓毒症休克的国际共识定义(Sepsis-3)将脓毒症定义为由宿主对感染的应答失调所致的威胁生命的器官功能障碍,脓毒症的高发病率和病死率及巨大的医疗负担使得2017年世界卫生大会和世界卫生组织将脓毒症列为全球卫生优先事项[11],它一直是急危重症领域的重点和难点。啮齿动物的盲肠结扎和穿刺模型(CLP法)已成为最广泛使用的实验性脓毒症金标准模型[12],盲肠结扎的长度和穿刺的孔径及次数是自噬发生,炎症反应和病死率的主要决定因素,故我们选择盲肠结扎50%,21G针贯通穿刺一次建造中级脓毒症模型。本实验观察到CLP术后小鼠精神萎靡,觅食差,活动差,呼吸急促,HE染色肝库普弗细胞数目增多,粒细胞浸润。ALT和AST显著升高,于术后12 h到达高峰,肝功能严重损伤。炎症始动因子TNF-α于术后3h达到高峰,激活细胞因子级联反应,二级炎症因子IL-6于术后6h达到高峰,这充分肯定了脓毒症肝损伤模型造模成功。
自噬的概念是1962被提出的[13],在正常生理条件下,自噬调控受损蛋白质和细胞器的更新以维持细胞稳态;在病理条件下,饥饿,缺氧,生长因子被剥夺,氧化损伤,遗传毒性等均会诱导自噬。自噬的完成涉及多种自噬相关蛋白复合物的协同作用,自噬体和自噬溶酶体的形成是关键节点。自噬体定义为封闭了细胞质与损伤细胞器的不同退化阶段双膜结构,不包括仅包含类似于背景细胞质的双层膜结构。自噬溶酶体被定义为具有细胞质或细胞器碎片的单膜囊泡,与自噬体内容物相比有不太明显的细胞器残留物。本实验中透射电镜观察到刚被自噬体包裹的损伤线粒体、即将融合的自噬体与溶酶体,还有包含降解物的自噬溶酶体,该结果呈现了在脓毒症肝细胞中自噬的三个关键步骤。
胞质型LC3-Ⅰ被磷脂酰乙醇胺(PE)的脂质化以形成膜结合LC3-Ⅱ是自噬体形成关键步骤,同时也是检测自噬发生的金标准;P62蛋白参与自噬体形成同时也作为自噬降解底物来衡量自噬的完成情况。本研究免疫印记结果证实在CLP术后直至6 h,脓毒症小鼠肝脏自噬蛋白LC3-Ⅱ/Ⅰ的比值逐渐升高,于6 h达到高峰,之后持续下降。LC3-Ⅱ蛋白的免疫荧光结果亦是上述趋势,在CLP术后6 h映了自噬体形成的数量,相比其他文献选择自噬蛋白LC3-Ⅱ/β-actin,本研究排除了LC3-Ⅰ本身含量对检测的影响并且该比值能够反映LC3-Ⅰ向LC3-Ⅱ的动态转换情况。有报道称,监测绿色荧光蛋白-LC3转基因小鼠CLP后肝脏、心脏和脾脏,LC3斑点的数量显著增加并在6 h达到峰值[14],这与本研究自噬高峰时间点一致。此外,P62蛋白含量先逐渐减少,在6 h最低,之后逐渐累积,与LC3-Ⅱ/Ⅰ呈相反趋势,反映了自噬初始被激活时P62作为自噬底物被利用,其含量在减少,之后开始蓄积。说明脓毒症发生6 h后自噬体形成数量下降,自噬从活跃走向被抑制。
迄今为止导致脓毒症自噬活性下降的机制仍不清楚,可能的机制是在遭遇微生物的初始阶段自噬过度活跃导致用于自噬诱导的必需前体的耗尽[15],也可能是自噬体与溶酶体的融合受损[16],目前认为自噬活性降低与器官衰竭有密切关系[17]。而自噬的激活似乎可以通过协助清除微生物[18]、中和微生物毒素[19]、维持线粒体完整性和控制细胞因子释放等保护多器官损伤。在脓毒症中肝细胞自噬的激活和抑制究竟是何机制将是本实验下一步研究方向。本实验尚有需要改进的地方,比如延长观测时间,探究在脓毒症后期自噬的发展情况;缩短检测时间间隔,把自噬的发生发展更加细致化精确化。
| [1] | Mizushima N, Ohsumi Y, Yoshimori T. Autophagosome formation in mammalian cells[J]. Cell Struct Funct, 2002, 27(6): 421-429. DOI:10.1247/csf.27.421 |
| [2] | Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation[J]. Nature, 2011, 469(7330): 323-335. DOI:10.1038/nature09782 |
| [3] | 方莹莹, 李春盛. C5a-C5L2与高迁移率族蛋白B1和Toll样受体在脓毒症中的研究进展[J]. 中华危重病急救医学, 2015, 27(2): 155-157. DOI:10.3760/cma.j.issn.2095-4352.2015.02.017 |
| [4] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/s0140-6736(18)30696-2 |
| [5] | 孙力超, 张国强. 促血管生成素(Ang):一种新的脓毒症血清标志物[J]. 中华急诊医学杂志, 2015, 24(2): 128-132. DOI:10.3760/cma.j.issn.1671-0282.2015.02.003 |
| [6] | 温前宽, 李彦, 杨建萍, 等. 严重脓毒症患者炎症因子的动态变化及预后意义[J]. 中华急诊医学杂志, 2015, 24(7): 779-783. DOI:10.3760/cma.j.issn.1671-0282.2015.07.020 |
| [7] | Hsieh CH, Pai PY, Hsueh HW, et al. Complete induction of autophagy is essential for cardioprotection in sepsis[J]. Ann Surg, 2011, 253(6): 1190-1200. DOI:10.1097/sla.0b013e318214b67e |
| [8] | Lo S, Yuan SSF, Hsu C, et al. Lc3 over-expression improves survival and attenuates lung injury through increasing autophagosomal clearance in septic mice[J]. Ann Surg, 2013, 257(2): 352-363. DOI:10.1097/sla.0b013e318269d0e2 |
| [9] | Chen YR, Wang XP, Templeton D, et al. The role of c-Jun N-terminal kinase (JNK) in apoptosis induced by ultraviolet c and γ radiation[J]. J Biol Chem, 1996, 271(50): 31929-31936. DOI:10.1074/jbc.271.50.31929 |
| [10] | Bone RC. The pathogenesis of sepsis[J]. Ann Intern Med, 1991, 115(6): 457. DOI:10.7326/0003-4819-115-6-457 |
| [11] | Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority:a WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/nejmp1707170 |
| [12] | Rittirsch D, Hoesel LM, Ward PA. The disconnect between animal models of sepsis and human sepsis[J]. J Leuk Biol, 2007, 81(1): 137-143. DOI:10.1189/jlb.0806542 |
| [13] | Ashford TP. Cytoplasmic components in hepatic cell lysosomes[J]. J Cell Biology, 1962, 12(1): 198-202. DOI:10.1083/jcb.12.1.198 |
| [14] | Takahashi W, Watanabe E, Fujimura L, et al. Kinetics and protective role of autophagy in a mouse cecal ligation and puncture-induced sepsis[J]. Cri Care, 2013, 17(4): R160. DOI:10.1186/cc12839 |
| [15] | Ho J, Yu J, Wong SH, et al. Autophagy in sepsis:Degradation into exhaustion?[J]. Autophagy, 2016, 12(7): 1073-1082. DOI:10.1080/15548627.2016.1179410 |
| [16] | Hsieh CH, Pai PY, Hsueh HW, et al. Complete induction of autophagy is essential for cardioprotection in sepsis[J]. An Surg, 2011, 253(6): 1190-1200. DOI:10.1097/sla.0b013e318214b67e |
| [17] | Howell GM, Gomez H, Collage RD, et al. Augmenting autophagy to treat acute kidney injury during endotoxemia in mice[J]. PLoS One, 2013, 8(7): e69520. DOI:10.1371/journal.pone.0069520 |
| [18] | Mansilla Pareja ME, Colombo MI. Autophagic clearance of bacterial pathogens:molecular recognition of intracellular microorganisms[J]. Front Cell Infect Micr, 2013, 3(1): 54. DOI:10.3389/fcimb.2013.00054 |
| [19] | Maurer K, Reyes-Robles T, Alonzo F Ⅲ, et al. Autophagy mediates tolerance to staphylococcus aureus alpha-toxin[J]. Cell Host Microbe, 2015, 17(4): 429-440. DOI:10.1016/j.chom.2015.03.001 |
 2019, Vol. 28
2019, Vol. 28




