2 郑州大学第一附属医院急诊科 450052
2 Department of Emergency, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
心肌肥厚的本质是在各种慢性刺激下,心脏为适应工作负荷的增加引起的一系列复杂的代偿性反应,早期可代偿性地维持心脏功能,而持续存在的心肌肥厚最终会发展成为不可逆转的心力衰竭[1]。心肌肥厚表现为心肌细胞蛋白质合成增多,胚胎基因激活,心肌细胞能量代谢的改变,兴奋收缩偶联改变,心肌细胞氧化应激增多,凋亡增多[2]。目前对心肌肥厚的治疗主要以β受体阻滞剂、血管紧张素转化酶抑制剂、钙拮抗剂为主[3]。然而近十年来,上述药物并未减少日益增多的心衰患病率和病死率[4],因此寻找新的治疗措施迫在眉睫。
热休克蛋白22(heat shock protein, Hsp22)/H11激酶是一种应激诱导蛋白,其响应于各种心肌应激条件,包括缺血、缺氧。研究表明,Hsp22通过调控线粒体氧化磷酸化保护哺乳动物心脏急性缺血-再灌注损伤[5-7]。Hsp22通过激活PI3K/AKT信号促进心脏生长和心肌细胞的存活[8]。上述研究均提示Hsp22的心脏保护作用,然而Hsp22是否能够减缓苯肾上腺素(phenylephrine, PE)诱导的心肌肥大反应尚无报道。本研究建立PE诱导的心肌细胞肥大模型,探讨Hsp22的抗心肌肥大作用和机制。
1 材料与方法 1.1 实验材料重组人Hsp22蛋白(ab119152)(Abcam公司,美国)一抗:磷酸化(P-)和总的(T-)AMP活化蛋白激酶α(AMPKα)抗体,蛋白激酶B(AKT)抗体,哺乳动物雷帕霉素靶点(mTOR)抗体(CST公司,美国);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(Santa Cruz公司,美国)。PE(Sigma公司,美国)。TUNEL试剂盒(Millipore公司,德国)。反转录试剂盒(罗氏公司,德国)。
1.2 原代大鼠心肌细胞培养取1~3 d的新生大鼠乳鼠[购买于湖北省实验动物研究中心SCXK(鄂)2018-0018],剪出心脏,去除心房部分,用剪刀将心脏剪成1~2 mm3的碎片,用0.125 %的胰酶消化心脏碎片10 min,5次,收集消化下来的细胞悬液,1 500 r/min离心10 min,去除上清液,用含15%的胎牛血清的DMEM-F12重悬细胞,过滤后采用差时贴壁法去除成纤维细胞,用溴脱氧尿苷抑制成纤维细胞生长。将心肌细胞种于六孔板内,48 h换液刺激。
1.3 细胞分组与处理为探讨Hsp22对心肌细胞肥大的影响,将培养的心肌细胞随机分为4组。对照组加与模型组相同体积的PBS;模型组用50 μmol/L PE刺激心肌细胞48 h;PE+1 μg/mL Hsp22组的心肌细胞同时给PE(50 μmol/L)和1 μg/mL Hsp22孵育48 h;PE+10 μg/mL Hsp22组的心肌细胞同时给予PE(50 μmol/L)和10 μg/mL Hsp22孵育48 h。
1.4 MTT细胞活性检测将细胞种于96孔板,PE刺激后用PBS清洗3次,采用MTT法(碧云天公司,上海)每孔10 μL孵育30 min,加入DMSO 150 μL震荡15 min,在酶标仪(美国LI-COR公司)下读取450处的吸光度,以对照组作为基线,计算每组细胞的活性。
1.5 α-肌球蛋白(α-actin)免疫荧光染色细胞爬片处理后用4%多聚甲醛进行固定,0.2% TritonX通透后用8%羊血清封闭1 h,α-actin一抗(Abcam公司,美国)孵育4育过夜,二抗孵育1 h后用DAPI(Invitrogen公司,美国)染细胞核后封片,显微镜(Olympus公司,日本)下观察。
1.6 ROS检测细胞种于96或24孔板,PE刺激处理后用PBS清洗3次,采用DCFH-DA荧光探针(碧云天公司,上海)染色孵育细胞30 min,PBS清洗3次后采用酶标仪(美国LI-COR公司)检测激发波长535 nm,发射波长610 nm荧光强度。
1.7 细胞凋亡检测采用原位末端转移酶标记技术(TUNEL)染色法检测细胞凋亡。细胞种于24孔板,刺激后用PBS清洗3次,1%多聚甲醛固定,乙醇:乙酸=2:1混合液后固定,PBS清洗后用TdT酶孵育1 h,滴加抗地高辛标记的荧光素二抗孵育30 min。DAPI孵育染色细胞核后在荧光显微镜下拍照。
1.8 反转录-聚合酶链反应(RT-PCR)检测mRNA表达量TRIzol(Invitrogen, 15596-026)提取细胞的总RNA,反转录试剂盒(Roche,04896866001)将每组2 mg的总RNA反转录为cDNA。利用LightCycler 480 SYBR Green荧光定量PCR仪(罗氏公司,德国)进行PCR反应。每个样品设3个复管。并用将其结果与GAPDH基因的表达进行对比。
1.9 蛋白免疫印迹收集处理结束后的细胞,将各组细胞用裂解缓冲液裂解后,离心后取上清液,采用比色法测定蛋白浓度。将组织裂解产物使用10% SDS-PAGE胶进行分离,然后转移到PVDF膜上,再使用5 %脱脂牛奶封闭2 h。4脂孵育一抗过夜。37℃孵育二抗1 h,使用双色红外成像系统进行扫膜分析(美国LI-COR公司)。采用Quantity One软件计算分析各蛋白条带和对应的内参蛋白(GAPDH)条带的灰度。
1.10 统计学方法使用SPSS 13.0进行统计分析。计量资料以均数±标准差(Mean±SD)表示。所有数据均使用单因素方差分析检测各组间差异;组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
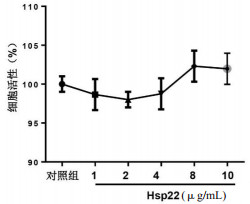
2 结果 2.1 Hsp22对原代大鼠心肌细胞活性的影响给予不同浓度的Hsp22(1、2、4、8、10 μg/mL)处理心肌细胞48 h,MMT实验发现上述浓度Hsp22并未影响心肌细胞活性[对照组(100±1.14)%;1 μg/mL组(98.65±1.32)%;2 μg/mL组(98.12±1.35)%;4 μg/mL组(98.76±2.43)%;8 μg/mL组(102.43±2.12)%;10 μg/mL组(101.98±2.54)%;F=6.622,P > 0.05](图 1)。取1 μg/mL和10 μg/mL Hsp22进行下一步实验。
|
| 图 1 Hsp22对原代大鼠心肌细胞活性的影响 Fig 1 The effect of Hsp22 on cell viability of cardiomyocytes |
|
|
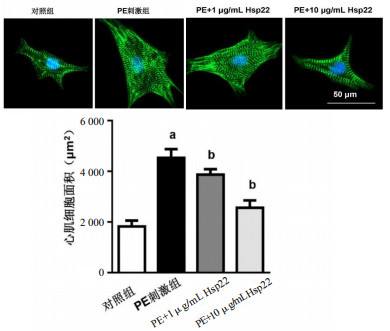
PE刺激心肌细胞48 h,同时给予两种浓度的Hsp22(1、10 μg/mL)处理。α-actin免疫荧光染色结果发现,与对照组比较,PE刺激后心肌细胞面积(μm2)明显增大(4 532±342 vs 1 823±243;t=16.01,P < 0.05);与PE刺激组比较,1和10μg/mL的Hsp22均能减小心肌细胞面积(μm2)(3 872±212和2 563±287,t=4.018,P < 0.05;t=10.80,P < 0.05),见图 2。
|
| α-actin染色,×400,绿色荧光,细胞核为蓝色荧光;与对照组比较,aP < 0.05;与PE刺激组比较,bP < 0.05 图 2 Hsp22对原代大鼠心肌细胞肥大的影响 Fig 2 The effect of Hsp22 on cardiomyocytes hypertrophy |
|
|
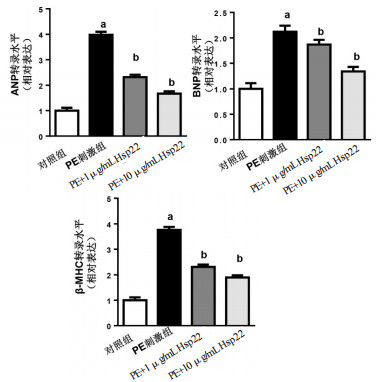
PE刺激心肌细胞48 h,同时给予两种浓度的Hsp22(1、10 μg/mL)处理。RT-PCR结果发现,PE刺激后心肌细胞肥厚相关基因心房利钠肽(ANP)(3.98±0.12 vs 1.00±0.13,t=44.84,P < 0.05)、B型利钠肽(BNP)(2.12±0.14 vs 1.00±0.17,t=16.85,P < 0.05),β肌球蛋白重链(β-MHC)(3.76±0.15 vs 1±0.12,t=41.53,P < 0.05)的转录水平明显升高。
与PE刺激组相比,1和10μg/mL的Hsp22均能降低ANP(2.32±0.09和1.67±0.08,t=27.12,P < 0.05;t=37.72,P < 0.05),BNP(1.87±0.09和1.34±0.08,t=4. 82,P < 0.05;t=12.74,P < 0.05)和β-MHC(2.31±0.10和1.89±0.09,t=23.68,P < 0.05;t=30.54,P < 0.05)的转录水平,见图 3。
|
| 与对照组比较,aP < 0.05;与PE刺激组比较,bP < 0.05 图 3 Hsp22对心肌肥厚标志物转录的影响 Fig 3 The effect of Hsp22 on the transcription level of hypertrophic markers in cardiomyocytes |
|
|
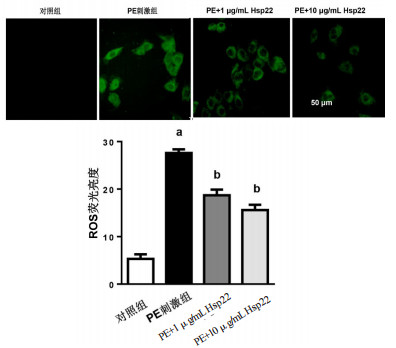
氧化应激在心肌肥厚中发挥重要作用。ROS检测发现,与对照组比较,PE刺激48 h后心肌细胞ROS水平升高明显(27.61±0.82 vs 5.3±1.2,t=43.61,P < 0.05)。
与PE刺激组比较,1和10μg/mL的Hsp22降低ROS的水平(18.7±1.8和15.6±1.1,t=15.23,P < 0.05;t=21.80,P < 0.05),见图 4。
|
| DCFH-DA荧光标记ROS水平(×200,绿色荧光);与对照组比较,aP < 0.05;与PE刺激组比较,bP < 0.05 图 4 Hsp22对心肌细胞氧化应激的影响 Fig 4 The effect of Hsp22 on oxidative stress in cardiomyocytes |
|
|
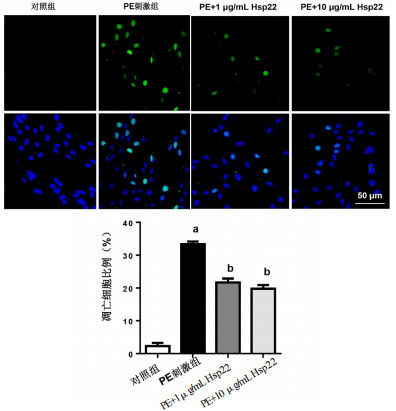
细胞凋亡在PE诱导的心肌肥厚中发挥关键作用。TUNEL染色发现,与对照组比较,PE刺激48 h后心肌细胞凋亡数量明显增多[(33.4±1.1)% vs(2.3±1.2)%,t=60.82,P < 0.05]。
与PE刺激组相比,1和10μg/mL的Hsp22降低心肌细胞凋亡数量[(21.7±1.2)%和(19.8±1.6)%,t=20.02,P < 0.05;t=24.70,P < 0.05],见图 5。
|
| TUNEL染色阳性细胞(×200,绿色荧光);细胞核为蓝色荧光;与对照组比较,aP < 0.05;与PE刺激组比较,bP < 0.05 图 5 Hsp22对心肌细胞凋亡的影响 Fig 5 The effect of Hsp22 on cell apoptosis in cardiomyocytes |
|
|
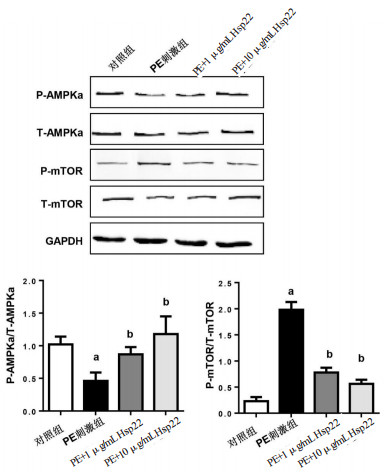
为探讨Hsp22影响心肌细胞肥大反应的机制,本研究检测了AMPKα信号通路,免疫印迹结果显示,与对照组比较,PE刺激后心肌细胞AMPKα活化明显减少(0.46±0.13 vs 1.02±0.12,t=7.75,P < 0.05),其下游分子mTOR的磷酸化增加(1.98±0.15 vs 0.23±0.08,t=25.22,P < 0.05),见图 6。
|
| 与对照组比较,aP < 0.05;与PE刺激组比较,bP < 0.05 图 6 Hsp22对AMPKα信号通路的影响 Fig 6 The effect of Hsp22 on AMPKα signaling in cardiomyocytes |
|
|
与PE刺激组比较,而1和10μg/mL的Hsp22均能增加AMPKα的磷酸化水平(0.87±0.11和1.18±0.27,t=5.89,P < 0.05;t=5.88,P < 0.05);其下游分子mTOR的磷酸化水平减少(0.78±0.09和0.56±0.08,t=16.80,P < 0.05;t=20.46,P < 0.05),见图 6。
3 讨论心肌肥厚指由一系列复杂的分子机制导致的心脏形态、结构和功能的改变,包括心脏重量增加、心肌间质细胞增殖、心肌细胞外基质改建、心肌细胞体积变大以及胚胎基因表达增加[9]。在多种心血管疾病早期,代偿性的心肌肥厚可使心脏做功增加,然而持续存在的心肌肥厚则逐渐发展为失代偿,最终导致不可逆转的心力衰竭[10]。据证实,心肌肥厚一旦发展成为心力衰竭,就难以用目前的治疗手段逆转恶化的心功能[11-12]。近年来,尽管心肌肥厚的发生机制已取得重要进展,但是临床上尚无十分有效的防治方法,心力衰竭的发病率和病死率仍居高不下[3]。本研究发现单纯给予Hsp22刺激对心肌细胞的活性并未产生不良影响,而不同浓度的Hsp22能够有效减缓PE诱导的心肌细胞肥大,减少胚胎基因的转录,提示Hsp22可能成为新的治疗靶点。以往研究发现Hsp22过表达,能够促进小鼠心肌细胞肥大性生长,增加蛋白酶体的活性[13]。然而本研究与该研究结果相反,外源性的Hsp22体外处理能够抑制PE诱导的心肌肥厚,这可能与Hsp22的来源有关,不同的Hsp22来源可能其在分子结构上存在差异,造成了功能上的异常;此外,外源性Hsp22可能作用于心肌细胞膜受体,刺激了不同的信号通路,导致相反的结果。
作为氧耗最高的器官之一,心脏的氧气供应和消耗之间保持着良好的平衡,而在多种病理刺激下,活性氧的产生超过抗氧化防御系统,则出现氧化应激[14]。氧化应激在高血压、心肌肥厚、心衰的发展中发挥着至关重要的作用。氧化应激造成多种细胞大分子功能障碍,包括许多重要的心肌蛋白,膜脂质,特别是线粒体心磷脂,最终导致心肌细胞死亡[15]。ROS还可以激活肥大信号,如酪氨酸激酶Src、GTP结合蛋白ras、蛋白激酶C、MAPK,NF-κB酶和缺氧诱导因子1,促进心肌肥厚的发展[16]。本研究发现Hsp22处理组能够抑制PE诱导的心肌细胞氧化应激,从而减少细胞凋亡,减轻细胞肥大反应。
AMPK是细胞能量的中心传感器,是调节心肌细胞能量代谢的重要分子[9]。近期研究表明AMPK还参与心肌肥厚的调控,AMPK激活后抑制其下游的mTOR分子,后者可通过调控真核起始因子和核糖体蛋白的激活促进蛋白质合成和细胞肥厚性生长[17]。目前,多种研究证实通过激活AMPKα可以抑制心肌肥厚的发展[3, 17]。本研究发现Hsp22能够增加AMPKα的激活,抑制mTOR的磷酸化,从而发挥抑制心肌肥厚的作用。
综上所述,Hsp22通过激活AMPKα抑制PE诱导的心肌细胞肥大反应,抑制氧化应激,减少细胞凋亡。Hsp22可能成为治疗心肌肥厚的新药物。
| [1] | Shimizu I, Minamino T. Physiological and pathological cardiac hypertrophy[J]. J Mol Cell Cardiol, 2016, 97: 245-262. DOI:10.1016/j.yjmcc.2016.06.001 |
| [2] | Wang J, Liew OW, Richards AM, et al. Overview of microRNAs in cardiac hypertrophy, fibrosis, and apoptosis[J]. Int J Mol Sci, 2016, 17(5): pii:E749. DOI:10.3390/ijms17050749 |
| [3] | Wu QQ, Xiao Y, Yuan Y, et al. Mechanisms contributing to cardiac remodelling[J]. Clin Sci, 2017, 131(18): 2319-2345. DOI:10.1042/cs20171167 |
| [4] | Xie WQ, Zhou L, Chen Y, et al. Circulating microRNAs as potential biomarkers for diagnosis of congenital heart defects[J]. World J Emerg Med, 2016, 7(2): 85-89. DOI:10.5847/wjem.j.1920-8642.2016.02.001 |
| [5] | Laure L, Long R, Lizano P, et al. Cardiac H11 kinase/Hsp22 stimulates oxidative phosphorylation and modulates mitochondrial reactive oxygen species production:Involvement of a nitric oxide-dependent mechanism[J]. Free Radic Biol Med, 2012, 52(11/12): 2168-2176. DOI:10.1016/j.freeradbiomed.2012.03.001 |
| [6] | Rashed E, Lizano P, Dai HC, et al. Heat shock protein 22 (Hsp22) regulates oxidative phosphorylation upon its mitochondrial translocation with the inducible nitric oxide synthase in mammalian heart[J]. PLoS One, 2015, 10(3): e0119537. DOI:10.1371/journal.pone.0119537 |
| [7] | Chen L, Lizano P, Zhao X, et al. Preemptive conditioning of the swine heart by H11 kinase/Hsp22 provides cardiac protection through inducible nitric oxide synthase[J]. Am J Physiol Heart Circ Physiol, 2011, 300(4): H1303-1310. DOI:10.1152/ajpheart.00979.2010 |
| [8] | Sui XZ, Li D, Qiu HY, et al. Activation of the bone morphogenetic protein receptor by H11kinase/Hsp22 promotes cardiac cell growth and survival[J]. Circ Res, 2009, 104(7): 887-895. DOI:10.1161/CIRCRESAHA.108.192328 |
| [9] | Tuomainen T, Tavi P. The role of cardiac energy metabolism in cardiac hypertrophy and failure[J]. Exp Cell Res, 2017, 360(1): 12-18. DOI:10.1016/j.yexcr.2017.03.052 |
| [10] | di Tarso Fernandes Facundo H, Brainard RE, de Lemos Caldas FR, et al. Mitochondria and cardiac hypertrophy[M]//di Tarso Fernandes Facundo H, Brainard RE, de Lemos Caldas FR, et al. eds. Advances in experimental medicine and biology. Cham: Springer International Publishing, 2017: 203-226. DOI: 10.1007/978-3-319-55330-6_11. |
| [11] | Samak M, Fatullayev J, Sabashnikov A, et al. Cardiac hypertrophy:an introduction to molecular and cellular basis[J]. Med Sci Monit Basic Res, 2016, 22: 75-79. DOI:10.12659/msmbr.900437 |
| [12] | Wang GN, Chen XF, Zhang G, et al. A case of thyroid emergency with cardiac arrest supported by extracorporeal membrane oxygenation[J]. World J Emerg Med, 2018, 9(4): 288-290. DOI:10.5847/wjem.j.1920-8642.2018.04.009 |
| [13] | Hedhli N, Wang L, Wang Q, et al. Proteasome activation during cardiac hypertrophy by the chaperone H11 Kinase/Hsp22[J]. Cardiovasc Res, 2007, 77(3): 497-505. DOI:10.1093/cvr/cvm054 |
| [14] | Sag CM, Santos CX, Shah AM. Redox regulation of cardiac hypertrophy[J]. J Mol Cell Cardiol, 2014, 73: 103-111. DOI:10.1016/j.yjmcc.2014.02.002 |
| [15] | Mitra A, Datta R, Rana S, et al. Modulation of NFKB1/p50 by ROS leads to impaired ATP production during MI compared to cardiac hypertrophy[J]. J Cell Biochem, 2018, 119(2): 1575-1590. DOI:10.1002/jcb.26318 |
| [16] | Mushtaq S, Ali T, Javed Q, et al. N-acetyl cysteine inhibits endothelin-1-induced ros dependent cardiac hypertrophy through superoxide dismutase regulation[J]. Cell J, 2015, 17(2): 355-360. DOI:10.22074/cellj.2016.3746 |
| [17] | Wang B, Zeng HS, Wen Z, et al. CYP2J2 and its metabolites (epoxyeicosatrienoic acids) attenuate cardiac hypertrophy by activating AMPKalpha2 and enhancing nuclear translocation of Akt1[J]. Aging Cell, 2016, 15(5): 940-952. DOI:10.1111/acel.12507 |
 2019, Vol. 28
2019, Vol. 28




