创伤性脑损伤(traumatic brain injury,TBI)是一种因外力所致的神经系统疾病,具有发病率、致残率高等特点[1-2]。创伤性脑损伤的损伤机制较为复杂,其中有因外力作用造成的损伤,如脑挫裂伤,脑震荡等;还有受伤之后逐渐出现其他损伤,如细胞凋亡、神经毒性、氧化应激等[3-6]。积极处理和预防这些损伤是脑外伤临床治疗的重要策略。其中脑创伤所诱导的氧化应激反应是一种重要的病理损伤途径,当发生创伤性脑损伤后,脑组织自由基过量蓄积从而破坏细胞生物膜[7-8],进而导致机体功能紊乱加重损伤。因此,脑创伤后抑制氧化应激反应是一种有效阻止疾病进展的方法。核因子相关因子2(nuclear factor related factor 2,Nrf2)是一个公认的保护因子。正常情况下,Nrf2与胞质蛋白伴侣分子(kelch-like ECH associated1 protein, Keap1)结合,处于相对失活抑制状态,其可以在创伤、感染以及其他应激状态的刺激下被激活,Nrf2与Keap 1解偶联,启动ARE调控的保护性因子的表达,提高细胞对各种刺激的抵抗力[4]。有研究显示,当Nrf2被激活后其表达量增高,下游的保护性因子转录被启动,从而提高细胞的抗氧化能力实现保护细胞作用。有文献指出,小鼠脑创伤后,脑组织中Nrf2蛋白的表达增加,抗氧化因子被激活,抑制氧化应激反应,从而实现对小鼠脑神经保护的作用[9-10]。因此,Nrf2蛋白在脑创伤的修复过程中起着重要的作用,调节Nrf2蛋白的表达可以改善脑创伤后的预后。
依达拉奉(edaravone,EDA)是一种自由基清除剂,具有较强的抗氧化应激能力[11],基于其较好的清除自由基、抑制脂质过氧化的能力,常被用于治疗脑梗死,但很少有报道显示其在脑创伤中有保护作用。先前文献显示,EDA通过激活Nrf2通路实现抗氧化应激保护作用[12]。但目前EDA是否可以通过调节创伤性脑损伤后脑组织中Nrf2蛋白的表达仍不是十分清楚,因此,在本研究中,笔者通过建立小鼠控制性脑皮质撞击模型,探讨EDA对小鼠创伤性脑损伤后的氧化应激反应的影响以及其可能机制。
1 材料与方法 1.1 主要试剂与仪器抗小鼠3-NT、Nrf2、H3抗体(美国abcam公司),抗小鼠β-actin抗体、抗小鼠二抗(杭州联科生物公司),依达拉奉(江苏先声制药集团),小鼠立体定位打击器(美国RWD Life Science公司),光学显微镜(日本Nikon公司)。
1.2 实验动物及分组90只雄性C57BL/6N小鼠,体质量为20~25 g,购于南京大学生物医药研究院,于温州医科大学动物实验中心分笼饲养,保持合适的条件,自由饮水和饮食。饲养观察7 d后,将小鼠随机(随机数字法)分为假手术组(Sham)、模型组(TBI)、给药组(TBI+EDA)各组30只。
1.3 实验动物模型建立实验前12 h常规禁食, 先将小鼠用4%水合氯醛(10 mL/kg)腹腔内注射麻醉,然后固定于脑立体定位仪上,保持合适的体位(图 1),使打击器平面与小鼠颅骨平面垂直,为了保持损伤程度稳定性,设定打击速度为4 m/s,打击深度为1 mm,打击结束后立即予以注射药物,每只小鼠给药组予以EDA(3 mg/kg,腹腔注射);假手术组只开骨窗不打击,造模结束之后,缝合切口,将小鼠置于热板复温待其苏醒后将其置于鼠笼饲养,分别给药24 h后和连续给药(每隔24 h一次)7 d后予以取脑组织进行检测。

|
| 图 1 小鼠创伤性脑损伤模型打击照片 |
|
|
使用神经功能缺损评分(NSS)[13]评估每组小鼠神经功能。每只小鼠在TBI后24 h测试神经功能情况,总分为10分,包括感觉、运动、生理反射和平衡能力测试,完全正常为0分,以上测试采用双人双盲法。
1.5 HE染色小鼠脑损伤给药治疗7 d后,予以水合氯醛腹腔注射麻醉,经过多聚甲醛灌注取脑,常规脱水、石蜡包埋、切片(5 mm)等过程后,将脑组织切片置于二甲苯中脱蜡10 min,共3次,然后无水乙醇浸泡,冲洗,苏木精-伊红染色,冲洗后,梯度酒精浸泡,二甲苯透明2次,每次5 min。最后用中性树胶或其他封片剂封片,显微镜下观察。
1.6 免疫荧光染色将小鼠撞击损伤24 h后的脑组织石蜡包埋切片,然后脑组织切片常规经过烘片,反复脱蜡,梯度酒精浸泡等一系列过程后,放入5%BSA中封闭,接着滴加一抗于4 ℃冰箱过夜,次日冲洗干净后,滴加二抗,再次冲洗,最后封片,镜检。每张片随机选择10个视野,观测各组免疫染色阳性细胞。
1.7 Western blot检测小鼠术后24 h,取小鼠脑皮质部位组织,将其匀浆、离心(12 000 r,10 min)后,取上清液移至EP管测定蛋白浓度,然后经过电泳、转膜等过程后,孵育一抗,最后将膜放入4℃摇床过夜,次日滴加二抗(1:10 000),最后于凝胶成像仪器中曝光。
1.8 试剂盒检测MDA根据试剂盒(中国碧云天生物技术研究所)说明书操作,先将各组术后24 h的小鼠处死,取脑皮质组织,经过裂解、匀浆离心(1 600 g/10 min)后,取上清液测定蛋白浓度,接着配制TBA储存液和MDA检测工作液,设置空白对照组,制作标准曲线,然后将样品加入MDA检测工作液混匀后,沸水浴加热15 min,水浴冷却至室温,离心机离心(1 000 g,10 min),取200 μL上清液加入到96孔板中,随后用酶标仪在532 nm测定吸光度,根据标准曲线计算MDA含量,每个样本同样的实验最少重复3次。
1.9 实时荧光定量聚合酶链反应(RT-qPCR)运用试剂盒提取组织样本总RNA,然后反转录成cDNA,最后进行RT-qPCR扩增。PCR引物如下:Nrf2,正向序列TTTTCCATTCCCGAATTACAGT,反向序列:AGGAGATCGATGAGTAAAAATGGT。
1.10 统计学方法采用SPSS 19.0统计软件进行统计学处理分析,数据以均数±标准差(Mean±SD)表示。多组间比较用单因素方差(ANOVA)分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
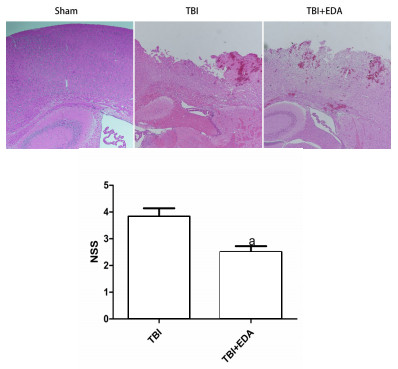
2 结果 2.1 EDA治疗可以改善小鼠创伤性脑损伤后神经功能缺损情况小鼠造模结束24 h后,采用双盲法对小鼠进行神经功能评估,NSS评分结果显示,与TBI组相比较,给药组评分明显下降。为进一步验证EDA在小鼠脑创伤后的保护作用,本研究对脑创伤后连续药物治疗7 d的小鼠脑组织进行HE染色,发现同样条件下,EDA治疗组小鼠脑组织的损伤面积较TBI组要减小,见图 2。
|
| 与TBI组比较,aP < 0.05 图 2 A:小鼠脑创伤后7 d各组大脑皮质HE染色结果;B:NSS神经评分结果 |
|
|
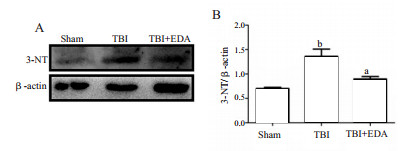
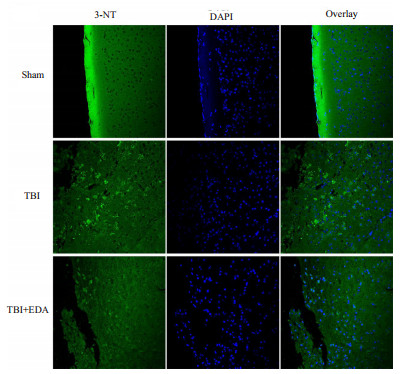
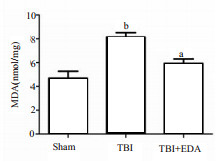
为了衡量小鼠脑创伤诱导的氧化应激反应中所产生的活性氮,在小鼠脑损伤后24 h,采用Western blot法检测3-硝基酪氨酸(3-NT),与Sham组比较,TBI组3-NT蛋白有所升高(P < 0.05),而给药组3-NT较TBI组有所下降(P < 0.05)(图 3)。为进一步验证EDA的治疗作用,本研究采用免疫荧光染色法检测3-NT的表达,结果与Western Blot一致,EDA治疗可以减低3-NT的表达(图 4)。同时本研究还检测了组织MDA的含量,与预计结果一致,TBI组MDA表达与Sham组比较明显升高(P < 0.01),而给药组与TBI组比较MDA有所下降(P < 0.05)(图 5)。
|
| A:3-NT的显影图像;B:3-NT与内参蛋白β-actin的比值;与TBI组比较,aP < 0.05;与sham组比较,bP < 0.01 图 3 EDA对小鼠脑创伤后3-NT蛋白表达的影响 |
|
|
|
| 图 4 小鼠脑创伤后不同组3-NT的免疫荧光染色结果 |
|
|
|
| 与TBI组比较,aP < 0.05;与sham组比较,bP < 0.01 图 5 小鼠脑创伤后脑组织中的MDA的表达量 |
|
|
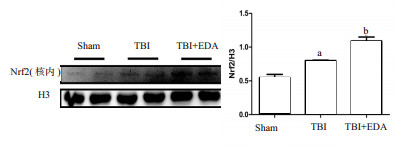
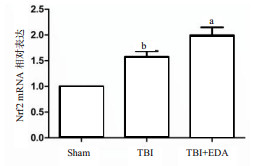
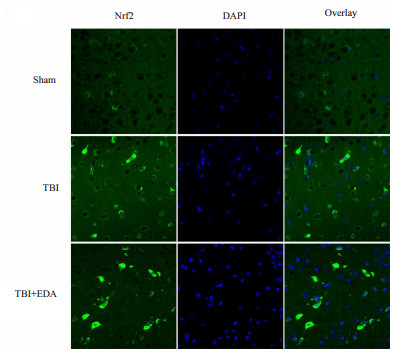
小鼠脑创伤24 h后,采用Western blot法检测皮质脑组织细胞核内Nrf2蛋白的表达量,TBI组Nrf2蛋白的表达量高于Sham组,而EDA治疗组与TBI组对比Nrf2蛋白的表达量更高,差异均有统计学意义,见图 6。为了进一步验证这个发现,本研究采用RT-qPCR检测Nrf2 mRNA的转录情况,结果同样显示,TBI组的Nrf2基因水平较Sham组比较有所升高(P < 0.05),而给药组和TBI组比较表达水平更高(P < 0.05),见图 7。为了更加直观地观察EDA的作用,采用免疫荧光法观察Nrf2蛋白的表达情况,如图 8所示,TBI组与Sham组比较,可见Nrf2蛋白入核表达增多,而EDA组与TBI组比较,Nrf2蛋白入核表达更加明显。
|
| A:Nrf2的显影图像;B:Nrf2与内参蛋白H3的比值;与sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 6 EDA对小鼠脑创伤后Nrf2蛋白表达的影响 |
|
|
|
| 与TBI组比较,aP < 0.05;与sham组比较,bP < 0.01 图 7 实时荧光定量PCR检测小鼠脑创伤后24 h脑组织中的Nrf2的表达量 |
|
|
|
| 图 8 小鼠脑创伤后不同组中Nrf2蛋白的免疫荧光染色结果 |
|
|
随着现代交通工具的普及,脑创伤的发生率也是逐年增加,因其具有较高的致残致死率,给社会带来严重的负担。虽然临床上对于TBI治疗的药物以及干预的方式越来越多,治疗的流程也越来越成熟,但是目前对于继发性脑损伤的治疗效果仍然不是十分满意。因此,对于脑创伤治疗手段仍需要进一步的研究。控制脑外伤的损伤机制是目前临床上治疗脑创伤的主要方法。先前较多的研究表明,小鼠脑创伤后会诱导脑组织出现氧化应激反应,产生过量的自由基,破坏神经细胞,导致神经细胞损伤甚至死亡[13-14],而较少有文献报道某种药物或者治疗手段对脑创伤后的氧化应激反应有良好的效果。EDA是一种公认的自由基清除剂,被广泛用于治疗脑梗死,疗效肯定。有研究表明,在小鼠脑缺血-再灌注损伤模型,EDA通过抑制氧化应激从而实现保护作用[15]。而脑创伤绝大多数是由外力所致,这有异于脑缺血的致病因素,其对药物反应也有可能不同。因此,本研究分析EDA在小鼠创伤性脑损伤后的保护作用,发现在小鼠脑创伤后,与TBI组对比,EDA治疗有减轻氧化应激和神经缺损程度的作用。
Nrf2是体内最重要的抗氧化应激因子之一,当其被激活,表达量增高时,其下游的相关基因,如依赖还原型辅酶/Ⅱ醌氧化还原酶1(NADPH: quinineoxidoreductase,NQO1)和血红素氧合酶(HO-1)抗氧化因子转录表达也增多,从而对各种代谢以及损伤引起的氧化应激反应具有保护作用。研究表明,提高Nrf2的表达量可以减轻氧化应激反应。亦有研究指出,将小鼠Nrf2基因敲除后,小鼠对氧化应激应激所诱导的损伤极为敏感[16]。此外,有文献报道,在小鼠损伤模型,EDA治疗可以增加Nrf2蛋白的表达来抑制氧化应激反应,从而减少损伤[15]。而且,还有研究显示EDA有缓解小鼠创伤性脑损伤引起的脑水肿的作用[17]。基于以上研究,笔者推测EDA对脑创伤性脑损伤的保护作用可能是通过调节Nrf2蛋白的表达来实现的。本研究结果显示在小鼠脑创伤模型中,EDA治疗可以上调脑组织的Nrf2的表达。
本实验也存在诸多的不足之处,比如EDA治疗组应该设置不同的剂量,为EDA的临床应用提供更多的选择。此外应该设置Nrf2蛋白的抑制剂,增加细胞实验来进一步验证EDA的作用,这些仍需继续完善。
综上所述,本研究通过建立小鼠创伤性脑损伤的模型,使用EDA治疗小鼠创伤性脑损伤,发现EDA可能通过抑制TBI诱导的氧化应激反应作用从而实现保护作用,其机制很可能是通过调节Nrf2蛋白来实现的。
| [1] | Ma EL, Smith AD, Desai N, et al. Bidirectional brain-gut interactions and chronic pathological changes after traumatic brain injury in mice[J]. Brain Behav Immun, 2017, 66: 56-69. DOI:10.1016/j.bbi.2017.06.018 |
| [2] | Kou K, Hou XY, Sun JD, et al. Current pre-hospital traumatic brain injury management in China[J]. World J Emerg Med, 2014, 5(4): 245-254. DOI:10.5847/wjem.j.issn.1920-8642.2014.04.001 |
| [3] | Wang D, Liu Y, Zhao YR, et al. Low dose of lipopolysaccharide pretreatment can alleviate the inflammatory response in wound infection mouse model[J]. Chin J Traumatol, 2016, 19(4): 193-198. DOI:10.1016/j.cjtee.2016.06.001 |
| [4] | 周圆圆, 张泓. Nrf2-ARE信号通路在神经系统中的研究进展[J]. 中华急诊医学杂志, 2012, 21(4): 444-446. DOI:10.3760/cma.j.issn.1671-0282.2012.04.031 |
| [5] | 程田, 刘雯雯, 马珊珊, 等. 沃顿胶对小鼠脑损伤后炎症和情绪的影响[J]. 中华急诊医学杂志, 2018, 27(7): 779-784. DOI:10.3760/cma.j.issn.167l-0282.2018.07.014 |
| [6] | 魏冠, 林清江, 陈炳基, 等. 丙戊酸抑制大鼠创伤性颅脑损伤后炎症反应[J]. 中华急诊医学杂志, 2017, 26(3): 313-317. DOI:10.3760/cma.j.issn.16710282.2017.03.015 |
| [7] | Krishna G, Agrawal R, Zhuang YM, et al. 7, 8-Dihydroxyflavone facilitates the action exercise to restore plasticity and functionality:Implications for early brain trauma recovery[J]. Biochim Biophys Acta, 2017, 1863(6): 1204-1213. DOI:10.1016/j.bbadis.2017.03.007 |
| [8] | Shan PR, Xu WW, Huang ZQ, et al. Protective role of retinoid X receptor in H9c2 cardiomyocytes from hypoxia/reoxygenation injury in rats[J]. World J Emerg Med, 2014, 5(2): 123-127. DOI:10.5847/wjem.j.issn.1920-8642.2014.02.008 |
| [9] | Liu ZW, Wang HD, Shi XF, et al. Dl-3-n-butylphthalide (NBP) provides neuroprotection in the mice models after traumatic brain injury via nrf2-ARE signaling pathway[J]. Neurochem Res, 2017, 42(5): 1375-1386. DOI:10.1007/s11064-017-2186-z |
| [10] | 危静, 吴建跃, 方蓉, 等. Nrf2/ARE信号系统在黄体酮对急性脑创伤多效神经保护中的作用[J]. 中华急诊医学杂志, 2016, 25(12): 1255-1259. DOI:10.3760/cma.j.issn.1671-0282.2016.12.009 |
| [11] | Tian AY, Ma H, Zhang RW, et al. Edaravone improves spatial memory and modulates endoplasmic reticulum stress-mediated apoptosis after abdominal surgery in mice[J]. Exp Ther Med, 2017, 14(1): 355-360. DOI:10.3892/etm.2017.4489 |
| [12] | Li YW, Liu HF, Zeng W, et al. Edaravone protects against hyperosmolarity-induced oxidative stress and apoptosis in primary human corneal epithelial cells[J]. PLoS One, 2017, 12(3): e0174437. DOI:10.1371/journal.pone.0174437 |
| [13] | Choi YK, Maki T, Mandeville ET, et al. Dual effects of carbon monoxide on pericytes and neurogenesis in traumatic brain injury[J]. Nat Med, 2016, 22(11): 1335-1341. DOI:10.1038/nm.4188 |
| [14] | Liu Y, Bao Z, Xu X, et al. Extracellular signal-regulated kinase/nuclear factor-erythroid2-like2/heme oxygenase-1 pathway-mediated mitophagy alleviates traumatic brain injury-induced intestinal mucosa damage and epithelial barrier dysfunction[J]. J Neurotrauma, 2017, 34(13): 2119-2131. DOI:10.1089/neu.2016.4764 |
| [15] | Fujiwara N, Som AT, Pham LD, et al. A free radical scavenger edaravone suppresses systemic inflammatory responses in a rat transient focal ischemia model[J]. Neurosci Lett, 2016, 633: 7-13. DOI:10.1016/j.neulet.2016.08.048 |
| [16] | Lu XY, Wang HD, Xu JG, et al. Deletion of nrf2 exacerbates oxidative stress after traumatic brain injury in mice[J]. Cell Mol Neurobiol, 2015, 35(5): 713-721. DOI:10.1007/s10571-015-0167-9 |
| [17] | Miyamoto K, Ohtaki H, Dohi K, et al. Therapeutic time window for edaravone treatment of traumatic brain injury in mice[J]. Biomed Res Int, 2013, 2013: 1-13. DOI:10.1155/2013/379206 |
 2019, Vol. 28
2019, Vol. 28




