2 浙江大学医学院附属第二医院呼吸科 310009 杭州
肺癌是患病率和病死率最高的恶性肿瘤之一,常首先侵犯胸腔内的肺门及纵隔淋巴结,获取这些淋巴结标本进行病理学检查,对于确立诊断和分期至关重要[1]。非小细胞肺癌分期的手段包括经支气管针吸活检术(transbronchial needle aspiration,TBNA)及纵隔镜手术等[2]。与传统的方法相比,气道内超声实时引导下经支气管针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)术,创伤小,可获得多组纵隔淋巴结标本,具备巨大的优势[3-5]。
超声弹性成像技术(ultrasound elastography,USE)是基于正常生物组织的弹性与病灶之间具有差异这一属性而开发的一种新型成像技术[6]。目前超声弹性成像技术常与造影技术等联合,在甲状腺结节[7],头颈部肿瘤[8]、前列腺癌[9]等领域的应用日趋成熟。支气管内超声弹性成像技术将弹性成像与常规超声结合,进一步提高EBUS-TBNA的准确性[10]。本研究通过气道内超声联合弹性成像技术,以探讨气道内超声弹性成像技术对纵隔及肺门淋巴结肿大的诊断与鉴别诊断的价值。
1 资料与方法 1.1 一般治疗收集从2016年1月至2016年11月在浙江大学医学院附属第二医院内镜中心行超声支气管镜及弹性成像检查,提示肺门纵隔淋巴结肿大,并有明确病理诊断的84例患者纳入研究。其中男性58例、女性26例,年龄21~80岁,排除标准:无明确病理诊断及失访的良性病变患者。所有病例最终均经EBUS-TBNA穿刺组织病理学检查结果确诊,良性病变患者随访6个月。本研究经医院伦理委员会审核通过,所有患者均签署知情同意书。
1.2 检查仪器和方法 1.2.1 检查方法(1) 术前要求禁食至少8 h;(2)麻醉方法:采用全凭静脉麻醉(total intravenous anaesthesia,TIVA),即以瑞芬太尼0.5 mg镇痛,配合咪唑安定10 mg和艾贝宁200 μg镇静,外加口咽通气管,保留自主通气的办法,至睫毛反射消失后行支气管镜检查,术中若烦躁明显可追加剂量至满意[11];(3)经鼻或口腔以常规电子支气管镜(型号1T260)检查;(4)再以超声支气管镜(型号奥林巴斯BF-UC260FW)前端置有探头水囊(型号MAJ-1351)在气管腔内观察淋巴结的位置及大小等;(5)常规超声检查目标淋巴结位置、直径等信息,并在同一层面行弹性成像(典型图像见图 1);(6)确定穿刺淋巴结后,在超声实时引导下,以奥林巴斯穿刺针(型号NA-201SX-4021或NA-201SX-4022)进行穿刺,每个淋巴结部位平均穿刺2-3针,获得满意组织病理为止;(7)获取的组织送检做病理学及细胞学检查。
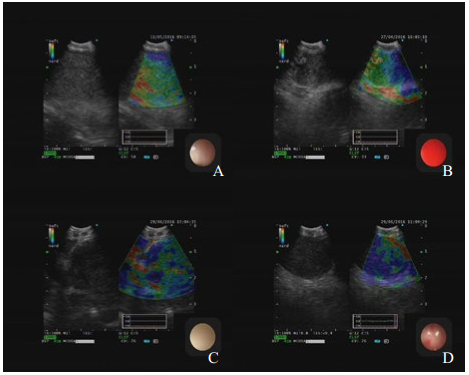
|
| A淋巴结回声中等,边界不清,回声均,大小23.4 mm×20.3 mm,弹性评分1分,EBUS-TBNA病理示结核;B淋巴结回声中等,边界不清,回声不均,大小16.9 mm×25.6 mm,弹性评分2分,EBUS-TBNA病理示结节病,C淋巴结低回声,边界清,回声不均,大小27 mm×36.4 mm,弹性评分3分,EBUS-TBNA病理示腺癌,D淋巴结低回声,边界清,回声均,大小32 mm×37.7 mm,弹性评分4分,EBUS-TBNA病理示小细胞肺癌 图 1 典型淋巴结常规超声及USE图像 |
|
|
通过软件收集弹性成像图片(JPEG图像),使用image-J软件计算出蓝色区域占淋巴结区域比值,进行弹性成像评分。评分标准[12]:①1分:小于20%的切面显示为蓝色;②2分:20%~50%的切面显示蓝色;③3分:50%~80%的切面显示为蓝色;④4分:超过80%的切面显示为蓝色。见图 1。
1.3 统计学方法以SPSS 23.0软件进行数据房内写,χ2检验用于分类变量检验,计量变量以均数±标准差(Mean±SD)表示,行成组t检验。受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)评价气道内超声弹性成像技术的诊断性试验,以P < 0.05为差异有统计学意义。
2 结果84例患者共检出105组淋巴结,病理结果报告良性病变32例,占30.5%,其中非特指肉芽肿性疾病12例(11.4%),淋巴结结核4例(3.8%),淋巴组织16例(15.2%);恶性肿瘤淋巴结转移73例,占69.5%,其中腺癌29例(27.6%),鳞癌21例(20%),腺鳞癌1例(0.95%),大细胞癌3例(2.9%),肺小细胞癌16例(15.2%);黏液表皮样癌1例(0.95%),不确定2例(1.9%)。淋巴结位置:上气管旁(right side of station 2,2R)2组,下气管旁(1eft and right side of station 4,4R/4L)40组,隆突下(subcarinal,7)40组,肺门(1eft and right side of station 10,10R/10L)7组,叶间(1eft and right side of station 11,11R/11L)16组。
恶性淋巴结与良性淋巴结在淋巴结回声、边界、内部回声和短径等方面差异有统计学意义(P < 0.05),见表 1。恶性淋巴结与良性淋巴结超声弹性成像评分差异有统计学意义(χ2=10.238,P < 0.05),见表 2。低回声、边界清楚、内部回声不均匀、短径>10 mm对恶性淋巴结诊断的AUC值分别为0.634、0.624、0.601、0.657,弹性评分≥3分时AUC面积最大,为0.869,见表 3。
| 组别 | 淋巴结回声 | 边界 | 内部回声 | 短径 | |||||||
| 低回声 | 中/高回声 | 清楚 | 模糊 | 均匀 | 不均匀 | > 10 mm | ≤10 mm | ||||
| 恶性淋巴结组(n=73) | 56 | 17 | 50 | 23 | 24 | 49 | 64 | 14 | |||
| 良性淋巴结组(n=32) | 16 | 16 | 14 | 18 | 17 | 15 | 9 | 18 | |||
| χ2值 | 14.486 | 5.038 | 5.038 | 33.152 | |||||||
| P值 | < 0.01 | < 0.05 | < 0.05 | < 0.01 | |||||||
| 方法 | AUC | 敏感度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) | 约登指数(%) |
| 低回声 | 0.634 | 76.7 | 50 | 77.8 | 48.5 | 26.7 |
| 边界清楚 | 0.624 | 68.5 | 56.2 | 78.1 | 43.9 | 24.7 |
| 内部回声不均 | 0.601 | 67.1 | 53.1 | 76.7 | 41.5 | 20.2 |
| 短径 > 10 mm | 0.657 | 87.7 | 43.7 | 87.7 | 56.3 | 31.4 |
| 弹性评分≥3 | 0.869 | 86.7 | 87.5 | 94 | 73.7 | 73.8 |
超声弹性成像技术原理就是对组织施加一个内部或外部的动态或者静态/准静态的激励,使组织内部产生不同程度的应变,弹性系数小的组织显示为红色;弹性系数大的组织显示为蓝色,弹性系数中等的组织显示为绿色,以色彩对不同组织的弹性编码来反映组织硬度。目前这一项技术在甲状腺、前列腺、头颈部肿瘤、乳腺等方面进行了广泛的应用[7-9, 13]。
EBUS-TBNA技术已成为肺癌纵隔分期的新标准,且有逐渐取代外科纵隔镜的趋势[14]。弹性成像技术与气道内超声结合,有望进一步提高阳性率。2014年Izumo研究[15]了气道内超声弹性成像技术对肺门纵隔淋巴结肿大诊断价值,依据弹性成像特征将淋巴结分为三类:Ⅰ型主要是非蓝色,Ⅲ型以蓝色为主,Ⅱ型则介于两者之间。将Ⅰ型视为“良性”、Ⅲ型为“恶性”时,其敏感度、特异度、阳性预测值、阴性预测值和诊断准确性分别为100%、92.3%、0.946、1.00、96.7%。Huang等[16]的研究表明将Ⅰ型判定为良性,Ⅲ型为恶性的灵敏度、特异度、阳性预测值、阴性预测值和诊断的正确率分别是96.43%,86.67%,87.10%,96.30%和91.38%。本研究在84例患者共检出105个肺门纵隔淋巴结,通过统计学分析发现低回声、边界清楚、内部回声不均匀、短径 > 10 mm和弹性评分≥3分对于恶性淋巴结诊断的AUC值分别为0.634、0.624、0.601、0.657和0.869。在弹性成像评分≥3分时AUC面积最大,此时敏感度、特异度、阳性预测值、阴性预测值和约登指数分别为86.7%、87.5%、94%、73.7%和73.8%,与以上相关研究结果相符,表明超声弹性成像技术对鉴别淋巴结的良恶性具有较高的诊断效能。本研究以弹性成像≥3分作为恶性的标准,最后病理证实有4例为良性,即假阳性,其中3例为慢性淋巴结炎性纤维组织增生,1例为结节病,此外,在小于3分为良性的淋巴结中有10例为恶性,即假阴性。出现假阳性的原因可能与这些淋巴结病变中纤维组织增生,导致硬度增加而导致误判。假阴性中与淋巴结病变较小,组织密度等有关,此外,与体表的弹性成像不同的是,气道内超声探头前带有水囊,操作过程中受部位操作者等因素会造成压力不均匀,导致弹性成像无法达到3~4分。
| [1] | Goldstraw P, Rami-Porta R, Asamura H, et al. The IASLC Lung Cancer Staging Project: External Validation of the Revision of the TNM Stage Groupings in the Eighth Edition of the TNM Classification of Lung Cancer[J]. J Thorac Oncol, 2017, 12(7): 1109-1121. DOI:10.1016/j.jtho.2017.04.011 |
| [2] | Silvestri GA, Gonzalez AV, Jantz MA, et al. Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5 Suppl): e211S-e250S. DOI:10.1378/chest.12-2355 |
| [3] | Navani N, Nankivell M, Lawrence DR, et al. Lung cancer diagnosis and staging with endobronchial ultrasound-guided transbronchial needle aspiration compared with conventional approaches: an open-label, pragmatic, randomised controlled trial[J]. Lancet Respir Med, 2015, 3(4): 282-289. DOI:10.1016/S2213-2600(15)00029-6 |
| [4] | Ge X, Guan W, Han F, et al. , Comparison of endobronchial ultrasound-guided fine needle aspiration and video-assisted mediastinoscopy for mediastinal staging of lung cancer[J]. Lung, 2015, 193(5): 757-766. DOI:10.1007/s00408-015-9761-3 |
| [5] | 床旁超声在急危重症临床应用专家共识组. 床旁超声在急危重症临床应用的专家共识[J]. 中华急诊医学杂志, 2016, 25(1): 10-21. DOI:10.3760/cma.j.issn.1671-0282.2016.01.005 |
| [6] | Ophir J, Alam SK, Garra BS, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues[J]. Ultrason Imaging, 1991, 13(2): 111-34. DOI:10.1016/0161-7346(91)90079-w |
| [7] | Xin S, Liu HJ, Jia HL, et al. Contrast-enhanced ultrasound and real-time elastography in the differential diagnosis of malignant and benign thyroid nodules[J]. Exp Ther Med, 2016, 12(2): 783-791. DOI:10.3892/etm.2016.3344 |
| [8] | Bhatia KSS, Lee YYP, Yuen EHY, et al. Ultrasound elastography in the head and neck.Part Ⅰ.Basic principles and practical aspectsk[J]. Cancer Imaging, 2013, 13(2): 253-259. DOI:10.1102/1470-7330.2013.0026 |
| [9] | Correas JM, Tissier AM, Khairoune A, et al. Prostate cancer: diagnostic performance of real-time shear-wave elastography[J]. Radiology, 2015, 275(1): 280-289. DOI:10.1148/radiol.14140567 |
| [10] | Rozman A, Malovrh MM, Adamic K, et al. Endobronchial ultrasound elastography strain ratio for mediastinal lymph node diagnosis[J]. Radiol Oncol, 2015, 49(4): 334-340. DOI:10.1515/raon-2015-0020 |
| [11] | 支气管镜在急危重症临床应用的专家共识[J].中华急诊医学杂志, 2016, 25(5): 568-572.DOI: 10.3760/cma.j.issn.1671-0282.2016.05.006. |
| [12] | Furukawa MK, Furukawa M. Diagnosis of lymph node metastases of head and neck cancer and evaluation of effects of chemoradiotherapy using ultrasonography[J]. Int J Clin Oncol, 2010, 15(1): 23-32. DOI:10.1007/s10147-009-0017-1 |
| [13] | Lee S H, Chung J, Choi H Y, et al. Evaluation of screening US-detected breast masses by combined use of elastography and color doppler US with B-Mode us in women with dense breasts: A multicenter prospective study[J]. Radiology, 2017, 285(2): 660-669. DOI:10.1148/radiol.2017162424 |
| [14] | Yasufuku K, Chiyo M, Sekine Y, et al. Real-time endobronchial ultrasound-guided transbronchial needle aspiration of mediastinal and hilar lymph nodes[J]. Chest, 2004, 126(1): 122-128. DOI:10.1378/chest.126.1.122 |
| [15] | Izumo T, Sasada S, Chavez C, et al. , Endobronchial ultrasound elastography in the diagnosis of mediastinal and hilar lymph nodes[J]. Jpn J Clin Oncol, 2014, 44(10): 956-62. DOI:10.1093/jjco/hyu105 |
| [16] | Huang H, Huang Z, Wang Q, et al. Effectiveness of the benign and malignant diagnosis of mediastinal and hilar lymph nodes by endobronchial ultrasound elastography[J]. J Cancer, 2017, 8(10): 1843-1848. DOI:10.7150/jca.19819 |
 2019, Vol. 28
2019, Vol. 28




