2 浙江大学医学院附属第二医院急诊医学科/浙江大学急救医学研究所,杭州 310009;
3 嘉兴市第一医院重症医学科,314000;
4 余姚市人民医院急诊医学科,315400
创伤是全球40岁以下人群的首要死因[1]。心脏骤停(cardiac arrest, CA)复苏后机体处于一种非自然的生理病理状态,容易发生多脏器功能损伤,被称为心脏骤停后综合征[2]。肠道作为整个机体代谢最活跃的部位之一,在创伤、休克及心肺复苏后最易受损,被认为是造成心、肺、肾等远隔重要脏器损伤的“启动器官”[3]。因此,积极防治复苏后肠损伤的发生发展,对心脏骤停后综合征的防治具有重要意义。研究证实参附注射液对心脏骤停复苏后的脏器功能具有保护作用[4-6],但针对复苏后的肠损伤的研究很少,本文旨在通过制作创伤性心脏骤停复苏的猪模型,评价早期应用参附注射液对复苏后肠损伤的影响。
1 材料与方法 1.1 实验动物及术前准备国产健康雄性白猪21头,由上海甲干生物医学公司提供,月龄3~4个月,体质量(33.1±3.6)kg。动物合格证号SCXK(沪)2015-0005。动物实验前一晚禁食,自由饮水。臀部肌肉注射氯胺酮20 mg/kg和咪达唑仑0.2 mg/kg诱导麻醉后,经右侧耳缘静脉给药,丙泊酚注射液负荷剂量0.1g注射后,微泵2.0~4.4 mg/(kg·h)维持镇静;芬太尼注射液1 μg/(kg·h)维持镇痛。经口气管插管连接深圳迈瑞SynoVent E5呼吸机;呼吸机调节参数:潮气量10 mL/kg, 吸入氧体积分数21%,PEEP 3 cmH2O(1mmHg=0.133kPa),并调节呼吸频率维持呼吸末CO2分压在35~45 mmHg(1mmHg=0.133kPa)。多参数监护仪进行实时监测。暴露右侧股动脉,置入8F Fast-Cath导管,用于放血;右侧股静脉置入Arrow单针双腔中心静脉导管,用于输血、输液;暴露左侧股动脉,置入7Fr Swan-Gans导管,用于监测动脉血压;右侧颈外静脉置入诱颤电极,用于诱发室颤;以上操作由两人同时进行,控制手术过程在45 min之内。空调控制室温23~26℃。
1.2 创伤性心脏骤停复苏猪模型的制作外科手术完成后,利用血泵经右股动脉20 min内匀速失血40%。失血完成后,经右室诱颤电极放电,当出现室颤波形并且平均动脉压(mean arterial pressure, MAP)降到20 mmHg以下视为诱颤成功,维持室颤无治疗5 min,开始心肺复苏(cardiopulmonary resuscitation, CPR):人工胸外按压和球囊辅助通气比例30:2,保证按压深度5~6 cm、频率100~120次/min,持续5 min。按压开始即液体复苏:1 h恒速输入失血量1.5倍的复方氯化钠液后,1h经输液泵恒速回输失血量0.5倍的自体血液量。心肺复苏2.5 min时,肾上腺素20 μg/kg静脉注射,心肺复苏5 min时,予ZOLL除颤监护仪150 J双向波电除颤1次,电除颤后即刻观察监护仪Ⅱ导联心电图波形及动脉血压,当出现规则的自主心律且MAP≥60 mmHg并持续维持5 min以上视为自主循环恢复(return of spontaneous circulation, ROSC)成功。ROSC未恢复则继续CPR 2 min、电除颤1次,重复此流程≤5次;5 min若还未ROSC,则放弃按压,视为复苏失败;连续监测6 h后动物脱机、拔管,拔除各处导管,缝合伤口,送回猪笼观察至复苏后24 h。
1.3 动物分组动物随机(随机数字法)分为假手术组(Sham组,n=5)、创伤性心脏骤停复苏组(traumatic cardiac arrest, TCA组,n=9)和参附组(SFI组,n=7)。Sham组只经历气管插管及动静脉置管,不进行放血和复苏;TCA组经历创伤失血性心脏骤停复苏过程,及常规输血输液抗休克治疗;SFI组在TCA组的基础上于复苏后5 min静脉注射参附注射液1.0 mL/kg,然后以1 mL/kg的总量微泵维持6 h(由雅安三九药业有限公司提供,国药准字号:Z20043117)。
1.4 观察指标于基线、复苏后1、3与6 h监测MAP、心率(heart rate, HR),检测动脉血pH值、乳酸的血清浓度。于基线、复苏后1、3、6与24 h检测肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α),白介素-6(interleukin-6, IL-6)、肠脂肪酸结合蛋白(intestinal fatty acid binding protein IFABP)与二胺氧化酶(diamine oxidase, DAO)的血清浓度。复苏后24 h经右侧耳缘静脉静注10%氯化钾注射液20mL,猪安乐死,迅速获取肠组织标本,用原位末端标记法(TUNEL法),将组织切片置于200倍光镜下随机选取3个视野,取平均值,计算棕黄色阳性细胞数占总细胞数的百分比,即凋亡指数(%)=阳性细胞数/总细胞数×100%(试剂由武汉博士德生物工程有限公司提供);用免疫组织化学染色法,将切片在200倍光镜下随机选取3个视野,以胞浆内出现棕黄色颗粒为阳性细胞,运用Image Proplus图像分析系统检测每个视野中半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)阳性表达的累积吸光度值,取平均值作为Caspase-3的表达水平(试剂由上海美轩生物科技有限公司提供)。
1.5 统计学方法采用SPSS19.0统计软件进行分析,计量资料进行正态性检验,正态分布者以均数±标准差(Mean±SD)表示;计数资料以比或率表示;通过重复测量方差分析各组组内及组间变化有无差异;同时间点的组间比较采用单因素方差分析,多重比较采用Bonferroni;率的比较采用χ2检验;以P < 0.05为差异有统计学意义。
2 结果 2.1 三组动物复苏前一般情况及复苏结果比较纳入研究的三组动物共21例,在复苏前三组动物的体质量、呼吸末CO2分压、HR、MAP值以及血乳酸水平的组间差异均无统计学意义(均P > 0.05)。TCA组中有8头猪、SFI组和Sham组中的所有猪均复苏成功,组间的死亡/存活比差异无统计学意义(P > 0.05)。
2.2 三组动物复苏前后血流动力学变化比较与Sham组相比,TCA组的HR在复苏后1、3与6 h明显增高(均P < 0.05),MAP值在复苏后1 h明显降低(P < 0.05),SFI组的HR在复苏后1、3 h明显增高(均P < 0.05),MAP的差异无统计学意义(均P < 0.05);与TCA组相比,SFI组的HR在复苏后3、6 h明显降低(均P < 0.05),MAP值较TCA组有所提升,但差异无统计学意义(P > 0.05)。见表 1。
| 组别 | BL | PR 1 h | PR 3 h | PR 6 h |
| HR(次/min) | ||||
| Sham | 90±12 | 94±8 | 92±6 | 93±9 |
| TCA | 91±22 | 167±24b | 163±34b | 168±33b |
| SFI | 87±15 | 153±26b | 127±12bc | 114±30d |
| MAP(mmHg) | ||||
| Sham | 117±6 | 120±5 | 119±5 | 119±3 |
| TCA | 106±16 | 94±18a | 107±18 | 113±18 |
| SFI | 105±13 | 107±21 | 118±8 | 116±21 |
| 注:HR,心率;MAP,平均动脉压;BL,基线值;PR,复苏后;Sham,假手术组;TCA,创伤性心脏骤停组;SFI,参附组。与同时点Sham组相比,aP < 0.05,bP < 0.01;与同时点TCA组相比,cP < 0.05,dP < 0.01 | ||||
与Sham组相比,TCA组的乳酸水平在复苏后1、3 h均明显增高(均P < 0.05),SFI组乳酸水平在复苏后1、3与6 h均明显增高(均P < 0.05);与TCA组相比,SFI组的乳酸水平在复苏后1、3 h明显降低(均P < 0.05);三组动物的pH值在复苏后各时点差异无明显统计学意义(均P > 0.05)。见表 2。
| 组别 | BL | PR 1 h | PR 3 h | PR 6 h |
| Lac(mmol/L) | ||||
| Sham | 1.2±0.7 | 0.6±0.3 | 0.8±0.3 | 0.6±0.2 |
| TCA | 2.3±2.0 | 9.5±3.2b | 6.8±3.9b | 3.5±3.0 |
| SFI | 2.1±0.6 | 6.2±1.0bc | 2.7±1.3bc | 1.4±0.3b |
| pH值 | ||||
| Sham | 7.46 ±0.10 | 7.47 ±0.04 | 7.47 ±0.03 | 7.47 ±0.04 |
| TCA | 7.48 ±0.09 | 7.13 ±0.06 | 7.23±0.17 | 7.42 ±0.09 |
| SFI | 7.49 ±0.03 | 7.10 ±0.05 | 7.34±0.04 | 7.46±0.03 |
| 注:Lac,乳酸;BL,基线值;PR,复苏后;Sham,假手术组;TCA,创伤性心脏骤停组;SFI,参附组。与同时点Sham组相比,aP < 0.05,bP < 0.01;与同时点TCA组相比,cP < 0.05,dP < 0.01 | ||||
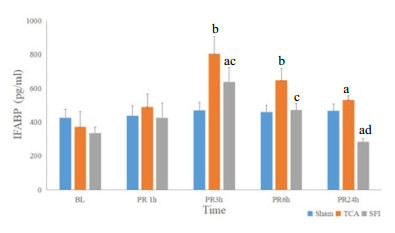
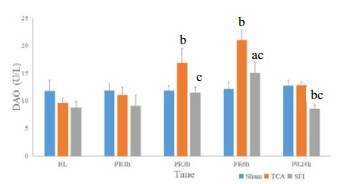
与Sham组相比,TCA组的IFABP与DAO水平在复苏后3、6 h明显增高(均P < 0.05),SFI组的IFABP水平在复苏后3 h、DAO水平在复苏后6 h明显增高(P < 0.05),在复苏后24 h明显降低(P < 0.05);与TCA组相比,SFI组的IFABP与DAO水平在复苏后3、6与24 h均明显降低(均P < 0.05)。(图 1,图 2)
|
| IFABP,肠脂肪酸结合蛋白;BL,基线值;PR,复苏后;Sham,假手术组;TCA,创伤性心脏骤停组;SFI,参附组。与同时点Sham组相比,aP < 0.05,bP < 0.01;与同时点TCA组相比,cP < 0.05,dP < 0.01 图 1 三组动物复苏前后IFABP的变化比较 |
|
|
|
| DAO,二胺氧化酶;BL,基线值;PR,复苏后;Sham,假手术组;TCA,创伤性心脏骤停组;SFI,参附组。与同时点Sham组相比,aP < 0.05,bP < 0.01;与同时点TCA组相比,cP < 0.01 图 2 三组动物复苏前后DAO的变化比较 |
|
|
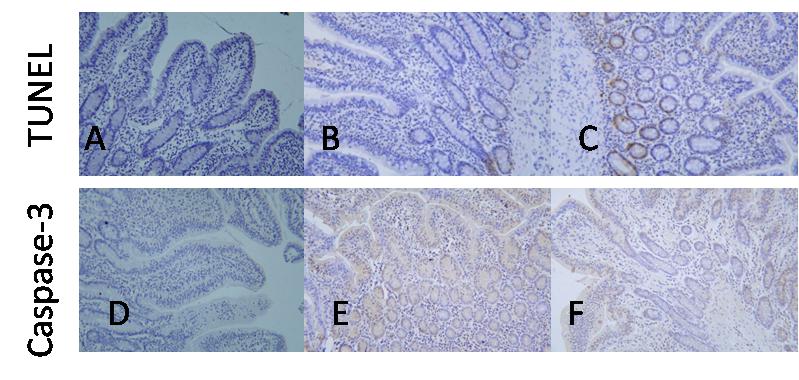
复苏后24 h TCA组与SFI组的肠组织细胞凋亡指数(%)分别为14.7±4.9,10.9±3.0,较Sham组1.4±0.9均明显增高,差异有统计学意义(均P < 0.05);TCA组与SFI组的Caspase-3蛋白阳性表达的IOD值分别为5.1±2.4,3.1±0.4,较Sham组2.7±1.6均有增高,但差异无统计学意义(P > 0.05)。SFI组的肠组织细胞凋亡指数和Caspase-3蛋白阳性表达的IOD值虽较TCA组均有所降低,但差异无统计学意义(P > 0.05)。(图 3)
|
|
组织细胞凋亡(TUNEL法):A代表Sham组,B代表TCA组,C代表SFI组。A组存在大量蓝色细胞,未见明显棕褐色细胞,提示肠组织细胞正常;B组可见棕黄色细胞,提示细胞凋亡显著;C组中也存在棕黄色细胞,但较B组减少,提示早期应用参附注射液能够减轻肠组织的细胞凋亡。 Caspase-3蛋白的表达:D代表Sham组,E代表TCA组,F代表SFI组。D组肠组织存在大量蓝色细胞,提示组织细胞正常;E组见状棕黄色的Caspase-3阳性细胞;F组中棕黄色区域较TCA组明显减少,提示早期应用参附注射液能够减少复苏后肠组织Caspase-3蛋白的表达 图 3 光镜下三组肠组织细胞凋亡情况(TUNEL×200)和Caspase-3表达(SP×200) |
|
|
肠黏膜作为肠道乃至整个机体代谢最活跃的部位,在创伤、休克及心肺复苏后最易受缺血-再灌注等病理因素影响,肠缺血再灌注损伤被认为是引起复苏后多脏器功能衰竭重要启动因素[7-8]。IFABP是一种脂肪酸结合蛋白,仅存在于肠道黏膜,当机体严重缺血时,肠黏膜对缺血非常敏感,细胞膜通透性增加致IFABP释放入血[9]。DAO是一种具有高度活性的细胞内酶,存在于小肠黏膜上皮绒毛细胞,在创伤、烧伤、放射损伤研究中,能够敏感地反应肠道黏膜损伤情况[10-11]。本研究制作了创伤性心脏骤停复苏的猪模型,TCA组的IFABP和DAO水平在心脏骤停复苏后迅速上升,提示在创伤性心脏骤停复苏后,肠道早期即出现明显的损伤,随着进一步的液体复苏肠损伤虽有所减轻,但至复苏后24 h仍未完全恢复;应用参附注射液后IFABP和DAO的表达在复苏后3、6与24 h已明显降低,提示参附注射液能够明显减轻创伤性心脏骤停复苏后的早期肠损伤。Wu等[12]在大鼠盲肠结扎穿孔所致的重症脓毒症模型中,应用参附注射液干预,并于8 h后处死,发现回肠组织结构、病理评分、黏膜上皮细胞凋亡指数及抗凋亡蛋白Bcl-2均有明显改善,血清TNF-α明显降低,且高剂量的参附注射液具有更强的保护效应,提示参附注射液改善肠损伤可能与抑制机体炎症反应、减轻细胞凋亡有关。
本研究发现复苏后TCA组HR迅速攀升,并持续维持在高水平,而应用参附注射液后的HR明显降低,MAP也有所提升,揭示参附注射液在复苏后具有稳定血流动力学的作用。既往有研究发现在心源性休克犬模型中,应用参附注射液在用药后30、60、120、180 min通过食道超声监测发现CO、MAP、主动脉每搏输出量均显著升高,而HR在60 min时开始显著下降,表明参附注射液能够提高MAP,依赖于提高CO,而患者的HR无明显增加,说明通过增加每搏量而不是HR来维持循环稳定[13]。这也本研究相一致。分析其机制可能与参附注射液的药理作用有关,其重要成分乌头类生物碱中所含β受体激动剂明显加强心肌收缩力度,改善每搏输出量及CO,而人参皂甙可能通过抑制休克时血管紧张素Ⅱ和去甲肾上腺素含量,来降低冠状动脉阻力和外周循环阻力,从而改善冠脉血流量和扩张外周血管, 进一步起到稳定血流动力学作用。
乳酸的升高往往提示细胞内缺氧和微循环灌注不足,与机体多脏器功能衰竭和死亡有着密切的关系[14]。pH值是反映人体酸碱状况的重要指标。本研究中,猪经历失血性休克,CPR期间的低灌注和ROSC后的缺血/再灌注的多重打击,虽三组动物pH值差异无统计学意义,但TCA组乳酸水平在复苏后迅速升高并于复苏后1 h达到高峰,说明机体打击极重,微循环灌注严重不足。而应用参附注射液后乳酸水平在复苏后明显降低,证明参附注射液能够改善机体打击后的组织需氧耗氧失衡,改善微循环灌注,及早纠正各器官组织缺氧状态,利于机体恢复。分析其机制可能与应用参附注射液能够机体的血流动力学,增加肠组织微循环的灌注有关。Wu等[15]在一项猪CA-CPR复苏模型,在复苏前应用参附注射液干预(1 mL/kg),发现在室颤、CPR期间及复苏后1 h冠脉灌注压均明显提升,肠微循环灌注均明显增加,从而证明参附注射液能够明显改善机体的大循环和微循环灌注。Qin等[16]在一项猪CA/CPR复苏模型研究中,应用参附注射液发现在ROSC后的1、3、6与24 h的动脉乳酸水平明显下降,乳酸清除率明显增加,可溶性血栓调节蛋白和内皮蛋白C受体水平均明显下降,证明它具有减轻血管内皮损伤和改善内环境的作用。
心脏骤停复苏是全身缺血-再灌注损伤的特殊形式,凋亡是缺血-再灌注损伤的重要机制之一。本研究发现TCA组在复苏后24 h均存在的凋亡指数增高和Caspase-3蛋白水平表达均增加,说明在创伤性心脏骤停复苏后肠组织存在明显的细胞凋亡;应用参附注射液后凋亡指数和Caspase-3表达较TCA组都有所降低,提示参附注射液能够减少复苏后的肠组织的细胞凋亡。Zhang等[4]在猪CA/CPR模型应用参附注射液,发现在复苏后6 h的肺脏细胞凋亡指数和Caspase-3蛋白较生理盐水组明显降低,抗凋亡蛋白Bal-2、超氧化物歧化酶、Na+-K+-ATP酶和Ca2+-ATP酶表达增加,证明参附注射液通过减轻肺脏的细胞凋亡、改善能量代谢和抗氧化能力来减轻复苏后的肺损伤。
| [1] | WHO. Global health estimates 2014 summary tables: deaths by cause, age and sex[C].Violence and injury: 2000-2002. |
| [2] | Neumar RW, Nolan JP, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A consensus statement from the International Liaison Committee on Resuscitation (American Heart Association, Australian and New Zealand Council on Resuscitation, European Resuscitation Council, Heart and Stroke Foundation of Canada, InterAmerican Heart Foundation, Resuscitation Council of Asia, and the Resuscitation Council of Southern Africa); the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; and the Stroke Council[J]. Circulation, 2008, 118(23): 2452-2483. DOI: 10.1161/CIRCULATIONAHA.108.190652. |
| [3] | Clark JA, Coopersmith CM. Intestinal crosstalk: a new paradigm for understanding the gut as the "motor" of critical illness[J]. Shock, 2007, 28(4): 384-393. DOI:10.1097/shk.0b013e31805569df |
| [4] | Zhang MY, Ji XF, Wang S, et al. Shen-fu injection attenuates postresuscitation lung injury in a porcine model of cardiac arrest[J]. Resuscitation, 2012, 83(9): 1152-1158. DOI:10.1016/j.resuscitation.2012.01.041 |
| [5] | Gu W, Li C, Yin W, et al. Shen-fu injection reduces postresuscitation myocardial dysfunction in a porcine model of cardiac arrest by modulating apoptosis[J]. Shock, 2012, 38(3): 301-306. DOI:10.1097/SHK.0b013e31825f6632 |
| [6] | Gu W, Hou X, Zhou H, et al. Protective effect of shen-fu injection on neuronal mitochondrial function in a porcine model of prolonged cardiac arrest[J]. Evid Based Complement Alternat Med, 2014, 2014: 523847. |
| [7] | Stallion A, Kou TD, Latifi SQ, et al. Ischemia/reperfusion: a clinically relevant model of intestinal injury yielding systemic inflammation[J]. J Pediatr Surg, 2005, 40(3): 470-477. DOI:10.1016/j.jpedsurg.2004.11.045 |
| [8] | Korth U, Krieter H, Denz C, et al. Intestinal ischaemia during cardiac arrest and resuscitation: comparative analysis of extracellular metabolites by microdialysis[J]. Resuscitation, 2003, 58(2): 209-217. DOI:10.1016/S0300-9572(03)00119-9 |
| [9] | Hanssen SJ, Derikx JP, Vermeulen WIC, et al. Visceral injury and systemic inflammation in patients undergoing extracorporeal circulation during aortic surgery[J]. Ann Surg, 2008, 248(1): 117-125. DOI:10.1097/SLA.0b013e3181784cc5 |
| [10] | Karabulut KU, Narci H, Gul M, et al. Diamine oxidase in diagnosis of acute mesenteric?schemia[J]. Am J Emerg Med, 2013, 31(2): 309-312. DOI:10.1016/j.ajem.2012.07.029 |
| [11] | Fukudome I, Kobayashi M, Dabanaka K, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats[J]. Med Mol Morphol, 2014, 47(2): 100-107. DOI:10.1007/s00795-013-0055-7 |
| [12] | Wu W, Jiang RL, Wang LC, et al. Effect of Shenfu injection on intestinal mucosal barrier in a rat model of sepsis[J]. Am J Emerg Med, 2015, 33(9): 1237-1243. DOI:10.1016/j.ajem.2015.01.056 |
| [13] | 殷文朋, 李春盛, 刘沐芸. 参附注射液对实验犬心原性休克血流动力学的影响[J]. 中华急诊医学杂志, 2008, 17(1): 45-49. DOI:10.3760/j.issn:1671-0282.2008.01.011 |
| [14] | Rivers EP, Kruse JA, Jacobsen G, et al. The influence of early hemodynamic optimization on biomarker patterns of severe sepsis and septic shock[J]. Crit Care Med, 2007, 35(9): 2016-2024. DOI:10.1097/01.CCM.0000281637.08984.6E |
| [15] | Wu J, Li C, Yuan W. Effects of Shenfu injection on macrocirculation and microcirculation during cardiopulmonary resuscitation[J]. J Ethnopharmacol, 2016, 180: 97-103. DOI:10.1016/j.jep.2016.01.027 |
| [16] | Yin Q, Liu B, Wu C, et al. Effects of Shen-Fu injection on coagulation-fibrinolysis disorders in a porcine model of cardiac arrest[J]. Am J Emerg Med, 2016, 34(3): 469-476. DOI:10.1016/j.ajem.2015.12.010 |
 2019, Vol. 28
2019, Vol. 28




