2 首都医科大学附属北京同仁医院急诊科 100176
暴发性紫癜(purpura fulminans, PF)是一种罕见的危及生命的综合征,以弥漫性血管内凝血(disseminated intravascular coagulation, DIC)和血管内血栓形成为特征而导致的皮肤紫癜[1],可发展为多器官功能衰竭和大血管栓塞,病死率高达18%~40%[2]。阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria, PNH)是一种罕见的获得性造血干细胞疾病,主要发生于成人,儿童也有报道[3]。PNH的中位发病年龄为30~40岁[4]。其临床表现为非特异性,其中血栓形成是PNH患者死亡的主要原因,发生率高达40%,血栓形成通常累及静脉系统,但静脉和动脉事件均有报道[5]。PNH合并PF临床罕见,本文结合北京协和医院急诊科收治的一例PNH合并PF患者,探讨PNH合并PF的诊断与治疗,以提高对该病的认识。
1 资料与方法患者男性,49岁,职员。主因“发热、咳嗽伴四肢疼痛6 d,皮疹4 d”于2018年1月23日入住北京协和医院急诊科。患者6 d前无诱因出现发热,最高体温38.8℃,伴咳嗽、咳白痰及四肢疼痛,予川贝枇杷膏等药物(其他药物不详)处理,咳嗽好转,体温下降。4 d前体温反复,最高体温39.4℃,伴头面、颈部散在大小不一的紫红色皮疹,呈进行性增多并融合,伴疼痛,无瘙痒。外院考虑病毒感染可能,予热毒宁、奥司他韦及人免疫球蛋白等治疗,效果欠佳。既往史:PNH 22年,口服华法林抗凝治疗约20年,近2年予低分子肝素5 000 U每日皮下注射抗凝治疗,目前口服泼尼松10 mg/d治疗;门静脉血栓10年。入院查体:T 38.8 ℃,P 140次/min,RR 30次/min,BP 105/66 mmHg(1 mmHg=0.133 kPa)。神志清楚,巩膜黄染,头面、颈部可见多发片状暗紫红色不规则瘀斑,边缘紫红色稍淡,界清(图 1);左小腿外侧局部可见一大小约1.0 cm×1.0 cm不规则瘀斑。心肺腹及神经系统查体未见明显异常。入院化验检查(括号内为参考值):血常规白细胞15.98×109/L[(3.5~9.5)×109/L],红细胞3.3×1012/L [(4.0~5.5)×1012/L],血红蛋白106 g/L(120~160 g/L),血小板46×109/L [(100~350)×109/L]。血涂片中性分叶93%(50%~70%),淋巴细胞1%(25%~40%)。尿常规尿胆原33 μmol/L(3~16 μmol/L),其余指标(-)。生化谷丙转氨酶25 U/L(9~50 U/L),肌酐47 μmol/L(59~104 μmol/L),钾3.9 mmo1/L(3.5~5.5 mmo1/L),白蛋白34 g/L(35~52 g/L),总胆红素50.3 pmo1/L(5.1~22.2 pmo1/L),结合胆红素18.1 μmo1/L(0.0~6.8 μmo1/L),钙2.08 mmol/L(2.25~2.75 mmol/L),钠131 mmo1/L(135~145 mmo1/L),葡萄糖6.2 mmol/L(3.9~6.1 mmol/L),肌酸激酶61 U/L(24~195 U/L),肌酸激酶同工酶0.1 μg/L (0~3.6 μg/L),心肌肌钙蛋白0.002 μg/L(0~0.056 μg/L),N末端B型钠尿肽原336 pg/mL(0~125 pg/mL)。凝血功能凝血酶原时间15.6 s(10.4~12.6 s),国际标准化比值1.3(0.86~1.14),凝血酶原活动度62.6% (74%~120%),活化部分凝血活酶时28.9 s(22.7~31.8 s),纤维蛋白原5.22 g/L(1.8~3.5 g/L),D-二聚体5.15 mg/L(0~0.55 mg/L)。血气分析pH 7.529(7.35~7.45),PCO2 29.5 mmHg(35~45 mmHg),PO2 44.0 mmHg(75~100 mmHg),Lac 1.9 mmol/L(< 1.8 mmol/L),BE 1.8 mmol/L(-3~+3 mmol/L)。降钙素原 < 0.5 ng/mL(< 0.5 ng/mL)。病毒核酸五项(外院)未见异常。心脏超声未见明显异常。血、尿毒理检测未见异常。初步诊断:发热、皮疹原因待查,皮肤坏死,药疹?休克,DIC?
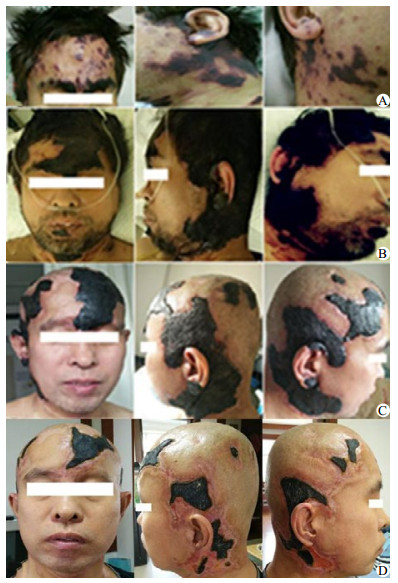
|
| A:患者发病初皮损情况;B:患者就诊时皮损情况;C:患者住院30 d皮损情况;D:患者发病60 d(出院20 d)皮损情况 图 1 患者发病后的皮损改变 |
|
|
入院后予液体复苏、厄他培南1.0 g/d静脉滴注抗感染、低分子肝素6 000 U/d皮下注射抗凝治疗。查尿常规、病毒核酸五项、胸腹盆腔CT、心脏超声等检查未见明确感染灶,考虑皮肤坏死继发感染不除外。入院第2日将抗生素调整为头孢美唑2.0 g/12 h静脉滴注抗感染治疗。完善相关检查及皮肤病理。患者入院后出现黄疸加重、浓茶色尿、血小板进行性减低、肝脾肿大及腹水,其他化验检查结果:抗凝血酶Ⅲ(AT-Ⅲ)减低,网织红细胞百分比升高、骨髓增生活跃;肝素诱导的血小板减少症(HIT)抗体、活化蛋白C抵抗(APC-R)、抗心磷脂抗体(ACL)、抗β2糖蛋白1(B2GP1)、狼疮抗凝物(LA)、血清免疫固定电泳(IgA+G+M)、血清蛋白电泳均阴性。治疗上予输注血小板,新鲜冰冻血浆改善凝血功能,多烯磷脂酰胆碱、丁二磺酸腺苷蛋氨酸保肝,泼尼松30 mg/d口服控制溶血,补充白蛋白及利尿纠正低蛋白血症、减轻腹水等治疗,患者症状明显好转,血小板维持在50×109/L以上,凝血功能逐渐好转,转氨酶降至正常、胆红素水平逐渐下降,血白蛋白逐渐升高、腹水明显减少。CD55(衰变加速因子)/CD59(反应性溶血膜抑制物)结果回报明显低于正常,将低分子肝素调整为6 000 U/12 h皮下注射加强抗凝治疗。皮肤创面分泌物培养、血培养、腹水培养结果均阴性,继续头孢美唑抗感染治疗,入院第13天患者血常规正常,头面、颈部皮损范围较前缩小。入院第15天皮肤病理回报(图 2),表皮轻度角化过度,棘层萎缩变薄;真皮全层大部分血管内有纤维素样血栓形成,血管周围炎症浸润不明显,符合PF诊断。入院第17天患者体温正常,生命体征平稳。入院28 d患者皮肤出血性坏死明显好转,转至血液科进一步治疗,于3月5日好转出院(图 1)。
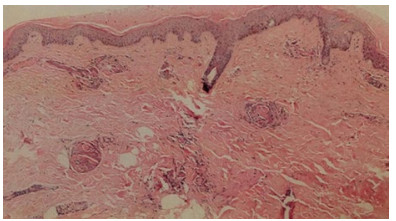
|
| 图 2 本例患者左小腿坏死组织病理(HE×40) |
|
|
PF又名坏死性紫癜,最常发生于1~3岁婴幼儿及16~18岁的青少年[6]。PF是由Guelliot在1884年首先描述[7],它最常发生于细菌或病毒所致的脓毒症,还见于蛋白C和蛋白S缺乏所致的遗传缺陷,以及获得性蛋白C、蛋白S缺乏[8]。蛋白C是一种在肝脏合成的维生素K依赖性蛋白质,活化蛋白C(activated protein C, aPC)除具有抗凝功能外,还有抗炎活性及保护内皮细胞屏障功能[9]。蛋白S也是维生素K依赖性蛋白质,其可显著增强aPC的抑制作用。PF以严重感染的并发症出现,以促凝血途径的异常激活、抗凝血途径的功能障碍和内皮损伤为特征[7],最终发展为DIC,表现为微血管血栓和皮肤紫癜[10]。
PNH是由于造血干细胞的磷脂酰肌醇聚糖锚生物合成A类基因(PIGA)突变,导致糖基化磷脂酰肌醇(GPI)合成障碍,从而导致GPI锚定蛋白CD55和CD59缺乏,这些细胞膜蛋白具有补体调节作用,它们的缺陷导致补体敏感性增加,发生了血管内溶血、炎症介质活化及游离血红蛋白释放等一系列病理生理变化,从而促使血栓形成[11]。PNH血栓形成相关机制主要包括:⑴溶血相关机制。溶血致大量游离血红蛋白释放及NO损耗,而游离血红蛋白释放和NO损耗,又被视为血小板活化聚集的始动因素。⑵非溶血相关机制。内皮细胞受损伤;血小板活化和组织因子增多;CD55和CD59缺乏;补体活化与炎性反应等[12]。蛋白C和蛋白S能与补体蛋白C4b结合而发挥抗凝作用,在PNH患者因组织因子(TF)表达量增多、血栓形成或肝功损伤,导致蛋白C和S慢性消耗,因而促进或加重血栓形成[13]。
本例患者,中年男性,急性起病,初始表现为发热、咳嗽、皮疹进行性加重,进而出现大片状皮肤坏死,入院时出现休克、DIC,皮肤病理活检显示真皮全层大部分血管内有纤维素样血栓形成,血管周围炎症浸润不明显,符合PF诊断。患者无明确感染灶,CD55/CD59明显减低,抗凝血酶Ⅲ、蛋白C、蛋白S减低;既往PNH、下肢DVT及门静脉血栓病史,否认家族遗传史,故考虑PNH相关PF诊断。但需与以下疾病鉴别:⑴肝素诱导的血小板减少症(HIT)。HIT是一种免疫介导的疾病,通常发生于肝素治疗后5~10 d,2周后发作不常见。其确定诊断依靠HIT抗体检测,该患者HIT抗体阴性,故可排除该病。⑵华法林诱发的皮肤坏死。华法林治疗早期会诱发蛋白C减少,引起血液短暂性的高凝状态,最终导致广泛性坏死性紫癜。该患者已停用华法林2年,此病可以排除。⑶抗磷脂综合征(APS)。APS是一种自身免疫性多系统疾病,特点是在持续存在抗磷脂抗体的情况下,出现动脉、静脉或小血管血栓栓塞事件和(或)病理妊娠。该患者抗心磷脂抗体(ACL)、抗β2糖蛋白1(β2GP1)阴性;狼疮抗凝物(LA) 1.13(≤1.2)阴性,根据修改版Sapporo标准[14]可排除。⑷血栓性血小板减少性紫癜(TTP)。TTP是一种血管性血友病因子(VWF)裂解酶ADAMTS13活性重度降低引起的血栓性微血管病。其特征为微血管病性溶血性贫血、血小板减少、神经功能异常和肾疾病。皮肤表现多为瘀点或瘀斑,而非皮肤血管发生完全闭塞和损害导致的紫癜。与本病不符。⑸皮肤血管炎。皮肤血管炎可由感染、药物、结缔组织病、恶性肿瘤等多种疾病引起,表现为皮肤瘀点、可触性紫癜、出血性大疱、网状青斑、荨麻疹等,确诊需要通过皮肤活检病理:①纤维素样坏死;②侵入或破坏血管壁的炎性浸润。根据该患者皮肤病理表现可排除该诊断。
PF的治疗效果主要取决于对该病的认识、积极治疗原发病、凝血功能异常的控制[8],以及预防感染、充分支持治疗。结合该患者的治疗,笔者认为主要治疗措施如下:⑴原发病治疗。PF的治疗有赖于纠正基础病因。该患者PNH多年,此次发病表现为皮肤静脉血栓形成及溶血。治疗方面:①艾库组单抗(eculizumab)可以用于PNH溶血的治疗及改善PNH血栓形成倾向[15],但价格昂贵。②糖皮质激素,该患者给予泼尼松控制溶血。糖皮质激素主要价值可能在于改善急性溶血的恶化,短期应用泼尼松龙可以减轻溶血的严重程度和持续时间。③抗凝治疗,急性血栓事件需要肝素抗凝;PNH常合并血小板减少,血小板减少是抗凝治疗的相对禁忌而不是绝对的,可通过输血将血小板维持在安全范围,而不应不进行抗凝治疗[16]。2009英国DIC诊治指南推荐在DIC患者(包括PF)中应用肝素治疗[17]。最近亦有研究支持PF患者进行肝素抗凝治疗[1];肝素治疗可能会减少PF患者的皮肤坏死的数量[18]。⑵抗感染治疗。急性感染性暴发性紫癜最常见,须积极寻找感染性因素。该患者无明确感染灶,但皮肤坏死继发感染不除外,故予头孢美唑抗感染治疗。⑶外科治疗。可根据患者皮损是否感染、皮损恢复情况选用焦痂切开术、人工植皮等。该患者皮肤病变无明显感染,皮损逐渐缩小,暂不同意人工植皮,未予外科手术干预。⑷抗休克等对症支持治疗。该患者出现心率快、血压低、乳酸高等休克表现,予积极液体复苏、改善组织灌注;予多烯磷脂酰胆碱、丁二磺酸腺苷蛋氨酸保肝治疗;补充白蛋白及利尿纠正低蛋白血症、减轻腹水等治疗。
综上所述,该病例考虑为PNH相关的PF,在临床工作中罕见,对此病提高认识至关重要,从而尽早明确诊断和采取相应治疗是患者预后良好的关键。
| [1] | Warkentin TE. Ischemic limb gangrene with pulses[J]. N Engl J Med, 2015, 373(7): 642-655. DOI:10.1056/nejmra1316259 |
| [2] | Campsall PA, Laupland KB, Niven DJ. Severe meningococcal infection[J]. Crit Care Clin, 2013, 29(3): 393-409. DOI:10.1016/j.ccc.2013.03.001 |
| [3] | Curran KJ, Kernan NA, Prockop SE, et al. Paroxysmal nocturnal hemoglobinuria in pediatric patients[J]. Pediatr Blood Cancer, 2012, 59(3): 525-529. DOI:10.1002/pbc.23410 |
| [4] | Schrezenmeier H, Muus P, Socié G, et al. Baseline characteristics and disease burden in patients in the International Paroxysmal Nocturnal Hemoglobinuria Registry[J]. Haematologica, 2014, 99(5): 922-929. DOI:10.3324/haematol.2013.093161 |
| [5] | Pu JJ, Brodsky RA. Paroxysmal nocturnal hemoglobinuria from bench to bedside[J]. Clin Transl Sci, 2011, 4(3): 219-224. DOI:10.1111/j.1752-8062.2011.00262.x |
| [6] | Veldman A, Fischer D, Wong FY, et al. Human protein C concentrate in the treatment of purpura fulminans: a retrospective analysis of safety and outcome in 94 pediatric patients[J]. Crit Care, 2010, 14(4): R156. DOI:10.1186/cc9226 |
| [7] | Chalmers E, Cooper P, Forman K, et al. Purpura fulminans: recognition, diagnosis and management[J]. Arch Dis Child, 2011, 96(11): 1066-1071. DOI:10.1136/adc.2010.199919 |
| [8] | Colling ME, Bendapudi PK. Purpura fulminans: mechanism and management of dysregulated hemostasis[J]. Transfus Med Rev, 2017, 32(2): 69-76. DOI:10.1016/j.tmrv.2017.10.001 |
| [9] | Griffin JH, Zlokovic BV, Mosnier LO. Protein C anticoagulant and cytoprotective pathways[J]. Int J Hematol, 2012, 95(4): 333-345. DOI:10.1007/s12185-012-1059-0 |
| [10] | Ding H, Cao XY, Ma XG, et al. Endothelial cell injury with inflammatory cytokine and coagulation in patients with sepsis[J]. World J Emerg Med, 2013, 4(4): 285-289. DOI:10.5847/wjem.j.1920-8642.2013.04.008 |
| [11] | Dezern AE, Brodsky RA. Paroxysmal nocturnal hemoglobinuria: a complement-mediated hemolytic anemia[J]. Hematol Oncol Clin, 2015, 29(3): 479-494. DOI:10.1016/j.hoc.2015.01.005 |
| [12] | 杜亚丽, 龙章彪, 韩冰. 阵发性睡眠性血红蛋白尿症与血栓发生的研究进展[J]. 基础医学与临床, 2017, 37(1): 128-132. DOI:10.3969/j.issn.1001-6325.2017.01.048 |
| [13] | Piccin A, Murphy C, Eakins E, et al. Circulating microparticles, protein C, free protein S and endothelial vascular markers in children with sickle cell anaemia[J]. J Extracell Vesicles, 2015, 4(1): 28414. DOI:10.3402/jev.v4.28414 |
| [14] | Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS)[J]. J Thromb Haemost, 2006, 4(2): 295-306. DOI:10.1111/j.1538-7836.2006.01753.x |
| [15] | Hillmen P, Muus P, Duhrsen U, et al. Effect of the complement inhibitor eculizumab on thromboembolism in patients with paroxysmal nocturnal hemoglobinuria[J]. Blood, 2007, 110(12): 4123-4128. DOI:10.1182/blood-2007-06-095646 |
| [16] | Ray JG, Burows RF, Ginsberg JS, et al. Paroxysmal nocturnal hemoglobinuria and the risk of venous thrombosis: review and recommendations for management of the pregnant and nonpregnant patient[J]. Pathophysiol Haemost Thromb, 2000, 30(3): 103-117. DOI:10.1159/000022532 |
| [17] | Levi M, Toh CH, Thachil J, et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation[J]. Br J Haematol, 2009, 145(1): 24-33. DOI:10.1111/j.1365-2141.2009.07600.x |
| [18] | Kuppermann N, Inkelis SH, Saladino R. The role of heparin in the prevention of extremity and digit necrosis in meningococcal purpura fulminans[J]. Pediatr Infect Dis J, 1994, 13(10): 867-872. DOI:10.1097/00006454-199410000-00004 |
 2019, Vol. 28
2019, Vol. 28




