2 宁夏医科大学, 银川 750004
2 Ningxia Medical University, Yinchuan 750004, China
休克是临床上常见的危重症之一,在临床救治中,对休克患者心、肾等脏器功能进行支持已经深入人心,但对肠屏障功能的维护还未得到应有的重视。肠道是休克后损伤最早、恢复最晚的靶器官,同时也是休克后发生全身炎症反应和MODS的“枢纽器官”。肠黏膜上皮屏障尤其肠黏膜上皮细胞间的紧密连接可有效地阻止肠腔内细菌、毒素及炎症介质等物质的旁细胞转运,对调节肠黏膜通透性和屏障完整性至关重要[1]。组织低灌注、炎症、毒素等多重因素可损伤肠屏障,但针对肠屏障功能的保护却缺乏有效治疗手段[2]。内源性一氧化碳(CO)是血红素氧合酶-1(hemeoxygenase-1, HO-1)的重要代谢产物,是促进细胞存活的重要气体信号分子,具有抗炎、抗缺血、抗凋亡等多重保护效应[3]。一氧化碳释放分子-2(carbon monoxide releasing molecule-2, CORM-2)是一种新型金属羰基化合物,溶解后可缓慢、持续、可控地释放CO[4]。本研究拟建立大鼠失血性休克肠屏障损伤模型,并用CORM-2干预大鼠,观察其对大鼠肠黏膜病理形态、超微结构、上皮细胞紧密连接蛋白表达及血清炎症因子水平的影响,旨在获得CO保护休克大鼠肠黏膜上皮屏障的实验证据。
1 材料与方法 1.1 实验动物和仪器设备健康雄性SD大鼠32只,10~14周龄,体质量(298±12)g,宁夏医科大学实验动物中心提供[许可证号SCXK(宁)2016009],实验前12 h禁食,自由饮水。
多功能监护仪(PHILIPS V24E),动脉压测定换能器(BD公司); 水合氯醛(北京金鑫天佑生物科技有限公司,中国),CORM-2(Sigma公司,美国,批号:MKBS0488V), 血浆D-乳酸试剂盒(北京中杉金桥公司,中国),ZO-1兔抗鼠多克隆抗体(Thermo公司,美国,批号:RF232767),Occludin兔抗鼠多克隆抗体(Thermo公司,美国,批号:RI237069),Claudin3兔抗鼠多克隆抗体(Abcam公司,英国,批号:ab15102),鼠TNF-α ELISA试剂盒(Invitrogen公司,美国,批号:BMS622)。
1.2 方法 1.2.1 CORM-2及iCORM-2的制备取5 mg的CORM-2粉末与0.5 mL的DMSO充分混匀,再加入4.5 mL生理盐水,使得DMSO的终体积分数为10%,药物需现用现配。iCORM-2的制备为将制备好的CORM-2置于37 ℃环境中24 h,使其释放出CO。
1.2.2 模型制备SD大鼠术前一晚禁食但不禁水,10%水合氯醛以3 mL/kg剂量腹腔内麻醉,备皮,仰卧位固定。左颈动脉和右颈静脉置入23号PE-50聚乙烯管,动脉导管用于监测动脉压、放血,静脉导管用于补液。皮下穿刺针电极持续记录心电图。手术完成后,待大鼠生理参数稳定开始诱导休克,采用Wiggers改良法制备大鼠失血性休克模型[5]。经颈动脉穿刺完毕后待平均动脉压(MAP)稳定10 min后开始诱导休克。用注射器从颈动脉三通处0.5 mL/min的速度放血或回注血(MAP >40 mmHg时放血,< 35 mmHg时回注,1 mmHg=0.133 kPa),维持大鼠MAP在35~40 mmHg间的休克状态120 min。维持休克状态120 min后行液体复苏,静脉输注复方氯化钠,30 min内将MAP升到100 mmHg以上停止复苏,待血流动力学稳定30 min后拔出动静脉导管,结扎动静脉后放回鼠笼中饲养,记录大鼠24 h生存情况。
1.2.3 实验分组32只大鼠随机(随机数字法)分为4组:假手术组、休克组、CORM-2组及iCORM-2组,每组各8只, 休克后未存活至预定时间者不计入组内。假手术组给予颈动脉,颈静脉置管,不制作休克模型; 休克组干预同模型制备; CORM-2组和iCORM-2组干预药物均为5 mg/kg于制作休克模型前1 h腹腔注射。
1.3 观察指标 1.3.1 肠道组织病理形态学观察假手术组术后24 h、实验各组制作休克模型24 h后处死大鼠,取距离阑尾10 cm的部分回肠组织,用生理盐水冲洗干净,4%甲醛溶液固定,经包埋、切片、苏木精-伊红(HE)染色后,光镜下观察肠黏膜形态,并用Chiu 6级评分法对肠黏膜损伤程度进行评价。Chiu评分:正常小肠黏膜绒毛为0分; 绒毛顶端黏膜下出现间隙,伴随毛细血管充血为1分; 肠黏膜下间隙扩张,肠黏膜与黏膜下层分离为2分; 肠黏膜与黏膜下层分离延伸到肠绒毛两侧为3分; 绒毛变钝,固有层及其血管暴露,炎症细胞浸润为4分; 固有膜消化崩解,出血或形成溃疡为5分。
1.3.2 透射电镜观察回肠超微结构变化假手术组术后24 h,实验各组制作休克模型24 h后处死大鼠,取距离阑尾10 cm的部分回肠组织修成1 mm3大小,4℃ 3%冰戊二醛固定,经四氧化锇固定,梯度酒精脱水,环氧丙烷浸透,包埋,制作厚度50 nm左右切片,醋酸铀、枸橼酸铅染色透射电镜观察回肠超微结构变化。
1.3.3 血浆D-乳酸测定假手术组术后24 h、实验各组制作休克模型24 h后取大鼠下腔静脉血样2 mL,以4 000 r/min,离心10 min分离血浆,样本置-80℃冰箱保存备用一批检测。用ELISA法测定血浆D-乳酸含量,操作按试剂盒说明书进行。
1.3.4 Western-blot检测回肠组织ZO-1、Occludin、Claudin3蛋白水平假手术组术后24 h,实验各组制作休克模型24 h后处死大鼠取部分回肠组织。裂解回肠组织提取总蛋白,用BCA法定量后,进行SDS-PAGE电泳并转移至PVDF膜。脱脂奶粉封闭1.5 h,分别加入ZO-1、Occludin、Claudin3抗体(1:500、1:200、1:200稀释),4 ℃孵育过夜,TBST洗膜3次,加入二抗(1:1 000稀释),室温下孵育1 h,TBST洗膜3次,加入ECL显影,用Gel-pro分析软件测定各蛋白条带灰度值。实验重复3次。
1.3.5 血清TNF-α测定假手术组术后24 h、实验各组制作休克模型24 h后取大鼠下腔静脉血样2 mL,以4 000 r/min,离心10 min分离血清,样本置-80℃冰箱保存备用一批检测。用ELISA法测定血清TNF-α含量,操作按试剂盒说明书进行。
1.4 统计学方法采用SPSS 17.0统计软件进行统计分析,对数据进行正态性检验和方差齐性检验,计量资料服从正态分布的以均数±标准差(Mean±SD)表示,非正态分布的计量资料以中位数(四分位数)[M(P25, P75)]表示。两组或多组间的对比分析采用单因素方差分析,组间两两比较采用SNK-q检验,方差不齐时分别采用Kruskal Wallis秩和检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肠道组织病理形态学观察如图 1所示,假手术组大鼠回肠黏膜固有层腺体细胞结构清晰,黏膜上皮完整,绒毛细胞排列整齐; 休克组大鼠回肠绒毛排列紊乱,绒毛表面明显游离,肠上皮细胞出现大量坏死,结构不连续,破坏明显; CORM-2组回肠上皮细胞少量坏死,绒毛部分节段结构不连续,未见明显水肿,较休克组显著改善; iCORM-2组肠黏膜上皮亦有大量坏死,绒毛水肿。与假手术组比较,其余各组Chiu评分升高,CORM-2组评分低于休克组和iCORM-2组,见表 1。
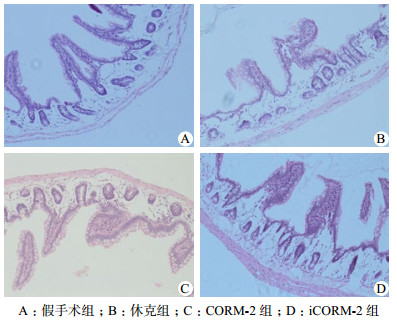
|
| 图 1 各组大鼠肠道组织病理形态学观察(HE×200) Figure 1 Pathological morphology of intestinal tissues in rats of each group (HE ×200) |
|
|
| 指标 | 假手术组 | 休克组 | CORM-2组 | iCORM-2组 | F值 | P值 |
| D-乳酸(ng/mL) | 65.09±33.16 | 139.49±28.83a | 75.65±34.14b | 135.75±25.19ac | 16.38 | < 0.01 |
| TNF-α(pg/mL) | 65.85(47.82,84.32) | 358.60(314.18,395.73)a | 104.00(93.10,131.95)b | 312.25(275.75,345.40)ac | 26.82 | < 0.01 |
| Chiu评分(分) | 0.41±0.28 | 3.14±0.68a | 2.13±0.52ab | 3.12±0.92ac | 31.99 | < 0.01 |
| 注:与假手术组比较,aP < 0.05;与休克组比较, bP < 0.05;与CORM-2组比较, cP < 0.05 | ||||||
如图 2所示,透射电镜下可见假手术组肠黏膜上皮排列规则、紧密,上皮细胞表面微绒毛丰富,杯状细胞分泌旺盛,线粒体内质网结构正常,细胞间紧密连接紧密; 休克组肠黏膜上皮排列紧密,上皮表面微绒毛略稀疏,部分微绒毛倒伏,杯状细胞形态全无,呈空泡状,部分细胞线粒体肿胀,基质变淡,嵴变短,内质网缺失,上皮细胞紧密连接增宽。CORM-2组上皮细胞表面微绒毛较假手术组稀疏,较休克组上皮微绒毛倒伏减轻,线粒体、内质网结构保存较好。iCORM-2组肠上皮细胞微绒毛水肿,线粒体、内质网水肿、结构破坏明显。
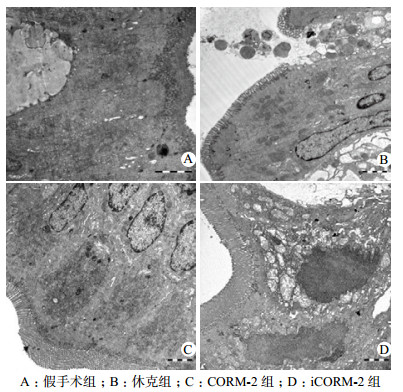
|
| 图 2 各组大鼠回肠超微结构变化(2 000 nm) Figure 2 The changes of ileum ultrastructure in rats of each group(2 000 nm) |
|
|
由表 1可见,与假手术组比较,休克组和iCORM-2组血浆D-乳酸明显升高(均P < 0.05),CORM-2组D-乳酸有升高趋势,但差异无统计学意义。CORM-2组血浆D-乳酸较休克组和iCORM-2组明显降低(均P < 0.05),后两组之间比较差异无统计学意义(P>0.05)。
2.4 各组大鼠回肠组织ZO-1、Occludin、Claudin3蛋白表达水平比较由图 3可见,与假手术组比较,休克组、iCORM-2组Claudin3、Occludin、ZO-1蛋白表达均降低(均P < 0.05)。CORM-2组仅Claudin3、ZO-1表达水平低于假手术组(均P < 0.05),Occludin蛋白表达与假手术组差异无统计学意义(P>0.05)。且CORM-2组上述蛋白表达均高于休克组及iCORM-2组(均P < 0.05),后两组之间上述蛋白表达差异无统计学意义(均P>0.05)。
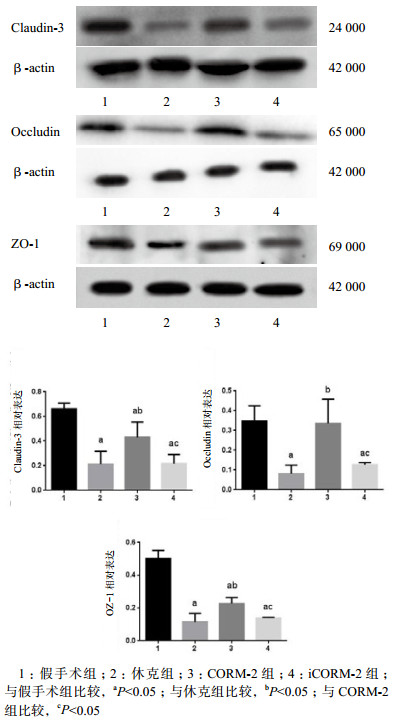
|
| 图 3 各组大鼠回肠组织Claudin3、Occludin、ZO-1蛋白表达水平比较 Figure 3 Comparison of expression levels of Claudin3, Occludin and ZO-1 proteins in ileum of rats among four groups |
|
|
由表 1可见,与假手术组比较,休克组和iCORM-2组血清TNF-α水平明显升高(均P < 0.05),CORM-2组TNF-α水平有升高趋势,但差异无统计学意义。CORM-2组TNF-α水平较休克组和iCORM-2组明显降低(均P < 0.05),后两组之间TNF-α水平差异无统计学意义(P>0.05)。
3 讨论肠道是休克时最早缺血,最迟恢复血供的器官,是休克应激反应的中心。肠道也是休克发生全身炎症反应的“枢纽器官”,因此肠屏障损伤通透性增高常预示预后不良[6]。肠上皮细胞紧密连接(TJ)在肠道黏膜屏障中起着重要作用,其受损会导致细胞间的通透性增加,细菌、内毒素和大分子物质通过细胞旁路途径进入组织、器官或循环,从而引发疾病[7]。本研究采用Wiggers改良法建立大鼠压力控制型失血性休克模型,大鼠维持休克状态120 min,结果证实休克组大鼠回肠绒毛排列紊乱,肠上皮细胞坏死。电镜下观察肠上皮表面微绒毛略稀疏,倒伏,杯状细胞破坏,线粒体肿胀,上皮细胞紧密连接增宽。肠紧密连接蛋白ZO-1、Occludin、Claudin3表达水平明显降低,提示休克可致肠黏膜病理形态和紧密连接分子结构损伤。D-乳酸是肠道固有细菌的代谢产物,其他组织既不能产生D-乳酸也不能代谢,所以血中的D-乳酸基本上来源于肠道,可反映肠道屏障的通透性[8]。本研究证实大鼠经历120 min休克,血浆D-乳酸明显升高,提示肠通透性增高,造模成功。
一氧化碳(CO)是一种与一氧化氮类似的体内重要信号分子,由于它的毒性而长期忽视了其生物学性能。内源性CO是血红素氧合酶的重要代谢产物之一,具有抗炎、抗氧化、抗凋亡等多重保护效应,尤其是细胞拮抗缺血-再灌注损伤的重要防御效应因子之一[9]。本研究结果证实CORM-2组休克大鼠回肠肠上皮病理损害明显减轻,上皮细胞表面微绒毛略稀疏,线粒体、内质网结构保存较好,病理形态和超微结构完整性优于休克组。同时ZO-1、Occludin、Claudin3蛋白表达也高于休克组,血浆D-乳酸低于休克组。上述结果显示CORM-2可有效保护失血性休克肠黏膜屏障结构完整性,并上调肠黏膜屏障重要分子结构紧密连接蛋白表达。而iCORM-2组则无此保护效应。Zhang等[10]在脓毒症肠道损伤模型中亦证实CORM可减轻肠黏膜损伤,上调紧密连接蛋白ZO-1和Claudin1蛋白表达,与本研究结果一致。
CO保护肠屏障的机制尚未阐明。本研究结果证实休克大鼠血清TNF-α水平明显升高,CORM-2明显降低休克大鼠TNF-α水平。已有证据表明促炎因子作用于相关的肠上皮或内皮组织,通过影响紧密连接蛋白的表达、结构和功能从而调控上皮或内皮的旁细胞途径通透性,是肠屏障损伤的重要机制之一。Ma等[11]研究证实TNF-α可以引起人肠道细胞系Caco-2旁细胞途径通透性升高,紧密连接分子ZO-1表达下降,而NF-κB的激活参与了TNF-α引起的通透性升高。Al-Sadi等[12]证实IL-1处理人肠道细胞系Caco-2,可引起其紧密连接蛋白Occludin mRNA和蛋白表达下调。相反,具有抗炎效应的IL-10可以阻断促炎因子IFN-γ导致的肠上皮细胞通透性增加,IL-10基因敲除大鼠可自主发展为慢性肠道炎症[13]。不同促炎细胞因子可通过不同信号转导通路影响紧密连接结构和功能,进而破坏肠黏膜屏障。TNF-α可通过MLCK/MLC(肌球蛋白轻链激酶/肌球蛋白轻链)信号通路重塑细胞骨架微丝,导致紧密连接前的肌动球蛋白环收缩,引起Occludin、Claudin-1、ZO-1等紧密连接蛋白及周围细胞骨架蛋白重新分布,使得紧密连接结构移位,细胞旁通路开放,肠黏膜通透性增加。同时可诱导多种促炎细胞因子如IL-6、IL-8等的产生,形成级联放大效应,进一步加重肠黏膜的损伤[14]。以上证据均表明炎症因子是肠黏膜屏障损伤的重要因素之一。而CO可通过多重途径发挥抗炎效应,如可抑制LPS刺激巨噬细胞ROS和炎症因子释放[15]。因此CO的抗炎效应可能是其保护肠黏膜屏障完整性的机制之一。
综上所述,CORM-2可有效保护休克大鼠肠屏障,降低肠黏膜通透性,上调紧密连接蛋白表达,其抗炎效应可能是其发挥保护作用的机制之一,但炎症因子调节紧密连接蛋白表达的机制有待进一步探讨。
| [1] | 钮凌颖, 李宁. 肠上皮细胞的紧密连接与肠道疾病[J]. 肠外与肠内营养, 2009, 16(1): 51-54. DOI:10.3969/j.issn.1007-810X.2009.01.019 |
| [2] | Bischoff SC, Barbara G, Buurman W, et al. Intestinal permeability--a new target for disease prevention and therapy[J]. BMC Gastroenterol, 2014, 14: 189. DOI:10.1186/s12876-014-0189-7 |
| [3] | Motterlini R, Otterbein LE. The therapeutic potential of carbon monoxide[J]. Nat Rev Drug Discov, 2010, 9(9): 728-743. DOI:10.1038/nrd3228 |
| [4] | Motterlini R. Carbon monoxide-releasing molecules (CO-RMs): vasodilatory, anti-ischaemic and anti-inflammatory activities[J]. Biochem Soc Trans, 2007, 35(Pt5): 1142-1146. DOI:10.1042/BST0351142 |
| [5] | Lomas-Niera JL, Perl M, Chung CS, et al. Shock and hemorrhage: an overview of animal models[J]. Shock, 2005, 24(Suppl 1): 33-39. DOI:10.1097/01.shk.0000191411.48719.ab |
| [6] | Jiang L, Yang L, Zhang M, et al. Beneficial effects of ulinastatin on gut barrier function in sepsis[J]. Indian J Med Res, 2013, 138: 904-911. |
| [7] | 梅梅, 向若兰, 俞光岩, 等. 促炎因子调控紧密连接的研究进展[J]. 生理科学进展, 2016, 47(1): 27-32. |
| [8] | Van der Voort PH, Westra B, Wester JP, et al. Can serum L-lactate, D-lactate, creatine kinase and I-FABP be used as diagnostic markers in critically ill patients suspected for bowel ischemia[J]. BMC Anesthesiol, 2014, 14: 111. DOI:10.1186/1471-2253-14-111 |
| [9] | Kaizu T, Ikeda A, Nakao A, et al. Protection of transplant-induced hepatic ischemia/reperfusion injury with carbon monoxide via MEK/ERK1/2 pathway downregulation[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 294(1): G236-244. DOI:10.1152/ajpgi.00144 |
| [10] | Zhang SL, Zheng SY, Wang X, et al. Carbon monoxide releasing molecule-2 reduces intestinal epithelial tight-junction damage and mortality in septic rats[J]. PLoS One, 2015, 10(12): e0145988. DOI:10.1371/journal.pone.0145988 |
| [11] | Ma TY, Iwamoto GK, Hoa NT, et al. TNF alpha induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 286: G367-376. DOI:10.1152/ajpgi.00173.2003 |
| [12] | Al-Sadi RM, Ma TY. IL-1 beta causes an increase in intestinal epithelial tight junction permeability[J]. J Immunol, 2007, 178: 4641-4649. DOI:10.4049/jimmunol.178.7.4641 |
| [13] | Arrieta MC, Madsen K, Doyle J, et al. Reducing small intestinal permeability attenuates colitis in the IL10 gene-deficient mouse[J]. Gut, 2009, 58(1): 41-48. DOI:10.1136/gut.2008.150888 |
| [14] | Capaldo CT, Nusrat A. Cytokine regulation of tight junctions[J]. Biochim Biophys Acta, 2009, 1788(4): 864-871. DOI:10.1016/j.bbamem.2008.08.027 |
| [15] | Katada K, Takagi T, Uchiyama K, et al. Therapeutic roles of carbon monoxide in intestinal ischemia-reperfusion injury[J]. J Gastroenterol Hepatol, 2015, 30(1): 46-52. DOI:10.1111/jgh.12742 |
 2019, Vol. 28
2019, Vol. 28




