随着现代军事及社会的发展,爆震伤已成为致残的主要原因之一,严重时可导致死亡[1-2]。爆震产生的冲击波作用于机体,可导致创伤性脑损伤(traumatic brain injury, TBI),常引起人格改变、感觉运动能力障碍、认知及学习能力损伤等长期后遗症,严重影响伤者的生活质量[3-6],而对于TBI的治疗目前并不是十分完善[7]。因此研究脑爆震伤损伤机制具有重要意义。目前,对于爆震伤的研究难以开展的因素之一是爆震伤模型的制备困难。本研究应用自主研发的小动物爆震伤模拟装置建立小鼠脑爆震伤模型,并通过检测脑组织损伤程度研究其损伤机制,为脑爆震伤的救治提供实验依据。
1 材料与方法 1.1 实验动物及分组30只健康昆明小鼠,雄性,体质量20~25 g,周龄8周。小鼠均由北部战区总医院实验动物中心采购(SCXK 2016-0002),常规培养,动物自由饮食饮水。动物福利和实验设计由医院伦理委员会审核通过。小鼠随机(随机数字法)分为2组:正常对照组(Ctrl组)和脑爆震伤模型组(TBI)组,每组15只。
1.2 脑爆震伤模拟装置设计此项研究过程中使用的脑爆震伤模拟装置是基于Awwad等[8]制作的爆震伤模型参考设计的。采用空气压缩到一定程度冲破铝膜产生的冲击波作用于小鼠头部,制备脑爆震伤模型。脑爆震伤模拟装置包括4部分:空气压缩装置、固定装置、保护装置及数据采集装置。如图 1A所示,装置主体下方为空气压缩装置,长度大约为100 cm的钢制管道连接空气压力泵及电源; 主体上方装置为长约30 cm的钢制管道,顶面为钢丝网用于固定保护罩,中间连接压力感应器; 主体上方及下方装置中间可放置不同厚度的铝膜,用螺丝固定,冲破铝膜时产生的冲击波随铝膜厚度增加而增强; 保护装置是由硬质塑料制成的圆筒,于一侧筒壁制作小鼠头部大小的圆孔,用于暴露小鼠脑部保护其他部位; 冲击波压力数据由压力感应器(PCB, GE公司, 美国)测定,通过数据线传输至电脑采集。

|
| 图 1 爆震伤模拟装置 Figure 1 Simulation device for blast injury |
|
|
小鼠腹腔注射2%戊巴比妥钠(1.5 mL/kg)进行麻醉,将麻醉后的小鼠放置于保护罩内,暴露后脑部,将1.4 mm铝膜放于中间层,螺丝固定,将处于保护罩内的小鼠固定于上方装置的钢丝网上(图 1C),接通电源,压力泵压缩空气,下方装置内空气压力逐渐升高,当超过铝膜所能承受的极限压力时,铝膜突然破裂,迅速膨胀的空气瞬时从爆破口以极高的速度喷出,形成的冲击波冲击小鼠暴露的头部,冲击波产生的压力通过压力感应器和数据线传输至电脑形成波形图。压力值(PSI)=电压值×1 000/50.08,将电脑记录的电信号转为压力值。
1.4 Morris水迷宫在室温下,将水迷宫高度21 cm直径150 cm的圆形池充满水,池壁为黑色。使用无毒白色涂料(catalog No. 187203, Palmer Paint Products)使水不透明,并保持在(22±1)℃。将水池分为四个象限,并将一个直径8 cm的圆形平台放置在第四象限。小鼠游泳路径使用池上的数字视频摄像机摄影并通过digibehave系统分析跟踪(Jiliang Software Company)。小鼠寻找平台所需时间的平均值被定义为逃逸潜伏期,该过程包括5 d训练和1 d测试。肺爆震伤模型建立成功后第2天,Ctrl组和TBI组小鼠以头朝池壁的方向放入水中,随机选取四个象限的起始位置之一作为放入位置。记录动物找到水下平台的时间。在训练中,时间超过60 s,引导小鼠到平台上停留10 s。将小鼠移开、擦干,电暖风取暖5 min,放回笼内。连续训练5 d,每天训练4次,间隔20 min。最后一次获得性训练结束后的第2天,开始60 s的探查训练。记录动物在放置平台的象限所花的时间,以此作为空间记忆的检测指标。
1.5 伊文思蓝实验使用伊文思蓝(EB, Sigma, E2129-10G, 美国)评估血脑屏障(blood brain barrier,BBB)通透性。小鼠用2%戊巴比妥钠(1.5 mL/kg)腹膜内麻醉。灌注前30 min将EB注入静脉,然后灌注0.9%盐水15 min。大脑被拍照并称质量。脑组织在0.5 mL 50%三氯乙酸中匀浆。样品在37℃孵育24 h,4 ℃ 12 000 r/min离心10 min,吸出上清液。样品的吸光度值通过iMarkTM酶标仪(Bio-Rad Laboratories,美国)测定。用EB梯度浓度的吸光度值建立标准曲线,计算脑组织渗出EB含量。
1.6 样本收集模型成功1周后,处死小鼠。小鼠腹腔注射2%戊巴比妥钠(1.5 mL/kg)麻醉,眼球放血处死小鼠。取出脑组织,将每组5只小鼠的脑组织放入4%甲醛溶液(上海歌凡,M003,中国)中固定,石蜡包埋、切片, 用于HE染色,观察组织学改变。将每组另外5只小鼠脑组织直接放置在液氮罐中,用于蛋白检测。
1.7 病理染色使用苏木精伊红(HE)染色试剂盒(Solarbio,G1120,中国)进行染色。石蜡切片脱蜡至水,苏木精染色5 min,流水冲洗5 min,1%乙酸乙醇30 s,水洗,0.5%伊红染色3 min,蒸馏水洗30 s后脱水,中性树胶封固,于光镜下观察。
1.8 Western blot冻存的脑组织通过蛋白提取试剂盒(Solarbio,FD0889,中国)提取总蛋白并通过BCA蛋白定量试剂盒(Solarbio,FD2001,中国)检测浓度。将配平好的蛋白样品加入相应比例的加样缓冲液,煮沸5 min致蛋白变性,SDS-PAGE电泳,转膜后移至5%脱脂奶粉PBST缓冲液中,室温封闭2 h,PBST洗膜3次后加入一抗Tau(1:2 000;cat. no. ab80579;Abcam,英国)、S100β(1:2 000;cat. no. ab52642;Abcam,英国)、胆碱乙酰转移酶(1:1 000;cat. no. ab181023;Abcam,英国)、Bcl-2(1:1 000;sc-7382;Santa Cruz Biotechnology,美国)、Bax(1:2 000;sc-526;Santa Cruz Biotechnology,美国)、Caspase-3(1:1 000;sc-7148;Santa Cruz Biotechnology,美国)、NF-κB(1:2 000;cat. no. ab16502;Abcam,英国)、IL-1β(1:1 000; cat. no. sc-7884; Santa Cruz Biotechnology,美国)、IL-4(1:1 000; cat. no. sc-73318; Santa Cruz Biotechnology,美国)、IL-6(1:2 000;ab208113;Abcam,英国)、IL-10(1:2 000;cat. no. ab9969;Abcam,英国)、IREα(1:2 000;#3294;Cell signaling,美国)、MDA5(1:500;ab69983;Abcam,英国)、COX2(1:2 000;ab15191;Abcam,英国)、SOD1(1:1 000;sc-11407;Santa Cruz Biotechnology,美国)、SOD2(1:1 000;sc-30080;Santa Cruz Biotechnology,美国)、GAPDH(1:5 000;cat. no. sc-32233;Santa Cruz Biotechnology,美国),4 ℃孵育过夜。然后,用PBST洗膜3次,加辣根过氧化物酶标记的抗小鼠(1:4 000; cat. no. ab6789; Abcam,英国)、抗兔(1:4 000; cat. no.ab6721; Abcam,英国)和抗大鼠(1:3 000;cat. no. ab97057; Abcam,英国)二抗,室温孵育1 h。洗膜3次,全自动化学发光图像分析系统进行(Tanon Science and Technology Co., 中国) ECL(Bio-Rad Laboratories,cat.# 170-5061,美国)显影。
1.9 统计学方法采用SPSS 20.0软件进行统计分析,两组计量资料的比较采用成组-t检验。统计检验为双侧概率检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 冲击波压力及小鼠病死率1.4 mm铝膜破裂产生的压力通过压力感应器由数据线传输至电脑形成波形图,见图 1B,高峰超压值为(337.46±18.30)PSI,小鼠病死率为80%。
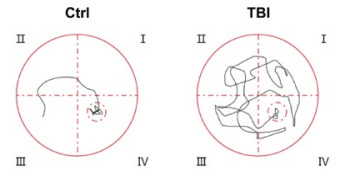
2.2 脑爆震伤影响小鼠空间学习记忆能力Ctrl组小鼠找到平台位置的时间为(11.2±2.1)s,TBI组小鼠寻找平台时间(54.6±8.4)s,与Ctrl组比较明显增加(t=-19.330,P < 0.05),提示脑爆震伤影响小鼠空间学习记忆能力(图 2)。
|
| 图 2 Morris水迷宫实验结果 Figure 2 Results of morris water maze test |
|
|
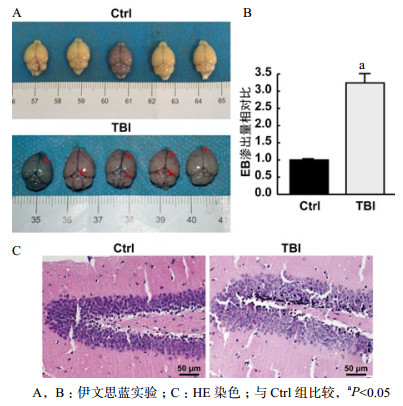
与Ctrl组小鼠相比,TBI组小鼠脑组织可见明显的EB渗出,EB相对渗出量比较可见TBI组小鼠明显增高3.22倍(t=-13.903, P < 0.05),提示脑爆震伤可致小鼠BBB破坏(图 3 A和B)。
|
| 图 3 脑爆震伤对小鼠血脑屏障及病理改变的影响 Figure 3 Effects of traumatic brain injury on blood-brain barrier and pathological changes in mice |
|
|
观察小鼠脑组织病理可见,Ctrl组海马区细胞排列规则,无损伤。TBI组海马区神经元变性,锥体细胞肿胀且排列不规则,神经元细胞核固缩(图 3C)。
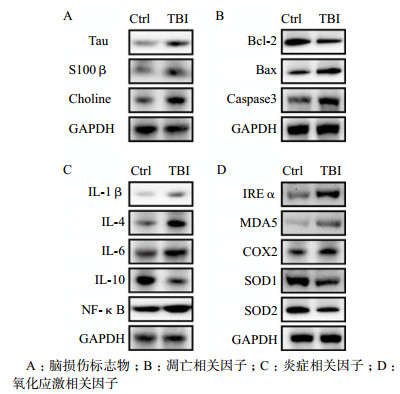
2.5 脑爆震伤促进小鼠脑组织损伤标志物的表达与Ctrl组脑组织损伤标志物Tau(0.26±0.03)、S100β(0.54±0.03)和胆碱(0.54±0.05)蛋白相比,TBI组Tau(0.46±0.04,t=-9.788,P < 0.05)、S100β(0.74±0.02, t=-12.433,P < 0.05)和胆碱(0.80±0.04,t=-7.970,P < 0.05)蛋白表达明显升高,提示脑爆震伤可导致小鼠脑组织损伤(图 4 A)。
|
| 图 4 Western-blot实验结果 Figure 4 Results of Western-blot analysis |
|
|
与Ctrl组抑凋亡因子Bcl-2(0.72±0.05)蛋白和促凋亡因子Caspase-3(0.44±0.03)、Bax(0.66±0.04)相比,TBI组Bcl-2(0.46±0.02,t=11.491,P < 0.05)表达明显降低,Caspase-3 (0.60±0.05,t=-4.472, P < 0.05)和Bax(0.78±0.04,t=-13.007,P < 0.05)蛋白表达明显升高,提示脑爆震伤可导致小鼠脑组织神经元细胞凋亡(图 4 B)。
2.7 脑爆震伤对小鼠脑组织炎症相关因子的影响与Ctrl组脑组织促炎因子IL-1β(0.22±0.04)、IL-4(0.65±0.02)、IL-6(0.88±0.05)、NF-κB(0.80±0.06)和抑炎因子IL-10(1.14±0.06)相比,TBI组IL-1β(0.31±0.05, t=-3.431, P < 0.05)、IL-4(0.97±0.03, t=-18.927,P < 0.05)、IL-6(1.07±0.08, t=-9.488,P < 0.05)和NF-κB(1.03±0.07, t=-4.507, P < 0.05)蛋白表达明显升高,IL-10(0.74±0.07,t=13.729,P < 0.05)蛋白表达明显降低,提示脑爆震伤诱导小鼠脑组织炎症反应(图 4 C)。
2.8 脑爆震伤对小鼠脑组织氧化应激相关因子的影响与Ctrl组脑组织促进氧化应激因子IREα(0.72±0.06)、MDA5(0.47±0.02)、COX2(0.70±0.07)和抑制氧化应激因子SOD1(1.17±0.05)、SOD2(0.81±0.05)相比,TBI组IREα(1.07±0.04,t=-9.665,P < 0.05)、MDA5(0.77±0.02,t=-23.678,P < 0.05)和COX2(0.86±0.02,t=-6.421,P < 0.05)蛋白表达明显升高,SOD1(0.99±0.01,t=7.731,P < 0.05)和SOD2(0.61±0.04,t=10.257,P < 0.05)蛋白表达明显降低,提示脑爆震伤可诱导小鼠脑组织氧化应激反应(图 4 D)。
3 讨论在国内,爆震伤动物模型的制备大多直接应用炸弹定向爆破产生的冲击波冲击动物从而引起器官损伤,但此种方法的不可控性导致动物模型的成功率低且重复率差,无法监控实验条件导致无法准确记录实验数据,同时导致的器官损伤多为多器官损伤且伤情不定,无法做到精准模型的制备; 而且装置体积过大,操作复杂,实验费用高昂,场地要求较高[9-12]。因此,寻找一种实验过程可控,便于记录实验条件,重复率高,操作简单,场地要求低,性价比较高的爆震伤模型制备方法是研究爆震伤的合理救治的关键之一。本课题组综合国内外现有的爆震伤模型制作方法并根据国外爆震伤模拟装置的实验参数,成功自主研发设计制作一款爆震伤模拟装置(专利号:201620222422.8),压力泵压缩空气到一定程度后爆破产生的冲击波,配合相应部位的保护装置,可实现定点可控单一器官的爆震伤精准模型。经过前期大量实验验证,该模型可以模拟爆炸产生的冲击波,其导致的动物器官损伤与真实的爆震伤极为相似; 可进行单次或多次同位点打击,为研究不同情况下的爆震伤提供了条件; 对单器官的精准冲击,同时又排除了弹片、爆炸产生的热度可能造成的损伤,更有利于爆震伤损伤机制的研究; 另外该装置可使实验过程可控,便于记录实验条件,重复率高,操作简单,场地要求低,性价比较高,完全实现了爆震伤模拟装置的小型化及精准化,可作为深入研究爆震伤损伤机制及保护性药物开发的良好实验工具。
本研究应用自主研发的爆震伤模拟装置建立小鼠脑爆震伤模型,并检测脑损伤程度,实验结果发现脑爆震伤可导致小鼠空间学习记忆能力丧失,血脑屏障破坏,海马区神经元损伤,同时诱导脑组织损伤标志物(Tau、S100β和胆碱)、炎性因子(IL-1β、IL-4、IL-6和NF-κB)、促凋亡细胞因子(Bax和Caspase-3)和促氧化应激相关因子(IREα、MDA5和COX2)的表达,抑制抑炎因子IL-10、抑制凋亡因子Bcl-2及抑制氧化应激因子SOD1和SOD2的表达。Rubovitch等[13]研究证明爆炸引起的创伤性脑损伤导致小鼠空间记忆显著下降。Wang等[14]发现小鼠空间记忆和血脑屏障破坏程度与爆炸冲击波强度和时间成正比。Fan等[15]证明脑爆震伤可诱导脑组织炎症反应。已有研究结果证明脑爆震伤引起细胞凋亡、血管损伤及氧化应激反应和Tau蛋白的表达增加[16-17]。这些文献报道的结果均与本实验结果相似。
综上所述,脑爆震伤可诱导小鼠空间学习记忆能力丧失、血脑屏障破坏、海马区神经元损伤,促进脑损伤标志物的表达,诱导脑组织炎症反应、氧化应激反应及细胞凋亡发生。通过以上几个方面的检测,实验证明笔者自主研发的爆震伤模拟装置建立小鼠脑爆震伤模型是成功的。
| [1] | Yamamoto S, Dewitt D, Prough D. Impact & blast traumatic brain injury: implications for therapy[J]. Molecules, 2018, 23(2): pii: E245. DOI:10.3390/molecules23020245 |
| [2] | Chai HT, Chen KH, Wallace CG, et al. Extracorporeal shock wave therapy effectively protects brain against chronic cerebral hypo-perfusion-induced neuropathological changes[J]. Am J Transl Res, 2017, 9(11): 5074-5093. |
| [3] | Agoston D, Kamnaksh A. Modeling the neurobehavioral consequences of blast-induced traumatic brain injury spectrum disorder and identifying related biomarkers[M]//Agoston D, Kamnaksh A. eds. Brain Neurotrauma. CRC Press, 2015: 309-328. DOI: 10.1201/b18126-28. |
| [4] | Song HL, Konan LM, Cui JK, et al. Ultrastructural brain abnormalities and associated behavioral changes in mice after low-intensity blast exposure[J]. Behav Brain Res, 2018, 347: 148-157. DOI:10.1016/j.bbr.2018.03.007 |
| [5] | 王正国, 张良. 创伤性脑损伤[J]. 中华急诊医学杂志, 2015, 24(5): 465-466. DOI:10.3760/cma.j.issn.1671-0282.2015.05.001 |
| [6] | 戴晶, 刘学磊, 金红旭. 轻度颅脑爆震伤与血脑屏障关系的研究进展[J]. 中华急诊医学杂志, 2017, 26(5): 493-497. DOI:10.3760/cma.j.issn.1671-0282.2017.05.003 |
| [7] | Kou K, Hou XY, Sun JD, et al. Current pre-hospital traumatic brain injury management in China[J]. World J Emerg Med, 2014, 5(4): 245-254. DOI:10.5847/wjem.j.issn.1920-8642.2014.04.001 |
| [8] | Awwad HO, Gonzalez LP, Tompkins P, et al. Blast overpressure waves induce transient anxiety and regional changes in cerebral glucose metabolism and delayed hyperarousal in rats[J]. Front Neurol, 2015, 6: 132. DOI:10.3389/fneur.2015.00132 |
| [9] | 李彦腾, 程岗, 刘邦鑫, 等. 几种颅脑爆震伤动物模型建立方法的比较[J]. 中华神经外科疾病研究杂志, 2017, 16(1): 87-89. |
| [10] | 郭运林, 刘建民, 刘元钦, 等. 颅脑爆震伤兔模型的建立[J]. 实用医药杂志, 2016, 33(3): 196-198. DOI:10.14172/j.issn1671-4008.2016.03.002 |
| [11] | 李彦腾, 程岗, 刘帅, 等. 舱室内爆炸致大鼠颅脑爆震伤模型的建立[J]. 解放军医学杂志, 2017, 42(9): 820-825. DOI:10.11855/j.issn.0577-7402.2017.09.13 |
| [12] | 扶宇, 王本瀚, 初霞, 等. 小鼠颅脑爆震伤模型制作及大脑皮质早期病理变化[J]. 神经解剖学杂志, 2018, 34(2): 249-254. DOI:10.16557/j.cnki.1000-7547.2018.02.019 |
| [13] | Rubovitch V, Zilberstein Y, Chapman J, et al. Restoring GM1 ganglioside expression ameliorates axonal outgrowth inhibition and cognitive impairments induced by blast traumatic brain injury[J]. Sci Rep, 2017, 7: 41269. DOI:10.1038/srep41269 |
| [14] | Wang HX, Zhang YP, Cai J, et al. A Compact blast-induced traumatic brain injury model in mice[J]. J Neuropathol Exp Neurol, 2016, 75(2): 183-196. DOI:10.1093/jnen/nlv019 |
| [15] | Fan KH, Ma J, Xiao WJ, et al. Mangiferin attenuates blast-induced traumatic brain injury via inhibiting NLRP3 inflammasome[J]. Chem Biol Interact, 2017, 271: 15-23. DOI:10.1016/j.cbi.2017.04.021 |
| [16] | Hubbard WB, Greenberg S, Norris C, et al. Distinguishing the unique neuropathological profile of blast polytrauma[J]. Oxid Med Cell Longev, 2017, 2017: 5175249. DOI:10.1155/2017/5175249 |
| [17] | Lucke-Wold BP, Naser ZJ, Logsdon AF, et al. Amelioration of nicotinamide adenine dinucleotide phosphate-oxidase mediated stress reduces cell death after blast-induced traumatic brain injury[J]. Transl Res, 2015, 166(6): 509-528. e1. DOI:10.1016/j.trsl.2015.08.005 |
 2019, Vol. 28
2019, Vol. 28




