2 福建省立医院急诊内科,福州 350001;
3 福建省急诊医学研究所,福州 350001
2 Department of Emergency Medicine, Fujian Provincial Hospital, Fuzhou 350001, China;
3 Fujian Provincial Emergency Medicine Institute, Fuzhou 350001, China
随着现代心肺复苏技术的不断规范,心肺复苏后自主循环恢复(restoration of spontaneous circulation, ROSC)比率较前已得到很大的提高,但许多患者ROSC后仍处于昏迷状态,且有近80%患者多于1年内死亡[1],所以心脏骤停(cardiac arrest, CA)后脑复苏是否成功已成为影响心肺复苏患者存活率的重要因素[2]。由于CA主要引起脑组织缺血缺氧性损伤,导致大量神经元细胞的坏死和凋亡,但迄今为止国内外均未完全证实某种药物可对CA后脑复苏有十分确切的脑保护作用。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是一类非造血组织来源但具有多分化潜能的干细胞,本研究旨在探讨BMSCs移植对CA后神经生长因子(nerve growth factor, NGF)、Caspase-3表达的影响,从而初步了解BMSCs改善神经功能的可能机制。
1 材料与方法 1.1 研究对象清洁级Sprague-Dawley(SD)雄性大鼠,共18只,体质量250~350 g,所有大鼠均由北京维通利华实验动物技术有限公司提供,批号SCXK(京)2012-0001,按随机数字表进行随机分组,共分成3组,每组6只。所有大鼠在22~25 ℃的实验室中饲养3 d以适应环境。本实验得到福建医科大学动物伦理委员会批准。
1.2 动物模型的制备七氟醚(恒瑞,上海)对大鼠诱导麻醉,腹腔注射戊巴比妥钠(0.1 mL/100 g,Sigma,上海)麻醉,常规气管插管,于腹股沟区置入动脉测压套组(Philips,荷兰),分别于大鼠四肢插入金属针以监测大鼠心电变化。待大鼠清醒后,注射维库溴铵(1 mg/kg,天台山,成都)肌松,并将气管插管末端堵塞形成窒息。以平均动脉血压(MAP)≤20 mmHg(1 mmHg=0.133 kPa),心电监护提示为室上性或室性节律但无动脉血压波形或者无心电活动作为CA模型成功建立的标准[3-4]。CA 6 min后于胸骨中下段进行胸外心脏按压,频率约为200次/min,深度约为胸廓前后径的1/3,同时予机械通气(奥尔科特,上海),呼吸机潮气量为0.5 mL/100 g,呼吸频率为100次/min,吸呼比为1:1。按压后2 min若无ROSC,按0.005 mg/kg给予肾上腺素,必要时可间隔2 min重复使用。ROSC标准:恢复自主窦性心律,MAP≥60 mmHg且以上心电以及血压情况至少维持10 min,若经以上复苏过程达10 min以上仍无ROSC的大鼠认定为复苏失败。操作过程中诱导CA的判断标准及ROSC的标准均严格按照文献报道方法进行[3-4]。ROSC后的大鼠继续予机械通气2 h,动物苏醒后拔除导管回笼。
1.3 ROSC后处理BMSCs组随机抽取本课题组前期已制备成功的BMSCs,以磷酸盐缓冲液(PBS)冲洗后配置成为1×106个细胞/0.5 mL,待成功复苏后1 h经尾静脉注射。CA组成功复苏后1 h经尾静脉注射等体积的PBS。
1.4 神经功能评分分别于复苏后第1、3和7天,对各组大鼠采用mNSS量表[5]评价其神经功能损伤的情况,以4个项目得分之和作为最终得分,得分为0~18分,得分越高,提示神经功能损伤越严重。
1.5 标本采集各组大鼠于复苏后第7天麻醉后,取下腔静脉血大约10 mL后处死,静脉血注入干燥的玻璃管后,静置10 min,用离心机(Thermo,上海)以4 000 r/min离心15 min,以吸管吸取上清液并保存于EP管,存放于-80℃冰箱,待实验全部完成后以ELISA法测定血清S100B(欣博盛,北京)的水平。同时取已处死大鼠海马区脑组织,保存于4%甲醛溶液中,以免疫组化方法检测脑组织中NGF(义森,上海)及Caspase-3(义森,上海)的阳性表达,并以Image Pro Plus 6.0软件计算其吸光度值。
1.6 统计学方法所有实验数据均经过方差齐性检验和正态性检验,并采用SPSS 19.0统计软件进行分析。计量资料采用均数±标准差(Mean±SD)表示,组间比较采用单因素方差分析(ANOVA),采用Homogeneity of Variances test进行方差齐性检验,以SNK-q法进行组间两两比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 改良神经功能缺损评分(mNSS)复苏后第1、3天,CA组、BMSCs组mNSS得分较假手术组均有明显升高(均P < 0.05); 在相同时间点,BMSCs组得分均低于CA组(均P < 0.05)。复苏后第7天,BMSCs组得分低于CA组(P < 0.05)。见表 1。
| 时点 | Sham组(n=6) | CA组(n=6) | BMSCs组(n=6) | P值 | A vs B | A vs C | B vs C |
| 实验前 | 0 | 0 | 0 | ||||
| 复苏后1 d | 0 | 11.2±0.4a | 6.1±0.5ab | < 0.01 | 0.002 | < 0.01 | 0.007 |
| 复苏后3 d | 0 | 8.8±0.5a | 1.7±0.4ab | < 0.01 | < 0.01 | 0.003 | 0.002 |
| 复苏后7 d | 0 | 4.5±0.6a | 0.9±0.3ab | < 0.01 | 0.008 | < 0.01 | < 0.01 |
| 注:与sham组比较,aP < 0.05;与CA组比较,bP < 0.05;A为Sham组,B为CA组,C为BMSCs组 | |||||||
复苏后第7天,CA组及BMSCs组大鼠血清S100B水平均明显升高; 且BMSCs组血清S100B水平明显低于CA组[(90.12±4.62)pg/mL vs(182.30±2.58)pg/mL,P < 0.05]。
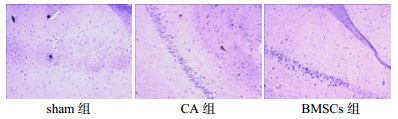
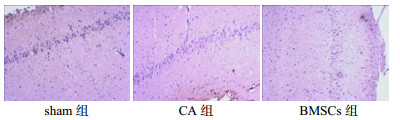
2.3 免疫组化检测NGF、Caspase-3表达情况于复苏后第7天,取大鼠海马区脑组织以免疫组化方法检测NGF、Caspase-3阳性表达水平,并以Image Pro Plus 6.0软件计算其吸光度值。NGF在CA组及BMSCs组表达水平均较Sham组明显升高(均P < 0.05),且BMSCs组表达水平高于CA组(P < 0.05)。Caspase-3在CA组及BMSCs组表达值均较Sham组明显升高(均P < 0.05),但BMSCs组中表达值低于CA组(P < 0.05)。见表 2,图 1~2。
| 组别 | NGF(n=6) | Caspase-3(n=6) |
| Sham组 | 3.299±0.846 | 4.100±0.914 |
| CA组 | 7.744±1.334a | 8.506±1.742a |
| BMSCs组 | 11.391±1.297ab | 6.256±1.036ab |
| 注:与sham组比较,aP < 0.05;与CA组比较,bP < 0.05 | ||
|
| 图 1 各组NGF表达(免疫组化×200) Figure 1 The expression of NGF among the three groups(immunohistochemistry×200) |
|
|
|
| 图 2 各组Caspase-3表达(免疫组化×200) Figure 2 The expression of Caspase-3 among the three groups(immunohistochemistry×200) |
|
|
CA后短时间内因大量神经元细胞坏死及凋亡从而引起脑功能的损伤,但迄今为止尚未有可靠证据完全证实某种药物或方法可对CA后脑复苏有明确的脑保护作用[6-7]。骨髓间充质干细胞(BMSCs)是一类非造血组织来源,但具有多向分化潜能的干细胞,在体外增殖培养过程中发现其可跨胚层、跨谱系分化,并稳定分化为多种中胚层细胞[8],自20世纪60年代末被发现后已被广泛应用于组织修复领域[9]。目前已有很多的动物实验均证实BMSCs移植具有改善神经功能预后[10]、减轻脑组织损害[11]的作用。本课题组前期研究亦已证实BMSCs可定植于海马损伤部位,减轻心脏骤停导致的缺血缺氧性损伤[12]。
本实验组中采用了改良神经功能缺损评分(mNSS),通过运动、感觉、平衡木实验、反射丧失和不正常运动几大方面对大鼠神经功能损伤的严重程度作出评价。Zheng等[13]和Ohtaki等[14]各自通过建立大鼠全脑缺血的动物模型,发现BMSCs治疗组神经元缺失减少,大鼠的认知能力均优于对照组。与文献报道一致,本实验中随着实验天数的增加,BMSCs移植组大鼠mNSS评分明显低于对照组,提示行为学改善明显优于对照组。S100B蛋白是一种低相对分子质量的特异性钙结合蛋白,多在中枢神经系统受到损伤后生成增多。目前认为S100B可作为预测神经功能损伤恢复的一个较为敏感的指标,并可早期对心搏骤停后因全脑缺血导致的神经损伤程度作出预判[15]。本实验结果显示ROSC后7 d,CA组及BMSCs组血清S100B蛋白水平均较sham组明显升高,但BMSCs组水平明显低于对照组。以上结果均证明外源性BMSCs移植可改善全脑缺血后神经功能损伤并促进损伤的神经组织功能的恢复。
BMSCs移植在脑复苏过程中可能通过分化为细胞替代、分泌神经营养因子、抗凋亡、免疫调节、促进血管形成和神经突触发生等机制改善脑复苏后神经功能的恢复[16],其中较为国内外学者接受的机制包括:①旁分泌作用。大脑缺血损伤的早期阶段,在脑缺血部位MSCs可以分泌大量营养因子,其中NGF对维持周围神经系统神经元的发育、表型的维护及对中枢神经系统胆碱能神经元功能的完整起到重要的作用[17-18]。Chen等[19]在建立脑外伤大鼠模型后,分别于1、4、7 d处死实验大鼠,在和MSCs共育的实验组脑组织中,通过ELISA法发现NGF浓度随着实验天数的增加发生相应的增长,提示在脑复苏过程中,NGF通过营养受缺血打击损伤的神经组织,并通过诱导新生血管生成、减少细胞凋亡、促进神经重塑、轴突生长、突触发生及重建神经环路达到脑复苏的目标[20-23]。Hawryluk等[24]在研究神经前体细胞及BMSCs对于大鼠脊髓损伤的修复作用过程中,发现鞘内注射移植BMSCs可明显上调NGF表达。②抗凋亡作用。脑细胞凋亡有内源性和外源性两条主要途径,且这两条途径最终均通过Caspase-3激活从而导致细胞凋亡[25]。范瑞娟等[26]通过线栓法制备大脑中动脉阻塞-再灌注模型,研究发现实验组大鼠Caspase-3表达阳性率较对照组明显减少,推测抑制大鼠脑缺血后Caspase-3的活性可抑制神经元凋亡,从而达到改善神经功能的目的。吴思荣等[27]采用Feeney法制作大鼠中度脑损伤模型,研究发现伤后脑内注射Caspase-3抑制物z-DEVD-fmk后,损伤灶皮质下白质和海马区Caspase-3蛋白和mRNA的表达均明显下降,Caspase-3活性明显降低,同时神经细胞凋亡指数也明显降低。Otsuka等[28]在比较预防性锻炼对于脑卒中大鼠模型神经保护作用的实验中,发现实验组中脑梗死面积、神经功能缺损以及运动能力均较对照组明显改善,同时发现实验组中Caspase-3水平明显低于对照组。由于本课题组前期研究已证实外源性BMSCs移植后可归巢于全脑缺血后大脑海马区损伤部位[29],且在本实验中发现BMSCs组中NGF表达阳性率明显高于CA组,同时Caspase-3表达阳性率则低于对照组。由此笔者可以推断骨髓间充质干细胞对于CA后脑复苏的作用可能与其上调了NGF的表达,同时下调Caspase-3的表达,起到修复营养受损的神经细胞以及抑制神经细胞凋亡的作用有关,从而最终改善CA后脑复苏神经功能。
综上所述,本研究通过观察mNSS评分和血清S100B水平,提示外源性BMSCs移植可促进CA后大鼠全脑缺血性损伤神经功能的恢复,可能与其上调了NGF的表达、下调了Caspase-3的表达有关,但不同剂量BMSCs是否会对脑复苏效果造成影响有待后续实验进一步证实。
| [1] | Madl C, Holzer M. Brain function after resuscitation from cardiac arrest[J]. Curr Opin Crit Care, 2004, 10(3): 213-217. DOI:10.1097/01.ccx.0000127542.32890.fa |
| [2] | Donoghue AJ, Nadkarni V, Berg RA, et al. Out-of-hospital pediatric cardiac arrest: an epidemiologic review and assessment of current knowledge[J]. Ann Emerg Med, 2005, 46(6): 512-522. DOI:10.1016/j.annemergmed.2005.05.028 |
| [3] | Hayashida K, Sano M, Kamimura N, et al. H2 gas improves functional outcome after cardiac arrest to an extent comparable to therapeutic hypothermia in a rat model[J]. J Am Heart Assoc, 2012, 1(5): e003459. DOI:10.1161/JAHA.112.003459 |
| [4] | Xu K, Puchowicz MA, Lust WD, et al. Adenosine treatment delays postischemic hippocampal CA1 loss after cardiac arrest and resuscitation in rats[J]. Brain Res, 2006, 1071(1): 208-217. DOI:10.1016/j.brainres.2005.11.060 |
| [5] | Chen JL, Li Y, Wang L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke, 2001, 32(4): 1005-1011. DOI:10.1161/01.str.32.4.1005 |
| [6] | Belousov AB. Novel model for the mechanisms of glutamate-dependent excitotoxicity: role of neuronal gap junctions[J]. Brain Res, 2012, 1487: 123-130. DOI:10.1016/j.brainres.2012.05.063 |
| [7] | Broughton BR, Reutens DC, Sobey CG. Apoptotic mechanisms after cerebral ischemia[J]. Stroke, 2009, 40(5): e331-339. DOI:10.1161/STROKEAHA.108.531632 |
| [8] | Wang X, Hisha H, Mizokami T, et al. Mouse mesenchymal stem cells can support human hematopoiesis both in vitro and in vivo: the crucial role of neural cell adhesion molecule[J]. Haematologica, 2010, 95(6): 884-891. DOI:10.3324/haematol.2009.013151 |
| [9] | Li XS, Yuan ZW, Wei XW, et al. Application potential of bone marrow mesenchymal stem cell (BMSCs) based tissue-engineering for spinal cord defect repair in rat fetuses with spina bifida aperta[J]. J Mater Sci Mater Med, 2016, 27(4): 77. DOI:10.1007/s10856-016-5684-7 |
| [10] | Hu Y, Zhang Y, Tian K, et al. Effects of nerve growth factor and basic fibroblast growth factor dual gene modification on rat bone marrow mesenchymal stem cell differentiation into neuron-like cells in vitro[J]. Mol Med Rep, 2016, 13(1): 49-58. DOI:10.3892/mmr.2015.4553 |
| [11] | Park BN, Kim JH, Lee K, et al. Improved dopamine transporter binding activity after bone marrow mesenchymal stem cell transplantation in a rat model of Parkinson's disease: small animal positron emission tomography study with F-18 FP-CIT[J]. Euro Radiol, 2015, 25(5): 1487-1496. DOI:10.1007/s00330-014-3549-3 |
| [12] | 陈锋, 林庆明, 唐夏泓, 等. 骨髓间充质干细胞移植修复心搏骤停后大鼠海马神经元损伤[J]. 中华急诊医学杂志, 2017, 26(4): 405-409. DOI:10.3760/cma.j.issn.1671-0282.2017.04.010 |
| [13] | Zheng W, Honmou O, Miyata K, et al. Therapeutic benefits of human mesenchymal stem cells derived from bone marrow after global cerebral ischemia[J]. Brain Res, 2010, 1310: 8-16. DOI:10.1016/j.brainres.2009.11.012 |
| [14] | Ohtaki H, Ylostalo JH, Foraker JE, et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses[J]. Proc Natl Acad Sci U S A, 2008, 105(38): 14638-14643. DOI:10.1073/pnas.0803670105 |
| [15] | Zhang W, Zhang F, Shi H, et al. Comparisons of rabbit bone marrow mesenchymal stem cell isolation and culture methods in vitro[J]. PLos One, 2014, 9(2): e88794. DOI:10.1371/journal.pone.0088794 |
| [16] | Llufriu S, Sepúlveda M, Blanco Y, et al. Randomized placebo-controlled phase Ⅱ trial of autologous mesenchymal stem cells in multiple sclerosis[J]. PLos One, 2014, 9(12): e113936. DOI:10.1371/journal.pone.0113936 |
| [17] | Aloe L, Rocco ML, Bianchi P, et al. Nerve growth factor: from the early discoveries to the potential clinical use[J]. J Transl Med, 2012, 10(1): 239. DOI:10.1186/1479-5876-10-239 |
| [18] | Lewin GR, Lechner SG, Smith ESJ. Nerve growth factor and nociception: from experimental embryology to new analgesic therapy[M]//Lewin GR, Lechner SG, Smith ESJ. eds. Neurotrophic factors. Berlin, Heidelberg: Springer Berlin Heidelberg, 2014: 251-282. DOI: 10.1007/978-3-642-45106-5_10. |
| [19] | Chen XG, Katakowski M, Li Y, et al. Human bone marrow stromal cell cultures conditioned by traumatic brain tissue extracts: growth factor production[J]. J Neurosci Res, 2002, 69(5): 687-691. DOI:10.1002/jnr.10334 |
| [20] | Deng YB, Ye WB, Hu ZZ, et al. Intravenously administered BMSCs reduce neuronal apoptosis and promote neuronal proliferation through the release of VEGF after stroke in rats[J]. Neurol Res, 2010, 32(2): 148-156. DOI:10.1179/174313209X414434 |
| [21] | Guo F, Lv S, Lou Y, et al. Bone marrow stromal cells enhance the angiogenesis in ischaemic cortex after stroke: involvement of notch signalling[J]. Cell Biol Int, 2012, 36(11): 997-1004. DOI:10.1042/CBI20110596 |
| [22] | Li N, Wang P, Ma XL, et al. Effect of bone marrow stromal cell transplantation on neurologic function and expression of VEGF in rats with focal cerebral ischemia[J]. Mol Med Rep, 2014, 10(5): 2299-2305. DOI:10.3892/mmr.2014.2502 |
| [23] | Pavlichenko N, Sokolova I, Vijde S, et al. Mesenchymal stem cells transplantation could be beneficial for treatment of experimental ischemic stroke in rats[J]. Brain Res, 2008, 1233: 203-213. DOI:10.1016/j.brainres.2008.06.123 |
| [24] | Hawryluk GW, Mothe A, Wang J, et al. An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury[J]. Stem Cells Dev, 2012, 21(12): 2222-2238. DOI:10.1089/scd.2011.0596 |
| [25] | Meloni BP, Meade AJ, Kitikomolsuk D, et al. Characterisation of neuronal cell death in acute and delayed in vitro ischemia (oxygen-glucose deprivation) models[J]. J Neurosci Methods, 2011, 195(1): 67-74. DOI:10.1016/j.jneumeth.2010.11.023 |
| [26] | 范瑞娟, 罗亚非, 陈永顺, 等. 桃红四物汤对大鼠脑缺血-再灌注损伤后大脑皮质神经元Caspase-3与p53表达的影响[J]. 神经解剖学杂志, 2015, 31(6): 739-745. DOI:10.16557/j.cnki.1000-7547.2015.06.0012 |
| [27] | 吴思荣, 惠国桢, 李向东, 等. 大鼠创伤性脑损伤后神经细胞凋亡的动态变化及其与caspase-3基因表达的关系[J]. 中华急诊医学杂志, 2009, 18(4): 361-366. DOI:10.3760/cma.j.issn.1671-0282.2009.04.007 |
| [28] | Otsuka S, Sakakima H, Sumizono M, et al. The neuroprotective effects of preconditioning exercise on brain damage and neurotrophic factors after focal brain ischemia in rats[J]. Behav Brain Res, 2016, 303: 9-18. DOI:10.1016/j.bbr.2016.01.04 |
| [29] | Tang X, Chen F, Lin Q, et al. Bone marrow mesenchymal stem cells repair the hippocampal neurons and increase the expression of IGF-1 after cardiac arrest in rats[J]. Exp Ther Med, 2017, 14(5): 4312-4320. DOI:10.3892/etm.2017.5059 |
 2019, Vol. 28
2019, Vol. 28




