脓毒症系机体对感染的反应失调而导致的威胁生命的器官功能障碍[1],是严重创伤、烧伤及外科大手术后常见的并发症之一[2-3]。巨噬细胞作为固有免疫系统的重要组成细胞,广泛分布于全身各个组织,能识别、吞噬及清除病原微生物,在脓毒症发生发展过程中起到免疫监视及防御的作用[4]。
S1P受体(sphingosine 1-phosphate receptor, S1PRs)是一类G蛋白偶联受体,广泛分布于内皮细胞、心肌细胞、神经细胞以及巨噬细胞、树突状细胞、T细胞等免疫细胞,与磷酸分子1-磷酸硝胺醇(sphingosine 1-phosphate, S1P)结合,启动细胞跨膜信号转导效应,介导S1P发挥其第一信使作用,调节细胞增殖、血管生成和炎症反应等[5]。S1PR3作为S1PRs家族中一个主要成员,与三种G蛋白发生偶联(Gi、Gq、G12/G13),介导广泛的生物学效应。当前,对S1PR3调控中枢及外周固有免疫细胞炎症反应的研究较为广泛[6-9]。
本课题组前期研究证实,由同源于S1PR3胞内第二个环的9个氨基酸序列(143 M-R-P-Y-D-A-N-K-R151)组成并经修饰后的肽可特异性活化S1PR3,增强巨噬细胞的细菌清除作用,改善脓毒症预后[10]。本研究通过对该肽进一步优化,并检测其效果,为脓毒症临床转化研究提供实验室基础。
1 材料与方法 1.1 主要材料与试剂 1.1.1 实验动物8周龄,体质量20~25 g,健康清洁级雄性C57BL/6小鼠(购自上海斯莱克实验动物有限公司)
1.1.2 主要试剂大肠杆菌菌株ATCC 25922(美国ATCC公司)、THP-1细胞系(美国ATCC公司),GY-5、RY-15和FITC-RY-15由上海吉尔生化有限公司合成,并经反向高效液相色谱(RP-HPLC)纯化,纯度大于99%。Thioglycollate Medium(上海生工)、DMEM培养基(美国Gibco公司)、PBS缓冲液(美国Gibco公司),DMSO(美国Sigma公司)、庆大霉素(美国Sigma公司)。
1.2 实验方法 1.2.1 骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDMs)制备、培养取8周龄雄性C57BL/6小鼠,颈椎脱臼处死后,用75%酒精浸泡5 min,无菌剥取胫骨和股骨,减去骨两端,用5 mL注射器抽取PBS缓冲液反复冲洗骨髓腔,直至骨髓腔变白,所得骨髓细胞置于50 mL离心管内,1 200 r/min,离心5 min,弃上清液,加入3 mL红细胞裂解液裂解红细胞,室温3 min。PBS缓冲液清洗裂解后细胞3次后,弃上清液,向分离到的骨髓细胞沉淀中加入含20 ng/mL GM-CSF的DMEM完全培养基,并将细胞转移至75 cm2培养瓶中,于37℃、5%CO2培养箱中培养24 h后,吸取未贴壁细胞,1 200 r/min,离心5 min,细胞计数,调整细胞密度为2×106/mL,种于6孔板内,于37℃、5%CO2培养箱内培养6~7 d。细胞每3 d用含20 ng/mL GM-CSF的DMEM培养基换液一次。
1.2.2 激光共聚焦成像检测S1PR3特异性激动剂入胞情况将THP-1细胞系种到confocal培养皿中,细胞密度为2×105/mL,DMEM培养基体积为1 mL; 次日更换培养基,静息3 h后,加入FITC-RY-15,置于37℃、5%CO2培养箱中,分别培养5 min、10 min、20 min、30 min; 激光共聚焦显微镜下观察并拍照。
1.2.3 庆大霉素保护实验将按上述方法所得的BMDMs,加入E. coli(E. coli:细胞=10:1),37 ℃恒温箱,5% CO2环境,吞噬60 min后,终止吞噬,更换新鲜DMEM培养基,并加入庆大霉素(终浓度1 µg/mL)孵育1 h,杀灭胞外残留E. coli,此时作为0点(即反应巨噬细胞吞噬能力)。更换新鲜含GY-5和RY-15的DMEM培养基,继续培养于37℃、5% CO2恒温箱中,培养时间为6 h(反应细胞杀菌能力)。不同时间点采用Triton X-100/PBS裂解细胞,收集裂解液,10倍梯度稀释后,LB板培养,并计算菌落数。
1.2.4 Western Blot检测ERK通路磷酸化水平将THP-1细胞系种于24孔板内,细胞密度为1×106/孔,培养基体积为400 μL; 次日更换培养基,静息3 h后,分别加入GY-5、RY-15,置于37℃,5%CO2培养箱中,分别培养10 min、20 min、30 min。提取细胞总蛋白,用Western Blot方法检测ERK和p-ERK表达水平。
1.3 统计学方法使用SPSS 17.0软件做统计学分析,计量资料采用均数±标准差(x±s)表示,组间数据比较采用独立样本t检验分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 人工合成S1PR3特异性激动剂的分子式如表 1所示,KRX-725是同源于S1PR3胞内第二个环的含9个氨基酸序列的短肽,前期研究证明[10],该短肽可以特异性激活S1PR3,增强巨噬细胞细菌清除作用,改善脓毒症预后。在此基础上,我们对该肽的结构进一步优化,合成了GY-5短肽,使其能与S1PR3胞内第二个环结合,激活下游通路。有研究表明,富含精氨酸的肽有显著的跨膜效应[11]。因此,本研究在GY-5短肽的C端增加了9个精氨酸,以增加其入胞的功能,即RY-15。进一步地,在RY-15的C端增加了FITC荧光染料,以验证其入胞效果。
| 名称 | 氨基酸序列 |
| KRX-725 | 143 M-R-P-Y-D-A-N-K-R 151 |
| GY-5 | GNleRPY-NH2 |
| RY-15 | RRRRRRRRRGGNleRPY-NH2 |
| FITC-RY | FITC-RRRRRRRRRGGNleRPY-NH2 |
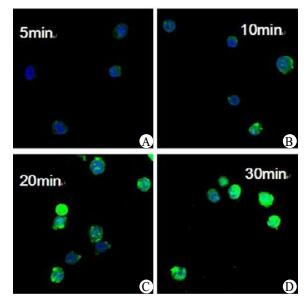
为检测S1PR3特异性激动剂RY-15的入胞效果,将带FITC荧光染料的RY-15与THP-1细胞系于37℃、5%CO2培养箱中共培养5 min、10 min、20 min、30 min后,用激光共聚焦显微镜观察并拍照,如图 1。结果显示,RY-15作用THP-1细胞10 min后,开始入胞; 30 min后,入胞效果显著。
|
| RY-15与THP-1细胞系分别共培养5 min(A)、10 min(B)、20 min(C)、30 min(D)。10 min后,RY-15开始入胞; 30 min后,RY-15入胞效果显著 图 1 RY-15作用不同时间点后入胞效果比较 Figure 1 Compare the effects of entering cell after RY-15 stimulating for different time in THP-1 cell |
|
|
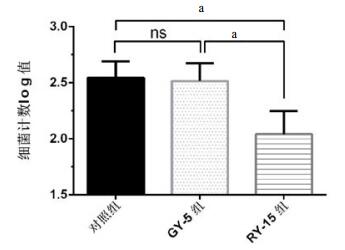
为观察GY-5和RY-15对于巨噬细胞清除细菌能力的作用,采用庆大霉素保护实验观察大肠杆菌被吞噬后的清除率。结果显示,GY-5和RY-15作用BMDMs 6 h后,GY-5组与对照组差异无统计学意义(n=3, t=0.864 1, P > 0.05),RY-15组细菌明显低于对照组(n=3, t=6.046, P < 0.05),如图 2。
|
| GY-5和RY-15作用于BMDMs 6 h后,GY-5组和RY-15组菌落数比较(n=3)。ns表示差异无统计学意义,aP < 0.05 图 2 GY-5和RY-15对BMDMs清除细菌功能的影响 Figure 2 The bactericidal effect of GY-5 and RY-15 in BMDMs |
|
|
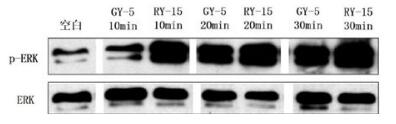
既往研究证明,S1PR3可以通过Gi活化下游的ERK通路,使其磷酸化[12-13]。因此,我们检测了GY-5和RY-15对巨噬细胞ERK通路的磷酸化水平,如图 3。结果显示,GY-5、RY-15均可以使ERK通路磷酸化,而RY-15对其活化作用更显著。有研究表明,巨噬细胞发挥吞噬杀菌作用,与细胞内ERK通路的活化有关[14-16]。因此,RY-15促进巨噬细胞清除细菌,可能是通过ERK通路的活化来发挥作用的,但具体的作用机制尚需进一步的实验证实。
|
| 注:GY-5和RY-15分别作用于THP-1细胞10 min、20 min、30 min后,检测ERK和p-ERK表达水平 图 3 GY-5和RY-15对THP-1细胞ERK磷酸化的影响 Figure 3 Compare the effects of GY-5 and RY-15 on ERK phosphorylation in THP-1 cell |
|
|
革兰阴性菌是脓毒症的主要致病菌[19],细菌的感染导致机体出现异常的炎症、免疫等反应,进而导致严重的器官功能障碍[1]。最新数据显示,每年全球超过1 900万人罹患脓毒症,其中死亡人数高达530万[2, 17-18]。
S1PR3属于七次跨膜G蛋白偶联受体家族成员,组成性表达于巨噬细胞等固有免疫细胞表面。S1PR3在介导免疫细胞炎症反应等方面已有很广泛的研究[20]。然而,S1PR3在巨噬细胞清除细菌方面的作用尚缺乏系统报道。
由同源于S1PR3胞内第二个环的9个氨基酸序列(143 M-R-P-Y-D-A-N-K-R151)组成并经修饰后的肽可特异性活化S1PR3,增强巨噬细胞细菌清除作用,改善脓毒症预后[10]。本研究对该肽进一步优化,得到了GY-5和RY-15,并检测其效果。首先,将带FITC荧光染料的RY-15与THP-1细胞系共培养5 min、10 min、20 min、30 min后,用激光共聚焦显微镜观察并拍照。结果显示,RY-15作用THP-1细胞10 min后,开始入胞; 30 min后,入胞效果显著。进一步地,通过庆大霉素保护实验,观察到RY-15能明显促进巨噬细胞对细菌的清除。在机制方面,本研究检测了GY-5和RY-15对THP-1细胞ERK通路的磷酸化水平,结果显示,GY-5和RY-15均可以使ERK通路磷酸化,且RY-15对其活化作用更显著。有研究表明,巨噬细胞等发挥吞噬杀菌作用,与细胞内ERK通路的活化有关[14-16]。因此,RY-15促进巨噬细胞清除细菌,可能是通过ERK通路的活化来发挥作用的,但具体的作用机制尚需进一步的实验证实。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Angus DC, van der Poll T. Severe sepsis and septic shock[J]. N Engl J Med, 2013, 369: 840-851. DOI:10.1056/NEJMra1208623 |
| [3] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [4] | Epelman S, Lavine KJ, Randolph GJ. Origin and functions of tissue macrophages[J]. Immunity, 2014, 41(1): 21-35. DOI:10.1016/j.immuni.2014.06.013 |
| [5] | Rosen H, Gonzalez-Cabrera PJ, Sanna MG, et al. Sphingosine 1-phosphate receptor signaling[J]. Annu Rev Biochem, 2009, 78(7): 743-768. DOI:10.1146/annurev.biochem.78.072407.103733 |
| [6] | Niessen F, Schaffner F, Furlan-Freguia C, et al. Dendritic cell PAR1-S1P3 signalling couples coagulation and inflammation[J]. Nature, 2008, 452(7187): 654-658. DOI:10.1038/nature06663 |
| [7] | Awojoodu AO, Ogle ME, Sefcik LS, et al. Sphingosine 1-phosphate receptor 3 regulates recruitment of anti-inflammatory monocytes to microvessels during implant arteriogenesis[J]. Proc Natl Acad Sci US A, 2013, 110(34): 13785-13790. DOI:10.1073/pnas.1221309110 |
| [8] | Nussbaum C, Bannenberg S, Keul P, et al. Sphingosine-1-phosphate receptor 3 promotes leukocyte rolling by mobilizing endothelial P-selectin[J]. Nat Commun, 2015, 6: 6416. DOI:10.1038/ncomms7416 |
| [9] | Van Doorn R, Van Horssen J, Verzijl D, et al. Sphingosine 1-phosphate receptor 1 and 3 are upregulated in multiple sclerosis lesions[J]. Glia, 2010, 58(12): 1465-1476. DOI:10.1002/glia.21021 |
| [10] | 张坚, 侯金超, 徐孟龙, 等. S1PR3激动剂KRX-725促进细菌清除影响脓毒症小鼠预后[J]. 中华急诊医学杂志, 2016, 25(1): 57-62. DOI:10.3760/cma.j.issn.1671-0282.2016.01.013 |
| [11] | Futaki S, Suzuki T, Ohashi W, et al. Arginine-rich peptides. An abundant source of membrane-permeable peptides having potential as carriers for intracellular protein delivery[J]. J Biol Chem,, 2001, 276(8): 5836-5840. DOI:10.1074/jbc.M007540200 |
| [12] | Kimura T, Watanabe T, Sato K, et al. Sphingosine 1-phosphate stimulates proliferation and migration of human endothelial cells possibly through the lipid receptors, Edg-1 and Edg-3[J]. Biochem J, 2000, 348: 71-76. DOI:10.1042/bj3480071 |
| [13] | An S, Zheng Y, Bleu T. Sphingosine 1-phosphateinduced cell proliferation, survival, and related signaling events mediated by G protein-coupled receptors Edg3 and Edg5[J]. J Biol Chem, 2000, 275: 288-296. DOI:10.1074/jbc.275.1.288 |
| [14] | Shiratsuchi H, Basson MD. Activation of p38 MAPKalpha by extracellular pressure mediates the stimulation of macrophage phagocytosis by pressure[J]. Am J Physiol Cell Physiol, 2005, 288(5): C1083-1093. DOI:10.1152/ajpcell.00543.2004 |
| [15] | Parsa KV, Butchar JP, Rajaram MV, et al. The tyrosine kinase Syk promotes phagocytosis of Francisella through the activation of Erk[J]. Mol Immunol, 2008, 45(10): 3012-3021. DOI:10.1016/j.molimm.2008.01.011 |
| [16] | McLeish KR, Klein JB, Coxon PY, et al. Bacterial phagocytosis activates extracellular signal-regulated kinase and p38 mitogen-activated protein kinase cascades in human neutrophils[J]. J Leukoc Biol, 1998, 64(6): 835-844. DOI:10.1002/jlb.64.6.835 |
| [17] | SepNet Critical Care Trials Group. Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study[J]. Intensive Care Med, 2016, 42(12): 1980-1989. DOI:10.1007/s00134-016-4504-3 |
| [18] | Adhikari NK, Fowler RA, Bhagwanjee S, et al. Critical care and the global burden of critical illness in adults[J]. Lancet, 2010, 376(9749): 1339-1346. DOI:10.1016/S0140-6736(10)60446-1 |
| [19] | Cheng B, Xie G, Yao S, et al. Epidemiology of severe sepsis in critically ill surgical patients in ten university hospitals in China[J]. Crit Care Med, 2007, 35(11): 2538-2546. DOI:10.1097/01.CCM.0000284492.30800.00 |
| [20] | 陈悦, 侯金超, 孙亚奇, 等. Myristoyl-glycine修饰的S1PR3特异性激动肽跨膜激活效应研究[J]. 中华急诊医学杂志, 2017(12): 1418-1421. DOI:10.3760/cma.j.issn.1671-0282.2017.12.017 |
 2018, Vol. 27
2018, Vol. 27




