急性胰腺炎(acute pancreatitis,AP)是指多种病因导致胰腺组织自身消化所致的胰腺水肿、出血及坏死等炎性损伤。当合并多器官功能障碍及胰腺局部并发症时,常常会危及患者生命,病死率可高达30%[1]。因此,对AP病情严重程度的早期识别具有重要的意义。2012年,国际胰腺病协会发布了修订版亚特兰大标准,AP按严重程度分为轻度急性胰腺炎(mild acute pancreatitis,MAP)、中度急性胰腺炎(moderately severe acute pancreatitis,MSAP)和重度急性胰腺炎(severe acute pancreatitis,SAP)[2]。20%~30%的AP,因过度全身炎症反应和胰腺坏死可进一步发展为SAP,主要以持续性多器官功能衰竭为特征性表现。强离子隙(strong ion gap,SIG)是一种反映体内酸碱失衡的新诊断指标,研究发现,SIG对危重患者的病情判断及预后评估具有重要的价值[3-4]。国内已有学者在急性中毒等疾病中有所应用[5]。因此,本研究拟探讨SIG在亚特兰大新分类标准下预测急性胰腺炎严重程度的价值。
1 资料与方法 1.1 一般资料选择2015年1月至2016年12月入住苏州大学附属第一医院的急性胰腺炎患者。诊断标准依据中华医学会外科学分会2014年发布的《急性胰腺炎诊治指南》[6]。纳入标准:符合急性胰腺炎诊断;年龄≥18周岁;发病至入院时间≤48 h。排除标准:糖尿病酮症酸中毒,慢性肾功能不全等其他疾病。
1.2 研究内容 1.2.1 资料收集收集患者临床资料包括年龄、性别、原发病因、住院时间、急性生理与慢性健康评分(APACHEⅡ)、Ranson评分等,患者入院后通过取动脉血检测患者pH值、PaO2、PaCO2、HCO3-、阴离子隙(anion gap, AG);通过取测静脉血检测患者血清电解质、白蛋白(ALB)、总胆红素(TBIL)、血肌酐(Scr)等指标。
1.2.2 检测及计算方法本研究动脉血气分析采用丹麦雷度ABL90血气分析仪,美国强生vitros5600生化分析仪及专机试剂和质控品测定血电解质、白蛋白和血肌酐等指标。血电解质主要包括钠离子(Na+)、钾离子(K+)、氯离子(Cl-)、磷离子(Pi-)。所有检测均在留取标本后2 h内完成。SIG可根据公式计算:SIG=AG-A-=AG-ALB(g/dL)×(1.2×pH-6.15)-PO4-×(0.097×pH-0.13);AG=Na++K+-Cl--HCO3-;PO4-(mg/dL)=Pi-(mmol/L)/0.323。
1.2.3 分组根据2012年修订版亚特兰大分类标准将患者分为MAP组、MSAP组和SAP组。MAP组是指无器官功能衰竭及局部或全身并发症;MSAP组是指有一过性(≤48 h)的器官功能衰竭;SAP组是指有持续(> 48 h)的器官功能衰竭。器官功能衰竭的诊断标准是根据改良Marshall评分确定,呼吸、心血管及肾脏任何一个器官评分≥2分定义为器官功能衰竭。
1.3 统计学方法应用SPSS 19.0统计软件进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,偏态分布的计量资料以中位数(四分位数)[M(P25, P75)]表示;组间计量资料的比较采用单因素方差分析或Kruskal-Wallis检验,组间两两比较采用Dunnett-t检验;计数资料的比较采用χ2检验或Fisher确切概率法;数据之间的相关性采用Spearman相关性分析;各指标对疾病严重程度预测价值的评价采用ROC曲线分析,并采用Z检验比较不同指标的曲线下面积(AUC)。以P < 0.05为差异具有统计学意义。
2 结果 2.1 三组患者的临床资料比较本研究共纳入AP患者133例,其中男92例,女41例,年龄18~81岁。三组患者年龄、性别的差异均无统计学意义(P > 0.05)。病因以胆源性AP最多,其次是高脂血症性与酒精性,分别占胰腺炎患者的60.9%、21.8%、10.5%。AP患者TBIL随着病情的加重有所增加,但差异无统计学意义(P > 0.05);随着胰腺炎严重程度的增加,Scr水平、APACHEⅡ评分、Ranson评分、住院时间、死亡人数均逐渐增加,三组间差异均有统计学意义(P < 0.01)。见表 1。
| 指标 | MAP组 (n=55) |
MSAP组 (n=52) |
SAP组 (n=26) |
P值 |
| 年龄(岁) | 52.6±18.6 | 53.7±16.4 | 55.8±17.1 | 0.744 |
| 性别(男/女) | 33/22 | 38/14 | 21/5 | 0.124 |
| 病因(例, %) | 0.039 | |||
| 胆源性 | 39(70.9) | 30(57.7) | 12(46.2) | |
| 酒精性 | 2(3.6) | 9(17.3) | 3(11.5) | |
| 高脂血症性 | 8(14.5) | 12(23.1) | 9(34.6) | |
| 其他 | 6(11.0) | 1(1.9) | 2(7.7) | |
| TBIL[μmol/L, M(P25, P75)] | 21.7(11.4, 32.5) | 22.9(10.6, 37.3) | 24.5(12.1, 49.8) | 0.457 |
| Scr[μmol/L, M(P25, P75)] | 64(49, 92) | 97(77, 123) | 141(105, 219) | <0.01 |
| APACHEⅡ[M(P25, P75)] | 3(2, 6) | 8(6, 14) | 14(9, 18) | <0.01 |
| Ranson评分[M(P25, P75)] | 1(0, 2) | 2(2, 4) | 4(3, 6) | <0.01 |
| 住院时间[d, M(P25, P75)] | 9(7, 12) | 11(9, 16) | 23(14, 31) | <0.01 |
| 死亡人数(例, %) | 0 | 0 | 4(15.4) | <0.01 |
| SIG (mmol/L, x±s) | 2.78±1.90 | 5.04±2.36 | 9.31±4.52 | <0.01 |
| 注:TBIL,总胆红素;Scr,血肌酐;SIG,强离子间隙 | ||||
如表 1所示,三组患者SIG比较差异有统计学意义(P < 0.01)。其中,SAP组SIG水平(9.31 ±4.52)最高,MSAP组(5.04±2.36)其次,均明显高于MAP组(2.78±1.90)。各组两两比较,SAP分别与MSAP和MAP(t=6.087,P < 0.01;t=8.975,P < 0.01),MSAP与MAP(t=3.484,P < 0.01)差异均有统计学意义。
2.3 SIG与APACHEⅡ评分、Ranson评分、住院时间的相关性SIG与APACHEⅡ评分(r=0.567,P < 0.01)、Ranson评分(r=0.502,P < 0.01)及住院时间(r=0.589,P < 0.01)均呈正相关。
2.4 SIG、Scr、APACHEⅡ评分及Ranson评分预测AP严重程度的价值SIG、Scr、APACHEⅡ评分及Ranson评分分别绘制ROC曲线,发现各指标预测MSAP+SAP组和SAP组ROC曲线下面积AUC均 > 0.5,结果见表 2、图 1。对SIG与Scr、APACHEⅡ评分及Ranson评分分别进行比较。ROC曲线分析发现,预测MSAP+SAP时,SIG的诊断效能优于Scr(0.874±0.029 vs .0.735±0.043,P < 0.01),但分别与APACHEⅡ评分(0.874±0.029 vs. 0.895±0.025,P > 0.05)及Ranson评分比较(0.874±0.029 vs. 0.890±0.025,P > 0.05),差异均无统计学意义;在预测SAP时,SIG与APACHEⅡ评分(0.910±0.030 vs. 0.867±0.034,P > 0.05)及Ranson评分(0.910±0.030 vs.0.871±0.032,P > 0.05)比较,差异均无统计学意义,但与Scr比较(0.910±0.030 vs. 0.755±0.054,P < 0.01),差异有统计学意义。
| 指标 | AUC | S.E. | 95%CI | Z值 | P值 |
| MSAP+SAP组 | |||||
| SIG | 0.874 | 0.029 | 0.805~0.925 | 12.781 | <0.01 |
| Scr | 0.735 | 0.043 | 0.652~0.808 | 5.455 | <0.01 |
| APACHE Ⅱ | 0.895 | 0.025 | 0.830~0.941 | 15.625 | <0.01 |
| Ranson | 0.890 | 0.025 | 0.824~0.937 | 15.362 | <0.01 |
| SAP组 | |||||
| SIG | 0.910 | 0.030 | 0.848~0.953 | 13.715 | <0.01 |
| Scr | 0.755 | 0.054 | 0.673~0.825 | 4.703 | <0.01 |
| APACHE Ⅱ | 0.867 | 0.034 | 0.797~0.919 | 10.666 | <0.01 |
| Ranson | 0.871 | 0.032 | 0.802~0.923 | 11.667 | <0.01 |
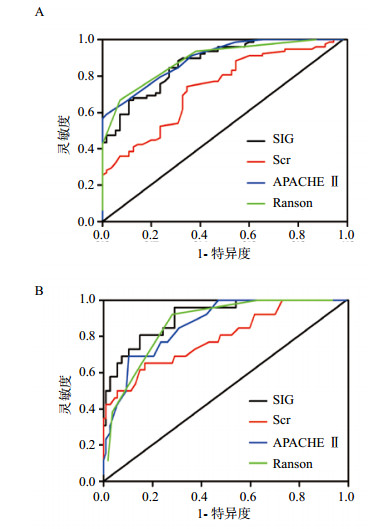
|
| A:预测MSAP+SAP时的ROC曲线;B:预测SAP时的ROC曲线 图 1 SIG、Scr、APACHEⅡ评分及Ranson评分预测AP严重程度的ROC曲线 Figure 1 ROC curves of SIG, Scr, APACHEⅡ score and Ranson score for predicting the severity of acute pancreatitis |
|
|
根据修订版的亚特兰大新标准,至少持续48 h器官功能障碍的AP才认定为SAP,也就是说AP发病后48 h是病情分级的时间窗,早期对AP的病情评估和预后判断有利于临床进行早期干预,防止向SAP发展。
酸碱平衡紊乱在危重患者中是最常见的,既往判断具体酸碱平衡紊乱是基于Henderson-Hasselbalch方程和阴离子间隙(AG)等的计算而来。SIG作为一个较新的监测人体内环境状态的指标,是通过检测动脉血气各项指标和静脉血电解质值后应用Stewart-Figge方法学的方程式计算得到的数值。校正了低白蛋白血症、磷酸盐及其他未测阴离子干扰影响,其结果比传统判断酸碱紊乱的方法更加稳定可靠[7]。有研究表明在预测复杂性酸碱紊乱和危重疾病的死亡能力方面,SIG比AG更有优势[8]。SIG作为未测定阴离子的总称,不受呼吸性酸碱平衡紊乱以及某些药物的影响,其本身也与pH值无关,因此能更有效地评价酸碱平衡紊乱,为危重患者早期病情进展和治疗效果提供可靠的预测依据。
在对一些危重患者的研究中发现,SIG虽然有一定的价值,但对死亡预测的风险能力较差[9];对入住重症监护室的6 878例危重患者酸碱平衡标记物进行分析发现[10],SIG的预测病死率的能力有限(AUC=0.631,95% CI:0.611~0.652),而去除乳酸影响后的SIG预测价值更低(AUC=0.521,95% CI:0.500~0.542)。而在另一项研究中发现,在ICU住院的危重患者中,SIG水平在入ICU前3 d时间里明显增加,是患者28 d内死亡有效的预测指标[11]。Funk等[12]比较心脏骤停后两个重要监测指标SIG和乳酸对复苏后存活患者中的预测价值,研究表明SIG的变化不受年龄、肾上腺素剂量、自主循环恢复时间和其他酸碱失衡指标的影响,升高的SIG水平与复苏后脑功能障碍表现相一致。另外,在依赖机械通气的危重患者中,SIG较其他酸碱平衡指标,能更有效地预测死亡风险[13]。
本研究发现SAP组SIG的水平最高,MSAP组其次,MAP组最低;表明SIG的水平在不同严重程度组之间存在差异。此外还发现,SIG与APACHEⅡ评分、Ranson评分及住院时间均呈正相关,进一步说明SIG水平可以反映急性胰腺炎的严重程度。住院时间是评估危重患者预后的重要指标,这就提示SIG可以用来判断临床预后。AP患者通常是从全身炎症反应开始,逐渐影响全身多个器官功能,常常因血流动力学改变导致灌注不足和内环境紊乱,这也许是AP患者SIG升高的重要原因[14]。肾脏是AP发生发展后容易受累的器官之一[15],Scr的异常被认为是SIG升高的独立危险因素[16]。本研究发现,随着病情的加重,Scr水平明显升高,SIG也出现明显差异,提示SIG可能与AP引起的急性肾损伤密切相关。ROC曲线也表明,在预测SAP严重程度方面,SIG诊断效能明显优于Scr,因此,SIG较Scr对AP的严重程度有更好的预测价值。
通过ROC曲线检验SIG预测AP严重程度的价值,并与经典的预测AP严重程度的APACHEⅡ评分、Ranson评分两种方法进行比较。本研究发现,在区分MSAP+SAP和SAP时,SIG与APACHEⅡ评分、Ranson评分AUC均大于0.5,三者诊断效能相仿。说明SIG在预测AP严重性方面,与APACHEⅡ评分、Ranson评分相当,但APACHEⅡ评分、Ranson评分因计算繁杂,使用并不方便,而SIG简单、快速、准确,值得在临床应用推广。
| [1] | Forsmark CE, Baillie J. AGA Institute technical review on acute pancreatitis[J]. Gastroenterology, 2007, 132(5): 2022-2044. DOI:10.1053/j.gastro.2007.03.065 |
| [2] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [3] | Kim S. Prognostic value of an initial strong ion gap in critically ill patients at the emergency department[J]. Ann Emerg Med, 2005, 46(3): 104-105. DOI:10.1016/j.annemergmed.2005.06.386 |
| [4] | Kaplan LJ, Kellum JA. Initial pH, base deficit, lactate, anion gap, strong ion difference, and strong ion gap predict outcome from major vascular injury[J]. Crit Care Med, 2004, 32(5): 1120-1124. DOI:10.1097/01.CCM.0000125517.28517.74 |
| [5] | 贾凌, 孙兆瑞, 杨志洲, 等. 强离子隙和肝肾功能在百草枯中毒中的应用比较[J]. 中华急诊医学杂志, 2015, 24(2): 192-195. DOI:10.3760/cma.j.issn.1671-0282.2015.02.017 |
| [6] | 中华医学会外科学分会胰腺外科学组. 急性胰腺炎诊治指南(2014)[J]. 中华外科杂志, 2015, 53(1): 50-53. DOI:10.3760/cma.j.issn.0529-5815.2015.01.012 |
| [7] | Kaae J, de Morais HA. Anion gap and strong ion gap: a quick reference[J]. Vet Clin North Am Small Anim Pract, 2008, 38(3): 443-447. DOI:10.1016/j.cvsm.2008.01.022 |
| [8] | Fidkowski C, Helstrom J. Diagnosing metabolic acidosis in the critically ill: bridging the anion gap, Stewart, and base excess methods[J]. Can J Anaesth, 2009, 56(3): 247-256. DOI:10.1007/s12630-008-9037-y |
| [9] | Rocktaeschel J, Morimatsu H, Uchino S, et al. Unmeasured anions in critically ill patients: can they predict mortality?[J]. Crit Care Med, 2003, 31(8): 2131-2136. DOI:10.1097/01.CCM.0000079819.27515.8E |
| [10] | Ho KM, Lan NS, Williams TA, et al. A comparison of prognostic significance of strong ion gap (SIG) with other acid-base markers in the critically ill: a cohort study[J]. J Intensive Care, 2016, 4: 43. DOI:10.1186/s40560-016-0166-z |
| [11] | Antonini B, Piva S, Paltenghi M, et al. The early phase of critical illness is a progressive acidic state due to unmeasured anions[J]. Eur J Anaesthesiol, 2008, 25(7): 566-571. DOI:10.1017/S0265021508003669 |
| [12] | Funk GC, Doberer D, Sterz F, et al. The strong ion gap and outcome after cardiac arrest in patients treated with therapeutic hypothermia: a retrospective study[J]. Intensive Care Med, 2009, 35(2): 232-239. DOI:10.1007/s00134-008-1315-1 |
| [13] | Novovic MN, Jevdjict J. Prediction of mortality with unmeasured anions in critically ill patients on mechanical ventilation[J]. Vojnosanit Pregl, 2014, 71(10): 936-941. DOI:10.2298/VSP1410936N |
| [14] | Wang GJ, Gao CF, Wei D, et al. Acute pancreatitis: etiology and common pathogenesis[J]. World J Gastroenterol, 2009, 15(12): 1427-1430. DOI:10.3748/wjg.15.1427 |
| [15] | Layer P, Dellinger EP, Forsmark CE, et al. Determinant-based classification of acute pancreatitis severity. International multidisciplinary classification of acute pancreatitis severity: the 2013 German edition[J]. Z Gastroenterol, 2013, 51(6): 544-550. DOI:10.1055/s-0033-1335526 |
| [16] | Zheng CM, Liu WC, Zheng JQ, et al. Metabolic acidosis and strong ion gap in critically ill patients with acute kidney injury[J]. Biomed Res Int, 2014, 2014: 819528. DOI:10.1155/2014/819528 |
 2018, Vol. 27
2018, Vol. 27




