急性胰腺炎(acute pancreatitis, AP)是一种临床常见的消化系统急症,在2009年美国消化系统疾病中,AP是患者住院的最主要的疾病,全年有超过27万住院患者,治疗费用超过26亿美元[1]。轻症病情常呈自限性,预后好;而重症患者病情危重、并发症多、病死率高,尽管目前重症急性胰腺炎的治疗有所改善,但仍有较高的发病率和病死率[2-3]。因此早期评估AP患者严重程度和预后对早期给予合理的支持治疗十分重要。目前有诸多评分系统、实验室生化指标对AP严重程度及预后进行评估,但仍未找到一种能很好地评估入院时及治疗过程中AP病情严重程度及预后的指标。近年来,心肌损伤及心功能障碍在危重疾病中受到广泛关注[4-6],国内也有关于心肌损伤与AP病情评估的相关报道[7-8],但病例数相对较小,且不符合目前新指南对AP严重程度分型的要求。本研究按照最新的指南诊断及分类标准,探讨心肌损伤相关标记物对AP严重程度的预测价值。
1 资料与方法 1.1 一般资料以2015年1月至2016年12月期间上海交通大学医学院附属瑞金医院急诊科收治的AP患者为分析对象,通过查阅患者病历数据库,回顾分析患者的临床资料。
1.1.1 纳入标准临床符合2012年亚特兰大AP诊断标准,并确诊为AP患者;临床资料齐全;发病时间 < 7 d。
1.1.2 患者排除标准年龄小于16周岁;妊娠期或哺乳期妇女;恶性肿瘤患者;慢性胰腺炎或胰腺炎清创术后患者;既往有急慢性心血管疾病的患者;入院前即存在慢性器官功能衰竭的患者。
1.2 病例分组根据2012亚特兰大国际共识制定的AP严重程度分类标准,结合患者入院72 h内病情严重程度评估,将临床资料齐全的患者分为轻症(mild acute pancreatitis, MAP)、中度重症(moderate severe acute pancreatitis, MSAP)、重症急性胰腺炎(SAP)三组。
轻症急性胰腺炎(MAP)为不伴有器官功能衰竭及局部或全身并发症的患者;中度重症急性胰腺炎(MSAP)为伴有一过性(< 48 h)的器官功能障碍或有局部并发症的患者;重症急性胰腺炎(SAP)为伴有持续的器官功能衰竭(48 h以上)的患者。
器官功能衰竭的诊断标准依据改良的Marshall评分系统,任何器官评分≥2分定义为存在器官功能衰竭[9]。
1.3 临床资料收集 1.3.1 基本信息姓名、性别、年龄、住院号、发病至入我院的时间、病因,平时有无高血压、糖尿病等慢性疾病,平时有无烟酒嗜好等生活习惯。
1.3.2 心肌损伤标记物和其他生化检测指标入院72 h内的cTnI(ng/mL)、CK-MB(ng/mL)、NT-proBNP(pg/mL)、CRP(mg/L)、PCT(ng/mL)最高值。
1.3.3 患者疾病严重程度评分变化入院72 h急性生理和慢性健康(APACHEⅡ)评分、序贯器官衰竭评分(SOFA)、性胰腺炎床旁指数(BISAP)评分、CT严重程度指数(CTSI)评分最高值。
1.4 统计学方法计量资料采用均数±标准差(x±s)表示,三组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,两组间比较采用成组t检验。采用Empower stats统计软件进行统计分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 基线资料符合本研究条件,且临床资料齐全最终纳入本研究进行分析的病例共有246例,男163例(66.26%),女83例(33.74%);年龄范围17~91岁,(48.15±14.72)岁;其中MAP 47例(19.11%),MSAP 151例(61.38%),SAP 48例(19.51%)。三组患者在性别与年龄构成、是否合并高血压、糖尿病等慢性疾病及是否有烟酒嗜好等生活习惯上差异无统计学意义,见表 1。
| 指标 | MAP组 | MSAP组 | SAP组 | P值 |
| 性别(男/女) | 29/18 | 97/54 | 37/11 | 0.199 |
| 年龄(岁, x±s) | 51.5±16.9 | 46.4±14.2 | 50.4±14.2 | 0.060 |
| 高血压(例, %) | 15(31.9) | 45(29.8) | 21(43.8) | 0.198 |
| 糖尿病(例, %) | 12(25.5) | 38(25.2) | 8(16.7) | 0.453 |
| 吸烟(例, %) | 16(34.0) | 50(33.1) | 25(52.1) | 0.054 |
| 饮酒(例, %) | 14(29.8) | 54(36.0) | 22(45.8) | 0.257 |
三组间比较发现,SAP较MAP、MSAP各指标的检验结果和疾病严重程度相关评分均显著升高,见表 2。
| 指标 | MAP组 | MSAP组 | SAP组 | P值 |
| CRP(mg/L) | 51.39±60.07 | 115.97±82.91 | 174.69±87.40 | <0.01 |
| PCT(ng/mL) | 1.27±4.14 | 1.03±1.61 | 7.36±12.05 | <0.01 |
| CTSI评分 | 1.38±0.75 | 3.07±1.64 | 4.30±1.28 | <0.01 |
| BISAP评分 | 0.60±0.71 | 1.53±0.86 | 2.50±0.88 | <0.01 |
| APACHEⅡ评分 | 3.06±2.65 | 5.33±3.45 | 12.21±5.85 | <0.01 |
| SOFA评分 | 0.72±0.90 | 2.23±1.89 | 6.10±2.97 | <0.01 |
| ProBNP(pg/mL) | 151.63±364.48 | 285.52±469.23 | 841.35±1666.53 | <0.01 |
| CK-MB(ng/mL) | 0.86±0.85 | 1.30±1.34 | 9.01±26.28 | <0.01 |
| cTnI(ng/mL) | 0.015±0.019 | 0.020±0.049 | 0.356±1.522 | 0.016 |
为判断心肌损伤标记物对SAP的预测价值,本研究对AP患者进一步分组,将研究对象分为SAP组与非SAP组(即MAP+MSAP),分别比较两组的各指标及相关评分水平。结果发现,SAP组较非SAP组各指标及相关评分水平显著升高(表 3)。
| 指标 | 非SAP组 | SAP组 | P值 |
| CRP(mg/L) | 103.51±82.90 | 174.69±87.40 | <0.01 |
| PCT(ng/mL) | 1.07±2.20 | 7.36±12.05 | <0.01 |
| CTSI评分 | 2.68±1.64 | 4.30±1.28 | <0.01 |
| BISAP评分 | 1.30±0.91 | 2.50±0.88 | <0.01 |
| APACHEⅡ评分 | 4.79±3.41 | 12.21±5.85 | <0.01 |
| SOFA评分 | 1.87±1.82 | 6.10±2.97 | <0.01 |
| ProBNP(pg/mL) | 246.43±444.33 | 841.35±1 666.53 | <0.01 |
| CK-MB(ng/mL) | 1.20±1.26 | 9.01±26.28 | <0.01 |
| cTnI(ng/mL) | 0.019±0.044 | 0.356±1.52 | <0.01 |
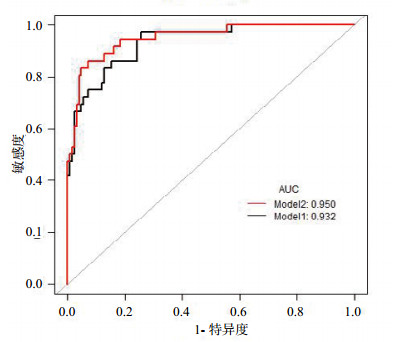
本研究用ROC曲线来描述各指标/评分对SAP的预测能力,建立两个模型来检测将这些指标综合在一起对SAP的预测效应(图 1),并检验心肌损伤标记物对SAP是否有预测价值。模型1为CRP与PCT水平、CTSI评分、BISAP评分、APACHEⅡ评分和SOFA评分的综合,称之为传统指标;模型2为传统指标加上proBNP、CK-MB、cTnI的综合。
|
| 模型1为传统指标的ROC曲线(AUC=0.932),模型2为传统指标加上心肌损伤标记物的ROC曲线(AUC=0.950),传统指标的参数包括CRP与PCT值、CTSI评分、BISAP评分、APACHE Ⅱ评分和SOFA评分,心肌损伤标记物包括proBNP、CK-MB和cTnI。Model 1 vs. Model 2,P=0.09 图 1 模型1与模型2对SAP的预测效应 Figure 1 The predictive effect of model 1 and model 2 for SAP |
|
|
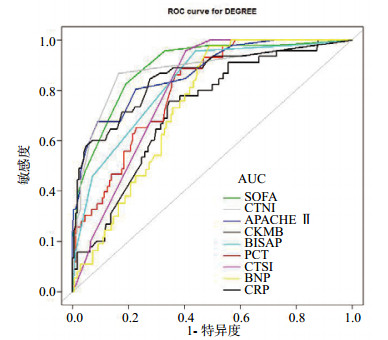
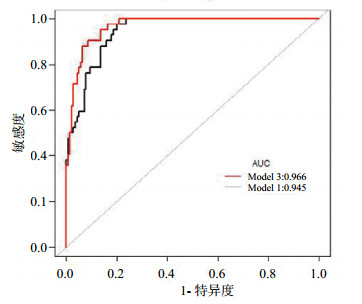
结果显示,模型1与模型2之间虽差异无统计学差异(P=0.09),但心肌损伤标记物与SAP仍有很大关系。对数据进一步分析,从各项指标的AUC来看,在心肌损伤相关标记物的三个指标中,proBNP对SAP的预测能力最小(AUC=0.763)(图 2,表 4)。将对SAP预测能力最小的proBNP去掉,建立模型3,即传统指标加上CK-MB、cTnI的综合;重新比较模型1与模型3对SAP的预测效应(图 3);模型1与模型3比较发现,传统指标加上CK-MB、cTnI对SAP的预测能力比单纯传统指标明显增加(AUC=0.966 vs. AUC=0.945,P=0.04),表明使用传统参数加上CK-MB、cTnI对SAP有更大的预测价值,心肌损伤标记物(CK-MB、cTnI)对SAP有一定的预测价值。
|
| 图 2 血CRP和PCT、CTSI评分、BISAP评分、APACHEⅡ评分、SOFA评分、proBNP、CK-MB和cTnI对SAP的预测效应汇总 Figure 2 The predictive ability of various indicators and score systems for SAP |
|
|
| 指标 | 最佳阈值 | AUC | 灵敏度(%) | 特异度(%) |
| CRP (mg/L) | 149.15 | 0.715 | 74.5 | 65.5 |
| proBNP (pg/mL) | 58.7 | 0.763 | 97.4 | 51.5 |
| CTSI | 3.5 | 0.772 | 91.5 | 59.0 |
| PCT (ng/mL) | 0.565 | 0.799 | 86.7 | 61.9 |
| BISAP | 1.5 | 0.815 | 93.8 | 55.8 |
| CK-MB (ng/mL) | 1.55 | 0.833 | 80.9 | 72.0 |
| APACHEⅡ | 9.5 | 0.872 | 66.7 | 91.4 |
| cTnI (ng/mL) | 0.015 | 0.872 | 85.1 | 83.7 |
| SOFA | 2.5 | 0.897 | 95.8 | 68.0 |
|
| 模型1为传统指标的ROC曲线(AUC=0.945),模型3为传统指标加上CK-MB、cTnI的ROC曲线(AUC=0.966)。Model 1 vs. Model 3, P=0.04 图 3 模型1与模型3对SAP的预测效应 Figure 3 The predictive effect of model 1 and model 3 on SAP |
|
|
目前已有若干种方法来对AP严重程度进行评估,如CRP、PCT、APACHEⅡ评分、SOFA评分等;这些评分虽灵敏度及特异度较高,但包含项目较多,操作性较差;故寻找简单、准确、客观的预测指标对病情评估具有实际临床意义。
SOFA评分用于评估器官功能障碍,现已有大量研究认为SAP患者早期死亡与器官功能衰竭密切相关,SOFA评分对SAP的预测价值较APACHEⅡ评分高[10-11],这也与本研究结果一致。APACHEⅡ评分大于7分考虑SAP,但有人认为该评分项目过于复杂且缺乏特异性[12-13]。BISAP评分并不能很好地鉴别一过性还是持续性的器官功能障碍,而持续器官功能障碍是SAP结局的重要决定因素[12]。CTSI评分是目前广泛使用的影像评分系统,但是它在预测器官功能障碍方面灵敏度较低[12]。CRP是一种非特异性急性期时相蛋白,在炎症条件下升高,是判断SAP最广泛使用的生化指标之一,但其准确性存在争议[14]。PCT是广泛用于细菌感染、脓毒症早期诊断的血清标志物,研究显示PCT不仅可以预测AP病情严重程度,还可以评估胰腺有无感染坏死[15-16];本研究结果显示PCT(AUC=0.799)对SAP的预测能力高于CRP(AUC=0.716),这也与其他的研究结果一致[15]。
近年来,心肌损伤相关标记物在重症急性胰腺炎、脓毒血症等危重症中研究较多,且心肌损伤相关标记物的升高与不良预后相关[7-8, 17]。在临床中,常会发现无心脏疾病及心功能障碍的AP患者早期心肌损伤标记物会升高,SAP致心肌损伤或心肌功能障碍具体病理生理机制尚未完全明确。有文献表明其主要机制可能与低血容量、电解质代谢紊乱(如低钙血症、低磷血症)和炎症细胞因子的作用有关[18]。
本研究结果表明,心肌损伤相关标记物proBNP、CK-MB、cTnI对SAP的有一定的预测价值,并且可以与传统指标相媲美。三者中,proBNP对SAP的预测能力最小(AUC=0.763),传统指标加上心肌损伤相关标记物的综合与单纯传统指标相比,对SAP的预测能力差异无统计学意义(AUC=0.950 vs. AUC=0.932,P=0.09);但去除proBNP后,传统指标加上CK-MB、cTnI的综合与单纯传统指标相比,预测能力升高(AUC=0.966 vs.AUC=0.945,P=0.04)。相关文献表明在危重症中,proBNP普遍升高,但其预测价值存在争议;proBNP的升高主要与内毒素及炎症因子、心肌抑制因子及循环血容量有关,可反映危重症患者心肌功能障碍,尤其左室收缩功能不全[19]。而proBNP主要是在心室壁张力增加及血容量负荷过重的情况下刺激心肌细胞大量分泌;但在SAP早期,液体大量渗出到第三间隙,血容量大量减少,甚至可出现低血容量休克,在SAP早期强化治疗过程中,早期控制性液体复苏、加用广谱蛋白酶抑制剂、血液滤过、脏器功能支持等治疗对缓解proBNP的刺激因素有显著作用[20]。
本研究与类似临床研究的不同之处:本研究是根据最新的AP分类和管理指南进行的,目前的研究结果可能更适用于当前的实践;同一组临床研究人员进行的短期研究,可减少临床数据的异质性。但此项研究存在许多局限性,比如回顾性观察研究设计的局限性;单中心数据的局限性,各医院之间急性胰腺炎疾病严重程度可能会有所不同。尽管如此,本研究的数据在其他中心也可作为参考。
综上所述,心肌损伤标记物CK-MB、cTnI对SAP有一定的预测价值,而且检验快速、简便,值得在临床上推广应用。
| [1] | Peery AF, Dellon ES, Lund J, et al. Burden of gastrointestinal disease in the United States: 2012 update[J]. Gastroenterology, 2012, 143(5): 1179-1187, e1-3. DOI:10.1053/j.gastro.2012.08.002 |
| [2] | Greenberg JA, Hsu J, Bawazeer M, et al. Clinical practice guideline: management of acute pancreatitis[J]. Can J Surg, 2016, 59(2): 128-140. DOI:10.1503/cjs.015015 |
| [3] | Srinivasan G, Venkatakrishnan L, Sambandam S, et al. Current concepts in the management of acute pancreatitis[J]. J Family Med Prim Care, 2016, 5(4): 752-758. DOI:10.4103/2249-4863.201144 |
| [4] | 叶静, 望亭松, 蒋婕, 等. 心肌酶检测对非心源性危重病的评估价值[J]. 中华急诊医学杂志, 2007, 16(9): 975-979. DOI:10.3760/j.issn.1671-0282.2007.09.022 |
| [5] | Spies C, Haude V, Overbeck M, et al. Serum cardiac troponin t as a prognostic marker in early sepsis[J]. Chest, 1998, 113(4): 1055-1063. DOI:10.1378/chest.113.4.1055 |
| [6] | Kociol RD, Pang PS, Gheorghiade M, et al. Troponin elevation in heart failure prevalence, mechanisms, and clinical implications[J]. J Am Coll Cardiol, 2010, 56(14): 1071-1078. DOI:10.1016/j.jacc.2010.06.016 |
| [7] | 方明, 曾红科, 甄享凡, 等. 心肌损伤标志物与重症急性胰腺炎预后的临床研究[J]. 中华急诊医学杂志, 2006, 15(3): 246-248. DOI:10.3760/j.issn.1671-0282.2006.03.014 |
| [8] | 秦芳芳.急性胰腺炎致心肌损伤的临床研究[D]沈阳: 中国医科大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1487695 |
| [9] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [10] | Adam F, Bor C, Uyar M, et al. Severe acute pancreatitis admitted to intensive care unit: SOFA is superior to Ranson's criteria and APACHE Ⅱ in determining prognosis[J]. Turk J Gastroenterol, 2013, 24(5): 430-435. DOI:10.4318/tjg.2013 |
| [11] | Tee YS, Fang HY, Kuo IM, et al. Serial evaluation of the SOFA score is reliable for predicting mortality in acute severe pancreatitis[J]. Medicine (Baltimore), 2018, 97(7): e9654. DOI:10.1097/MD.0000000000009654 |
| [12] | Khanna AK, Meher S, Prakash S, et al. Comparison of Ranson, Glasgow, MOSS, SIRS, BISAP, APACHE-Ⅱ, CTSI scores, IL-6, CRP, and procalcitonin in predicting severity, organ failure, pancreatic necrosis, and mortality in acute pancreatitis[J]. HPB Surg, 2013, 2013: 367581. DOI:10.1155/2013/367581 |
| [13] | 雷衍军, 王湘英. 急性胰腺炎严重程度及预后评估的研究进展[J]. 医学综述, 2013, 19(6): 1060-1063. DOI:10.3969/j.issn.1006-2084.2013.06.035 |
| [14] | Meher S, Mishra TS, Sasmal PK, et al. Role of biomarkers in diagnosis and prognostic evaluation of acute pancreatitis[J]. J Biomark, 2015, 2015: 519534. DOI:10.1155/2015/519534 |
| [15] | Dias BH, Rozario AP, Olakkengil SA, et al. Procalcitonin strip test as an independent predictor in acute pancreatitis[J]. Indian J Surg, 2015, 77(Suppl 3): 1012-1017. DOI:10.1007/s12262-014-1112-8 |
| [16] | Mofidi R, Suttie SA, Patil PV, et al. The value of procalcitonin at predicting the severity of acute pancreatitis and development of infected pancreatic necrosis: systematic review[J]. Surgery, 2009, 146(1): 72-81. DOI:10.1016/j.surg.2009.02.013 |
| [17] | Sheyin O, Davies O, Duan W, et al. The prognostic significance of troponin elevation in patients with sepsis: a meta-analysis[J]. Heart Lung, 2015, 44(1): 75-81. DOI:10.1016/j.hrtlng.2014.10.002 |
| [18] | Yegneswaran B, Kostis JB, Pitchumoni CS. Cardiovascular manifestations of acute pancreatitis[J]. J Crit Care, 2011, 26(2): 225 e11-225.e18. DOI:10.1016/j.jcrc.2010.10.013 |
| [19] | Varpula M, Pulkki K, Karlsson S, et al. Predictive value of N-terminal pro-brain natriuretic peptide in severe sepsis and septic shock[J]. Crit Care Med, 2007, 35(5): 1277-1283. DOI:10.1097/01.CCM.0000261893.72811.0F |
| [20] | 毛恩强. 重症急性胰腺炎急性反应期强化治疗的要点[J]. 肝胆外科杂志, 2011, 19(4): 244-246. DOI:10.3969/j.issn.1006-4761.2011.04.002 |
 2018, Vol. 27
2018, Vol. 27




