糖原合酶激酶-3β (glycogen synthase kinase-3β, GSK-3β)是普遍存在于真核生物内的多功能的丝氨酸苏氨酸蛋白激酶,它可能在多种信号传导过程中发挥着重要的调节作用[1]。近年来研究表明,GSK-3β在脓毒症、缺血-再灌注损伤、关节炎、休克等多种疾病并发多器官功能障碍过程中发挥重要作用[2-6]。GSK-3β作为一个可行有效的治疗靶点已成为研究者们关注的热点话题。
GSK-3β抑制剂干预急性胰腺炎(acute pancreatitis, AP)动物模型已有文献报道[7],但其中采用的实验动物、诱导的实验模型、GSK-3β抑制剂的类别、给药途径和剂量各不相同,导致各研究结果缺乏一致性和可比性。因此,本研究通过牛磺胆酸钠逆行胰胆管注射制备大鼠重症急性胰腺炎(severe acute pancreatitis, SAP)模型,应用GSK-3β的常用抑制剂TDZD- 8 (4-benzyl-2-methyl-1, 2, 4 -thia Diazolidine-3, 5-dione, TDZD-8),观察静脉注射TDZD-8干预大鼠SAP合并急性肾损伤模型的量效关系,并将三种常用GSK-3β抑制剂TDZD-8、氯化锂(lithium chloride, LiCl)、3-(2, 4-dichlorophenyl)-4- (1-methyl-1H-indol-3-yl)-1H-pyrrole-2, 5- dione (SB216763)对该模型的作用效果进行对比,以探讨针对SAP并发肾损伤最有效的GSK-3β抑制剂类别及其最有效、安全的合理剂量,为GSK-3β抑制剂的临床应用提供理论支持和实验依据。
1 材料与方法 1.1 实验动物与分组SPF级雄性SD大鼠96只、体质量150~200 g(湖北省疾病预防控制中心提供)。随机(随机数字法)分为8组(n=12):假手术组(sham operation group,SO组)、重症急性胰腺炎组(SAP组)、TDZD-8预处理组0.25、0.5、1.0、2.0 mg/kg(SAP+TDZD-8 pretreatment group,TD组,分别标记为TD1、TD2、TD3、TD4组),LiCL预处理组(L组)和SB216763预处理组(SB组),均以12 h为观察点。实验过程未到观察时间点死亡大鼠弃之不用,直至达到实验目标数。
1.2 动物模型制备及处理重症急性胰腺炎大鼠模型造模方法:实验前大鼠禁食12 h,自由饮水。采用5%异氟烷对SD大鼠进行诱导和2%异氟烷维持麻醉,无菌操作下行上腹正中切口进腹,采用1 mL注射器针头穿过十二指肠对系膜缘经乳头逆行插入主胰管,以约0.1 mL/min恒速向主胰管注射5%牛磺胆酸钠溶液(1 mL/kg,Sigma公司)制备重症急性胰腺炎大鼠模型[8]。
分组及处理具体如下:(1)重症急性胰腺炎组(SAP组),按照上述方法制备重症急性胰腺炎大鼠模型,造模前30 min经股静脉注射无菌处理的10% DMSO溶液(0.1 mL/100 g);(2)假手术组(SO组),假手术组制备同重症急性胰腺炎组,但不向胆胰管注入5%牛磺胆酸钠溶液,而是注射等量生理盐水;术前30 min经股静脉注射与SAP组等体积的溶剂10% DMSO;(3)TDZD-8预处理组(TD组),操作处理同SAP组,于模型制备前30 min由股静脉穿刺给予0.25、0.5、1.0、2.0 mg/kg的TDZD-8溶液,分别标记为TD1、TD2、TD3、TD4组;(4)LiCl预处理组(L组,SAP+LiCl组),操作处理同TDZD-8组,SAP造模前30 min经大鼠股静脉注射GSK-3β抑制剂LiCl(40 mg/kg,溶于10% DMSO溶液,该剂量参考前期文献[9]);(5)SB216763预处理组(SB组,SAP+SB216763组),操作处理同TDZD-8组,SAP造模前30 min经大鼠股静脉注射GSK-3β抑制剂SB216763(1 mg/kg,溶于10% DMSO溶液,该剂量参考前期文献[10])。
1.3 标本采集所有大鼠均于造模后12 h时处理取材;下腔静脉穿刺采血,离心后分离血清-20℃保存备用;取部分胰腺组织和左侧肾脏组织4%多聚甲醛固定用于光镜组织病理学检查;其余肾脏组织立即经液氮冻存后转入-80℃冰箱保存备用。
1.4 指标检测方法胰腺、肾脏组织病理学检查。胰腺、肾脏组织4%多聚甲醛固定、石蜡包埋制片,HE染色后光镜下观察,依据Schmidt标准[11]按胰腺水肿、腺泡、腺管坏死程度、出血和脂肪液化坏死、炎症和血管周围炎性浸润四方面对胰腺损伤进行病理学评分,按Paller等[12]对肾脏损伤程度的病理评分方法并改良方法进行评分。
腹水量测定。提前称量干棉球质量(D, g),以干棉球吸附干净各组大鼠腹水后称其湿质量(W, g)。腹水量(ascites)=湿棉球质量(W)-干棉球质量(D)。
血清淀粉酶(AMY)、血脂肪酶(LIPA)、血清肌酐(Cr)、血清尿素氮(BUN)及谷丙转氨酶(ALT)水平在武汉大学人民医院检验中心予以检测。
Western-Blot检测肾脏组织GSK-3β及磷酸化p-GSK-3β (ser9)蛋白的表达。冻存的各组肾脏组织以蛋白裂解液匀浆,冰上孵育30 min后,4℃、13 000 r/min离心30 min,取上清液,得总蛋白;BCA法测定蛋白浓度;取40 μg蛋白样品上样行SDS-PAGE凝胶电泳,蛋白电转至NC膜,10%脱脂奶粉封闭2 h,加入GSK-3β兔抗大鼠多克隆抗体(1:1 000,Cell signalling Technology公司)、p-GSK-3β (ser9)兔抗大鼠多克隆抗体(1:1 000,Cell signalling Technology公司)或β-actin一抗(1:2 000,cell signaling technology公司),置于4℃冰箱振荡孵育过夜后,TBST漂洗,加辣根过氧化酶标记二抗(1:3 000),室温孵育1 h后以ECL化学发光试剂于暗室显影,凝胶图像分析系统检测蛋白质印迹条带。
1.5 统计学方法采用SPSS 17.0统计软件进行分析,各组数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析ANOVA检验,组间两两比较用LSD-t检验,方差不齐则进行秩和检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 腹水量测定结果SO组大鼠腹腔仅可见极少量腹水,为无色透明。SAP组大鼠腹水量较SO组明显增多(P < 0.05),且颜色呈红褐色。TD2、TD3、TD4组均较SAP组大鼠腹水量明显减少(P < 0.05),TD1组较SAP组差异无统计学意义(P > 0.05),TD2、TD3、TD4组腹水减少量差异无统计学意义(P < 0.05),但均较TD1组显著(P < 0.05),L组和SB组大鼠均较SAP组腹水量明显减少(P < 0.05),TD3组、L组和SB组腹水减少量差异无统计学意义(P > 0.05),见图 1。
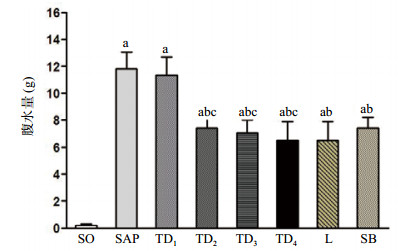
|
| 与SO组比较,aP < 0.05;与SAP组比较,bP < 0.05;与TD1组比较,cP < 0.05 图 1 各组大鼠腹水量测定 Figure 1 Determination of the amount of ascites in rats of each group |
|
|
以造模后12 h作为观察点,SAP组大鼠血清淀粉酶(AMY)含量较SO组显著增高(P < 0.05);TD1组大鼠血清AMY水平与SAP组比较,差异无统计学意义(P < 0.05);TD2、TD3、TD4组AMY水平均较TD1组、SAP组显著降低,差异有统计学意义(P < 0.05),TD2、TD3、TD4组三组之间比较,TD3、TD4组之间AMY水平差异无统计学意义(P > 0.05),但均较TD2组降低,且差异有统计学意义(P < 0.05)。L组和SB组AMY水平均较SAP组显著降低,差异有统计学意义(P < 0.05),TD3组、L组和SB组三组之间比较,TD3组明显较L组和SB组AMY含量更低,且差异有统计学意义(P < 0.05)。L组和SB组AMY水平差异无统计学意义(P > 0.05),见图 2A。
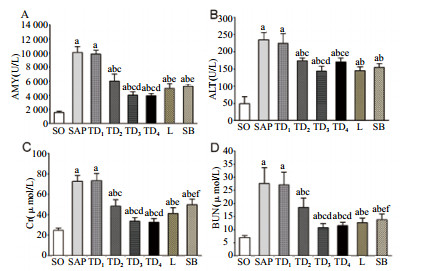
|
| A:血清淀粉酶(AMY)的变化;B:血清谷丙转氨酶(ALT)的变化;C:血清肌酐(Cr);D:尿素氮(BUN)的变化;与SO组比较,aP < 0.05;与SAP组比较,bP < 0.05;与TD1组比较,cP < 0.05;与TD2组比较,dP < 0.05;与TD3组比较,eP < 0.05;与L组比较,fP < 0.05 图 2 各组大鼠血情指标变化情况 Figure 2 Changes of blood index of rats in each group |
|
|
SAP组大鼠ALT水平较SO组显著增高(P < 0.05);TD2、TD3、TD4组大鼠血清ALT水平与SAP组相比显著降低(P < 0.05);TD1组ALT水平与SAP组比较差异无统计学意义(P > 0.05)。TD4组大鼠血清ALT水平高于TD3组,差异有统计学意义(P < 0.05)。L组和SB组血清ALT水平均较SAP组显著降低,差异有统计学意义(P < 0.05),TD3组、L组和SB组三组之间比较,血清ALT水平差异无统计学意义(P > 0.05),见图 2B。
SAP组大鼠血清肌酐(Cr)和尿素氮(BUN)均较SO组显著增高(P < 0.05);TD2、TD3、TD4组大鼠血清Cr和BUN水平与SAP组相比显著降低(P < 0.05),TD1组与SAP组比较,差异无统计学意义(P > 0.05);TD2、TD3、TD4组三组之间比较,TD3、TD4之间Cr和BUN水平差异无统计学意义(P > 0.05),但均较TD2组降低,且差异有统计学意义(P < 0.05)。L组和SB组Cr和BUN水平均较SAP组显著降低,差异有统计学意义(P < 0.05),TD3组、L组和SB组三组之间比较,TD3组明显较L组和SB组Cr和BUN含量更低,且差异有统计学意义(P < 0.05)。L组Cr和BUN水平较SB组含量低,且差异有统计学意义(P < 0.05),见图 2C, D。
2.3 胰腺组织病理学变化SO组大鼠光镜下可见胰腺小叶结构完整,偶见轻度水肿,无出血及炎症细胞浸润;SAP组光镜下可见胰腺正常结构被严重破坏,小叶间隔增宽,腺泡大量坏死,甚至原有结构消失;胰腺小血管出血明显,扩张的叶间隔之间可见部分红细胞,部分切片可见典型的胰周脂肪坏死;胰腺小叶间可见炎症细胞浸润明显,血管周围也可见大量炎症细胞渗出。给予各梯度剂量TDZD-8及各类GSK-3β抑制剂预处理后,胰腺腺泡水肿、坏死、胰腺小叶间隔内出血及炎症细胞浸润均较SAP组有不同程度减轻。
胰腺组织病理学评分:SAP组病理评分较SO组明显增高,差异有统计学意义(P < 0.05)。TD1组胰腺病理评分与SAP组比较差异无统计学意义(P < 0.05),TD2、TD3、TD4组大鼠胰腺病理评分与SAP组相比显著降低(P < 0.05);TD2、TD3、TD4组随着药物浓度的提高,胰腺病理评分逐渐降低(P < 0.05),但TD3与TD4组差异无统计学意义。L组和SB组胰腺组织病理学评分较SAP组显著降低,差异有统计学意义(P < 0.05),TD3组、L组和SB组三组之间比较,TD3组较L组和SB组胰腺组织病理评分均降低,差异有统计学意义(P < 0.05)。L组较SB组评分稍降低,且差异有统计学意义(P < 0.05),见图 3。
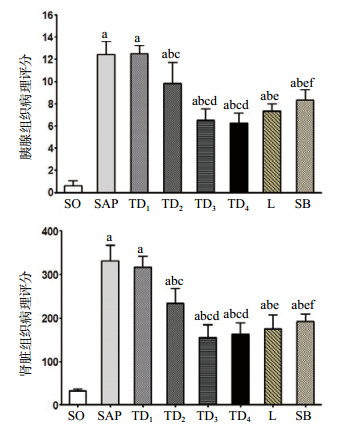
|
| 与SO组比较,aP < 0.05;与SAP组比较,bP < 0.05;与TD1组比较,cP < 0.05;与TD2组比较,dP < 0.05;与TD3组比较,eP < 0.05;与L组比较,fP < 0.05 图 3 各组大鼠胰腺、肾脏组织病理学评分 Figure 3 Histopathological score of pancreas and kidney in rats of each group |
|
|
SO组大鼠肾脏结构完整,肾小管上皮无水肿,细胞界限清楚,肾间质无血管充血、无炎症细胞浸润等表现;SAP组可见大量肾小球淤血性改变,细胞界限模糊,肾小管上皮细胞坏死脱落,管腔内可见大量管型形成,肾小管管腔变窄或闭塞,大量炎症细胞浸润。给予各梯度剂量TDZD-8及各类GSK-3β抑制剂预处理后,肾小球淤血,肾小管上皮细胞水肿、坏死及炎细胞浸润程度均较SAP组有不同程度减轻,见图 4。
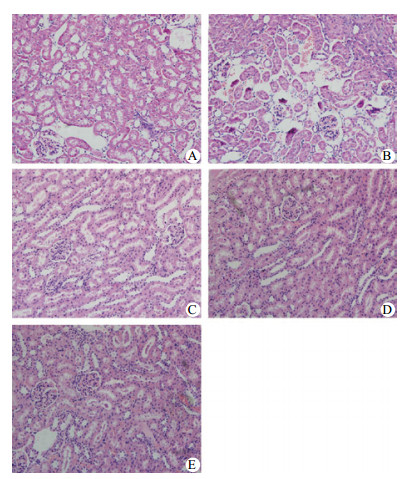
|
| A:SO组大鼠肾脏组织结构完整,肾小管上皮无水肿,细胞界限清楚,肾间质无血管充血、出血样改变,无炎症细胞浸润等表现;B:SAP组可见大量肾小球淤血性改变,细胞界限模糊,肾小管上皮细胞坏死脱落,管腔内可见大量管型形成,肾小管管腔变窄或闭塞,大量炎症细胞浸润;C:TD3组;D:L组;E:SB组;三个药物干预组中肾小球淤血,肾小管上皮细胞水肿、坏死及炎细胞浸润程度均较SAP组有不同程度减轻 图 4 各组大鼠肾脏病理组织学改变(HE×200) Figure 4 Histopathologcial changes of kidney in rats of each group(HE×200) |
|
|
肾脏组织病理学评分:SAP组病理评分较SO组明显增高,差异有统计学意义(P < 0.05)。TD1组肾脏病理学评分与SAP组比较差异无统计学意义(P < 0.05),TD2、TD3、TD4组大鼠肾脏病理评分与SAP组相比显著降低(P < 0.05);TD2、TD3、TD4组随着药物浓度的提高,肾脏病理评分逐渐降低(P < 0.05),但TD3与TD4组差异无统计学意义。L组和SB组肾脏组织病理学评分较SAP组显著降低,差异有统计学意义(P < 0.05),TD3组、L组和SB组三组之间比较,TD3组较L组和SB组肾脏组织病理评分均降低,差异有统计学意义(P < 0.05)。L组较SB组大鼠肾脏病理学评分稍降低,且差异有统计学意义(P < 0.05),见图 3。
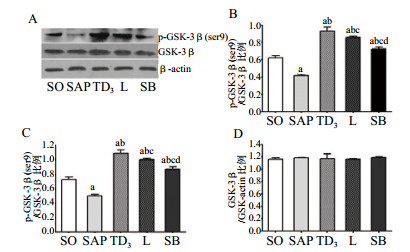
2.5 Western blot检测各组肾脏组织中GSK-3β和p-GSK-3β ser9蛋白的表达结果应用Western blot法对各组大鼠肾组织GSK-3β表达进行半定量分析发现,各组中GSK-3β蛋白表达均处于较一致的水平,差异无统计学意义(P > 0.05)。而p-GSK-3β ser9表达在SAP组中表达明显低于SO组,差异有统计学意义(P < 0.05);而TD3、L、SB三组中的p-GSK-3β ser9均较SAP组明显增强,其中以TD3组表达最强,强于L组和SB组,L组表达强于SB组,组间比较差异均有统计学意义(P < 0.05),见图 5。
|
| 与SO组比较,aP < 0.05;与SAP组比较,bP < 0.05;与TD3组比较,cP < 0.05;与L组比较,dP < 0.05 图 5 各组大鼠肾组织GSK-3β及磷酸化p-GSK-3β(ser 9)蛋白表达 Figure 5 The expression of GSK-3 beta and phosphorylated p-GSK-3 beta (SER 9) protein in renal tissues of rats in each group |
|
|
急性胰腺炎是临床上一种常见的急腹症,发病急、进展快、严重危害患者的生命健康[13-14]。GSK-3β抑制剂在精神紊乱性疾病、糖尿病、阿尔茨海默病以及癌症、缺血-再灌注损伤等多种疾病中的研究已成为国内外研究和关注的热点,有关GSK-3β及其抑制剂在急性胰腺炎及其胰外脏器损伤中的作用的报道少见。本实验观察了GSK-3β的常用抑制剂TDZD-8对SAP的治疗作用,并将三种常用GSK-3β抑制剂TDZD-8、氯化锂(LiCl)、SB216763对该模型的作用效果进行对比,旨在探讨GSK-3β抑制剂在防治SAP及其胰外脏器损伤中合理的类别及剂量-效应关系。
Cuzzocrea等[7]证实,GSK-3β抑制剂TDZD-8能显著降低SAP小鼠模型血浆和胰腺组织中TNF-α、IL-1β水平,减少胰腺组织中炎症细胞的浸润,降低血浆中胰淀粉酶和胰脂肪酶含量,减轻胰腺损伤程度。另外有研究发现,TDZD-8治疗能显著降低细胞的凋亡及星形胶质细胞的增生,改善新生儿缺氧缺血性脑损伤[15]。在其他模型中,GSK-3β抑制剂也被广泛应用,在大鼠小肠缺血-再灌注模型中,给予GSK-3β抑制剂TDZD-8能降低回肠组织中TNF-α、IL-1β含量,减少肠组织中炎症细胞的浸润,表明TDZD-8能缓解肠道缺血-再灌注引起的炎症发应,减轻肠道损伤[16]。在心肌缺血-再灌注损伤模型中,抑制GSK-3β的活性,可明显减少线粒体通透性转换孔的开放,从而改善心肌缺血-再灌注的损伤[17]。
目前开发的GSK-3β抑制剂在化学结构上差异很大,按作用机制可主要分为小分子ATP竞争性抑制剂和非ATP竞争抑制剂。小分子ATP竞争性抑制剂特点是多数为小分子疏水的杂环化合物,相对分子质量一般小于600,多数通过与GSK-3βSer9磷酸化位点ATP竞争性地结合抑制GSK-3β活性,SB216763即为其代表药物。非ATP竞争性抑制剂一般以无机离子抑制剂锂(Li)和TDZD-8作为代表,Li是第一个发现的GSK-3β抑制剂但锂抑制GSK-3β活性的机制目前不完全清楚。TDZD-8是GSK-3β的非ATP竞争小分子抑制剂,它主要磷酸化GSK-3β ser9从而降低GSK-3β的活性。它的特点是不阻断其他一系列的激酶如蛋白激酶A和C,酪蛋白激酶Ⅱ和依赖细胞周期素激酶1等的活性。又有研究发现TDZD-8的结合口袋除了T-loop区外,还可以与ATP竞争催化区域,也可以作为与ATP竞争的小分子抑制剂。因此可以认为TDZD-8是有双重抑制作用。TDZD-8是最广泛应用于实验的GSK-3β抑制剂,因此本研究将其作为主要研究药物,鉴于目前SAP的模型制备未完全统一,参考相关的炎症疾病模型中的剂量使用情况[18],本研究将TDZD-8设立为0.25、0.5、1.0和2.0 mg/kg四个剂量梯度进行量效关系探讨。本实验研究结果显示,静脉给予不同剂量的TDZD-8均能不同程度地减少SAP大鼠的腹水量,降低药物组血清AMY、Cr、BUN及ALT水平,并显著降低胰腺病理评分,表明了TDZD-8对SAP时胰腺及胰外脏器的损伤均具有保护作用。但使用不同剂量TDZD-8,其治疗效果有显著差别,TD1(0.25 mg/kg)组几乎对SAP无缓解作用,TD4 (2.0 mg/kg)组可显著降低血清AMY、Cr、BUN以及胰腺病理评分,但其ALT水平较高,对肝脏功能有一定损坏作用,而TD2(0.5 mg/kg)组对上述各个指标均有效果,但效果不如TD3组(1.0 mg/kg)作用明显,可显著降低上述各指标。综合实验结果可见,TD3组使用1.0 mg/kg TDZD-8均较TD1(0.25 mg/kg)组、TD2(0.5 mg/kg)组和TD4组(2.0 mg/kg)具有明显效果,而且更安全,对药物的代谢器官损伤较小。
本研究将常用的三种不同的GSK-3β抑制剂,TDZD-8、氯化锂(LiCl)、SB216763对该模型的作用效果进行对比,结果发现三种抑制剂均对SAP大鼠肾损伤具有治疗作用,降低血清AMY、Cr、BUN及ALT水平,并能降低胰腺及肾脏的病理评分。通过Western blot法评估各组肾脏组织中GSK-3β和p-GSK-3β ser9蛋白的表达结果发现,各组大鼠肾脏GSK-3β蛋白表达处于较一致的水平,并未发生明显变化,而磷酸化的p-GSK-3β ser9在SO组大鼠肾脏组织中的表达稍弱,在SAP组表达最弱,而TD3和L、SB组中的表达均增强,均强于SO组,其中TD3组表达最强,L组表达稍强于SB组。已有研究证明,GSK-3β在细胞内通常呈活性状态,其通过磷酸化下游底物而发挥其生物学作用。在受到外界刺激后,GSK-3β Ser9磷酸化而使该酶活性降低,从而改变下游成份的活性或功能,本研究证明使用GSK-3β抑制剂可以使p-GSK-3β Ser9表达增强,更加证实了这一点,增强p-GSK-3β ser9的表达,其实是抑制了GSK-3β的活性,从而抑制其损伤作用,本研究结果还可以得出三种抑制剂中以TDZD-8预处理组中TD3组效果最佳的结论。推断可能与其具有非ATP竞争小分子抑制和ATP竞争小分子抑制的双重抑制作用有关,当然其具体机制仍有待进一步证实。
综上所述,对于牛磺胆酸钠诱导的SAP大鼠模型,静脉给予TDZD-8 1.0 mg/kg体质量预处理对该模型具有最佳合理安全的量效关系。然而,TDZD-8等GSK-3β抑制剂的给药途径、给药方式和给药时间,以及其具体作用机制仍有待进一步的研究。
| [1] | Hong H, Chen F, Qiao Y, et al. GSK-3β activation index is a potential indicator for recurrent inflammation of chronic rhinosinusitis without nasal polyps[J]. J Cell Mol Med, 2017, 21(12): 3633-3640. DOI:10.1111/jcmm.13274 |
| [2] | Dugo L, Collin M, Allen DA, et al. GSK-3beta inhibitors attenuate the organ injury/dysfunction caused by endotoxemia in the rat[J]. Crit Care Med, 2005, 33(9): 1903-1912. DOI:10.1097/01.CCM.0000178350.21839.44 |
| [3] | Wang D, Zhang X, Li D, et al. Kaempferide protects against myocardial ischemia/reperfusion injury through activation of the PI3K/Akt/GSK-3β pathway[J]. Mediators Inflamm, 2017, 2017: 5278218. DOI:10.1155/2017/5278218 |
| [4] | Cuzzocrea S, Mazzon E, Di Paola R, et al. Glycogen synthase kinase-3beta inhibition attenuates the degree of arthritis caused by type Ⅱ collagen in the mouse[J]. Clin Immunol, 2006, 120(1): 57-67. DOI:10.1016/j.clim.2006.03.005 |
| [5] | Jellestad L, Fink T, Pradarutti S, et al. Inhibition of glycogen synthase kinase (GSK)-3-β improves liver microcirculation and hepatocellular function after hemorrhagic shock[J]. Eur J Pharmacol, 2014, 724: 175-184. DOI:10.1016/j.ejphar.2013.12.029 |
| [6] | 张浙, 肖盐, 刁孟元, 等. PI3K/AKt/GSK3β信号通路在复苏中颈部降温的脑保护作用[J]. 中华急诊医学杂志, 2017, 26(5): 554-559. DOI:10.3760/cma.j.issn.1671-0282.2017.05.014 |
| [7] | Cuzzocrea S, Malleo G, Genovese T, et al. Effects of glycogen synthase kinase-3beta inhibition on the development of cerulein-induced acute pancreatitis in mice[J]. Crit Care Med, 2007, 35(12): 2811-2821. DOI:10.1097/01.CCM.0000295303.62996.9F |
| [8] | Wei M, Gong YJ, Tu L, et al. Expression of phosphatidylinositol-3 kinase and effects of inhibitor Wortmannin on expression of tumor necrosis factor-α in severe acute pancreatitis associated with acute lung injury[J]. World J Emerg Med, 2015, 6(4): 299-304. DOI:10.5847/wjem.j.1920-8642.2015.04.009 |
| [9] | Wang Y, Huang WC, Wang CY, et al. Inhibiting glycogen synthase kinase-3 reduces endotoxaemic acute renal failure by down-regulating inflammation and renal cell apoptosis[J]. Br J Pharmacol, 2009, 157(6): 1004-1013. DOI:10.1111/j.1476-5381.2009.00284.x |
| [10] | Gurrieri C, Piazza F, Gnoato M, et al. 3-(2, 4-dichlorophenyl)-4-(1-methyl-1H-indol-3-yl)-1H-pyrrole-2, 5-dione (SB216763), a glycogen synthase kinase-3 inhibitor, displays therapeutic properties in a mouse model of pulmonary inflammation and fibrosis[J]. J Pharmacol Exp Ther, 2010, 332(3): 785-794. DOI:10.1124/jpet.109.153049 |
| [11] | Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Ann Surg, 1992, 215(1): 44-56. DOI:10.1097/00000658-199201000-00007 |
| [12] | Paller MS, Hoidal JR, Ferris TF. Oxygen free radicals in ischemic acute renal failure in the rat[J]. J Clin Invest, 1984, 74(4): 1156-1164. DOI:10.1172/JCI111524 |
| [13] | Zhao XW, Yan L, Xu D, et al. Enterogenous infection of Candida albicans in immunocompromised rats under severe acute pancreatitis[J]. World J Emerg Med, 2016, 7(4): 294-299. DOI:10.5847/wjem.j.1920-8642.2016.04.010 |
| [14] | Gülen B, Sonmez E, Yaylaci S, et al. Effect of harmless acute pancreatitis score, red cell distribution width and neutrophil/lymphocyte ratio on the mortality of patients with nontraumatic acute pancreatitis at the emergency department[J]. World J Emerg Med, 2015, 6(1): 29-33. DOI:10.5847/wjem.j.1920-8642.2015.01.005 |
| [15] | Wang H, Huang S, Yan K, et al. Tideglusib, a chemical inhibitor of GSK3β, attenuates hypoxic-ischemic brain injury in neonatal mice[J]. Biochim Biophys Acta, 2016, 1860(10): 2076-2085. DOI:10.1016/j.bbagen.2016.06.027 |
| [16] | Cuzzocrea S, Mazzon E, Esposito E, et al. Glycogen synthase kinase-3beta inhibition attenuates the development of ischaemia/reperfusion injury of the gut[J]. Intensive Care Med, 2007, 33(5): 880-893. DOI:10.1007/s00134-007-0595-1 |
| [17] | Yang S, Li H, Tang L, et al. Apelin-13 protects the heart against ischemia-reperfusion injury through the RISK-GSK-3β-mPTP pathway[J]. Arch Med Sci, 2015, 11(5): 1065-1073. DOI:10.5114/aoms.2015.54863 |
| [18] | Gao HK, Yin Z, Zhang RQ, et al. GSK-3beta inhibitor modulates TLR2/NF-kappaB signaling following myocardial ischemia-reperfusion[J]. Inflamm Res, 2009, 58(7): 377-383. DOI:10.1007/s00011-009-0002-1 |
 2018, Vol. 27
2018, Vol. 27




