百草枯(PQ)是一种高效性、非选择性、接触性除草剂,因其强力的除草能力和接触土壤后快速失活的特性,自20世纪60年代以来,它被许多国家推广应用于农业生产[1]。近年来,由于百草枯的广泛使用及其致命的不良反应,百草枯中毒的发生更加频繁[2]。在发展中国家,这已经成为一项高病死率(> 50%)的重大公共卫生问题[1]。
迄今为止,急性百草枯中毒无特效解毒剂,中毒患者病死率高达60%~80%[3]。中毒早期死亡者大多是由百草枯导致的肾、肝、肺和胰腺等多个脏器衰竭引起[1-2, 4]。其机制主要是百草枯消耗细胞色素P450还原酶等多种酶,产生各种活性氧物质(O2-、H2O2和OH-), 激活人体免疫系统并诱导多种炎症因子的产生,进一步加重组织损伤及细胞凋亡。传统的治疗方法有:催吐、洗胃、导泻、利尿、血液净化[5]和其他对症治疗。然而,这些方法对百草枯中毒的治疗效果并不明确[2, 6]。在对百草枯中毒的有效治疗方面,有研究报道中重度百草枯中毒患者能够从联合应用免疫抑制剂治疗中获益[3, 7-19]。但仍有其他相关研究的结果与之不一致,Perriëns等[11]的研究表明,免疫抑制剂治疗改善百草枯中毒患者预后的可能性不大,Eddleston等[17]的研究提示免疫抑制疗法没有任何益处,尚缺乏足够的临床证据支持。同时,关于中重度百草枯中毒患者MODS的发生率的研究较少。因此,开展了这项Meta分析,纳入了最新发表的临床试验研究数据,以此评价免疫抑制剂对中重度百草枯中毒患者MODS发生率的影响。
1 资料与方法本篇Meta分析按照优先申报项目的系统综述和Meta分析指南进行开展和报道[20]。该方法基于Cochrane协作网的建议。
1.1 文献检索系统地检索了从1986年3月至2017年8月内PubMed、EMBASE、中国知网和万方数据库中所有已发表的评估免疫抑制治疗中重度百草枯中毒患者的研究,一般情况下,尿液检查结果显示深蓝色提示中重度百草枯中毒[21],提示预后较差。搜索条件包括:百草枯中毒,甲泼尼龙(MP)、强的松、地塞米松(DEX)、氢化可的松、环磷酰胺(CP)。所有相关的报告和评论都经过手动搜索,以获得更多符合条件的研究。在无法获得相关数据时,通过联系作者来获取更详细的信息。
1.2 文献筛选纳入条件:(1)成人百草枯中毒患者应用免疫抑制治疗对比安慰剂或空白对照的疗效评估的随机对照试验或观察性研究;(2)研究人群为百草枯中毒患者;(3)实验组患者接受免疫抑制药物治疗(甲泼尼龙(MP)、强的松、地塞米松(DEX)、氢化可的松、环磷酰胺(CP)、环孢素);(4)报道一项或一项以上的治疗结果。
排除条件:(1)未设置对照组的研究;(2)报告的结果与本研究目的无关。
1.3 数据提取使用预先准备的提取方式,两位成员独立记录以下内容:①试验的特点:作者,年份,研究设计,样本大小,免疫抑制剂组病例数,对照组病例数,人口特征,血浆百草枯浓度,尿百草枯浓度,实验组与对照组的用药和随访时间;②入选患者的特征:年龄、性别、到达急诊室或医院所经过的时间、从摄入百草枯到开始血液灌流所经过的时间;③研究结果:病死率、MODS发生率、急性肾脏衰竭(ARF)、肝损伤、缺氧及肺纤维化的发生率。
预定的主要结果为MODS的发生率,次要结果包括病死率、ARF、肝损伤和缺氧的发生率。按照Cochrane协作网的建议[22],检验所纳入研究有效结果的偏倚(随机序列的产生、分配隐藏、参与者和工作人员的盲法,结果评估的盲法,结果的不完整性,选择性结果报告和其他偏倚),满足超过以上检验内容6项、4~6项和少于4项的研究分别被定义为高、中、低质量研究。
1.4 统计学方法对随机对照试验和观察性研究进行Mantel-Haenszel随机效应荟萃分析。所有统计分析均应用Cochrane协作网提供的Rev Man 5.3统计软件。百草枯中毒与临床研究结果(包括MODS的发病率、病死率、ARF、肝损伤和缺氧的发生率)之间的关联采用相对危险度(RR)和95%置信区间(90%CI)评价。通过标准卡方检验评估试验中的异质性,规定P < 0.10时有意义。用I2统计方法评估异质性,并规定I2 > 50%时有意义。因为各研究之间临床和方法学的差异很大,因此应用随机效应模型进行统计学分析。我们通过进行亚组分析,①实验组是否应用糖皮质激素(甲强龙或地塞米松等糖皮质激素),②环磷酰胺的剂量[小于、等于或大于15 mg/(kg·d)],③环磷酰胺的应用时间(小于、等于或大于2 d)来探索存在异质性的可能原因。
2 结果 2.1 研究的特征本篇Meta分析依据报道系统评价和Meta分析的PRISMA声明[23]。最初检索到153篇文献,其中3篇随机对照试验[7-9],2篇前瞻性研究[10-11]和5篇非随机对照试验[12-16]纳入本研究,总共包含635例患者。排除的文献有:15篇重复文献,4篇Meta分析,10篇评估血必净治疗效果,31篇个案报道,38篇动物实验,26篇与本研究的直接目标不相关,12篇没有应用免疫抑制药物,6篇无对照组和1封读者来信,见图 1
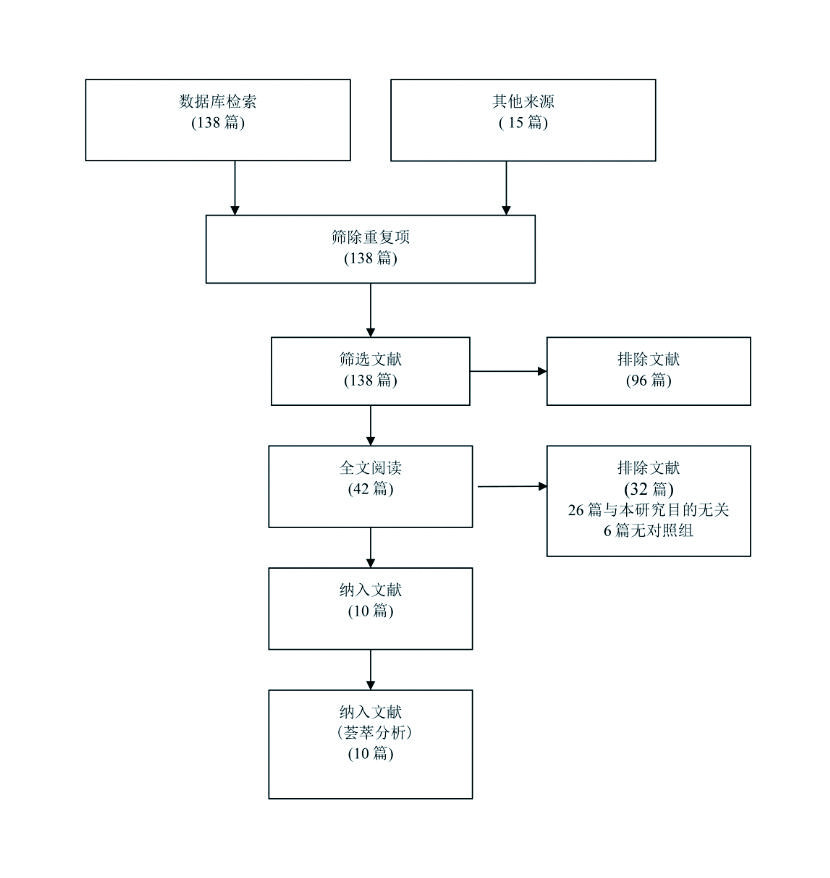
|
| 图 1 文献筛选流程图 |
|
|
本篇Meta分析纳入的研究中的患者均为中重度百草枯中毒。大多数的研究[7-8, 10, 14]应用的免疫抑制药物和应用方法是:环磷酰胺15 mg/(kg·d),连续应用2天;甲强龙1 g/d,连续应用3天。3项研究共138例患者应用甲强龙联合环磷酰胺治疗[10, 12, 15],2项研究共82例患者应用地塞米松联合环磷酰胺治疗[11, 16],2项研究共134例患者联合应用甲强龙、地塞米松和环磷酰胺治疗[8, 14],1项研究共20例患者使用甲强龙联合环磷酰胺与美司钠治疗[7],1项研究共211例患者应用环磷酰胺加环孢菌素A[13],1项研究共50例患者单独应用环磷酰胺。纳入研究的主要特点见表 1。
| 作者/年份 | 研究类型 | 国家和社区 | 样本量(实验组/对照组) | 中毒程度 | 血PQ浓度检测 | 尿PQ浓度检测 | 免疫抑制剂治疗组 | 对照组 | 随访时间 | ||||
| MP | CP | Others | MP | CP | DEX | ||||||||
| Lin/2011 | 非RCT | 中国台湾地区 | 111 (59/52) |
重度 | YES | YES | Ⅳ 1 g/24 h 3 days | Ⅳ 15 mg/kg/24 h 2 days | DEX Ⅳ 5 mg/6h | NG | Oral 2mg/kg/24h | Ⅳ 5mg/6h | 60 d |
| Afzali/2008 | RCT | 伊朗 | 20 (9/11) |
中度至重度 | NO | YES | Ⅳ 1 g/24 h 3 days | Ⅳ 15 mg/kg/24 h 2 days | Mesna Ⅳ 15 mg/kg 4 days | NG | NG | NG | NG |
| Lin/2006 | RCT | 中国台湾地区 | 23 (16/7) |
重度 | YES | YES | Ⅳ 1 g/24 h 3 days | Ⅳ 15 mg/kg/24 h 2 days | DEX Ⅳ 20mg/24h | NG | NG | Ⅳ 5mg/6h | 6周 |
| Lin/1999 | 前瞻性研究 | 中国台湾地区 | 50 (22/28) |
中度至重度 | NO | YES | Ⅳ 1 g/24 h 3 days | Ⅳ 15 mg/kg/24 h 2 days | NG | NG | NG | Ⅳ 10 mg/8h | NG |
| Lin/1996 | 非RCT | 中国台湾地区 | 33 (16/17) |
中度至重度 | NO | YES | Ⅳ 1 g/24 h 3 days | Ⅳ 1 g/24 h 2 days | NG | NG | NG | NG | NG |
| Wang/2008 | 非RCT | 中国 | 55 (26/29) |
中度至重度 | NG | NG | Ⅳ 240mg/8h 7days | Ⅳ 400mg/24h 7days | NG | NG | NG | NG | NG |
| Xu/2012 | 回顾性研究 | 中国 | 211 (111/100) |
中度至重度 | NG | NG | NG | Ⅳ 15 mg/kg/24 h 2 days | Cyclosporin A Oral 250mg bid 3weeks | NG | NG | NG | NG |
| Chen/2014 | RCT | 中国 | 50 (25/25) |
中度至重度 | NG | NG | NG | Ⅳ 15 mg/kg/24 h 2 days | NG | Ⅳ 500mg/24h 3days | NG | NG | 4周 |
| Perriëns/1992 | 前瞻性研究 | 苏里南共和国 | 47 (33/14) |
NG | YES | YES | NG | Ⅳ 1.66mg/kg/8h to a maximum of 4g 2 weeks | DEX Ⅳ 8mg/8h 2 weeks | NG | NG | NG | NG |
| Vieria/1997 | 非RCT | 巴西 | 35 (25/10) |
NG | NG | NG | NG | Ⅳ 15mg/kg d1 10mg/kg d2, 7mg/kg d3-5 | DEX 1.5mg/kg/24h d1-4, 1mg/kg daily for d5-7 | NG | NG | NG | NG |
| 注:PQ,百草枯;ISD,免疫抑制药物;MP,甲强龙;CP,环磷酰胺;DEX,地塞米松;RCT,随机对照试验;Ⅳ,静脉输液;NG,未提及 | |||||||||||||
所有的研究均报告了患者的病死率,大多数研究提供了年龄、性别,到达急救室或医院经过的时间,和从摄入药物到开始血液灌流的时间。MODS、ARF、肝损伤、缺氧、肺纤维化的发生率分别在3、4、5、6、2项研究中有报道。患者的特征和结果见表 2。
| 作者/时间 | 年龄 (实验组/对照组) |
性别(男/女) (实验组/对照组) |
中毒后到医院时间(h) | 中毒后血液灌流开始时间(h) | 病死率(%)n (实验组/对照组) |
ARF(%)n (实验组/对照组) |
肝损伤(%)n (实验组/对照组) |
缺氧(%)n (实验组/对照组) |
MODS(%)n (实验组/对照组) |
| Lin/2011 | 41.0(18-79)/ 32.5(18-79) |
(44/15)/ (35/17) |
3.0(1.0-21.0)/ 3.0(0.5-21.0) |
6.0(3.5-23.7)/ 5.5(3.0-24.5) |
(66.1) 39/ (92.3) 48 |
NG | (23.7) 14/ (23.1) 12 |
(28.8) 17/ (23.1) 12 |
NG |
| Afzali/2008 | (27± 10)/ (25 ±10) |
(8/1)/ (8/3) |
(5±2)/ (4.5±2) |
(10±2)/ (10±2) |
(33.3) 3/ (81.8) 9 |
(66.7) 6/ (100) 11 |
(100) 9/ (100) 11 |
(44.4) 4/ (72.7) 8 |
NG |
| Lin/2006 | (33.6 ±14.3)/ (37.0 ±13.8) |
(11/5)/ (5/2) |
3.0(0.5-12.5)/ 2.0(1.0, 13.0) |
(7.0±4.3)/ (7.5±7.3) |
(31.3) 5/ (85.7) 6 |
(87.5) 14/ (71.4) 5 |
(25.0) 4/ (14.3) 1 |
(56.3) 9/ (57.1) 4 |
NG |
| Lin/1999 | (28.2 ±11.1)/ (16.8 ±10.1) |
(13/9)/ (18/10) |
(5.1±4.8)/ (5.9±5.4) |
(7.6±4.9)/ (8.5±5.5) |
(18.2) 4/ (57.1) 16 |
(68.2) 15/ (89.3) 25 |
(68.2) 15/ (60.7) 17 |
(45.5) 10/ (67.9) 19 |
NG |
| Lin/1996 | (29.4 ± 14.4)/ (31.7 ± 10.2) |
(7/9)/ (9/8) |
NG | NG | (25.0) 4/ (70.6) 12 |
(62.5) 10/ (58.8) 10 |
(37.5) 6/ (29.4) 5 |
(25.0) 4/ (17.6) 3 |
NG |
| Wang/2008 | (29.5 ±11)/ (29.3 ±9.9) |
(11/15)/ (12/17) |
(6.1±6.0)/ (6.0±5.9) |
NG | (42.3) 11/ (72.4) 21 |
NG | NG | (42.3) 11/ (72.4) 21 |
(38.5) 10/ (67.0) 20 |
| Xu/2012 | (32.0 ±15.0)/ (34.0 ±15.0) |
NG | (3.5±1.9)/ (3.6±1.7) |
NG | (44.1) 49/ (64.0) 64 |
NG | NG | NG | (33.3) 37/ (51.0) 51 |
| Chen/2014 | NG | NG | NG | NG | (16.0) 4/ (44.0) 11 |
NG | NG | NG | (4.0) 1/ (32) 8 |
| Perriëns/1992 | NG | NG | NG | NG | (60.6) 20/ (64.3) 9 |
NG | NG | NG | NG |
| Vieria/1997 | NG | NG | NG | NG | (28.0) 7/(100) 10 | NG | NG | NG | NG |
| 注:ARF,急性肾脏衰竭;MODS,多器官功能障碍;ISD,免疫抑制剂;NG,未提及 | |||||||||
在分析MODS的发生率时,纳入1篇随机对照试验和2篇观察性研究[9, 12-13]。随机对照试验的结果显示,免疫抑制剂组患者的MODS发生率(4%)低于对照组(32%),χ2=6.640,P < 0.05。结果表明,应用免疫抑制剂治疗可以降低中重度百草枯中毒患者MODS的发生率。
2项包含266例患者的观察性研究证实了免疫抑制治疗与中重度百草枯中毒患者MODS发生率的降低明显相关(RR=0.30;95% CI:0.16~0.56),异质性较低(I2 = 0%)(图 2)。
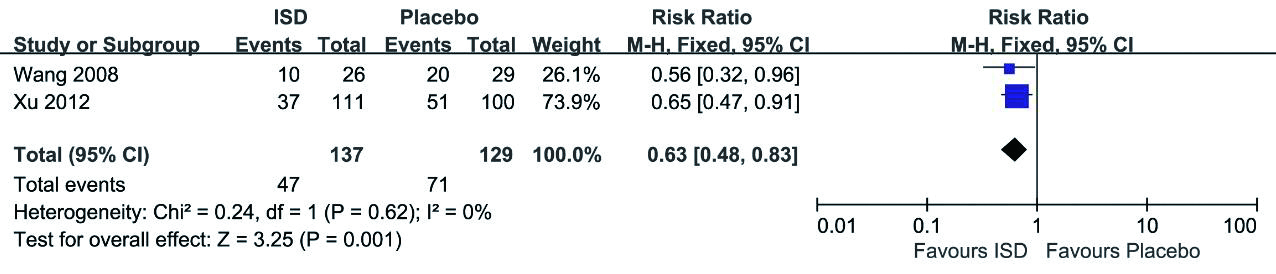
|
| 图 2 MODS的发生率 |
|
|
由于数据报告的不一致性(数据以中位数或x±s表示形式记录)和不完整性,部分指标被合并,用于评估免疫抑制剂对病死率,ARF、肝损伤及缺氧发生率的影响。包括10项研究报道的病死率、4项研究报道的ARF的发生率、5项研究报道的肝损伤发生率以及6项研究报道的低氧的发生率,见表 2。
在表 3中,随机对照试验的合并结果表明,免疫抑制治疗与百草枯中毒患者病死率的降低相关(RR=0.48;95% CI:0.28~0.82),各研究存在中度异质性(I2 = 55%)。免疫抑制治疗与肝损伤发病率的增高(RR=1.11;95% CI:0.84~1.46)、ARF发生率的降低(RR=0.83;95% CI:0.61~1.14)以及缺氧率的降低(RR=0.71;95% CI:0.48~1.05)无关。非随机对照试验的分析结果证实了我们在随机对照试验中的发现。
| 不良事件 | 效应模型 | 事件发生数/组内病例数(%) | RR(95%CI) | P值 | I2, (%) | ||
| 免疫抑制剂治疗组 | 对照组 | ||||||
| 病死率 | RCT | M-H随机效应模型 | 36/105(34.3) | 51/85(60.0) | 0.48 (0.28~0.82) | 0.007 | 55 |
| Non-RCT | M-H随机效应模型 | 110/237(46.4) | 155/208(74.5) | 0.58 (0.45~0.76) | < 0.0001 | 57 | |
| ARF | RCT | M-H随机效应模型 | 35/47(74.5) | 41/46(89.1) | 0.83 (0.61~1.14) | 0.25 | 39 |
| Non-RCT | |||||||
| 肝损伤 | RCT | M-H固定效应模型 | 28/47(59.6) | 29/46(63.0) | 1.11 (0.84~1.46) | 0.47 | 0 |
| Non-RCT | M-H固定效应模型 | 20/75(26.7) | 17/69(24.6) | 1.10 (0.63~1.91) | 0.75 | 0 | |
| 缺氧 | RCT | M-H固定效应模型 | 23/47(48.9) | 31/46(57.4) | 0.71 (0.48~1.05) | 0.09 | 0 |
| Non-RCT | M-H随机效应模型 | 32/101(31.7) | 36/98(36.7) | 0.90 (0.46~1.67) | 0.74 | 53 | |
| 注:M-H,Mantel-Haenszel;RR,相对风险度;ISD,免疫抑制药物;RCT,随机对照试验;ARF,急性肾脏衰竭 | |||||||
L'Abbé plot显示,随着对照组内病死率的升高,免疫抑制剂组的病死率上升变缓,这提示免疫抑制剂对重度百草枯中毒患者的治疗可能存在优势(图 3)。图 4显示了5项非随机对照试验的结果,包含445例中度至重度百草枯中毒患者,其与随机对照试验的结果一致,提示免疫抑制药物在有效救治重度百草枯中毒患者中可能存在优势。
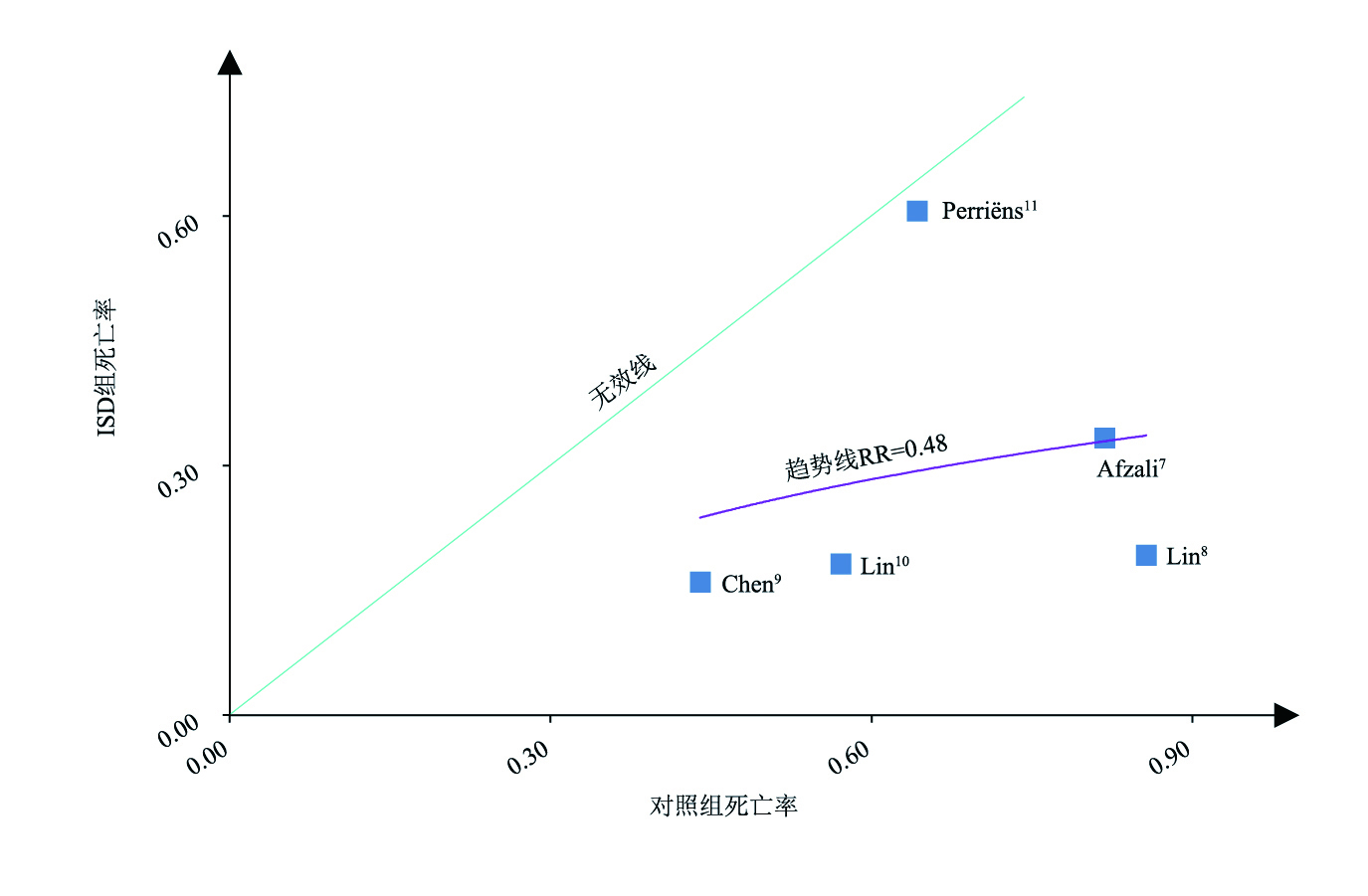
|
| 图 3 随机对照试验的L'Abbé plot |
|
|
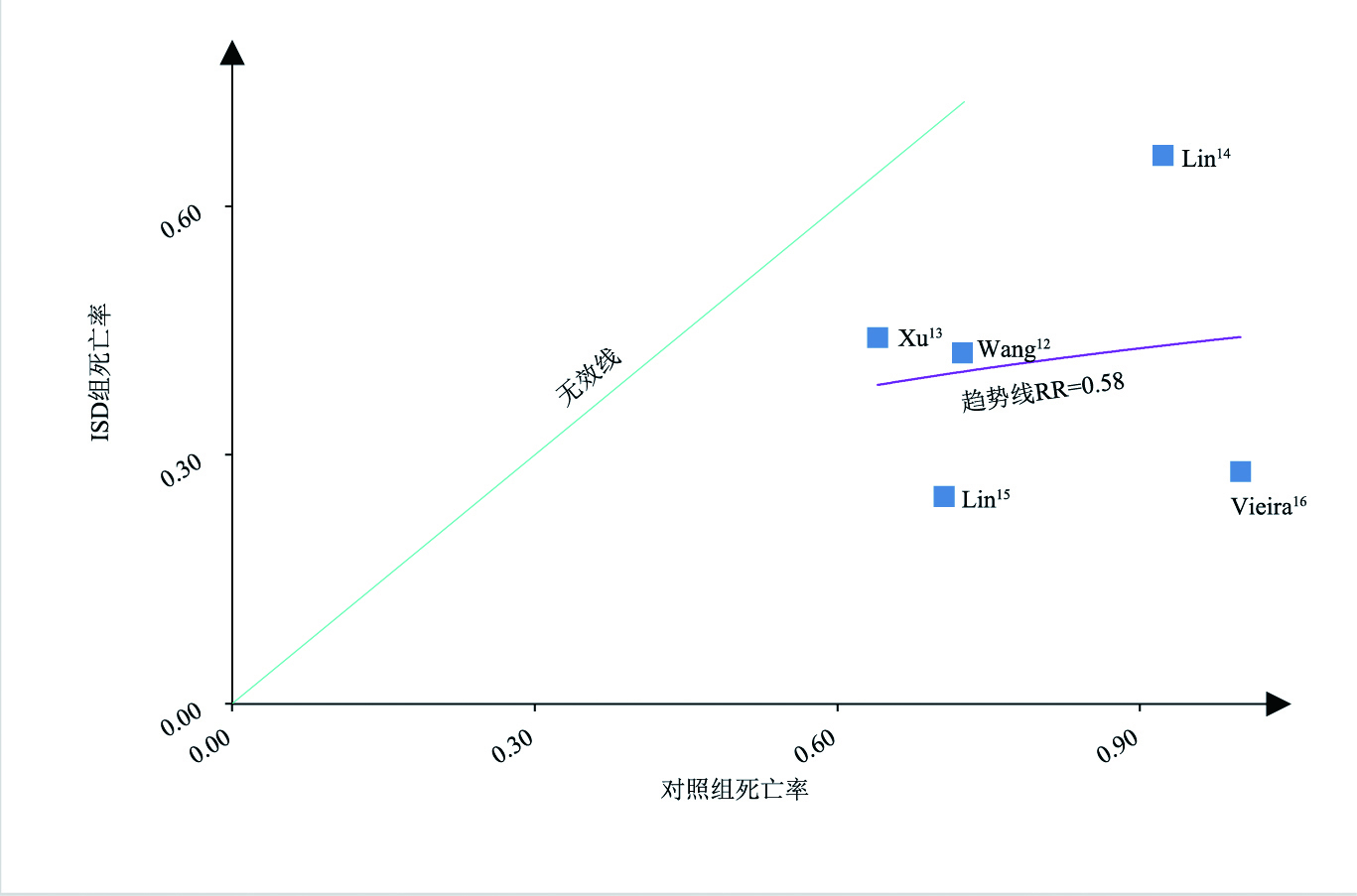
|
| 图 4 非随机对照试验的L'Abbé plot |
|
|
根据Cochrane协作网提供的评估工具,表 4中显示了3个随机对照试验和2项前瞻性研究的偏倚风险。在4项研究中,选择偏倚得到了很好的控制。然而,在中毒程度[8, 11]、血浆百草枯浓度[7, 9, 10]、尿百草枯浓度[9]和随访时间方面,各研究之间存在差异。其中3项为高质量研究,2项是中等质量研究,主要由于文章中没有报道随机序列生成,分配隐藏和盲法的应用。
| 偏倚风险 | Afzali/2008 | Lin/2006 | Lin/1999 | Chen/2014 | Perriëns/1992 |
| 随机序列生成 | 高 | 低 | 低 | 低 | 高 |
| 分配隐藏 | 高 | 低 | 未知 | 低 | 高 |
| 盲法 | 高 | 高 | 高 | 高 | 高 |
| 不完整的研究结果报告 | 低 | 低 | 低 | 低 | 未知 |
| 选择性报告 | 低 | 低 | 高 | 低 | 未知 |
| 其他偏倚 | 低 | 低 | 低 | 低 | 未知 |
免疫抑制剂治疗组病死率的亚组分析分组依据为:(1)是否使用了糖皮质激素(甲强龙或地塞米松或其他糖皮质激素),(2)环磷酰胺的应用剂量(CP < 15 mg/(kg·d)或CP = 15 mg/(kg·d)或CP > 15 mg/(kg·d)),(3)环磷酰胺的应用时间(> 2 d或=2 d或 < 2 d)(见表 5)。亚组分析结果显示,在应用糖皮质激素(甲强龙或地塞米松)、环磷酰胺应用剂量等于15 mg/(kg·d)和环磷酰胺应用时间等于2 d的条件下,百草枯中毒患者病死率明显降低。因为有限的样本量和亚组分析存在固有的偏倚,在解释这些亚组分析的结果时应特别谨慎。
| 亚组分层 | 病例数(研究数) | 事件发生数/组内病例数(%) | RR (95% CI) | P值 | I2, (%) | |
| 实验组 | 对照组 | |||||
| 是否使用糖皮质激素 | ||||||
| 是 | 140(4) | 12/47 (25.5) | 31/46 (67.4) | 0.47 (0.32~0.70) | 0.01 | 73 |
| 否 | 50(1) | 4/25 (16.0) | 11/25 (44.4) | |||
| 环磷酰胺剂量 | ||||||
| < 15 mg/(kg·d) | 47(1) | 20/33 (60.6) | 9/14 (64.3) | |||
| =15 mg/(kg·d) | 143(4) | 16/72 (22.2) | 42/71 (59.2) | 0.36 (0.22~0.58) | < 0.0001 | 0 |
| > 15 mg/(kg·d) | 0(0) | |||||
| 环磷酰胺应用时间 | ||||||
| < 2 d | 0(0) | |||||
| =2 d | 143(4) | 16/72 (22.2) | 42/71 (59.2) | 0.36 (0.22~0.58) | < 0.0001 | 0 |
| > 2 d | 47(1) | 20/33 (60.6) | 9/14 (64.3) | |||
| 注:RCT,随机对照试验;ISD,免疫抑制药物;RR,相对风险度 | ||||||
本研究纳入了3项随机对照试验,2项前瞻性研究和5项非随机对照试验,包含653例患者,以此来研究免疫抑制剂对中重度百草枯中毒患者MODS发生率的影响。我们发现免疫抑制剂的应用与MODS发生率的降低以及病死率的降低明显相关,与肝损伤发病率的升高、ARF和缺氧发生率的降低无明显相关, 也就是说,免疫抑制剂并未加重肝损伤、急性肾衰和缺氧的发生率。同时我们还发现,在环磷酰胺剂量等于15 mg/(kg·d)或环磷酰胺应用时间等于2 d的条件下,百草枯中毒患者病死率明显降低。本篇荟萃分析发现环磷酰胺的应用剂量等于15 mg/(kg·d)和环磷酰胺应用时间等于2 d的条件下,百草枯中毒患者病死率明显降低,有待进一步的大规模的临床研究加以验证,而且这个发现与中国医师协会急诊分会颁布的急性百草枯诊治专家共识(2013)[6]并不矛盾,同时又有新的进展。
免疫抑制剂对中重度百草枯中毒患者是有益的。在这些纳入的研究中,3个随机对照试验和1项前瞻性研究分析了免疫抑制剂对中重度百草枯中毒患者病死率的影响[7-8, 10-11],但这些试验没有评估免疫抑制剂对百草枯中毒患者MODS发病率的影响,其中2项研究缺乏血浆百草枯浓度指标[7, 10]。有1项研究是关于应用免疫抑制剂治疗百草枯诱导的肺纤维化的治疗及预后预测的系统回顾提示免疫抑制疗法没有任何益处[17],在这篇系统回顾中[17],4篇纳入的研究缺乏对照组,2篇为案例报道,这导致结果的可靠性较低。1篇评估免疫抑制治疗对百草枯所致肺纤维化的影响的系统综述中提出免疫抑制治疗对百草枯导致的肺纤维化有益[30],但是在这篇文献中,纳入的3篇研究均没有报道关于肺纤维化的相关信息[7, 8, 10],因此,这项研究结果并不令人信服。1项分析百草枯中毒儿童临床特点的回顾性研究提示早期应用大剂量免疫抑制剂(甲强龙)有效[18]。另一项病死率为(33.3%)的关于儿童百草枯中毒的研究也得出了类似结论[19]。然而,这两项研究缺乏对照组,很难得出准确的结论,因此为确保本研究的可信性,我们排除了这两项研究。值得一提的是,大量案例报道显示免疫抑制剂治疗对中重度百草枯中毒患者有益,最新的一项回顾性研究也显示,冲击治疗后延长甲强龙治疗疗程可降低中重度百草枯中毒患者的病死率[31],但一项由Perriëns等[11]人开展的研究表明,免疫抑制剂治疗改善百草枯中毒患者预后的可能性不大。本研究检索出的研究主要是糖皮质激素和环磷酰胺在百草枯中毒中的应用,有1篇关于环孢素作为免疫抑制剂在百草枯中的应用是关于动物实验的[32],未纳入本研究,也可以作为今后研究的方向。
2015年的一项Meta分析中[3],其纳入的一项研究中的部分患者属于爆发性中毒[10],为了保证纳入患者中毒水平的一致性,本研究排除了这部分患者。在这项Meta分析中,3篇随机对照试验[7-8, 10]和2篇非随机对照试验[14-15]被合并来计算相对危险度,其结果可能产生一定的误导,且Cochrane协助网并不建议对转换后的数据进行合并。尽管利用各种敏感性分析避免可能的偏倚,但汇总结果仍然具有高度的异质性,这可能使得出的结论具有误导性,为了减少数据转换可能带来的偏差,笔者将随机对照试验和非随机对照试验的数据分别合并,以此保证结果的可信度。
关于免疫抑制剂与MODS发病率降低的相关性的结果在之前的任何Meta分析中均未报道。MODS是百草枯中毒患者死亡的一个主要原因[7],通过产生的大量活性氧物质激活人体免疫系统,并诱导多种炎性细胞因子产生,进一步导致组织的损伤[1-2]可能是百草枯中毒导致器官损伤的主要机制之一。免疫抑制剂可以通过减少炎性细胞因子的产生从而降低MODS的发生率。患者病死率的下降与免疫抑制剂的应用相关,MODS发生率的降低可能是其原因之一。由于各项研究中免疫抑制剂的应用种类、剂量和时间不完全一致,这可能会导致结果存在一定的异质性。
同时,本篇Meta分析也具有一定的局限性:第一,纳入研究的样本量较少;第二,在免疫抑制剂治疗组中,纳入的各项研究中免疫抑制剂的应用种类、剂量和应用时间不完全一致;第三,疾病的严重程度不一致,3个随机对照试验中患者是中度至重度百草枯中毒,这可能是由于血浆或尿百草枯浓度的测量误差。由于大多数研究没有报告MODS的相关数据,需要更多的实验来验证这一结果。
| [1] | Sun IO, Lee KY. Cyclophosphamide dose:how much is needed to win the war against paraquat poisoning?[J]. Korean J Intern Med, 2013, 28(4): 410-412. DOI:10.3904/kjim.2013.28.4.410 |
| [2] | Shi X, Zhang Y, Wang Y. Impact of Xuebijing and ulinastatin as assistance for hemoperfusion in treating acute paraquat poisoning[J]. Int J Clin Exp Med, 2015, 8(8): 14018-14023. |
| [3] | He F, Xu P, Zhang J, et al. Efficacy and safety of pulse immunosuppressive therapy with glucocorticoid and cyclophosphamide in patients with paraquat poisoning:A Meta-analysis[J]. Int Immunopharmacol, 2015, 27(1): 1-7. DOI:10.1016/j.intimp.2015.04.030 |
| [4] | Li Y, Wang M, Gao Y, et al. Abnormal pancreatic enzymes and their prognostic role after acute paraquat poisoning[J]. Sci Rep, 2015, 5: 17299. DOI:10.1038/srep17299 |
| [5] | Gao Y, Zhang X, Yang Y, et al. Early haemoperfusion with continuous venovenous haemofiltration improves survival of acute paraquat-poisoned patients[J]. J Int Med Res, 2015, 43(1): 26-32. DOI:10.1177/0300060514549782 |
| [6] | 中国医师协会急诊分会. 急性百草枯诊治专家共识(2013)[J]. 中国急救医学, 2013, 33(6): 484-489. |
| [7] | Afzali S, Gholyaf M. The effectiveness of combined treatment with methylprednisolone and cyclophosphamide in oral paraquat poisoning[J]. Arch Iran Med, 2008, 11(4): 387-391. |
| [8] | Lin JL, Lin-Tan DT, Chen KH, et al. Repeated pulse of methylprednisolone and cyclophosphamide with continuous dexamethasone therapy for patients with severe paraquat poisoning[J]. Crit Care Med, 2006, 34(2): 368-373. DOI:10.1097/01.ccm.0000195013.47004.a8 |
| [9] | 陈义鹏. 早期强化免疫抑制治疗对中重度百草枯中毒的疗效[J]. 中国基层医药, 2014(21): 3305-3306. DOI:10.3760/cma.j.issn.1008-6706.2014.21.041 |
| [10] | Lin JL, Leu ML, Liu YC, et al. A prospective clinical trial of pulse therapy with glucocorticoid and cyclophosphamide in moderate to severe paraquat-poisoned patients[J]. Am J Respir Crit Care Med, 1999, 159(2): 357-360. DOI:10.1164/ajrccm.159.2.9803089 |
| [11] | Perriëns JH, Benimadho S, Kiauw IL, et al. High-dose cyclophosphamide and dexamethasone in paraquat poisoning:a prospective study[J]. Hum Exp Toxicol, 1992, 11(2): 129-134. DOI:10.1177/096032719201100212 |
| [12] | 王文生, 马增香, 卢清龙, 等. 大剂量甲泼尼龙联用环磷酰胺改善百草枯中毒患者肺组织损伤的临床研究[J]. 中华急诊医学杂志, 2008, 17(7): 757-759. |
| [13] | 许玲, 胡蓬勃, 吕毅, 等. 环磷酰胺联合环孢菌素A对急性百草枯中毒预后的影响[J]. 中国实用医刊, 2012, 39(11): 44-46. |
| [14] | Lin JL, Lin-Tan DT, Chen KH, et al. Improved survival in severe paraquat poisoning with repeated pulse therapy of cyclophosphamide and steroids[J]. Intensive Care Med, 2011, 37(6): 1006-1013. DOI:10.1007/s00134-010-2127-7 |
| [15] | Lin JL, Wei MC, Liu YC. Pulse therapy with cyclophosphamide and methylprednisolone in patients with moderate to severe paraquat poisoning:a preliminary report[J]. Thorax, 1996, 51(7): 661-663. DOI:10.1136/thx.51.7.661 |
| [16] | Vieira RJ, Zambrone FA, Madureira PR, et al. Treatment of paraquat poisoning usingcyclophosphamide and dexamethasone[J]. J Toxicol Clin Toxicol, 1997, 35: 515-516. |
| [17] | Eddleston M, Wilks MF, Buckley NA. Prospects for treatment of paraquat-induced lung fibrosis with immunosuppressive drugs and the need for better prediction of outcome:a systematic review[J]. QJM, 2003, 96(11): 809-824. DOI:10.1093/qjmed/hcg137 |
| [18] | Ge W, Wang HL, Sun RP. Clinical characteristics of paraquat poisoning in 22 Chinese children[J]. Indian J Pediatr, 2014, 81(7): 670-674. DOI:10.1007/s12098-013-1155-z |
| [19] | Hsieh YW, Lin JL, Lee SY, et al. Paraquat poisoning in pediatric patients[J]. Pediatr Emerg Care, 2013, 29(4): 487-491. DOI:10.1097/PEC.0b013e31828a347e |
| [20] | Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and Meta-analyses:the PRISMA statement[J]. BMJ, 2009, 339: b2535. DOI:10.1136/bmj.b2535 |
| [21] | Scherrmann JM, Houze P, Bismuth C, et al. Prognostic value of plasma and urine paraquat concentration[J]. Hum Toxicol, 1987, 6(1): 91-93. DOI:10.1177/096032718700600116 |
| [22] | Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions, version 5. 1. 0[updated March 2011] [J]. Cochrane Collaboration 2011. Cochrane Collaboration website. www. cochrane-handbook. org. Accessed October 28, 2015. |
| [23] | Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and Meta-analyses:the PRISMA statement[J]. Ann Intern Med, 2009, 15(14): 264. DOI:10.7326/0003-4819-151-4-200908180-00135 |
| [24] | Addo E, Poon-King T. Leucocyte suppression in treatment of 72 patients with paraquat poisoning[J]. Lancet, 1986, 1(8490): 1117-1120. DOI:10.1016/s0140-6736(86)91836-2 |
| [25] | Addo E, Ramdial S, Poon-King T. High dosage cyclophosphamide and dexamethasone treatment of paraquat poisoning with 75% survival[J]. West Indian Med J, 1984, 33(4): 220-226. |
| [26] | Botella de Maglia J, Belenguer Tarin JE. Paraquat poisoning. A study of 29 cases and evaluation of the effectivenessof the "Caribbean scheme"[J]. Med Clin (Barc), 2000, 115(14): 530-533. DOI:10.1016/s0025-7753(00)71615-0 |
| [27] | Garcia J, Frontado C, Tilac C, et al. Intoxicacion moderada a severa por paraquat tratada conesteroides e inmunosupresores. Datos preliminares[J]. Ann Intern (Caracas), 2000, 16(3): 177-181. |
| [28] | Chen GH, Lin JL, Huang YK. Combined methylprednisolone and dexamethasone therapy for paraquat poisoning[J]. Crit Care Med, 2002, 30(11): 2584-2587. DOI:10.1097/01.CCM.0000034930.94572.B7 |
| [29] | Chomchai S, Chomchai C. Treatment of moderate to severe paraquat poisoning with dexamethasone/cyclophosphamide combination:a case series from the toxicology consultation service at Siriraj Hospital, Bangkok, Thailand[J]. J Toxicol Clin Toxicol, 2003, 41: 520-521. |
| [30] | Li LR, Sydenham E, Chaudhary B, et al. Glucocorticoid with cyclophosphamide for paraquat-induced lung fibrosis[J]. Cochrane Database Syst Rev, 2014(8): CD008084. DOI:10.1002/14651858.CD008084.pub4 |
| [31] | Gao J, Feng S, Wang J, et al. Prolonged methylprednisolone therapy after the pulse treatment for patients with moderate-to-severe paraquat poisoning:A retrospective analysis[J]. Medicine (Baltimore), 2017, 96(25): e7244. DOI:10.1097/MD.0000000000007244 |
| [32] | 张锡刚, 鲁晓霞, 何跃忠. 甲泼尼龙联合环孢素A对百草枯中毒的防治[J]. 中华急诊医学杂志, 2010, 19(4): 351-356. |
 2018, Vol. 27
2018, Vol. 27




