组织抑制因子-1(tissue inhibitor of metalloproteinases-1, TIMP-1)为基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)的内源性抑制剂,主要参与细胞外基质(extracellular matrix,ECM)的合成与分解代谢[1],TIMP-1充当信号分子调节多种细胞的功能,如增殖,迁移,分化,血管生成等等[2]。炎症损伤是脓毒症内皮损伤的重要病理生理机制,越来越多的证据[3-5]表明MMP-9及TIMP-1作为炎症因子的下游产物参与脓毒症的发生与发展。本研究拟用脓毒症患者的血清刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立内皮细胞损伤体外模型,采用RNA干扰技术抑制TIMP-1基因的表达,探讨TIMP-1在脓毒症内皮损伤中的保护作用。
1 材料与方法 1.1 主要材料与试剂 1.1.1 人脐静脉内皮细胞(HUVECs)株由三峡大学肿瘤微环境与免疫治疗湖北省重点实验提供。
1.1.2 主要试剂胎牛血清(Gibco公司,澳洲,美国),DMEM固体培养基(低糖型)(Invitrogen公司,加利福尼亚州,美国),TurboFect Transfection Reagent和BCA试剂盒(Thermo公司,纽约,美国),兔源MMP-9、TIMP-1、血栓调节蛋白(thrombomoduline,TM)多克隆抗体(abcam公司,伦敦,英国),ELISA试剂盒(博士德试剂公司,武汉,中国),兔源β-Actin抗体、羊抗兔IgG-HRP(谷歌生物,武汉,中国)。由上海吉玛生物制药技术有限公司遵照siRNA合成原则合成3对TIMP-1 siRNA和阴性对照siRNA。TIMP-1 siRNA1上游序列:5'-GCAAUUCCGACCUCGUCAUTT-3',下游序列:5'-AUGACGAGGUCGGAAUUGCTT-3';TIMP-1 siRNA2上游序列:5'-GCAGCGAGGAGUUUCUCAUTT-3',下游序列:5'-AUGAGAAACUCCUCGCUGCTT-3';TIMP-1 siRNA3上游序列:5'-GCACAGUGUUUCCCUGUUUTT-3',下游序列:5'-AAACAGGGAAACACUGUGCTT-3';Negative control FAM上游序列:5'-UUCUCCGAACGUGUCACGUTT-3',下游序列:5'-ACGUGACACGUUCGGAGAATT-3'。
1.2 实验方法 1.2.1 脓毒症患者及健康对照者血清的制备根据Sepsis 3.0[6]诊断标准,选取2016年3月至9月在宜昌市第一人民医院ICU住院治疗的脓毒症患者10例,其中男女各5例,年龄(63±15.4)岁。对照组为5名健康志愿者,男3例,女2例,年龄(60±10.9)岁。两组人员性别、年龄比较差异无统计学意义(P < 0.05)。每位患者在诊断为脓毒症当日未行特殊治疗前采血10 mL,对照组每人采血5 mL。枸橼酸抗凝,室温静置4 h后,3000 r/min离心15 min,取上清液,分别将10例患者和5例健康者的血清混匀,置-80 ℃冰箱保存备用。每位患者均签署知情同意书。
1.2.2 细胞培养与转染HUVECs在37℃ 5% CO2培养箱中培养,2~3 d传代1次,所有实验细胞传代不超过10次。转染前1 d接种4×105个细胞于6孔板中,当细胞生长至60 %时采用TurboFect转染试剂转染siRNA,转染方法参照TurboFect说明书,转染10 h后在荧光显微镜下观察转染效率,48 h收集细胞提取蛋白,采用western blot方法筛选出抑制率最高的siRNA序列进行分组实验。
1.2.3 细胞处理与分组将生长状态良好且细胞密度达60 %的细胞随机分为5组:空白组(10 %胎牛血清培养组)、对照组(10 %健康志愿者血清干预组)、脓毒症组(10 %脓毒症患者血清干预组)、阴性对照组(阴性siRNA转染+ 10 %脓毒症患者血清干预组)、TIMP-1 siRNA转染组(TIMP-1 siRNA转染+ 10 %脓毒症患者血清干预组),每组设5个复孔。
1.2.4 MTT法检测内皮细胞存活率收集对数期细胞,计数调整细胞浓度至1×105 /mL,取100 μL/孔接种于96孔板中,置37 ℃ 5 % CO2培养箱中培养24 h后,阴性对照组和TIMP-1 siRNA组预先转染24 h,各组分别于加入血清0 h,6 h,12 h,24 h,48 h后弃培养上清液,加入含MTT的DMEM (-)培养基(MTT浓度为200 mg/L),每孔100 μL,置培养箱中继续培养4 h,弃上清液,加DMSO溶液,每孔200 μL,置室温摇床溶解20 min,最后在全波长酶标仪上检测波长为570 nm处的A值。
1.2.5 ELISA检测HUVECs培养上清液中MMP-9及TIMP-1的含量取HUVECs接种于96孔板内,接种密度为1×104 /孔,用含10 %胎牛血清的DMEM培养24 h后,阴性对照组和TIMP-1 siRNA组预先转染24 h,各组分别于加入血清0 h,6 h,12 h,24 h,48 h收集培养上清液,4 ℃ 12 000 r/min离心2 min取上清液,按照ELISA试剂盒说明书进行操作。
1.2.6 Western blot检测MMP-9、TIMP-1及TM蛋白的表达将HUVECs接种于6孔板内,细胞贴壁生长至60 %时给予不同处理因素,48 h后弃培养液,用1×PBS洗涤3次,加适量0.25 %胰蛋白酶消化细胞,将细胞悬液800 r/min离心3 min后弃上清液,加入适量含抑制剂的蛋白裂解液,吹打混匀后冰置15 min,再经4 ℃ 12 000 r/min离心10 min,取上清液,采用BCA试剂盒测定蛋白浓度。按每孔50 μg蛋白量上样,经SDS-PAGE胶电泳转移至PVDF膜上,5 %脱脂奶粉室温封闭1 h,加适当比例一抗(MMP-9 1: 1 000,TIMP-1 1: 500,TM 1: 1 000,β-Actin 1: 3 000) 4 ℃过夜,TBST洗3次,每次10 min,加适当比例二抗(1: 3 000)室温孵育1 h,然后TBST洗3次,每次10 min。用吸水纸吸净PVDF膜上的液体,滴加等比例混合的A、B显影液,在凝胶成像系统下取图并分析实验结果。
1.3 统计学方法用SPSS23.0软件进行数据处理和统计分析。所有实验数据用均数±标准差(x±s)表示,计量资料采用完全随机设计的方差分析,并用LSD-t法做多样本均数间的两两比较,方差不齐时先进行变量转换,以P < 0.05差异有统计学意义。
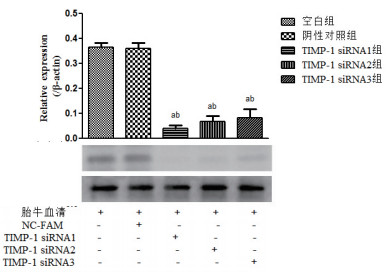
2 结果 2.1 Western blot筛选高效的siRNA片段3对序列均可抑制TIMP-1蛋白表达,其中siRNA1序列对TIMP-1蛋白的抑制效果最佳,故选其进行后续实验,见图 1。
|
| 与空白组比较,aP < 0.01;与阴性对照组比较,bP < 0.01 图 1 组织抑制因子-1(TIMP-1)蛋白表达变化(WB) Figure 1 The protein expression of tissue inhibitor of Metalloproteinases-1(TIMP-1)ineachgroup determined by Western blot |
|
|
与对照组比较,脓毒症组和TIMP-1 siRNA1组各时间点A值呈下降趋势,于12 h开始呈显著下降(P < 0.05);而TIMP-1 siRNA1组OD值于12-48 h明显低于脓毒症组(P < 0.05);空白组与对照组差异无统计学意义(P > 0.05);脓毒症组与阴性对照组差异无统计学意义(P > 0.05),见表 1。
| 组别 | 0 h | 6 h | 12 h | 24 h | 48 h |
| 空白组 | 0.308±0.072 | 0.454±0.083 | 0.602±0.091 | 0.834±0.096 | 1.240±0.121 |
| 对照组 | 0.300±0.041 | 0.426±0.081 | 0.567±0.086 | 0.769±0.082 | 1.184±0.113 |
| 脓毒症组 | 0.310±0.042 | 0.376±0.064 | 0.446±0.071a | 0.531±0.050b | 0.753±0.086b |
| 阴性对照组 | 0.332±0.061 | 0.354±0.073 | 0.419±0.056b | 0.517±0.083b | 0.701±0.087b |
| TIMP-1 siRNA1组 | 0.326±0.051 | 0.285±0.057a | 0.334±0.061bc | 0.360±0.079bd | 0.494±0.070bd |
| 注:与对照组比较,aP < 0.05,bP < 0.01;与脓毒症组比较,cP < 0.05,dP < 0.01 | |||||
与对照组比较,脓毒症组和TIMP-1 siRNA1组各时间点MMP-9及TIMP-1含量明显增加(P < 0.01);与脓毒症组比较,TIMP-1 siRNA1组MMP-9含量于12~48 h明显增加(P < 0.05),而TIMP-1含量于6~48 h明显下降(P < 0.05);脓毒症组和阴性对照组各时间点MMP-9及TIMP-1含量差异无统计学意义(P > 0.05),见表 2和表 3。
| 组别 | 0 h | 6 h | 12 h | 24 h | 48 h |
| 对照组 | 17.20±3.701 | 19.61±3.647 | 22.20±3.847 | 21.24±4.690 | 23.11±4.951 |
| 脓毒症组 | 49.60±9.451a | 53.00±7.382a | 59.40±9.991a | 73.40±7.503a | 63.80±6.496a |
| 阴性对照组 | 48.81±8.585a | 50.80±5.891a | 57.62±7.403a | 71.00±7.550a | 62.40±6.801a |
| TIMP-1 siRNA1组 | 50.10±8.337a | 55.01±6.083a | 66.46±6.986ab | 78.40±7.503ab | 82.20±7.759ac |
| 注:与对照组比较,aP < 0.01;与脓毒症组比较,bP < 0.05,cP < 0.01 | |||||
| 组别 | 0 h | 6 h | 12 h | 24 h | 48 h |
| 对照组 | 10.02±2.451 | 11.20±2.387 | 12.25±2.588 | 12.44±2.074 | 11.42±2.302 |
| 脓毒症组 | 19.80±2.387a | 22.01±3.808a | 24.37±3.864a | 30.61±3.847a | 28.11±3.551a |
| 阴性对照组 | 19.26±2.234a | 21.20±2.387a | 24.03±2.491a | 29.76±4.393a | 27.40±3.074a |
| TIMP-1siRNA1组 | 20.11±3.033a | 19.68±5.181ab | 21.81±2.387ab | 22.64±2.915ac | 21.85±3.193ac |
| 注:与对照组比较,aP < 0.01;与脓毒症组比较,bP < 0.05,cP < 0.01 | |||||
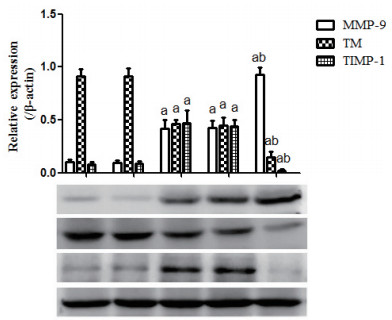
与对照组比较,脓毒症组MMP-9及TIMP-1表达升高(P < 0.01),TM表达降低(P < 0.01),TIMP-1 siRNA1组MMP-9表达升高(P < 0.01),TIMP-1及TM表达降低(P < 0.01);与脓毒症组比较,TIMP-1 siRNA1组MMP-9表达升高(P < 0.01),TIMP-1及TM表达降低(P < 0.01);空白组与对照组MMP-9、TIMP-1及TM蛋白表达差异无统计学意义(P > 0.05);脓毒症组与阴性对照组MMP-9、TIMP-1及TM蛋白表达差异无统计学意义(P > 0.05),见图 2。
|
| 1:空白组;2:对照组;3:脓毒症;4:阴性对照组;5:TIMP-1 siRNA1组。与对照组比较,aP < 0.01;与脓毒症组比较,bP < 0.01 图 2 各组细胞MMP-9、TIMP-1及TM蛋白表达变化(WB) Figure 2 The protein expression of matrixMetalloproteinase-9(MMP-9), tissue inhibitor of Metalloproteinases-1(TIMP-1)and thrombomoduline(TM) ineachgroup determined by Western blot |
|
|
脓毒症是由针对感染的失控宿主反应导致的致命性器官功能障碍[6],是机体免疫亢进和免疫抑制失衡所引起的一种全身性瀑布式炎症反应[7]。内皮衬托于血管表面,最先感应各种理化因素的刺激,是启动和放大炎症、凝血的关键。脓毒症时,内皮细胞既是效应细胞又是靶细胞,细菌释放的内毒素结合炎症细胞表面特异性TLR4/CD14受体,激活炎症通路,释放各种炎性介质,造成内皮损伤,同时损伤的内皮又释放各种介质,强化各炎症细胞间的相互作用,这样形成炎症和凝血瀑布,加速各组织器官的损伤。国内外研究[8-10]表明炎症介质可以激活MMP-9通过降解ECM促进炎症细胞向炎症区域迁移,由此加剧炎症反应,而使用乌司他丁[11-12]、血必净[13]、强力霉素[14]、奥美沙坦[15]等抑制MMP-9活性的药物,能减少炎症因子的释放,减轻组织损伤,改善疾病预后。
TIMP-1作为MMP-9的内源性抑制剂,特异性结合MMP-9催化活性中心的锌离子,抑制MMP-9酶原活化或使已活化的MMP-9失活[1]。在脓毒症致MODS的研究中,Maitra等[16]采用盲肠结扎穿孔法建立脓毒症大鼠模型,通过RT-PCR和Western-blot技术分别从基因和蛋白水平上检测脓毒症大鼠肝组织中MMP-9和TIMP-1的表达,结果显示模型组较对照组MMP-9和TIMP-1表达均上调,且MMP-9/TIMP-1的比例下降。而多项临床研究也发现严重脓毒症患者的外周血中TIMP-1的水平显著升高,且与疾病的严重程度及预后密切相关[5]。本实验采用内皮细胞与脓毒症患者的血清共培养,研究相关指标与内皮损伤之间的关系,结果发现较对照组,脓毒症组培养上清液中MMP-9及TIMP-1的含量显著增加,细胞表面MMP-9、TIMP-1及TM蛋白表达上调,由此笔者推测,脓毒症患者的血清中含有大量炎性介质能刺激内皮细胞合成并分泌大量的MMP-9及TIMP-1,而MMP-9/TIMP-1两者比例失调使细胞外基质合成和降解失衡从而造成内皮损伤。
MMP-9及TIMP-1均可被炎症介质如INF-ɑ、IL-1β等上调,参与基质的重塑,TIMP-1基因敲除后胶原降解增加,ECM结构及功能的完整性遭到破坏,从而影响相应组织器官的功能。研究发现NF-κB基因敲除的脓毒症小鼠,MMP-9的表达受抑制,同时血清中INF-α、IL-6、IL-17的含量下降,提示MMP-9可能通过NF-κB炎症通路发挥作用。结合本次研究结果,笔者推测脓毒症血清诱导人脐静脉内皮细胞中炎症反应通路被激活,炎症介质释放增加,从而上调MMP-9及TIMP-1的表达。为了进一步验证TIMP-1与内皮损伤之间的关系,采用RNA干扰技术沉默HUCEVs的TIMP-1基因,结果显示较脓毒症组,TIMP-1 siRNA组内皮细胞的存活率下降,培养上清液中MMP-9的含量增加,细胞表面MMP-9蛋白表达上调,TM蛋白表达下调,以上提示TIMP-1基因抑制后MMP-9表达上调,大量MMP-9的释放,使胶原蛋白降解增加,内皮失去胶原的支持和保护,发生不可逆性损伤。本次研究表明脓毒症患者的血清能诱导内皮细胞损伤,而TIMP-1在其中发挥保护作用;但是本研究未能验证MMP-9如何影响炎症通路的形成,在细胞模型方面也只采用单一的基因干扰,未同时使用过表达技术或构建动物模型,所以就TIMP-1在脓毒症内皮损伤中的具体机制还有待进一步研究。
| [1] | Ries C. Cytokine functions ofTIMP-1[J]. Cell Mol Life Sci, 2014, 71(4): 659-672. DOI:10.1007/s00018-013-1457-3 |
| [2] | Lambert E, Dasse E, Haye B, et al. TIMPs as multifacial proteins[J]. Crit Rev Oncol Hematol, 2004, 49(3): 187-198. DOI:10.1016/j.critrevonc.2003.09.008 |
| [3] | Alqahtani MF, Smith CM, Weiss SL, et al. Evaluation of new diagnostic biomarkers in pediatric sepsis:matrix metalloproteinase-9, tissue inhibitor of metalloproteinase-1, mid-regional pro-atrial natriuretic peptide, and adipocyte fatty-acid binding protein[J]. PLoS One, 2016, 11(4): e0153645. DOI:10.1371/journal.pone.0153645 |
| [4] | Bojic S, Kotur-Stevuljevic J, Kalezic N, et al. Diagnostic Value of Matrix Metalloproteinase-9 and Tissue Inhibitor of Matrix Metalloproteinase-1 in Sepsis-Associated Acute Kidney Injury[J]. Tohoku J Exp Med, 2015, 237(2): 103-109. DOI:10.1620/tjem.237.103 |
| [5] | Mühl D, Nagy B, Woth G, et al. Dynamic changes of matrix Metalloproteinases and their tissue inhibitors in severe sepsis[J]. J Crit Care, 2011, 26(6): 550-555. DOI:10.1016/j.jcrc.2011.02.011 |
| [6] | Singer M, Deutsschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Sepsis Shock (Sepsis-3)[J]. JAMA, 2016, 315: 801-810. DOI:10.1001/jama.2016.0287 |
| [7] | 苏磊, 徐秋林. 精准医学时代的脓毒症研究[J]. 中华急诊医学杂志, 2016, 25(2): 133-138. DOI:10.3760/cma.j.issn.1671-0282.2016.02.001 |
| [8] | Collazos J, Asensi V, Martin G, et al. The effect of gender and genetic polymorphisms on matrix Metalloprotease (MMP) and tissue inhibitor (TIMP) plasma levels in different infectious and non-infectious conditions[J]. Clinical and Experimental Immunology, 2015, 182(2): 213-219. DOI:10.1111/cei.12686 |
| [9] | 余旻, 李冠兰, 刘先哲, 等. 基质金属蛋白酶-9在多器官功能障碍综合征中的变化[J]. 中华急诊医学杂志, 2009, 18(2): 165-169. DOI:10.3760/cma.j.issn.1671-0282.2009.02.014 |
| [10] | Wei F, Liu S, Luo L, et al. Anti-inflammatory mechanism of ulinastatin:Inhibiting the hyperpermeability of vascular endothelial cells induced by TNF-α via the RhoA/ROCK signal pathway[J]. Int Immunopharmacol, 2017, 46: 220-227. DOI:10.1016/j.intimp.2017.03.007 |
| [11] | 尹海燕, 陶珮, 叶小玲, 等. 乌司他汀对老年脓毒症患者肠屏障功能的保护[J]. 中华急诊医学杂志, 2016, 25(2): 177-181. DOI:10.3760/cma.j.issn.1671-0282.2016.02.008 |
| [12] | 朱永, 李娜, 何振扬, 等. 血必净对严重脓毒症患者内皮功能及血清炎症因子的影响[J]. 中国临床研究, 2016, 29(6): 746-752. DOI:10.13429/j.ckni.cjcr.2016.06.007 |
| [13] | 景颖, 郑兴, 陈少萍, 等. 强力霉素影响基质金属蛋白酶活性和血管重构的实验研究[J]. 中国病理生理杂志, 2006, 22(9): 1708-1711. |
| [14] | Araújo AA, Lopes de Souza G, Souza TO, et al. Olmesartan decreases IL-1β and TNF-α levels; downregulates MMP-2, MMP-9, COX-2, and RANKL; and upregulates OPG in experimental periodontitis[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 386(10): 875-884. DOI:10.1007/s00210-013-0886-8 |
| [15] | Maitra SR, Jacob A, Zhou M, et al. Modulation of matrix Metalloproteinase-9 and tissue inhibitor of matrix Metalloproteinase-1 in sepsis[J]. Int J Clin Exp Med, 2010(3): 180-185. |
 2018, Vol. 27
2018, Vol. 27




