慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是急性肺栓塞的严重并发症,未经治疗预后非常差。准确了解CTEPH的危险因素、病生理变化、诊断及治疗的进展,对CTEPH及早诊断并采取及时、恰当的治疗至关重要。2015年ESC将肺高压定义为静息状态下,右心导管测定的平均肺动脉压(mean pulmonary artery pressure,mPAP)≥25 mmHg[1]。依据肺高压的病因、临床表现、病生理、血流动力学特征及治疗方案等特点临床上将肺高压分为Ⅰ~Ⅴ型。刚刚结束的2018年第6届世界肺高血压会议对肺高压的分型及定义进一步调整,将mPAP≥20 mmHg视为肺高压,目的是及早识别肺高压(虽尚未发布相关指南)。CTEPH作为肺高压的第IV类,是指肺动脉血栓栓塞症(pulmonary thromboembolism,PTE)经过正规抗凝治疗3月后,mPAP≥ 25 mmHg,肺动脉楔压(pulmonary artery wedge pressure,PAWP)≤15 mmHg;同时肺灌注通气扫描明确提示肺血流灌注与通气不匹配,或肺动脉增强CT出现典型的肺栓塞征象即可诊断。其特征为血栓导致的肺动脉纤维化及相关的肺微血管管壁重塑;伴有肺动脉压力及肺循环阻力升高,继而导致右心室扩张乃至右心功能衰竭等表现[2]。肺高压终末期患者运动耐力及生活质量进一步下降,其全因死亡风险较非肺高压患者升高2倍[3]。目前推荐证据级别较高、研究较多的除了Ⅰ型肺高压(靶向药物治疗),就是Ⅳ型肺高压(肺动脉内膜剥脱术、球囊肺动脉成形术、靶向药物治疗)[1]。且CTEPH及时诊断和准确治疗可以明显改善预后的研究[4],本章重点介绍有关CTEPH的国内、国外研究进展。
1 CTEPH的发病率CTEPH的发病率统计结果存在很大的差异源于不同的入选和排除标准、样本量(287~866例不等)[5-7]、随访时限(2~5年不等)[5-6, 8]、检测手段(超声诊断[6, 8]、右心导管诊断[6-7])及患者表现(有症状性或者无症状性肺动脉高压[9])等标准不统一。既往报道CTEPH的发病率约为0.1%~0.5%[10],近些年随访急性肺栓塞患者2年后发现,有症状的CTEPH发生率为3.8%[11]、无症状者约1.8%[9]。
急性肺栓塞患者治疗不规范、反复出现的静脉栓塞事件将成为CTEPH的主要原因[12]。遗憾的是,并非所有的CTEPH患者均能提供明确的急性肺栓塞病史[13],所以有理由推测,肺栓塞患者的CTEPH的实际发生率远高于现有研究的结果。
2 CTEPH潜在的危险因素前血栓栓塞事件是CTEPH的高危因素,尽管部分患者不能提供明确的血栓事件病史[13]。一项注册研究结果显示,74.8%的CTEPH患者有明确的急性肺栓塞病史、56.1%存在VTE病史[13]。各种原因如Ⅷ因子、狼疮抗凝物、抗磷脂抗体水平变化及Leiden V基因突变等因素导致的先天性及获得性高凝状态均与CTEPH密切相关[14]。另有研究显示,甲状腺激素替代治疗及脾切除被视为血栓前状态,脾切除患者血小板功能障碍在CTEPH的发展中也起重要的作用[15-16]。CTEPH与恶性肿瘤,PAH相关性基因及血型等均有一定相关性[16-17]。并非所有急性肺栓塞患者都会发展为CTEPH,发展为CTEPH常见的危险因素,见表 1[18]。
CTEPH的发病机制不仅仅涉及到残存血栓负荷,肺动脉壁瘢痕形成、炎症反应、小血管病变及右室功能障碍均与CTEPH的发生、发展密切相关。机械性阻塞和继发内皮细胞炎症在CTEPH的发生、发展过程中起着非常关键的作用。越来越多证据提示肺动脉功能紊乱,纤维蛋白溶解障碍及远端小动脉损伤在CTEPH的发展中同样起着重要的作用[19-20]。
CTEPH患者的血液中存在高浓度的异常纤维蛋白原分子如纤维蛋白原Aα-Thr312Ala,导致α链交联增加从而导致纤维蛋白结构异常[21]。研究发现部分CTEPH患者近亲属患CTEPH或肺高压,可能与单核苷酸多态性[22]、纤维蛋白原功能[23]障碍密切相关。β链的基因突变如P235L/γ R375W, P235L/γ Y114H and P235L及α链的基因突变如L69H和R554H均会对体内纤溶作用产生抵抗[24]。近期发现E链基因突变如β15-42片段突变可导致溶解延迟。先天性及获得性纤维蛋白原功能障碍导致肺灌注不能完全恢复进而形成CTEPH[25]。
血管再生障碍是CTEPH发展中的另一关键因素。研究表明在血栓形成早期血管再生是血栓正常溶解的关键因素[26]。血管内皮生长因子受体-2/激酶插入结构域蛋白受体(vascular endothelial growth factor receptor 2/kinase insert domain protein receptor,VEGF-R2/Kdr)可促进血栓形成新生血管,而CTEPH患者内皮细胞特异性缺失VEGF-R2/Kdr,导致血栓血管再生障碍,进而导致CTEPH形成。其中脾切除、感染等均可能与此相关。
小血管的炎症反应同样参与了CTEPH的整个发展进程[2, 25, 27]尤其是炎性肠病及骨髓炎患者的CTEPH的发病率较高,推测炎症反应与CTEPH相关[28]。研究显示CTEPH患者与炎症反应相关的基因水平明显上调[27, 29],表现为CTEPH患者的CD40及TNF-α水平要高于其他类型的肺高压患者及正常人群,且CD40水平与CTEPH患者预后密切相关,而肺动脉内膜剥脱术(pulmonary endarterectomy, PEA)后TNF-α水平有明显下降[28-30]。PAH患者血浆及肺组织的内皮素-1浓度明显升高[1]。
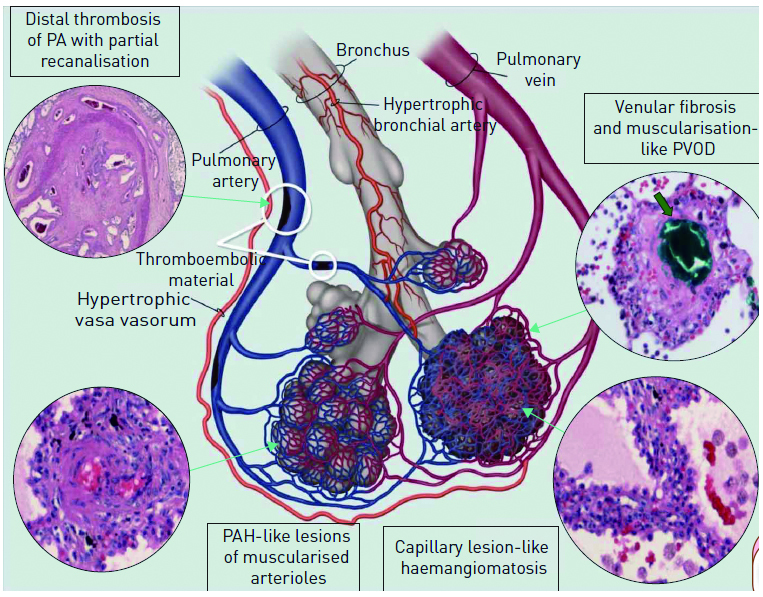
无血栓阻塞的肺动脉在CTEPH发展中扮演什么样的角色呢?很有意思的是,研究发现未被阻塞的肺动脉会出现同样的病理变化。原因是肺动脉阻塞后,支气管动脉及肺后动脉之间的连接部位因压差升高而扩张以改善肺灌注,但同时将未被阻塞的小动脉暴露在高压力下而导致内皮功能障碍(图 1),出现与特发性肺动脉高压相似的血管损伤如内膜增厚,阻力血管重建,内膜纤维化,内膜肌纤维增生及致丛样病变等,甚至影响远端肺动脉,导致肺血管阻力增加逐渐发展为症状性CTEPH[31-32]。除此之外,NO-sGC-cGMP信号传导通路与远端肺动脉损伤密切相关,CTEPH患者内皮细胞的一氧化氮合酶激活物不对称二甲基精氨酸的水平升高,而NO的水平降低,NO通路等抗增殖机制紊乱可能对CTEPH患者血管的重建产生重要影响[33]。不宜行PEA及术后复发的CTEPH患者经sGC激动剂(利奥西呱)治疗后临床症状及血流动力学明显改善,可从侧面佐证NO-sGC-cGMP信号传导通路在CTEPH发展中的重要作用[34]。
4 诊断 4.1 临床特征CTEPH早期因症状不典型或者不明显,早期诊断较为困难。通常伴有进行性呼吸困难,运动不耐受,可伴有下肢水肿、疲劳、不典型胸痛等。随着病情进展,逐渐出现右心衰竭可以表现为头晕、晕厥等症状[35]。查体时可闻及P2亢进,剑突下可触及心尖抬举样搏动及可闻及收缩期杂音。右心功能进一步恶化可表现为颈静脉怒张,肝颈静脉回流征阳性、肝肿大、水肿等[36]。CTEPH患者常伴有中到重度低氧血症,一旦肺动脉高压合并右向左分流即出现艾森曼格综合征时,其低氧血症表现会更加明显且无法通过吸氧来改善,严重影响着患者的生活质量[28]。
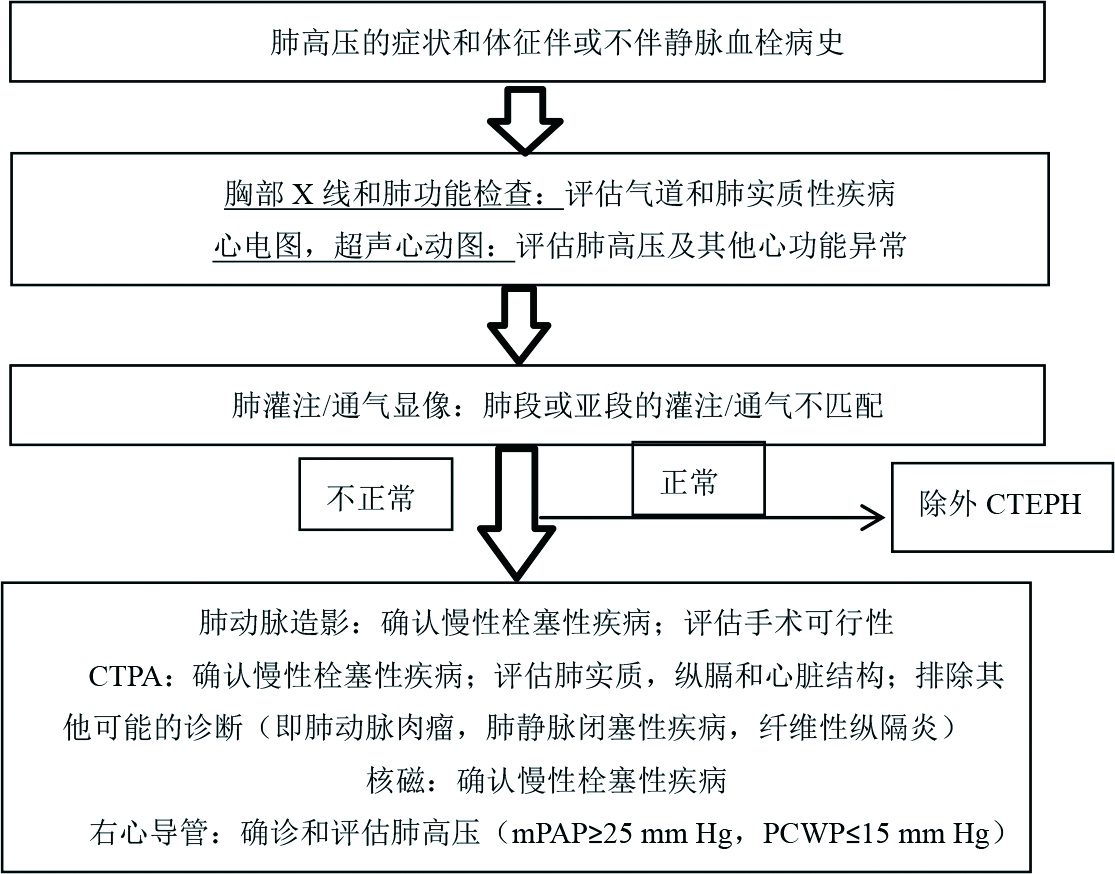
4.2 诊断时机及手段急性肺栓塞需经过正规抗凝治疗3月后,如右心导管仍存在mPAP≥25 mmHg,PAWP≤15 mmHg方可诊断。CTEPH仅依靠病史及体格检查诊断非常困难,更常见的心肺疾病如心肌病,缺血性心脏病,限制性或阻塞性肺疾病均可有相似的症状或体征[13]。胸片及肺功能有助于除外气道疾病及肺实质性疾病、心电图可发现肺高压与其他心脏疾病的蛛丝马迹、超声心动可用于筛查怀疑有肺血管疾病的患者是否存在肺动脉高压及右心功能不全、肺灌注/通气是筛查CTEPH的重要手段,其敏感性为96%~97.4%[13, 37]。诊断CTEPH的影像学金标准为肺动脉造影,肺动脉增强CT因分辨率高、无创等优势趋于取代肺动脉造影,但肺动脉增强CT敏感性要低于肺通气灌注显像,检测肺动脉主干的敏感性和特异性分别为97%及97.1%,而检测远端肺动脉栓塞的敏感性仅为85.8%,特异性为94.6%[38]。2018年JACC指南推荐CTEPH的诊断流程为:依据症状、体征及病史等疑似CTEPH时进行胸部X线、肺功能、心电图、超声心动检查等检查,除外其他疾病后完善肺灌注通气显像,结果正常即可除外CTEPH,如结果异常,则需进一步完善CTPA、右心导管等有创检查进一步明确诊断[18](表 2,流程图见图 2)。
| 诊断手段 |
| 诊断方法及特征及阳性表现 |
| 胸部X线: |
| 慢性肺栓塞:肺血少、不对称性肺动脉干扩张、有胸膜病变;肺高压:后期会出现肺动脉干增宽、右心房及右心室增大 |
| 心电图:右心室肥厚伴电轴右偏 |
| 肺功能检测:弥散功能障碍、中度限制性通气障碍 |
| 超声心动:肺动脉高压、右心房扩大、右心室扩大、三尖瓣反流速度增加 |
| 肺灌/注通气显像:首选检查手段(肺通气与灌注不匹配) |
| CTPA:敏感性较肺通气/灌注低、右心室扩大、肺动脉充盈缺损、支气管动脉形成侧支循环、肺间质灌注不良 |
| MRI:敏感度与CTPA相似,用于评估肺血流动力学、右心室大小及功能、 |
| 肺动脉造影及右心导管:评估疾病部位和程度的“金标准”,对段及亚段水平病变敏感度高于CTPA、术前评估 |
4.3 CTEPH影像学分类
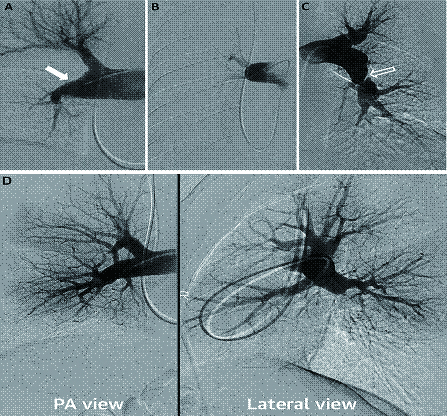
CTEPH肺动脉造影的特征性表现包括:带状或网状,内膜不规则,囊袋状缺损,血管突然狭窄,肺动脉完全阻塞等[39](图 3)。
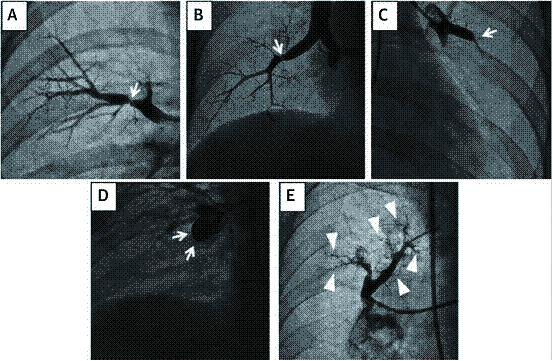
根肺动脉造影的影像学变现的患者病变部位的受损程度及远端血流情况,以新的形态学标准分为以下五类:A型,环状狭窄;B型,网状病变;C型,次全病变;D型,完全闭塞;E型,弯曲病变[40] (图 4)。
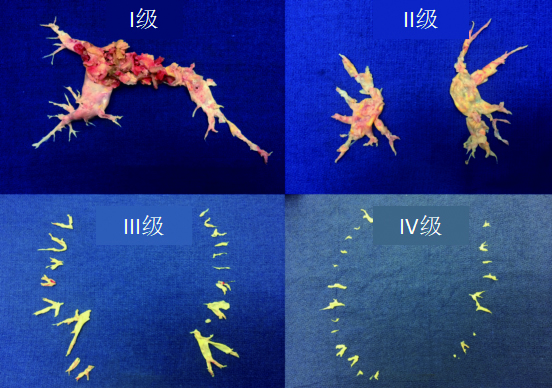
根据血栓的位置,UCSD建议将CTEPH中的肺血栓栓塞分为各级:Ⅰ级:累及肺动脉主干;Ⅱ级:始于肺动脉段;Ⅲ级:始于肺动脉亚段;Ⅳ级:仅限于肺动脉亚段。此外,IC级为单只肺动脉完全闭塞,右肺动脉或左肺动脉完全闭塞,0级则未见相应肺内CTEPH(图 5)。值得注意的是,这种分类是在PEA术中进行的分类。随着成像方式的改进,术前预测疾病水平的能力有所提高,尽管不是所有情况都能进行预测。对于Ⅲ至Ⅳ级病变即使专业性更强的术者进行手术,并发症的发生率也更高,但手术成功后血流动力学仍有望得到改善。
5 CTEPH治疗CTEPH患者无论选择何种治疗方案,均需要终身抗凝[1]。一旦确诊CTEPH,患者需要评估PTE手术(PEA)的可行性。如手术不可行或术后出现持续性肺高压症状或手术风险过高,需要考虑靶向药物治疗或靶向药物联合球囊肺血管成形术(balloon pulmonary angioplasty, BPA)治疗。通常会选择药物治疗联合BPA以稳定血流动力学并改善预后[18]。
5.1 手术治疗PEA是治疗CTEPH的首选方法,但是需要结合影像学证据、血流动力学变化、患者本身因素及手术团队的经验等[41]。目前手术适应证仍依据加州大学圣地亚哥分校(UCSD)制定的标准并不断完善[42-43]:⑴mPAP > 30 mmHg,PVR > 3 wood;⑵世界卫生组织肺高压心功能分级为Ⅲ~Ⅳ级(WHO心功能Ⅲ~Ⅳ级);⑶血栓位于主肺动脉或肺动脉近端;⑷无严重合并症[44];大部分行PEA的CTEPH患者为WHOⅢ~Ⅳ,一般无症状的CTEPH患者多数不考虑手术治疗。
随着技术的日趋成熟,WHO心功能Ⅱ级的患者也有接受PEA的治疗的报道(无论是否存在CTEPH典型症状)[45],PVR升高及右室功能衰竭也不能成为症状性的CTEPH患者绝对禁忌证[46]。个体方案选择与生活质量及预期寿命密切相关。显而易见,20岁WHO心功能Ⅱ级的CTEPH患者与80~90岁的WHO心功能Ⅱ级的患者治疗方案选择理论上应该有所考虑。需要注意的是,研究发现如患者存在器质性肺病如严重肺气肿或间质性肺病时并不能从PEA术获益,反而增加PEA的风险[46]。基于PEA手术过程复杂,需要经验丰富的外科医生(指在开始进行CTEPH研究的案例评估当年完成 > 20例PEA术,和(或)在进行案例评估前已完成 > 20例PEA术,和(或)在进行案例前3年内完成 > 20例PEA术[47])领导的多学科CTEPH团队根据血栓部位及血流动力学变化制定个体化手术方案。深受鼓舞的是经过20余年的不断摸索,成功的PEA术后1年生存率 > 90%,5年生存率 > 80%,10年生存率 > 70%。很显然,治疗方案和成功率很大程度上取决于手术团队的经验和整体实力[42, 48]。对于无手术条件的CTEPH患者及PEA术后复发的患者则预后相对较差,很遗憾的是对于这部分患者目前却没有明确的治疗以及随访方案[49]。
5.2 介入治疗鉴于栓塞部位手术难度过大、PVR升高程度与可行手术的栓塞部位程度不匹配、PVR > 15 wood或年龄、并发症等原因无法行手术治疗的患者约占1/3[13],且另有一部分患者即使PEA很成功,但术后仍存在肺高压,此部分患者可尝试进行BPA治疗。所以,不宜行PEA的CTEPH患者可考虑BPA治疗,但由于手术评估的复杂性(需要考虑年龄、肺血管阻力、栓子部位、右室衰竭程度及患者的倾向等[50])及术后肺水肿的发生率较高[51],建议由肺血管学专家、心脏内科介入专家、PEA外科专家及医学影像学专家组成的多学科专家小组CTEPH患者是否适合行BPA术。基于BPA缺乏长期预后的RCT研究,2015年ESC指南对BPA的推荐力度仅为IIb/C[1, 52],也有建议将PEA及BPA联合应用[1, 41]。对于不能行PEA且不宜应用靶向药物治疗的患者是否能真正从BPA中获益尚不完全清楚,仍需进一步研究。
5.3 药物治疗药物治疗适用于不能接受手术治疗、顽固性肺高压及术后复发的患者。但必须强调的是,药物治疗不能作为手术治疗的替代方案(表 3)。药物治疗只适用于非手术适应证CTEPH患者的治疗(图 6)。
| PAH靶向药物治疗 | 推荐类别-证据级别 | ||||
| WHO-FCⅡ | WHO-FCⅢ | WHO-FCⅣ | |||
| 钙离子通道拮抗剂 | I/C | I/C | - | ||
| 内皮素受体拮抗剂 | 安倍生坦 | I/A | I/A | IIb/C | |
| 波生坦 | I/A | I/A | IIb/C | ||
| 马西替坦 | I/B | I/B | IIb/C | ||
| 磷酸二酯酶-5抑制剂 | 西地那非 | I/A | I/A | IIb/C | |
| 他达拉非 | I/B | I/B | IIb/C | ||
| 伐地那非 | IIb/B | IIb/B | IIb/C | ||
| 鸟苷酸环化酶激活剂 | 利奥西呱 | I/B | I/B | IIb/C | |
| 前列环素类似物 | 依前列醇 | 静脉注射 | - | I/A | I/A |
| 伊洛前列素 | 吸入 | - | I/B | IIb/C | |
| 静脉注射 | - | IIa/C | IIb/C | ||
| 曲前列环素 | 皮下注射 | - | I/B | IIb/C | |
| 吸入 | - | I/B | IIb/C | ||
| 静脉注射 | - | IIa/C | IIb/C | ||
| 口服 | - | IIb/B | - | ||
| 贝拉普特 | - | IIb/B | - | ||
| 前列环素受体激动剂 | 塞乐西帕(口服) | I/B | I/B | - | |
| 注:WHO-FC:WHO功能分级 | |||||
目前治疗肺高压的药物包括钙离子通道拮抗剂(CCBs),内皮素受体拮抗剂(ERAs),磷酸二酯酶-5(PDE-5)抑制剂,前列环素类似物及前列环素受体激动剂以及可溶性鸟苷酸环化酶(sGC)激动剂[1]。目前正在进行的RACE试验(不宜手术的CTEPH患者应用利奥双胍与BPA的研究;NCT 02634203)正在探讨利奥双胍与BPA对无法手术的CTEPH的相对益处问题,其结果值得期待[18]。目前有明确证据证明对CTEPH有效的药物只有利奥西呱[34]。
利奥西呱作为sGC激动剂作用于NO-sGC-cGMP信号传导通路,sGC能够被NO激活而催化cGMP的合成。肺动脉高压患者NO合成不足,NO供体类药物虽然有效但半衰期短,利奥西呱作为sGC激动剂可以直接激活sGC,也能稳定NO-sGC结合,从而上调第二信使cGMP。CHEST-1及CHENST-2研究表明利奥西呱能够有效降低肺血管阻力,并提高6分钟步行实验结果,获益时间甚至长达1年[34, 53],是唯一作为I类推荐的CTEPH靶向药物。
西地那非用于治疗的主要机制是通过抑制PDE-5上调cGMP水平作用于NO-sGC-cGMP信号传导通路,但由于缺少数据只作为IIb/C类推荐。
BENEFIT(Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension)研究表明,波生坦作为内皮素受体拮抗剂,能明显降低肺血管阻力,且在PEA术前16周使用能够明显改善右室功能及右室重塑[54-55]。MERIT(Macitentan for the Treatment of Inoperable Chronic Thromboembolic Pulmonary Hypertension)所得结果相似[56]。2015年ESC指南中作为症状性CTEPH患者且不宜行PEA术者使用,推荐级别为IIb/B类。
前列腺素类似物及前列腺素受体激动剂通过调节前列腺素代谢途径来起作用,同样适用于PAH,作为CTEPH的靶向药物则同样因数据不足而作为IIb/B类推荐
总之,CTEPH为急性肺栓塞患者并非罕见的并发症,具有高致残率的特点。提高认识、规范诊断、及时治疗可以最大限度改善患者预后。CTEPH的治疗在过去的10年里取得长足进步,PEA仍然是唯一有效的治疗方案,并可达亚段或远端肺动脉。针对不宜手术的患者也可应用相应的靶向药物治疗。BPA为不宜行PTE术的患者提供了介入治疗的替代方案,但因为缺乏BPA术后的长期随访数据,其安全性,有效性及持久性还需进一步证实。基于此,强烈建议将CTEPH患者转诊至经验丰富的专家中心以接受多学科小组会诊,制定有效的评估、治疗及护理方案。
| [1] | Lau EM, Tamura Y, McGoon MD, et al. The 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension:a practical chronicle of progress[J]. Eur Respir J, 2015, 46(4): 879-882. DOI:10.1183/13993003.01177-2015 |
| [2] | Simonneau G, Torbicki A, Dorfmüller P, et al. The pathophysiology of chronic thromboembolic pulmonary hypertension[J]. Eur Respir Rev, 2017, 26(143). |
| [3] | Lowe BS, Therrien J, Ionescu-Ittu R, et al. Diagnosis of pulmonary hypertension in the congenital heart disease adult population impact on outcomes[J]. J Am Coll Cardiol, 2011, 58(5): 538-546. DOI:10.1016/j.jacc.2011.03.033 |
| [4] | Delcroix M, Lang I, Pepke-Zaba J, et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension:results from an international prospective registry[J]. Circulation, 2016, 133(9): 859-571. DOI:10.1161/CIRCULATIONAHA.115.016522 |
| [5] | Poli D, Grifoni E, Antonucci E, et al. Incidence of recurrent venous thromboembolism and of chronic thromboembolic pulmonary hypertension in patients after a first episode of pulmonary embolism[J]. J Thromb Thrombolysis, 2010, 30(3): 294-299. DOI:10.1007/s11239-010-0452-x |
| [6] | Yang S, Yang Y, Zhai Z, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism[J]. J Thorac Dis, 2015, 7(11): 1927-1938. |
| [7] | Miniati M, Monti S, Bottai M, et al. Survival and restoration of pulmonary perfusion in a long-term follow-up of patients after acute pulmonary embolism[J]. Medicine (Baltimore), 2006, 85(5): 253-262. DOI:10.1097/01.md.0000236952.87590.c8 |
| [8] | Korkmaz A, Ozlu T, Ozsu S, et al. Long-term outcomes in acute pulmonary thromboembolism:the incidence of chronic thromboembolic pulmonary hypertension and associated risk factors[J]. Clin Appl Thromb Hemost, 2012, 18(3): 281-288. DOI:10.1177/1076029611431956 |
| [9] | Martí D, Gómez V, Escobar C, et al. Incidence of symptomatic and asymptomatic chronic thromboembolic pulmonary hypertension[J]. Arch Bronconeumol, 2010, 46(12): 628-633. DOI:10.1016/j.arbres.2010.07.012 |
| [10] | Moser KM, Auger WR, Fedullo PF. Chronic major-vessel thromboembolic pulmonary hypertension[J]. Circulation, 1990, 81(6): 1735-1743. DOI:10.1161/01.CIR.81.6.1735 |
| [11] | Pengo V, Lensing AW, Prins MH, et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism[J]. N Engl J Med, 2004, 350(22): 2257-2264. DOI:10.1056/NEJMoa032274 |
| [12] | Klok FA, Zondag W, van Kralingen KW, et al. Patient outcomes after acute pulmonary embolism. A pooled survival analysis of different adverse events[J]. Am J Respir Crit Care Med, 2010, 181(5): 501-506. DOI:10.1164/rccm.200907-1141OC |
| [13] | Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH):results from an international prospective registry[J]. Circulation, 2011, 124(18): 1973-1981. DOI:10.1161/CIRCULATIONAHA.110.015008 |
| [14] | Wong CL, Szydlo R, Gibbs S, Laffan M. Hereditary and acquired thrombotic risk factors for chronic thromboembolic pulmonary hypertension[J]. Blood Coagul Fibrinolysis, 2010, 21(3): 201-206. DOI:10.1097/MBC.0b013e328331e664 |
| [15] | Kimmig LM, Palevsky HI. Review of the association between splenectomy and chronic thromboembolic pulmonary hypertension[J]. Ann Am Thorac Soc, 2016, 13(6): 945-954. DOI:10.1513/AnnalsATS.201512-826FR |
| [16] | Bonderman D, Wilkens H, Wakounig S, et al. Risk factors for chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2009, 33(2): 325-331. |
| [17] | Xi Q, Liu Z, Zhao Z, et al. High frequency of pulmonary hypertension-causing gene mutation in Chinese patients with chronic thromboembolic pulmonary hypertension[J]. PLoS One, 2016, 11(1): e0147396. DOI:10.1371/journal.pone.0147396 |
| [18] | Mahmud E, Madani MM, Kim NH, et al. Chronic thromboembolic pulmonary Hypertension:Evolving Therapeutic Approaches for Operable and Inoperable Disease[J]. J Am Coll Cardiol, 2018, 71(21): 2468-2486. DOI:10.1016/j.jacc.2018.04.009 |
| [19] | Lang IM, Pesavento R, Bonderman D, et al. Risk factors and basic mechanisms of chronic thromboembolic pulmonary hypertension:a current understanding[J]. Eur Respir J, 2013, 41(2): 462-468. DOI:10.1183/09031936.00049312 |
| [20] | Lang I. Chronic thromboembolic pulmonary hypertension:a distinct disease entity[J]. Eur Respir Rev, 2015, 24(136): 246-252. DOI:10.1183/16000617.00001115 |
| [21] | Suntharalingam J, Goldsmith K, van Marion V, et al. Fibrinogen Aalpha Thr312Ala polymorphism is associated with chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2008, 31(4): 736-741. DOI:10.1183/09031936.00055107 |
| [22] | Dodson MW, Desmarais J, Best DH, et al. Heritability in chronic thromboembolic pulmonary hypertension:pedigree analysis suggests a high prevalence of venous thromboembolism in family members of CTEPH patients, but a low prevalence of CTEPH. A28. FROM PE TO CTEPH:FADE AWAY OR NOT?[J]. Am J Respir Crit Care Med, 2016, 193: A1237. |
| [23] | Planquette B, Chiles PG, Marsh JJ, et al. CTEPH associated fibrinogen abnormalities among patients with acute PE. A28. FROM PE TO CTEPH:FADE AWAY OR NOT?[J]. Am J Respir Crit Care Med, 2016, 193: A1244. |
| [24] | Morris TA, Marsh JJ, Chiles PG, et al. High prevalence of dysfibrinogenemia among patients with chronic thromboembolic pulmonary hypertension[J]. Blood, 2009, 114(9): 1929-1936. DOI:10.1182/blood-2009-03-208264 |
| [25] | Morris T. The connection between pulmonary embolism and chronic thromboembolic pulmonary hypertension:research session at the American Thoracic Society 2016 Meeting[J]. J Thorac Dis, 2016, 8(Suppl 7): S573-575. |
| [26] | Alias S, Redwan B, Panzenboeck A, et al. Defective angiogenesis delays thrombus resolution:a potential pathogenetic mechanism underlying chronic thromboembolic pulmonary hypertension[J]. Arterioscler Thromb Vasc Biol, 2014, 34(4): 810-819. DOI:10.1161/ATVBAHA.113.302991 |
| [27] | Matthews DT, West J, Austin ED, et al. Blood transcriptome in patients with chronic thromboembolic pulmonary hypertension differs from patients with pulmonary arterial hypertension and healthy controls.A28. FROM PE TO CTEPH:FADE AWAY OR NOT?[J]. Am J Respir Crit Care Med, 2016, 193: A1245. |
| [28] | Quarck R, Wynants M, Verbeken E, et al. Contribution of inflammation and impaired angiogenesis to the pathobiology of chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2015, 46(2): 431-443. DOI:10.1183/09031936.00009914 |
| [29] | Shigeta A, Tanabe N, Naito A, et al. Preoperative serum CD40 ligand level as a promising predictor of surgical outcome in patients with chronic thromboembolic pulmonary hypertension. A28. FROM PE TO CTEPH:FADE AWAY OR NOT?[J]. Am J Respir Crit Care Med, 2016, 193: A1235. |
| [30] | Langer F, Schramm R, Bauer M, et al. Cytokine response to pulmonary thromboendarterectomy[J]. Chest, 2004, 126(1): 135-141. DOI:10.1378/chest.126.1.135 |
| [31] | Moser KM, Bloor CM. Pulmonary vascular lesions occurring in patients with chronic major vessel thromboembolic pulmonary hypertension[J]. Chest, 1993, 103(3): 685-692. DOI:10.1378/chest.103.3.685 |
| [32] | Dorfmüller P, Günther S, Ghigna MR, et al. Microvascular disease in chronic thromboembolic pulmonary hypertension:a role for pulmonary veins and systemic vasculature[J]. Eur Respir J, 2014, 44(5): 1275-1288. DOI:10.1183/09031936.00169113 |
| [33] | Skoro-Sajer N, Mittermayer F, Panzenboeck A, et al. Asymmetric dimethylarginine is increased in chronic thromboembolic pulmonary hypertension[J]. Am J Respir Crit Care Med, 2007, 176(11): 1154-1160. DOI:10.1164/rccm.200702-278OC |
| [34] | Simonneau G, D'Armini AM, Ghofrani HA, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension:a long-term extension study (CHEST-2)[J]. Eur Respir J, 2015, 45(5): 1293-1302. DOI:10.1183/09031936.00087114 |
| [35] | Gall H, Hoeper MM, Richter MJ, et al. An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan[J]. Eur Respir Rev, 2017, 26: 160121. DOI:10.1183/16000617.0121-2016 |
| [36] | Kim NH, Delcroix M, Jenkins DP, et al. Chronic thromboembolic pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62: D92-99. DOI:10.1016/j.jacc.2013.10.024 |
| [37] | Tunariu N, Gibbs SJ, Win Z, et al. Ventilation perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension[J]. J Nucl Med, 2007, 48: 680-684. DOI:10.2967/jnumed.106.039438 |
| [38] | Sugiura T, Tanabe N, Matsuura Y, et al. Role of 320-slice CT imaging in the diagnostic workup of patients with chronic thromboembolic pulmonary hypertension[J]. Chest, 2013, 143: 1070-1077. DOI:10.1378/chest.12-0407 |
| [39] | Auger WR, Fedullo PF, Moser KM, et al. Chronic major-vessel thromboembolic pulmonary artery obstruction:appearance at angiography[J]. Radiology, 1992, 182: 393-398. DOI:10.1148/radiology.182.2.1732955 |
| [40] | Kawakami T, Ogawa A, Miyaji K, et al. Novel angiographic classification of each vascular lesion in chronic thromboembolic pulmonary hypertension based on selective angiogram and results of balloon pulmonary angioplasty[J]. Circ Cardiovasc Interv, 2016, 9: e003318. DOI:10.1161/CIRCINTERVENTIONS.115.003318 |
| [41] | Anderson RJ, Malhotra A, Kim NH. Pulmonary hypertension:evolution of pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension[J]. J Thorac Dis, 2016, 8(Suppl 7): S562-565. |
| [42] | Jenkins D, Madani M, Fadel E, et al. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension[J]. Eur Respir Rev, 2017, 26(143). |
| [43] | Madani MM, Auger WR, Pretorius V, et al. Pulmonary endarterectomy:recent changes in a single institution's experience of more than 2 700 patients[J]. Ann Thorac Surg, 2012, 94(1): 97-103. DOI:10.1016/j.athoracsur.2012.04.004 |
| [44] | Jamieson SW, Auger WR, Fedullo PF, et al. Experience and results with 150 pulmonary thromboendarterectomy operations over a 29-month period[J]. J Thorac Cardiovasc Surg, 1993, 106(1): 116-126. |
| [45] | Taboada D, Pepke-Zaba J, Jenkins DP, et al. Outcome of pulmonary endarterectomy in symptomatic chronic thromboembolic disease[J]. Eur Respir J, 2014, 44(6): 1635-1645. DOI:10.1183/09031936.00050114 |
| [46] | Madani M, Mayer E, Fadel E, et al. Pulmonary Endarterectomy. Patient Selection, Technical Challenges, and Outcomes[J]. Ann Am Thorac Soc, 2016, 13(3): S240-247. |
| [47] | Jenkins DP, Biederman A, D'Armini AM, et al. Operability assessment in CTEPH:Lessons from the CHEST-1 study[J]. J Thorac Cardiovasc Surg, 2016, 152(3): 669-674.e3. DOI:10.1016/j.jtcvs.2016.02.062 |
| [48] | Lankeit M, Krieg V, Hobohm L, et al. Pulmonary endarterectomy in chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2017. |
| [49] | Jenkins D. Pulmonary endarterectomy:the potentially curative treatment for patients with chronic thromboembolic pulmonary hypertension[J]. Eur Respir Rev, 2015, 24(136): 263-271. DOI:10.1183/16000617.00000815 |
| [50] | Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension:the Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)[J]. Eur Heart J, 2016, 37: 67-119. DOI:10.1093/eurheartj/ehv317 |
| [51] | Yandrapalli S, Tariq S, Kumar J, et al. Chronic thromboembolic pulmonary hypertension:epidemiology, diagnosis, and management[J]. Cardiol Rev, 2017. |
| [52] | Rivers-Bowerman MD, Zener R, Jaberi A, et al. Balloon pulmonary angioplasty in chronic thromboembolic pulmonary hypertension:new horizons in the interventional management of pulmonary embolism[J]. Tech Vasc Interv Radiol, 2017, 20(3): 206-215. DOI:10.1053/j.tvir.2017.07.011 |
| [53] | Ghofrani HA, D'Armini AM, Grimminger F, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension[J]. N Engl J Med, 2013, 369(4): 319-329. DOI:10.1056/NEJMoa1209657 |
| [54] | Jaïs X, D'Armini AM, Jansa P, et al. Bosentan for treatment of inoperable chronic thromboembolic pulmonary hypertension:BENEFiT (Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension), a randomized, placebo-controlled trial[J]. J Am Coll Cardiol, 2008, 52(25): 2127-2134. DOI:10.1016/j.jacc.2008.08.059 |
| [55] | Surie S, Reesink HJ, Marcus JT, et al. Bosentan treatment is associated with improvement of right ventricular function and remodeling in chronic thromboembolic pulmonary hypertension[J]. Clin Cardiol, 2013, 36(11): 698-703. DOI:10.1002/clc.22197 |
| [56] | Ghofrani HA, Simonneau G, D'Armini AM, et al. Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1):results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study[J]. Lancet Respir Med, 2017, 5: 785-794. DOI:10.1016/S2213-2600(17)30305-3 |
 2018, Vol. 27
2018, Vol. 27