创伤性脑损伤(traumatic brain injury, TBI)会导致运动、感觉和认知功能短期或长期的缺损,同时伴随着精神抑郁等异常表现,影响患者恢复[1]。TBI发生相关的神经病理学演变过程从原发性机械损伤到延迟诱导的分子和细胞级联损伤即继发性损伤,导致神经元细胞进一步死亡,轴突破坏,脱髓鞘,星形胶质细胞和小胶质细胞增生和炎症等一系列病变[2]。TBI诱导的神经炎症加重继发性损伤的程度,同时,临床研究表明,TBI发生后星形胶质细胞激活,释放促炎细胞因子和活性氧(ROS),最终导致神经元变性和星形胶质细胞瘢痕形成[3]。近来研究发现,脐带沃顿胶(Wharton's jelly,WJ)组织含有大量的hUC-MSCs和脐带基质[4]。移植人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)能够修复中枢神经系统损伤。本研究通过原位移植WJ组织来观察分析对TBI小鼠的治疗效果和炎症及情绪状态的调控。
1 材料与方法 1.1 实验动物、材料及仪器脐带由捐赠者签署知情同意书后,郑州大学第一附属医院产科提供,检测传染性相关指标均呈阴性后用于本实验。实验用雄性C57BL/6小鼠购于北京维通利华实验动物技术有限公司[许可证号:SYXK(京)2006-0024],8~12周龄,体质量20~26 g,随机(随机数字法)分组,每组24只,TNF-α和IL-1β Elisa试剂盒(南京建成生物工程研究所),二氢乙锭(hydroethidine, HEt)购自美国Medchemexpress公司,兔抗GFAP单克隆抗体(美国Cell Signal Technology公司),兔抗CD68单克隆抗体(美国Abcam公司),荧光二抗CY3(上海生工生物有限公司),兔抗Iba1单克隆抗体(美国Abcam公司),荧光二抗FITC(上海生工生物有限公司),抗人CD45-PerCP、HLA-ABC-FITC、HLA-DR-FIT,CD29-PE、CD34-PE、CD44-FITC、以及PE-IgG2a、PerCP-IgG1和FITC-IgG1(美国Biolegend公司)。立体定位仪及颅脑打击器(深圳瑞沃德公司),荧光显微镜(莱卡),冰冻切片机(莱卡)。
1.2 脐带沃顿胶的分离与培养和细胞表型鉴定取长约2 cm的新鲜脐带组织,在超净台中用磷酸盐缓冲液(PBS)洗掉血污,放入培养皿中分离。剥离脐带外膜,分离出脐带中的3条血管,剩余的为沃顿胶组织。在培养皿中剪成约1 mm3的组织块,移到培养瓶中培养,1周左右组织块周围能观察到贴壁的梭形细胞,鉴定细胞表型,若为hUC-MSCs,将产生细胞的组织块分离出来待用。
选取生长状态良好的第3代细胞进行鉴定。采用直接法分别加入20 μL的抗人CD45-PerCP、HLA-ABC-FITC、HLA-DR-FIT,CD29-PE、CD34-PE、CD44-FITC、于对照管中分别加入等量的抗人PE-IgG2a和PerCP-IgG1,FITC-IgG1,避光下温育20 min,PBS洗3次,1 500 r/min离心5 min,重悬制成单细胞悬液进行流式细胞仪检测。
1.3 TBI模型的建立建立实验小鼠改良式自由落体脑外伤模型。使用10%的水合氯醛麻醉小鼠(3 mL/kg),待小鼠麻醉后备皮,医用碘伏消毒,沿头皮中线纵切一个长约3 cm的切口,暴露出右侧颅骨,在前囟后1.5 mm、中线右侧1.5 mm处,用环形钻钻开一个直径3 mm的圆形骨窗,保证硬脑膜完整。把小鼠固定到立体定位仪上,调整颅脑打击器,使用直径3 mm的撞针,打击速度6 m/s,深度2 mm。止血,骨蜡闭合骨窗,缝合伤口,碘伏消毒,术后给予保温处理。术后24 h,对于WJ移植组,将处理好的WJ组织移植到小鼠骨窗中心,骨蜡闭合骨窗后缝合。对照组(Vechile组)只做打击处理,术后1 d,腹腔注射生理盐水100 μL,骨蜡闭合骨窗后缝合。
1.4 神经功能缺损评分(neurologic deficit score,NDS)在TBI后第1天,3天,7天,14天,21天和28天使用NDS评分检测小鼠神经功能缺损[5]。NDS评分主要包括身体平衡性,前肢对称性,转圈实验,强迫旋转,攀爬能力,跛行6个主要评分项目,每项分值为0~4分,正常为0分,严重为4分。
1.5 糖水偏好实验(sucrose preference test,SPT)糖水偏嗜实验用于评价小鼠的情绪状况[6],于TBI后第21天开始检测,持续7 d。TBI后21 d,把小鼠的饮用水换为浓度为1%的蔗糖水,3 d后再更换为纯水和糖水,分别称质量,第28天再次称重质量,得到糖水和纯水的消耗量,计算得到小鼠糖水偏嗜度[小鼠糖水偏嗜度=糖水消耗量/(糖水消耗量+纯水消耗量)×100%]。
1.6 悬尾实验(tail suspension test,TST)悬尾实验在损伤28 d后用于检测TBI后小鼠的抑郁症状[6],正常情况下,小鼠会四肢运动摆脱倒立的位置。将小鼠放置实验台上,熟悉环境1 h,用长17 cm的胶带,一端固定在小鼠尾巴末端1 cm处,另一端固定于平台架子上,使小鼠头部朝向桌面,距离桌面约55 cm。录像6 min,记录小鼠逃脱倒立位置时四肢或躯干运动的时间(轻微运动不计),记录小鼠的不动时间。
1.7 强迫游泳实验(forced swim test,FST)TBI后28 d使用强迫游泳实验检测小鼠抑郁情况。在一个圆柱形的容器中放入清水(高:25 cm,直径:22 cm,温度:23 ℃),将小鼠放入水中,拍摄6 min,分析后4 min视频,记录小鼠的游泳时间(漂浮或仅有一肢体微动不计),计算小鼠的悬浮时间。
1.8 脑含水量的测定损伤3 d后,麻醉小鼠,心脏取血后取出损伤侧脑组织,迅速称取湿质量,放入烘箱,100 ℃下烘烤48 h,取出称取干质量,计算大脑的水含量[大脑水含量=(湿质量-干质量)/湿质量×100%],检测脑水肿情况。
1.9 Elisa检测炎症因子的表达使用Elisa试剂盒检测小鼠血液中炎症相关因子TNF-α和IL-1β的表达情况。取之前实验中取得的小鼠血液,离心吸取上清液,按照Elisa试剂盒说明书操作步骤进行实验,每组3个重复。
1.10 活性氧的检测TBI后3 d,给予小鼠腹腔注射HEt(10 μL/g),1 h后处死,PBS和4%多聚甲醛灌注后取脑组织,4%多聚甲醛固定过夜,再转移到25%和30%的蔗糖水中分别浸泡24 h梯度脱水,待脑组织下沉到试管底部后即可使用OCT包埋,冰冻切片机切片,荧光显微镜观察拍照。
1.11 免疫荧光染色TBI后3 d和28 d,麻醉小鼠,心脏取血,灌注后取脑组织,固定和脱水后,冰冻切片机切片。对切片进行免疫荧光染色[7],使用PBS洗片后,转入含有0.05%吐温20的柠檬酸溶液90 ℃孵育20 min,静置恢复至室温,PBST清洗,使用脱脂奶粉和山羊血清封闭2 h,孵育一抗(GFAP、Iba1或CD68),37 ℃下2 h或者4 ℃过夜,PBST清洗,孵育荧光二抗(CY3或FITC)37 ℃下2 h,PBST清洗后中性树胶封片,荧光显微镜下观察拍照。
1.12 统计学方法所有数据均使用SPSS 21.0软件进行统计分析,数据用均数±标准差(x±s)表示。不同时间点比较采用重复测量设计的两因素方差分析,以P < 0.05为差异有统计学意义。
2 结果本研究共使用C57BL/6小鼠51只,每组24只,所有小鼠死亡3只,其中WJ组1只,Veh组2只,死亡小鼠及时取出并造模补足。
2.1 hUC-MSCs的表面特异标记鉴定流式细胞仪检测第3代MSCs,结果显示,CD29和CD44呈高表达,CD34、CD133、CD45和HLA-DR(MHCII)均呈阴性表达,见图 1。
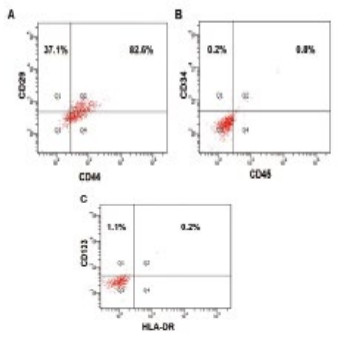
|
| 图 1 流式细胞仪鉴定MSCs细胞表型 Figure 1 Identification of phenotype of MSCs by flow cytometry |
|
|
NDS评分结果显示(表 1),对比Veh组,WJ移植组从术后3 d开始,评分明显降低(F=54.65,P < 0.05),表明移植WJ能降低TBI小鼠的神经功能缺损。
| 分组 | 1 d | 3 d | 7 d | 14 d | 21 d | 28 d |
| Veh组 | 15.2±1.5 | 13.5±1.2 | 12.0±1.6 | 10.5±1.6 | 9.0±1.7 | 7.8±1.2 |
| WJ组 | 14.8±1.2 | 11.0±1.4a | 9.5±1.5a | 7.7±0.8a | 6.5±0.6a | 5.3±0.8a |
| 注:与Veh组比较,aP < 0.05 | ||||||
| 分组 | SPT(%) | TST(s) | FST(s) |
| Veh组 | 54.49±1.505 | 144.7±5.493 | 260.3±4.558 |
| WJ组 | 64.56±2.279a | 115.7±4.660a | 215.8±5.003a |
| 注:与Veh组比较,aP < 0.05 | |||
对TBI小鼠进行糖水偏嗜实验、悬尾试验和强迫游泳实验评价小鼠的抑郁情况,结果显示,对比Veh组,移植WJ能显著提高小鼠的糖水偏嗜度(t=3.687,P=0.004)。在悬尾实验和强迫游泳实验中,WJ移植组小鼠不动时间和悬浮时间和均高于Veh组(t=4.026,t=6.575,P < 0.01,P=0.002)。
2.4 WJ移植减轻TBI后的脑水肿损伤3 d后检测小鼠脑含水量评价小鼠脑水肿情况,WJ治疗组的脑含水量明显低于Veh组,分别为(75.58±1.559)%和(84.48±1.802)%,结果表明WJ能明显减少脑含水量(n=6,t=3.733,P=0.004),降低脑水肿。
2.5 WJ移植减轻TBI后的炎症反应Elisa试剂盒检测炎症因子IL-1β和TNF-α的表达,结果显示,对比Veh组,WJ移植组IL-1β(图 2A)和TNF-α(图 2B)表达量[(44.429±3.422)ng/mL和(658.712±43.175)ng/ml]均明显低于Veh组[(70.717±4.124)ng/mL和(1 043.118±56.813)ng/mL],差异有统计学意义(n=6,t=4.906和5.387,P=0.000 6,P=0.000 3),表明移植WJ组织能减轻TBI小鼠的炎症反应。
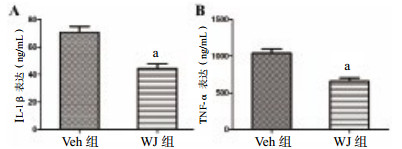
|
| 与Veh组比较,aP < 0.05 图 2 各组IL-1β和TNF-α的表达情 Figure 2 Expression of IL-1β and TNF-α in each group |
|
|
TBI后3 d,HEt染色检测小鼠损伤部位ROS的积累,统计分析荧光强度,WJ移植组(2 151±406.287)明显低于Veh组(3 687±380.466),WJ移植后能有效减少小鼠TBI后损伤部位ROS的积累(n=6,t=2.760,P=0.020),见图 3。

|
| 图 3 两组损伤部位活性氧的表达(×200) Figure 3 Expression of reactive oxygen speciesin each group(×200) |
|
|
TBI刺激后脑组织中星形胶质细胞活化,免疫荧光染色观察星形胶质细胞的荧光强度(图 4),图 3中统计分析结果显示,对比Veh组(2 906±431.591),移植WJ(1 658±312.912)能明显减少急性期星形胶质细胞的活化,差异有统计学意义(n=6,t=2.342,P=0.041)。
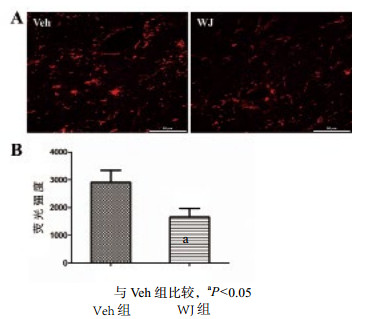
|
| 图 4 两组星形胶质细胞的表达(×400) Figure 4 Expression of astrocytes in each group(×400) |
|
|
TBI后3 d,免疫荧光染色检测小鼠TBI后脑组织中小胶质细胞的数量,结果显示,与Veh组相比较(20.833±2.212)个,移植WJ(15.167±1.249)个明显减少TBI后的小胶质细胞的数量,差异有统计学意义(n=6,t=2.230,P=0.049)。CD68标记活化的小胶质细胞,结果表明,与Veh组相比较(38.833±3.301)个,移植WJ(13.500±2.094)个明显减少TBI后的小胶质细胞的数量,差异有统计学意义(n=6,t=6.481,P < 0.01),见图 5。
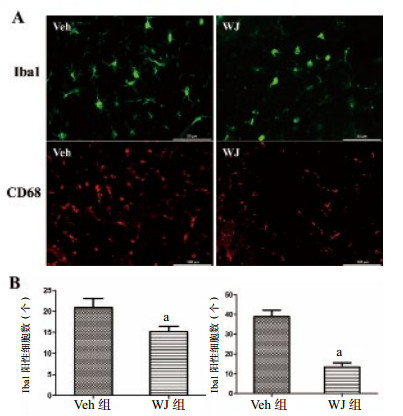
|
| 与Veh组比较,aP < 0.05 图 5 小胶质细胞的表达(×400)和活化的小胶质细胞的表达(×200)和细胞计数 Figure 5 Expression of microglia in(×400)and activated microglia(×200) |
|
|
TBI是由外力引起的大脑损伤,其引发的炎症和氧化损伤反应可导致继发性损伤,现今仍无有效的治疗方法。许多研究表明脑外伤后移植干细胞可促进神经功能恢复[8-9]。在不同种类的干细胞中,hUC-MSCs具有来源广泛、易采集、伦理学争议少等显著优势,被认为是治疗脑外伤最有前景的干细胞之一,但是多数研究仅观察了神经功能的修复,对于机体炎症和情绪状态的研究较为忽视。人脐带血管周围包裹的蛋白样组织被称为脐带WJ组织,组织中富含多种透明质酸和胶原成分,微环境结构可以支持细胞生长和充当组织支架,填充脑损伤后带来的缺损,同时能持续培养出大量hUC-MSCs[10]。目前关于WJ移植治疗脑损伤的报道较少。本研究给予TBI小鼠移植WJ组织,探究其对TBI小鼠情绪状况和炎症的调节作用。
脑外伤后由于脑功能失调和紊乱,导致精神状态改变(例如混乱)或神经功能障碍(例如局灶性体征,癫痫发作)。这些症状是异质性的,包括身体,认知和情感障碍,其中许多与抑郁症的特征重叠,严重影响后期恢复和适应生活[11]。在本研究中,移植WJ治疗脑外伤,通过检测小鼠的神经功能缺损评分,包括身体平衡性,攀爬能力,前肢对称性,跛行,转圈实验,强迫旋转六个项目衡量小鼠的神经功能缺损情况,发现WJ组织能够显著改善小鼠的神经功能障碍。小鼠处于抑郁情绪时,糖水偏嗜度明显降低,TBI后移植WJ组织能显著增加小鼠的糖水偏嗜度。悬尾试验时,正常情况下,小鼠会四肢运动摆脱处于倒立的位置,TBI后其不动时间明显增加,移植WJ组织能减少其不动时间。对小鼠进行强迫游泳实验,TBI后WJ移植组悬浮时间明显减少,这些结果表明移植WJ组织能明显改善小鼠的抑郁情绪。
脑水肿是由于脑外伤后损害了血脑屏障和大脑细胞膜的正常代谢功能,血管中液体外渗,在胞外间隙,组织间隙和脑细胞内积聚而形成。脑外伤后会立刻发生脑水肿,如果没有及时治疗,会造成严重的后果[12]。损伤后的炎症反应对脑外伤的发展至关重要[13]。脑外伤后ROS的积累会引发氧化应激反应,产生大量氧化中间产物,引起细胞坏死,神经元变性[14]。使用Elisa方法检测炎症因子TNF-α和IL-1β的表达情况,本研究发现移植WJ组织能够减轻损伤后的炎症反应,同时损伤3 d后对TBI小鼠进行HEt染色发现,WJ组织能够减少损伤部位ROS的产生。
TBI后的继发性损伤诱导星形胶质细胞和小胶质细胞增殖和激活,导致星形胶质细胞瘢痕形成,释放炎症细胞因子和ROS,最终导致神经元变性[15]。TBI诱导的神经炎症在继发性损伤严重程度和进展中起关键作用。临床前和临床研究表明,TBI后慢性小胶质细胞激活会导致进行性神经退行性病变和相关的神经功能缺损。星形胶质细胞是神经系统中存在最多的细胞,继发性损伤前期,星形胶质细胞大量激活并增殖,形成胶质瘢痕,同时会释放小分子维持炎症反应,不利于治疗[16]。本研究发现WJ组织移植治疗TBI后,GFAP、Iba1和CD68表达明显下降,说明活化的星形胶质细胞和小胶质细胞明显较少。
WJ组织治疗脑外伤对神经功能起到的保护作用可能是由于其能够提供大量的hUC-MSCs,释放神经营养因子,减轻神经炎症。笔者推测移植WJ组织促进脑外伤神经功能重塑可能与增加神经元细胞的分化和神经突触的形成有关,后续将会进一步研究。
| [1] | Mayer AR, Quinn DK, Master CL. The spectrum of mild traumatic brain injury: a review[J]. Neurology, 2017, 89(6): 623-632. DOI:10.1212/WNL.0000000000004214 |
| [2] | Faden AI. Microglial activation and traumatic brain injury[J]. Ann Neurol, 2011, 70(3): 345-346. DOI:10.1002/ana.22555 |
| [3] | Jassam YN, Izzy S, Whalen M, et al. Neuroimmunology of traumatic brain injury: time for a paradigm shift[J]. Neuron, 2017, 95(6): 1246-1265. DOI:10.1016/j.neuron.2017.07.010 |
| [4] | Gauthaman K, Fong CY, Suganya CA, et al. Extra-embryonic human Wharton's jelly stem cells do not induce tumorigenesis, unlike human embryonic stem cells[J]. Reprod Biomed Online, 2012, 24(2): 235-246. DOI:10.1016/j.rbmo.2011.10.007 |
| [5] | Zhao X, Wu T, Chang CF, et al. Toxic role of prostaglandin E2 receptor EP1 after intracerebral hemorrhage in mice[J]. Brain Behav Immun, 2015, 46: 293-310. DOI:10.1016/j.bbi.2015.02.011 |
| [6] | Zhu HT, Bian C, Yuan JC, et al. Curcumin attenuates acute inflammatory injury by inhibiting the TLR4/MyD88/NF-kappaB signaling pathway in experimental traumatic brain injury[J]. J Neuroinflammation, 2014, 11: 59. DOI:10.1186/1742-2094-11-59 |
| [7] | Wu H, Wu T, Li M, et al. Efficacy of the lipid-soluble iron chelator 2, 2'-dipyridyl against hemorrhagic brain injury[J]. Neurobiol Dis, 2012, 45(1): 388-394. DOI:10.1016/j.nbd.2011.08.028 |
| [8] | Wang S, Cheng H, Dai G, et al. Umbilical cord mesenchymal stem cell transplantation significantly improves neurological function in patients with sequelae of traumatic brain injury[J]. Brain Res, 2013, 1532: 76-84. DOI:10.1016/j.brainres.2013.08.001 |
| [9] | Koutsoudaki PN, Papastefanaki F, Stamatakis A, et al. Neural stem/progenitor cells differentiate into oligodendrocytes, reduce inflammation, and ameliorate learning deficits after transplantation in a mouse model of traumatic brain injury[J]. Glia, 2016, 64(5): 763-779. DOI:10.1002/glia.22959 |
| [10] | Sobolewski K, Malkowski A, Bankowski E, et al. Wharton's jelly as a reservoir of peptide growth factors[J]. Placenta, 2005, 26(10): 747-752. DOI:10.1016/j.placenta.2004.10.008 |
| [11] | Scholten AC, Haagsma JA, Cnossen MC, et al. Prevalence of and risk factors for anxiety and depressive disorders after traumatic brain injury: a systematic review[J]. J Neurotrauma, 2016, 33(22): 1969-1994. DOI:10.1089/neu.2015.4252 |
| [12] | Wei J, Pan X, Pei Z, et al. The beta-lactam antibiotic, ceftriaxone, provides neuroprotective potential via anti-excitotoxicity and anti-inflammation response in a rat model of traumatic brain injury[J]. J Trauma Acute Care Surg, 2012, 73(3): 654-660. DOI:10.1097/TA.0b013e31825133c0 |
| [13] | 魏冠, 林清江, 陈炳基, 等. 丙戊酸抑制大鼠创伤性颅脑损伤后炎症反应[J]. 中华急诊医学杂志, 2017, 26(3): 313-317. DOI:10.3760/cma.j.issn.1671-0282.2017.03.015 |
| [14] | Cheng T, Wang W, Li Q, et al. Cerebroprotection of flavanol (-)-epicatechin after traumatic brain injury via Nrf2-dependent and -independent pathways[J]. Free Radic Biol Med, 2016, 92: 15-28. DOI:10.1016/j.freeradbiomed.2015.12.027 |
| [15] | Liu P, Li YS, Quartermain D, et al. Inhaled nitric oxide improves short term memory and reduces the inflammatory reaction in a mouse model of mild traumatic brain injury[J]. Brain Res, 2013, 1522: 67-75. DOI:10.1016/j.brainres.2013.05.032 |
| [16] | Su Y, Fan W, Ma Z, et al. Taurine improves functional and histological outcomes and reduces inflammation in traumatic brain injury[J]. Neuroscience, 2014, 266: 56-65. DOI:10.1016/j.neuroscience.2014.02.006 |
 2018, Vol. 27
2018, Vol. 27




