脓毒症相关急性肺损伤和急性呼吸窘迫综合征是脓毒症发展到一定阶段常见严重并发症,是导致危重患者死亡的主要原因之一。虽然进行了大量研究,目前其机制尚未完全阐明。
肝素结合蛋白(heparin-binding protein, HBP)是主要存在于中性粒细胞分泌颗粒的炎症介质,在中性粒细胞激活后通过胞吐作用释放。HBP作用于血管内皮,可增加其通透性[1]。多项研究认为HBP与ARDS的发生相关,并可作为临床发生和预后的预测指标。整合素(integrin)是一种介导细胞和其外环境如细胞外基质之间连接的跨膜受体,其中由CD11b和CD18两个亚基组成的β2整合素在中性粒细胞的聚集和激活中起到重要的作用。而多个研究证实β2整合素与ARDS的发生相关[2-4]。但β2整合素参与的ARDS病理过程中,是否通过β2整合素相关的中性粒细胞激活,导致HBP的释放进而促进血管渗漏出现的肺损伤仍未可知。本研究使用结肠穿刺法(cecal ligation-peferation, CLP)制作脓毒症相关急性肺损伤模型,观察肺损伤指标肺组织湿干比、BALF蛋白浓度以及肝素结合蛋白和β2整合素水平,并使用β2整合素亚基CD18抗体阻断整合素功能,评估对肺损伤的影响及HBP、整合素与肺损伤的相关性,探讨ARDS的发生机制,以期为ARDS的治疗提供理论依据。
1 材料与方法 1.1 实验动物32只6~8周C57BL/6小鼠,体质量22~25 g,由同济大学实验动物中心提供,合格证号SYXK(沪)2014-0026。购进后在SPF级动物房饲养1周,维持正常昼夜循环,操作前12 h禁食不禁水。
1.2 分组30只小鼠被随机(随机数字法)分至3组,分别为对照组、CLP组和抗体处理组,每组10只。
1.3 手术操作每组动物均使用1.5%浓度戊巴比妥,50 mg/kg腹腔注射麻醉。麻醉满意后仰卧位固定于操作台,腹部备皮后于腹部正中开1 cm左右切口,分离盲肠,距盲肠末端1.5 cm处予以缝线结扎。使用16号针头在结扎后的盲肠部位针刺3次,轻按盲肠挤出少许粪便。回纳肠管,伤口缝合。对照组仅行麻醉及腹腔切开,不行盲肠结扎和针刺,其余操作相同。抗体组动物于操作前30 min经尾静脉注射CD18抗体(Abcam, Cambridge, UK)50 μg/只。
1.4 标本采集和测量术后24 h后,处死小鼠,切取肺叶,4%甲醛固定,石蜡包埋,切片,HE染色后行组织学检查并进行肺损伤Smith评分。
肺湿干比(W/D)测定:取小鼠左肺,吸水纸吸干表面液体后称量湿质量,60℃烤箱烘干约24 h至恒重后称量干质量。湿干比=湿质量/干质量。
肺泡灌洗液蛋白测定:麻醉后颈部解剖,暴露气管使用留置针进行插管,解剖胸部,确保插管进入右肺后结扎。生理盐水0.5 mL灌洗3次,每次反复灌洗3个回合。灌洗液于1 200转4℃离心10 min,取上清液保存-20 ℃冰箱用于蛋白检测。BALF采用BCA蛋白定量法测量。
HBP测定:小鼠心脏采血2 mL后离心,血清使用酶联免疫吸附(ELISA)检测试剂盒(江莱生物,上海,中国)测HBP水平,底层血细胞分离后流式细胞术测量整合素表达情况。
整合素测定:使用流式细胞术测定中性粒细胞表面β2整合素亚基CD18表达水平。分离的中性粒细胞制成1×105/mL细胞悬液。抗小鼠CD18单抗作为一抗(Abcam, Cambridge, UK), 再加荧光素标记二抗(抗小鼠IgG-FITC)(Sigma, San Francisco, USA), 最后上机进行流式细胞术检测。
1.5 统计学方法采用SPSS 17.0和GraphPad Prism 5统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,相关性分析采用Pearson法进行分析。以P < 0.05为差异有统计学意义。
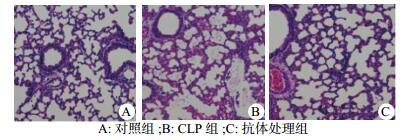
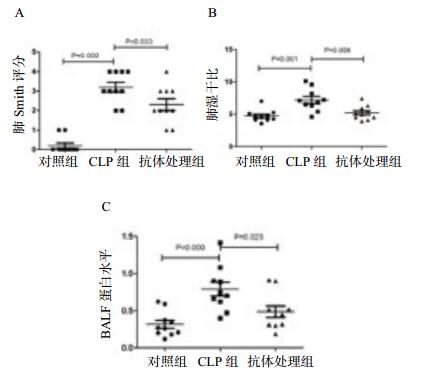
2 结果 2.1 小鼠肺组织病理学改变及病理组织评分对照组肺组织形态学未见损伤改变,CLP组肺组织呈现如下改变:肺间质及肺泡腔内可见大量炎性细胞浸润,部分肺泡塌陷,肺泡腔见嗜伊红物质渗出。抗体处理组可见部分肺泡内炎性细胞浸润,肺泡间隔一定程度增厚,但改变较CLP明显减轻(图 1)。使用smith法进行肺损伤评分,结果提示与对照组相比,CLP组小鼠肺损伤(t=10.607,P < 0.01)明显加重。抗体处理组小鼠肺smith评分较CLP组下降(t=2.307,P=0.033),差异有统计学意义,见图 2A。
|
| A:对照组; B: CLP组; C:抗体处理组 图 1 各组肺组织HE染色(200×) Figure 1 Lung tissue HE staining results of each group(200×) |
|
|
使用肺湿干比评价肺损伤时肺部液体渗出血管情况; 结果提示与对照组比,CLP组肺湿干比明显增大(t=3.968, P=0.001);抗体处理组肺湿干比较CLP组下降(t=3.080, P=0.006),见图 2B。
|
| 图 2 各组肺组织Smith评分(A)、肺湿干比(B)、BALF蛋白水平(C)比较 Figure 2 Comparison of lung tissue Smith Score(A), Lung wet/dry ratio(B), BALF protein(C) among groups |
|
|
BALF蛋白水平测量结果提示,CLP组较对照组明显升高(t=4.331, P < 0.01),抗体处理组可见较CLP组有所下降(t=2.484, P=0.023),见图 2C。
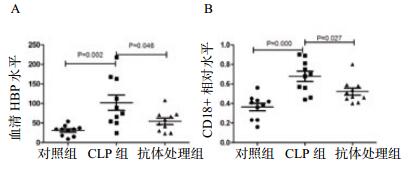
2.3 各组小鼠血清HBP和中性粒细胞CD18表达水平比较ELISA法检测小鼠血清HBP水平,结果提示HBP在CLP组明显升高(t=3.515, P=0.002),经抑制整合素功能抗体处理后明显下降(t=2.218, P=0.046),见图 3A。
|
| 图 3 各组血清HBP(A)与中性粒细胞CD18(B)水平比较 Figure 3 Comparison of plasma HBP (A) and PMN CD18+ rate(B) |
|
|
流式细胞术检测中性粒细胞表面CD18表达情况,以提示整合素在不同组动物的功能状态。结果提示CLP组的CD18阳性率明显增加(t=4.816,P < 0.01),抗体处理后下降(t=2.411,P=0.027),见图 3B。
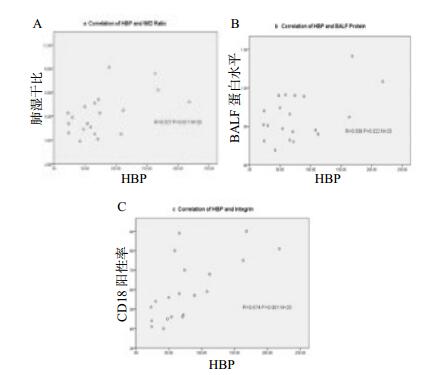
2.4 相关性分析就CLP组及抗体处理组动物血清HBP与肺水肿评分进行相关性分析,结果提示血清HBP水平与肺组织湿干比(r=0.527, P=0.017)(图 4A)、BALF蛋白水平(r=0.508, P=0.022)(图 4B)均呈正相关。且HBP与CD18阳性率呈正相关(r=0.674 P=0.001)(图 4C)。
|
| A:HBP与肺干湿比; B:HBP与BALF蛋白水平; C:HBP与CD18阳性率 图 4 血清HBP与肺损伤相关指标的相关性分析 Figure 4 Correlation analyses of HBP and lung injury related index |
|
|
虽然急性肺损伤/急性呼吸窘迫综合征的机制迄今未完全阐明,但感染导致的系统性炎症反应综合征是其重要病因。目前人们普遍认为ALI/ARDS是全身炎症反应综合征(system inflammatory response syndrome, SIRS)在肺部的表现,其本质是一种肺内过度性、失控性炎性反应。ALI/ARDS以肺血管内皮细胞和(或)肺泡上皮细胞的损伤为基础, 可导致液体和蛋白自血管腔进入间质间隙和肺泡。本研究证实CLP可成功制作感染相关急性肺损伤模型,出现肺炎症细胞的浸润,液体和蛋白进入肺间质进而肺湿干比升高,BALF蛋白水平升高,符合一般ARDS病理变化。这些变化都是以肺毛细血管内皮高通透性为病理特征,与中性粒细胞在肺毛细血管内的大量聚集和释放其产物有关[5]。
HBP是一种多功能的炎症介质,主要存在于中性粒细胞的分泌颗粒和嗜天青颗粒中。正常情况下中性粒细胞处于非活化状态,必须在趋化因子和激活剂作用下才被激活,进而发生胞吐作用,释放HBP从而发生多种病理作用。研究发现HBP与血管通透性改变相关,HBP在血管通透性增加情况下显著增加。Linder等[6]研究发现内皮细胞对HBP刺激的应答与中性粒细胞化学刺激后的表现是相同的。体内外实验证实,在使用免疫方法清除HBP后,原本存在的内皮细胞的通透性改变完全受到抑制[7]。HBP活化内皮细胞,使胞内游离钙离子浓度升高,肌动蛋白纤维紧张,内皮细胞骨架重排,改变内皮细胞外形,增加细胞周围间隙,导致细胞旁渗透性增加[8]。肝素结合蛋白被认为是作用于血管内皮细胞的最主要的上游信号,通过影响血管渗透性改变与脓毒症休克的发生有直接关系。有研究证实HBP水平在脓毒症早期升高[9-11]。本课题组前期进行的临床研究也支持以上结论,并进一步发现HBP其可作为脓毒症相关ARDS的早期预测指标[12]。在本研究中,与对照组比较,ARDS小鼠的肺病理评分、肺湿干比以及BALF蛋白水平均明显升高,同时血清HBP也明显升高,且相关性分析提示HBP与肺损伤严重程度有一定的相关性,进一步证实HBP在肺损伤中的作用。
整合素家族作为重要的介导细胞与细胞间黏附,并进行信号传导的细胞表面蛋白,在细胞信息、周期调节、细胞形态以及运动中起到重要作用。位于中性粒细胞表面的主要是CD11b/CD18组成的β2整合素。在中性粒细胞的血管贴壁黏附、激活中均有重要作用。β2整合素的功能参与了急性肺损伤的病理过程,在LPS诱发的急性肺损伤模型上,如果用单克隆抗体5c6拮抗CD11b处理,肺组织中蛋白渗出及PMN的聚集均得到缓解[13]。另一个研究中使用CD11b单克隆抗体处理肺损伤模型动物,发现处理后动物白细胞在肺毛细血管的黏附降低,肺损伤模型动物肺毛细血管血流增加[14]。本研究中使用CD18抗体抑制中性粒细胞整合素功能,结果与肺损伤模型组比较,CD18抗体处理后小鼠肺部渗出减少,肺组织病理评分降低、肺组织湿干比降低,BALF蛋白水平降低,整体降低了肺损伤的严重程度,进一步证实了β2整合素在肺损伤模型中的价值。
部分研究已经注意到中性粒细胞表面的整合素和HBP存在的关系。一项离体实验发现,免疫复合物与中性粒细胞膜表面整合素结合,激活中性粒细胞,诱导其颗粒胞吐作用释放HBP[15]。对于体外培养的细胞,使用M蛋白刺激中性粒细胞与内皮细胞共同培养,可见HBP的释放,同时观察到内皮细胞肌动蛋白的激活以及细胞骨架的变化。使用抗体清除整合素,细胞培养的上清液中HBP水平明显下降[16]。这些过程中整合素在激活中性粒细胞并促进HBP的释放中起到重要作用[17]。本研究通过抗体抑制β2整合素功能,结果实验动物肺损伤指标降低,同时HBP水平也下降。而且在肺损伤模型组与抗体处理组的小鼠可见整合素水平与HBP浓度存在相关性,提示整合素可能参与了HBP的释放,这与体外研究的结果一致。
本研究中感染相关肺损伤动物HBP和整合素均明显升高,抑制整合素功能后可见肺损伤情况及HBP水平降低。研究证实了整合素和HBP水平在肺损伤组中存在正相关。推测在肺损伤/ARDS病理过程中,HBP和整合素均起到重要作用,可能中性粒细胞表面的整合素与中性粒细胞的激活以及肝素结合蛋白的释放有关,进而导致肺部血管渗透性改变,这个过程可能是ARDS的一个发病机制,为ARDS的治疗提供了潜在思路。
| [1] | Fisher J, Linder A. Heparin-binding protein: a key player in the pathophysiology of organ dysfunction in sepsis[J]. J Intern Med, 2017, 281(6): 562-574. DOI:10.1111/joim.12604 |
| [2] | Preira P, Forel JM, Robert P, et al. The leukocyte-stiffening property of plasma in early acute respiratory distress syndrome (ARDS) revealed by a microfluidic single-cell study: the role of cytokines and protection with antibodies[J]. Crit Care, 2016, 20: 8. DOI:10.1186/s13054-015-1157-5 |
| [3] | Gardinali M, Borrelli E, Chiara O, et al. Inhibition of CD11-CD18 complex prevents acute lung injury and reduces mortality after peritonitis in rabbits[J]. Am J Respir Crit Care Med, 2000, 161(3 Pt 1): 1022-1029. |
| [4] | de Azevedo-Quintanilha IG, Vieira-de-Abreu A, Ferreira AC, et al. Integrin αDβ2 (CD11d/CD18) mediates experimental malaria-associated acute respiratory distress syndrome (MA-ARDS)[J]. Malar J, 2016, 15(1): 393. DOI:10.1186/s12936-016-1447-7 |
| [5] | Matthay MA, Zemans RL. The acute respiratory distress syndrome: pathogenesis and treatment[J]. Annu Rev Pathol, 2011, 6: 147-163. DOI:10.1146/annurev-pathol-011110-130158 |
| [6] | Linder A, Soehnlein O, Åkesson P. Roles of heparin-binding protein in bacterial infections[J]. J Innate Immun, 2010, 2(5): 431-438. DOI:10.1159/000314853 |
| [7] | Di Gennaro A, Kenne E, Wan M, et al. Leukotriene B4-induced changes in vascular permeability are mediated by neutrophil release of heparin-binding protein (HBP/CAP37/azurocidin)[J]. FASEB J, 2009, 23(6): 1750-1757. DOI:10.1096/fj.08-121277 |
| [8] | Gautam N, Herwald H, Hedqvist P, et al. Signaling via beta(2) integrins triggers neutrophil-dependent alteration in endothelial barrier function[J]. J Exp Med, 2000, 191(11): 1829-1839. DOI:10.1084/jem.191.11.1829 |
| [9] | Bentzer P, Fisher J, Kong HJ, et al. Heparin-binding protein is important for vascular leak in sepsis[J]. Intensive Care Med Exp, 2016, 4: 33. DOI:10.1186/s40635-016-0104-3 |
| [10] | Chew MS, Linder A, Santen S, et al. Increased plasma levels of heparin-binding protein in patients with shock: a prospective, cohort study[J]. Inflamm Res, 2012, 61(4): 375-379. DOI:10.1007/s00011-011-0422-6 |
| [11] | 刘杨, 马少林, 王学斌. 血清肝素结合蛋白在脓毒症休克中的预测作用[J]. 中华急诊医学杂志, 2014, 23(1): 79-83. DOI:10.3760/cma.j.issn.1671-0282.2014.01.019 |
| [12] | 刘杨, 王学斌, 马少林, 等. 肝素结合蛋白在急性呼吸窘迫综合征中的意义[J]. 中华急诊医学杂志, 2014, 23(5): 549-553. DOI:10.3760/cma.j.issn.1671-0282.2014.05.019 |
| [13] | Chen H, Bai C, Wang X. The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J]. Expert Rev Respir Med, 2010, 4(6): 773-783. DOI:10.1586/ers.10.71 |
| [14] | Wang Y, Roller J, Menger MD, et al. Sepsis-induced leukocyte adhesion in the pulmonary microvasculature in vivo is mediated by CD11a and CD11b[J]. Eur J Pharmacol, 2013, 702(1/3): 135-141. DOI:10.1016/j.ejphar.2013.01.024. |
| [15] | Soehnlein O, Oehmcke S, Ma X, et al. Neutrophil degranulation mediates severe lung damage triggered by streptococcal M1 protein[J]. Eur Respir J, 2008, 32(2): 405-412. DOI:10.1183/09031936.00173207 |
| [16] | Herwald H, Cramer H, Mörgelin M, et al. M protein, a classical bacterial virulence determinant, forms complexes with fibrinogen that induce vascular leakage[J]. Cell, 2004, 116(3): 367-379. DOI:10.1016/S0092-8674(04)00057-1 |
| [17] | Gautam N, Olofsson AM, Herwald H, et al. Heparin-binding protein (HBP/CAP37): a missing link in neutrophil-evoked alteration of vascular permeability[J]. Nat Med, 2001, 7(10): 1123-1127. DOI:10.1038/nm1001-1123 |
 2018, Vol. 27
2018, Vol. 27




