电子胎心监护(electronic fetal monitoring,EFM)作为一种评估胎儿宫内状态的手段。对EFM图形的完整的描述应包括基线、基线变异、加速、减速及宫缩等5个方面,另外,由于正弦波形有着非常特殊的临床意义,往往预示胎儿已存在严重缺氧,常见于胎儿重度贫血[1]、胎母输血的病例,需要特别引起重视。正弦波形:明显可见的、平滑的、类似正弦波的图形,长变异3~5周期/min,持续≥20 min[2]。当NST严重异常,出现正弦波形时,胎儿宫内缺氧状态已非常明确,不需要进行CST,以免加重胎儿缺氧状态,并延误抢救胎儿的时机,临床主要以急诊剖宫产手术终止妊娠。现将浙江大学医学院附属妇产科医院2017年4月至2017年7月收治的2例电子胎心监护发现FHR表现为正弦波形的孕妇经阴道分娩做回顾性分析,报道如下。
1 资料与方法病例1,孕妇35岁,G5P1,因“停经37+周,不规则腹痛5 h,胎心监护示NST(-),正弦波”入院,产科检查:胎位LOA,胎心155次/min,孕母宫高32 cm,腹围88 cm,胎动可及,未及明显胎盘早剥征象,评估无头盆不称,B超提示羊水指数7.6 cm。入院后立即吸氧,胎心监护示NST(-)(图 1A),13:30人工破膜,羊水清,持续胎心监护,13:43胎心监护示CST(+)(图 1B),15:25宫口开全,胎心监护示CST(+)(图 1C),15:31胎儿娩出。新生儿Apgar评分1~5 min:8分~9分,全身皮肤苍白,可见吸凹,送新生儿科。产程经过顺利。产后诊断:正弦波,孕5产2孕37+周LOA平产活婴,会阴I度裂伤,急产。新生儿予合理保温、监测生命体征、抗感染、补液支持治疗,按需喂养后情况稳定。病例2,孕妇41岁,G7P2,因“停经40+周,妊娠期糖尿病,胎心监护示NST(-)(图 2A),正弦波”入院。产科检查:胎位ROA,胎心134次/min,胎动可及,无阴道异常流血流液,评估无头盆不称,B超提示羊水指数19.9 cm,脐动脉S/D比值3.6,胎儿双手半握拳,呼吸样运动不明显。入院后2.5 U缩宫素静滴,胎心监护示OCT(+)(图 2B),宫口2 cm,先露-1 cm,人工破膜,羊水I°,胎心监护示CST(+)(图 2C),宫口4公分,先露+0.5cm,间笨三酚针80mg静推,胎心监护示CST(+)(图 2D), 12:13宫口开全,12:15胎儿娩出,新生儿Apgar评分1~5 min:6分~10分,因窒息转新生儿科治疗。产程经过顺利。产后诊断:正弦波,孕7产3孕40+周LOA平产活婴,妊娠期糖尿病,急产。新生儿予合理保温、监测生命体征、监测血糖、抗感染、补液支持治疗,按需喂养后情况稳定。
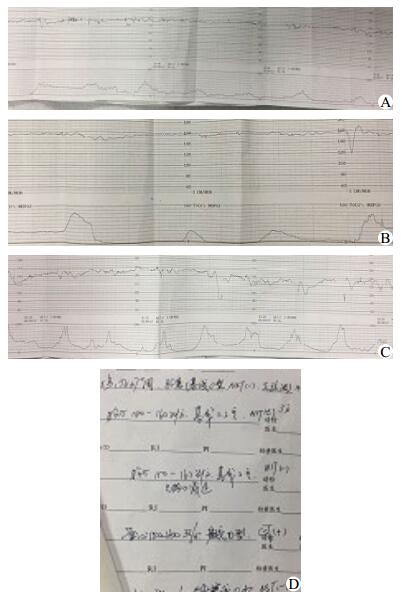
|
| 图 1 胎心监护(A、B、C)胎心监护结果(D) |
|
|
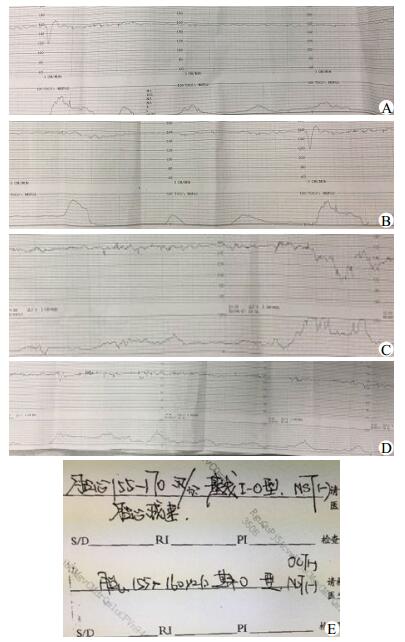
|
| 图 2 胎心监护(A、B、C、D)胎心监护结果(E) |
|
|
胎心监护利用胎心监护仪连续测记胎心率的变化,参考胎心率曲线和宫缩压力图形,评估胎儿健康状况,尽早发现问题并采取有效的处理措施,最大限度地提高新生儿的生存质量[3]。美国于2008年将胎心监护呈现正弦形列为胎儿宫内存在严重贫血或缺氧的标志,明确提出对于某一个胎心监护的图形,应全面综合考虑其体现的基线、变异、加速、减速的评价情况。研究表明,随着胎龄的增加,胎心率基线逐渐下降、胎心率基线变异逐渐增加、胎心加速次数和幅度增多、醒睡周期逐渐明显口[4]。
英国和加拿大在胎心监护指南[5]中,均明确提出胎心基线出现轻度变异即≤5次/min时,应当特别注意其持续时间。2012年的一项研究[6]指出,基于分娩前胎心监护减速图形的特点(减速深度、持续时间、频率等)的非NICHD的读图方法,对于酸中毒的预测价值更高。产程中如不能良好的监测胎心是会增加死产发生机会的[7]。缺氧时间过长会导致胎儿器官,特别是神经系统和心血管系统的功能产生严重不良影响。因此,胎心率监护应注意动态观察,可以适时进行重复监测,及时发现异常情况并及时作处理[8]。
胎监类型诊断按2015年FIGO产时胎监指南进行分类[9], 将不同的胎心曲线分为三类,Ⅰ类为正常、Ⅱ类为中间型、Ⅲ类为异常。在1项纳入了2 808例因急诊因素行剖宫产手术的病例研究中,发现其中有30%的急诊手术都是在出现Ⅲ类胎儿监护异常30 min后进行手术的,其新生儿结局并没有显著改善。多数胎儿在发现时已处于严重贫血的状态,其病死率达30%~50%[10]。正弦波属于Ⅲ类,属于异常监护图形的一种,与胎儿发生酸中毒的高风险密切相关。此类胎心监护图形的发生与新生儿缺血缺氧脑病、中枢性脑瘫以及新生儿酸中毒的发生明确相关,但同时并不增加新生儿远期神经系统相关的不良结局发生率。发现Ⅲ类胎心监护图形后需要采取相应的临床处理,如持续密切的监测,加强吸氧,加速产程进展的处理以及做好急诊剖宫产手术的准备等。Jackson等[11]还发现,产程中Ⅱ类图形时长增加与新生儿不良预后相关。Hamillton等[12]对3 695例分娩前特殊减速胎心监护图形的研究也发现,分娩前非中度变异减速可能与新生儿代谢性酸中毒相关。尽管目前还没有随机试验评估供氧对于胎儿窘迫处理的有效性,但是孕妇吸氧能够改善胎儿的氧合。经过胎心监护不间断的观察记录变化趋势,可以很好地掌握胎动、胎心以及宫缩的相关性。本次2例产妇产程均为急产,产程进展快。从发现正弦波监护图形至结束分娩之间可接受的时间阶段目前尚无明确的研究结果,但在临床上常常依据30 min这一源于临床经验的意见。但对于无改善的正弦波监护图形,则要尽快结束妊娠。
正弦波发生的原因很多,主要是严重缺氧、贫血等。研究表明,99%的正弦波胎儿失血量小于15 mL,大部分不会出现临床症状,当失血量达到30 mL, 则可引起胎儿宫内严重贫血、缺氧甚至胎死宫内,出现胎动减少或消失、胎心监护异常, 有研究显示, 正常情况下胎儿血液不能进入母体血循环,但当胎盘屏障受损时,可导致胎儿血液进入母体血循环引起胎儿失血及母婴间的溶血性反应,从而导致胎母输血综合征的发生。异常的胎心监护可提示各种原因造成的胎儿缺氧、酸中毒,但是该监测手段容易受到多种因素的影响,如胎儿生理性醒一睡周期、镇静药物、母体状态等,假阳性率较高,特异性及可重复性差,可能导致过度诊断和治疗。电子胎心监护仪可以避免这些因素的影响,连续记录胎心率的变化,在临床上广泛应用[17]。病例1新生儿全身皮肤苍白,存在严重贫血。2例新生儿都存在酸中毒。
| [1] | Reddy A, Moulden M, Redman CW. Antepartum high-frequency fetal heart rate sinusoidal rhythm: computerized detection and fetal anemia[J]. Am J Obstet Gynecol, 2009, 200(4): 401-407. DOI:10.1016/j.ajog.2008.10.026 |
| [2] | Macones GA, Hankins GD, Spong CY, et al. The 2008 National Institute of Child Health and Human Development workshop report on electronic fetal monitoring: update on definitions, interpretation, and research guidelines[J]. Obstet Gynecol, 2008, 112(3): 661-666. DOI:10.1097/AOG.0b013e3181841395 |
| [3] | Rosner J, Rochelson B, Rosen L, et al. Intermittent absent end diastolic velocity of the umbilical artery: antenatal and neonatal characteristics and indications for delivery[J]. J Matern Fetal Neonatal Med, 2014, 27(1): 94-97. DOI:10.3109/14767058.2013.806475 |
| [4] | Van Leeuwen P, Cysarz D, Edelhauser F, et al. Heart rate variability in the individual fetus[J]. Auton Neurosci, 2013, 178(12): 24-28. DOI:10.1016/j.autneu.2013.01.005 |
| [5] | Oladapo O T, Tuncalp O, Bonet M, et al. WHO model of intrapartum care for a positive childbirth experience: Transforming care of women and babies for improved health and well-being[J]. BJOG, 2018. DOI:10.1111/1471-0528.15237 |
| [6] | Cahill AG, Roehl KA, Odibo AO, et al. Association and prediction of neonatal acidemia[J]. Am J Obstet Gynecol, 2012, 207(3): 201-206. DOI:10.1016/j.ajog.2012.06.046 |
| [7] | Kc A, Wrammert J, Clark RB, et al. Inadequate fetal heart rate monitoring and poor use of partogram associated with intrapartum stillbirth: a case-referent study in Nepal[J]. BMC Pregnancy Childbirth, 2016, 16: 233. DOI:10.1186/s12884-016-1034-5 |
| [8] | Filmar G, Panagopoulos G, Minior V, et al. Elevated umbilical artery systolic/diastolic ratio in the absence of fetal growth restriction[J]. Arch Gynecol Obstet, 2013, 288(2): 279-285. DOI:10.1007/s00404-013-2764-5 |
| [9] | Ayres-De-Campos D, Spong CY, Chandraharan E. FIGO consensus guidelines on intrapartum fetal monitoring: Cardiotocography[J]. Int J Gynaecol Obstet, 2015, 131(1): 13-24. DOI:10.1016/j.ijgo.2015.06.020 |
| [10] | Hanssens SA, Coulon CD, Clouqueur EM, et al. Suspected hemorrhagic ovarian cyst causing fetal anemia measured by the peak systolic velocity in the middle cerebral artery[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 171(1): 187-188. DOI:10.1016/j.ejogrb.2013.08.004 |
| [11] | Jackson M, Holmgren CM, Esplin MS, et al. Frequency of fetal heart rate categories and short term neonatal outcome[J]. Obstet Gynecol, 2011, 118(4): 803-808. DOI:10.1097/AOG.0b013e31822f1b50 |
| [12] | Hamilton E, Warrick P, O'Keeffe D. Variable decelerations: do size and shape matter?[J]. J Matern Fetal Neonatal Med, 2012, 25(6): 648-653. DOI:10.3109/14767058.2011.594118 |
 2018, Vol. 27
2018, Vol. 27




