高迁移率族蛋白B1(high mobility group box-1 protein, HMGB1)是一种存在于真核细胞核内与染色体紧密结合,参与维持核苷酸稳定和调控基因转录的非组蛋白。研究证实,HMGB1可被分泌至细胞外,作为一种免疫激活信号,可直接活化抗原呈递细胞和介导初始T细胞分化[1]。笔者既往研究证实,HMGB1在体外可直接介导T淋巴细胞Th1/Th2功能性分化,并与其刺激剂量及时间呈相关性[2],但目前对于其中受体机制尚不明确。鉴于糖基化终产物受体(receptor for advanced glycation endproducts, RAGE)为HMGB1一个重要受体[3],本研究通过体外实验探讨HMGB1对CD4+T细胞Th1/Th2功能性分化的调控作用是否与RAGE相关,旨在既往研究基础上进一步阐明HMGB1对T淋巴细胞免疫调节的受体机制。
1 材料与方法 1.1 主要试剂培养液RPMI 1640、10%胎牛血清和其他细胞培养材料均购自北京天润善达生物科技公司;重组HMGB1(rhHMGB1,编号1690-HMB)、刀豆素A(ConA,编号2656)来源于R & D公司;抗小鼠CD4+T淋巴细胞MieroBeads(编号130-090-860)购自MiltenyiBiotee公司;RAGE中和抗体为Immunoway Technology公司产品(编号YT3993);小鼠干扰素-γ(interferon-γ,IFN-γ)、白介素-4(interleukin 4, IL-4)检测ELISA试剂盒购自美国Biosouree公司(编号分别为MBS734963,MBS2882941);总RNA提取Trizol试剂盒(编号LS1040)、逆转录-试剂盒(编号A5001)均为美国Promega公司产品;RealMasterMix(SYBRGreen)试剂盒来源于北京天根生化科技公司;荧光定量PCR引物及内参照β-actin引物均由上海生工生物工程公司合成。
1.2 方法 1.2.1 小鼠脾脏CD4+T细胞分离培养BALB/c小鼠禁食8 h,处死后固定、皮肤消毒,无菌留取脾脏,置于平皿中,用1 mL注射器和25 G针头将500 μL胶原酶D注入每个脾脏,将组织切成小片。脾脏碎片在37 ℃孵育25 min,加入10 mmol/L EDTA后再孵育5 min;用活塞在钢网上研磨,用缓冲液洗平皿和滤网。收集细胞悬液,注入尖体离心管中,1 500 r/min×5 min离心,弃上清,加入3 mL PBS制成细胞悬液后,加入到6 mL淋巴细胞分离液中,3 000 r/min×15 min离心,可见中间层云雾状低密度细胞层,小心吸出后用PBS离心洗涤2次得到淋巴细胞悬液;进一步采用MiniMACs免疫磁性分离系统进行分离CD4+T细胞,通过孵育、分选、洗脱等步骤得到CD4+T细胞;台盼蓝检测分离细胞的活性大于97%,用10%FCS-RPMl l640完全培养基重悬CD4+T细胞,备用。
1.2.2 细胞培养、分组与处理将CD4+T细胞调整浓度为2×106/L,接种至96孔培养板,0.2 mL/孔,37 ℃5%CO2孵箱孵育2 h使得细胞适应体外环境,加入终浓度为3 μg/L的ConA,孵育12 h;在实验中依据HMGB1刺激剂量随机分成4组:对照组、10 ng/mL组、100 ng/mL组和1 000 ng/mL,分别在不同组别加入相应PBS或溶于PBS的相应终浓度的HMGB1,刺激12 h、24 h和48 h时间点收集细胞上清液,检测白介素-4(IL-4)和干扰素-γ(IFN-γ)浓度,计算两者比值。分析HMGB1对于CD4+T细胞Th1/Th2分化影响的量效和时效关系,选择最佳刺激剂量及时间;根据选定HMGB1刺激时间剂量,调整CD4+T细胞浓度为2×106/L,实验分组分为对照组、A组(HMGB1刺激)、B组(HMGB1+PBS刺激)、C组(HMGB1+RAGE抗体刺激);A、B、C组加入HMGB1工作液,对照组则加入等量的HMGB1工作液的溶剂PBS液;C组提前2 h加入经PBS液1:200稀释的RAGE中和抗体,终浓度为5 μg/L;B组加入相同体积的PBS液;每组4个重复孔,HMGB1刺激相应时间后,收集培养上清液和细胞标本。
1.2.3 酶联免疫吸附试验法检测IL-4和IFN-γ严格按照ELISA检测试剂盒说明书操作步骤进行。
1.2.4 Western-blot检测RAGE的表达收集各组处理后的细胞,加入150 μL/孔RIPA裂解液,轻轻吹打混匀;裂解液转移至离心管防止冰上20 min,4 ℃ 12 000×g离心30 min;取上清,用BCA法进行蛋白定量;利用上样缓冲液对样本蛋白浓度进行标化,100 ℃水浴5 min,各组50 μg蛋白上样,进行十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳,半干法进行蛋白转膜。含5%牛血清白蛋白封闭液封闭1.5 h。先后予以RAGE一抗4 ℃孵育过夜(1:1 000),二抗室温孵育1 h(1:5 000);洗涤、显影、灰度扫描后,以目的蛋白条带和内参β-actin条带灰度比值表示RAGE蛋白表达情况。
1.2.5 荧光定量PCR法测定RAGE、CATA-3 mRNA表达收取各组2×107细胞,采用Trizol萃取法提取细胞总RNA,利用逆转录-试剂盒进行cDNA合成,具体操作步骤均严格按照试剂盒说明书进行;反转录产物采用SYBR Green荧光定量试剂盒和实时荧光定量PCR仪进行定量检测;内参β-actin上游引物为5’-TGA CGT GGA CAT CCG CAA AG -3’,下游引物为5’-CTG GAA GGT GGA CAG CGA GG -3’。RAGE上游引物为5’-GCC CTC CAG TCT ACT CTC G-3’,下游引物为5’-TGT GTG GCC ACC CAT TCC AG-3’。CATA-3上游引物为5’-ATA CTG GAA GGG TGG TGA GGT-3’,下游引物为5’-TCC AAA AAG TGC AAA AAG GTG-3’。采用7500型荧光定量PCR仪(美国Applied Biosystems公司)进行PCR循环检测,PCR反应条件:95 ℃变性20 s,55 ℃退火15 s,72 ℃延伸30 s,共40循环,扩增产物用琼脂糖凝胶电泳,Gelpro32分析软件进行分析,取目的基因相对值(目的基因/β-actin)进行比较。
1.3 统计学方法用SPSS 17.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,并用LSD-t检验进行组间两两比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 HMGB1对CD4+T细胞Th1/Th2功能性分化的影响鉴于CD4+T淋巴细胞可分化成以分泌IFN-γ、IL-2、TNF-α等促炎细胞因子的Th1细胞和以IL-4、IL-10等为主的Th2细胞[4],本实验中分别检测IFN-γ、IL-4表达情况,采用两者比例来评估Th1/Th2分化情况。如图 1A所示,与对照组相比,10 ng/mL的HMGB1刺激CD4+T细胞IFN-γ/IL-4比值明显升高(P < 0.05),而100 ng/mL、1 000 ng/mL HMGB1刺激CD4+T细胞IFN-γ/IL-4比值显著降低(P < 0.05);而100 ng/mL的HMGB1刺激CD4+T细胞24h,IFN-γ/IL-4比值显著降低(P < 0.05),48 h则更为明显(P < 0.05);结合本实验结果以及既往文献[5]报道,本研究中选择HMGB1刺激浓度为100 ng/mL,刺激时间为24 h。
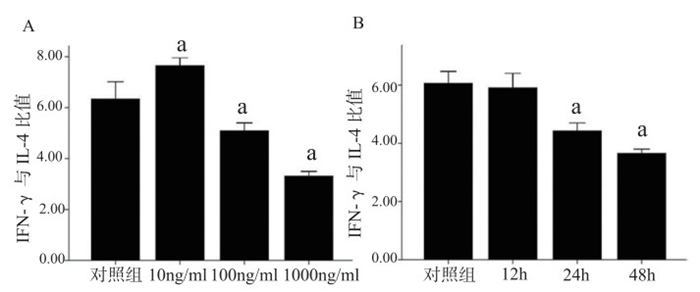
|
| 与对照组比较,aP < 0.05 图 1 HMGB1对CD4+T细胞Th1/Th2功能性分化的影响 Figure 1 The effect of HMGB1 on Th1/Th2 differentiation of CD4+ T lymphocytes |
|
|
如图 2A所示,与对照组比较,100 ng/mL HMGB1刺激CD4+T细胞24 h,A组的RAGE蛋白表达显著升高(P < 0.05);RAGE mRNA较对照组亦明显升高(图 2B)(P < 0.05)。
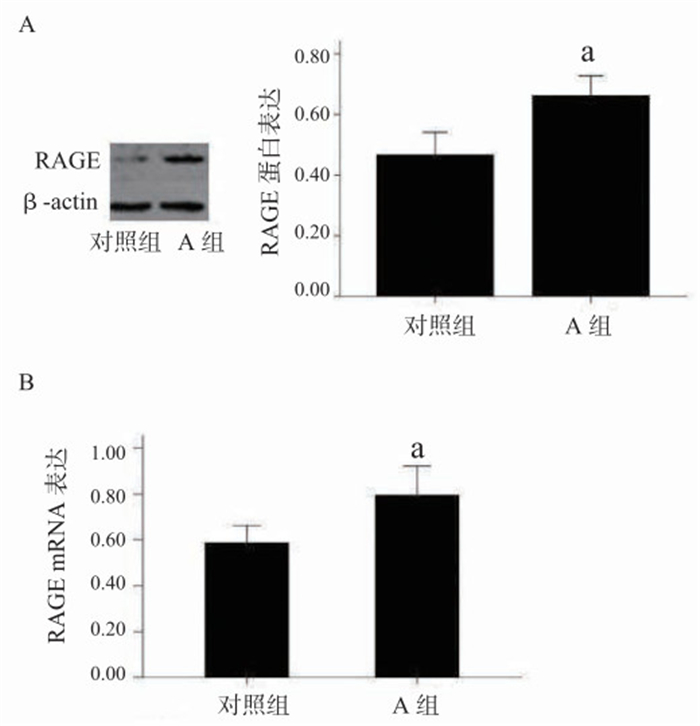
|
| 与对照组比较,aP < 0.05 图 2 HMGB1对CD4+T细胞RAGE表达的影响 Figure 2 The effect of HMGB1 on expression of RAGE in CD4+ T lymphocytes |
|
|
如表 1和图 3所示,与对照组比较,A组IFN-γ/IL-4明显降低(P < 0.05),GATA3 mRNA显著升高(P < 0.05);而与A组比较,C组IFN-γ/IL-4显著升高(P < 0.05),GATA3 mRNA下降(P < 0.05),而B组的IFN-γ/IL-4和GATA3 mRNA差异无统计学意义(P > 0.05)。
| 组别 | IFN-γ/IL-4 | GATA3 mRNA |
| 对照组 | 7.37±0.36 | 0.41±0.05 |
| A组 | 5.75±0.27a | 0.89±0.06a |
| B组 | 5.66±0.31a | 0.88±0.05a |
| C组 | 6.19±0.14ab | 0.67±0.04ab |
| 注:与对照组比较,aP < 0.05,与A组比较,bP < 0.05 | ||
|
| 图 3 抗-RAGE中和抗体对CD4+T细胞GATA3 mRNA表达的影响 Figure 3 The effect of anti-RAGE neutralizing antibody on HMGB1-mediated GATA3 mRNA expression in CD4+ T lymphocytes |
|
|
如图 4所示,与对照组比较,A组RAGE表达显著增加(P < 0.05);与A组比较,C组较A组RAGE表达明显降低(P < 0.05),而B组RAGE的表达差异无统计学意义(P > 0.05);而C组较对照组RAGE的表达仍有明显增加(P < 0.05)。
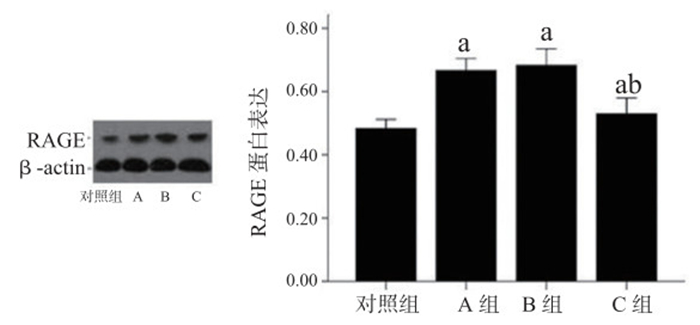
|
| 与对照组比较,aP < 0.05;与A组比较,bP < 0.05 图 4 RAGE中和抗体对HMGB1介导CD4+T细胞RAGE表达的影响 Figure 4 The effect of anti-RAGE neutralizing antibody on HMGB1-mediated RAGE expression in CD4+ T lymphocytes |
|
|
脓毒症(sepsis)是机体对于病原体感染而发生的全身炎症反应综合征,进一步发展可导致脓毒性休克(septic shock)、多脏器功能不全(multiple organ dysfunction syndrome, MODS)等,是ICU危重症患者主要死亡原因之一[6]。业已明确,脓毒症发病过程中,T淋巴细胞增殖能力下降,数目减少,并出现了以白介素(IL)-4和IL-10生成增加为特征的Th2型免疫反应,最终导致机体免疫抑制状态的形成,是脓毒症发生和发展的重要因素[7]。尽管如此,目前对于脓毒症相关的T细胞免疫功能紊乱形成的确切机制尚未阐明。
HMGB1最初作为一种在真核细胞核内参与维持核苷酸稳定和调控基因转录,与染色体紧密结合的非组蛋白而被人们所认识。在过去的十几年里,大量的研究证实,核内的HMGB1可由炎症细胞主动分泌和受损细胞被动释放两种方式分泌至细胞外。细胞外的HMGB1作为一种“免疫预警信号”通过激活各种免疫细胞,包括T淋巴细胞、调节性T细胞、树突状细胞、巨噬细胞和自然杀伤细胞等[8-9],从而参与机体免疫功能的调节。在严重烫伤延迟复苏大鼠模型中,血清中HMGB1大量产生的同时,观察到T淋巴细胞免疫功能明显受到抑制,其中包括了其增殖能力、IL-2和IL-2R表达下降以及初始T细胞功能性分化向Th2漂移。而且,HMGB1特异性拮抗剂——丙酮酸乙酯(EP)治疗后可以一定程度逆转烫伤大鼠T细胞免疫抑制现象,提示HMGB1可能参与了T淋巴细胞免疫功能的调节[10]。笔者既往研究证实,较大剂量HMGB1和延长刺激时间可直接导致T淋巴细胞增殖能力下降、IL-2分泌减少以及向Th2免疫反应分化[2]。本研究资料也证实小剂量(10 ng/mL)HMGB1能诱导CD4+T淋巴细胞分泌Th1型细胞因子增加,而100 ng/mL和1 000 ng/mL浓度的HMGB1刺激则导致CD4+T淋巴细胞功能性分化向Th2漂移,呈剂量依懒性;同样100 ng/mL HMGB1刺激24 h、48 h导致CD4+T淋巴细胞分泌Th2型细胞因子增加,呈时效关系。尽管如此,目前对于HMGB1对T淋巴细胞免疫功能调控作用的受体机制尚未见报道。
RAGE是晚期糖基化终产物(advanced glycation end products, AGEs)的一种特征性细胞表面受体, 为免疫球蛋白超家族成员,活化后可激活细胞内氧化应激,调节蛋白激酶和核因子的活性。目前已知,RAGE是一个具有多种配体的受体,包括AGEs、S100蛋白、淀粉样蛋白-β肽(Aβ)、磷脂酰丝氨酸和HMGB1等[11]。据报道,RAGE的配体影响DCs的分化,而DCs分泌的HMGB1对于初始T淋巴细胞的克隆增殖和功能性分化是需要的,提示HMGB1/RAGE细胞途径的激活,有助于获得性免疫反应的发生[12]。Moser等[13]发现RAGE存在于T淋巴细胞表面,包括静止期的CD4+ T细胞和CD8+ T细胞亚群,而且RAGE表达沉默的T细胞与野生型T细胞相比,其对于抗原诱导的T细胞增殖反应能力下降。因此笔者推测HMGB1可能通过RAGE受体途径调控CD4+ T细胞的功能性分化。本研究资料显示,HMGB1刺激下CD4+ T细胞RAGE蛋白和RAGE mRNA表达均显著上升,且采用RAGE中和抗体干预后能一定程度上逆转HMGB1介导的CD4+ T细胞向Th2分化。与本研究结果不同的是,Chen等[14]利用RAGE基因敲除小鼠发现,RAGE-/-小鼠T淋巴细胞较野生型小鼠对于抗CD3 mAb和抗CD28 mAb刺激分泌更多IL-10;而采用RAGE小分子阻断剂TTP488干预野生型小鼠T细胞发现其分泌IFN-γ减少;RT-PCR发现在Th1型细胞因子环境下,RAGE mRNA表达水平明显增加,提示RAGE活化有助于T细胞向Th1功能性分化。因此,本研究观察了该剂量的RAGE中和抗体对HMGB1介导RAGE表达变化的影响,发现RAGE中和抗体干预下,与对照组比较,HMGB1介导RAGE表达增加并未完全受到抑制,RAGE仍有部分活化。由此,笔者认为本实验中该剂量的HMGB1可能过度激活了RAGE受体,从而导致下游信号通路的过度活化,产生了CD4+ T细胞向Th2分化。这与笔者在既往研究证实100 ng/mL HMGB1刺激T淋巴细胞24 h导致细胞内信号蛋白丝裂原活化激酶(MAPK)过度活化,而利用特异性阻断剂适当降低其活化程度可一定程度减轻HMGB1介导的T淋巴细胞功能性分化向Th2漂移[2]相一致,但两者是否具有联系性仍有待于进一步研究。
核转录因子GATA3为Th2细胞分化特异性转录因子,其不仅能诱导初始T淋巴细胞向Th2功能性分化,还能对Th1细胞分化具有抑制作用[15]。研究证实,坏死细胞所释放的核酸、免疫复合物以及组织蛋白可明显诱导T淋巴细胞GATA3表达增加,进一步诱导T淋巴细胞向Th2分化[16]。因此,本实验利用RT-PCR检测了GATA3 mRNA表达,发现与对照组比较,HMGB1刺激能显著增强CD4+ T细胞GATA3 mRNA的表达,而RAGE中和抗体干预后能降低HMGB1介导的GATA3 mRNA的表达,进一步提示GATA3可能参与了HMGB1介导的CD4+ T细胞免疫功能障碍过程。
综上所述,本研究证实HMGB1介导T淋巴细胞向Th2功能性分化的免疫调控作用至少部分是通过过度活化RAGR/GATA3途径来实现的,在笔者既往研究基础上为HMGB1的免疫调节功能提供了一定理论基础。尽管如此,对于其中的详尽分子机制还有待于进一步研究;虽然RAGE是HMGB1第一个被识别的受体,但随着对HMGB1生物学功能的深入研究,发现HMGB1具有多种非特异性受体,如Toll样受体2(TLR2)和Toll样受体4(TLR4)等等,这些受体是否同样参与HMGB1对T细胞免疫功能调节过程目前仍然不清楚,有待以后的研究中逐步阐明。
| [1] | Daniels MJ, Brough D. Unconventional pathways of secretion contribute to inflammation[J]. Int J Mol Sci, 2017, 18(1). pii: E102. DOI: 10.3390/ijms18010102. |
| [2] | Lu ZQ, Tang LM, Zhao GJ, et al. Overactivation of mitogen-activated protein kinase and suppression of mitofusin-2 expression are two independent events in high mobility group box 1 protein-mediated T cell immune dysfunction[J]. J Interferon Cytokine Res, 2013, 33(9): 529-541. DOI:10.1089/jir.2012.0054 |
| [3] | Ding J, Cui X, Liu Q. Emerging role of HMGB1 in lung diseases: friend or foe[J]. J Cell Mol Med, 2017, 21(6): 1046-1057. DOI:10.1111/jcmm.13048 |
| [4] | 计小静, 郝济伟, 王丽雪, 等. Exendin-4调控烫伤小鼠T淋巴细胞免疫功能的交感神经机制[J]. 中华急诊医学杂志, 2017, 26(6): 644-649. DOI:10.3760/cma.j.issn.1671-0282.2017.06.009 |
| [5] | Zhao GJ, Yao YM, Lu ZQ, et al. Up-regulation of mitofusin-2 protects CD4+ T cells from HMGB1-mediated immune dysfunction partly through Ca(2+)-NFAT signaling pathway[J]. Cytokine, 2012, 59(1): 79-85. DOI:10.1016/j.cyto.2012.03.026 |
| [6] | 王永进, 何钢. 感染性休克液体复苏进展[J]. 中华急诊医学杂志, 2017, 26(1): 123-128. DOI:10.3760/cma.j.issn.1671-0282.2017.01.028 |
| [7] | 潘东峰, 李富荣, 梁诗颂, 等. 淋巴细胞亚群联合检测对脓毒症患者不良预后的评估价值[J]. 中华急诊医学杂志, 2015, 25(5): 524-529. DOI:10.3760/cma.j.issn.1671-0282.2015.05.018 |
| [8] | Huang LF, Yao YM, Sheng ZY. Novel insights for high mobility group box 1 protein-mediated cellular immune response in sepsis: Asystemic review[J]. World J Emerg Med, 2012, 3(3): 165-171. DOI:10.5847/wjem.j.1920–8642.2012.03.001 |
| [9] | Bertheloot D, Latz E. HMGB1, IL-1α, IL-33 and S100 proteins: dual-function alarmins[J]. Cell Mol Immunol, 2017, 14(1): 43-64. DOI:10.1038/cmi.2016.34 |
| [10] | Zhang LT, Yao YM, Dong YQ, et al. Relationship between high mobility group box-1 protein release and T cell suppression in rats after thermal injury[J]. Shock, 2008, 30(4): 449-455. DOI:10.1097/SHK.0b013e3181672495 |
| [11] | Xue J, Manigrasso M, Scalabrin M, et al. Change in the molecular dimension of a rage-ligand complex triggers rage signaling[J]. Structure, 2016, 24(9): 1509-1522. DOI:10.1016/j.str.2016.06.02.1 |
| [12] | Dumitriu IE, Baruah P, Valentinis B, et al. Release of high mobility group box 1 by dendritic cells controls T cell activation via the receptor foradvanced glycation end products[J]. J Immunol, 2005, 174(12): 7506-7515. DOI:10.4049/jimmunol.174.12.7506 |
| [13] | Moser B, Desai DD, Downie MP, et al. Receptor for advanced glycation end products expression on T cells contributes to antigen-specific cellular expansion in vivo[J]. J Immunol, 2007, 179(12): 8051-8058. DOI:10.4049/jimmunol.174.12.7506 |
| [14] | Chen Y, Akirav EM, Chen W, et al. RAGE ligation affects T cell activation and controls T cell differentiation[J]. J Immunol, 2008, 181(6): 4272-4278. DOI:10.1113/jphysiol.2009.169011 |
| [15] | 顾伟, 李春盛, 殷文明, 等. 转录因子GATA-3和T-bet的表达失衡在复苏后急性肺损伤中的作用[J]. 中华急诊医学杂志, 2014, 23(1): 8-14. DOI:10.3760/cma.j.issn.1671-0282.2017.01.028 |
| [16] | Imanishi T, Ishihara C, Badr Mel S, et al. Nucleic acid sensing by T cells initiates Th2 cell differentiation[J]. Nat Commun, 2014, 5: 3566. DOI:10.1038/ncomms4566 |
 2018, Vol. 27
2018, Vol. 27




