先天性成骨不全(osteogenesis imperfecta, OI)又称脆骨病或脆骨-蓝巩膜-耳聋综合征, 文献报道发病率为1/10 000~1/15 000[1]。其主要病理改变是多发性骨折, 疾病严重程度与OI分型有关, 致死性OI常在宫内或围产期死亡, 非致死性OI出生后反复骨折, 病程长, 无治愈方法, 故产前诊断后建议终止妊娠。超声是产前诊断OI的主要方法, 典型OI主要表现为长骨短小弯曲, 和(或)多发性骨折, 而在无长骨变短且长骨骨折弯曲不明显的病例, 即使有家族阳性史, 超声检查也很难确诊, 导致患儿出生、产时产后病死率升高。本文就不典型OI一例及相关文献复习报道如下。
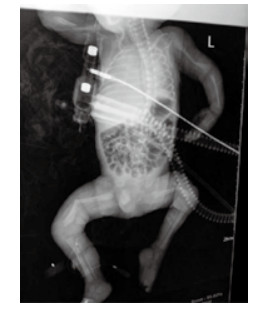
1 资料与方法孕妇20岁, 因“停经38周、阴道流液伴下腹坠胀1 h”于2015年9月10日23:45入住浙江大学明州医院产科。孕妇平素月经规律, 停经3个月在社区医院建卡定期产前检查, 停经17周产前筛查低风险, 停经20周自觉胎动无异常, 停经25周社区医院超声检查未见异常, 停经32周再次社区医院超声示胎儿臀先露, 羊水指数(AFI)22.5 cm, 余未见异常。既往体健, 无遗传病家族史, 孕期无病毒感染及放射线等不良接触史。入院查体:生命体征平稳, 发育正常, 营养可, 心肺听诊无异常; 腹膨隆, 宫高33 cm, 腹围99 cm, 胎位LSA, 胎心率140次/min, 先露臀、棘上3 cm, 宫口容1指, 羊水淡黄色。入院超声检查:宫内孕, 单活胎, 臀位, 双顶径9.3 cm, 股骨长7.4 cm, 头围33.4 cm, AFI 9.6 cm。因“臀先露”于9月11日02时09分剖宫产娩出一男活婴, 手术顺利, 重2 550 g, 身长50 cm, 面部外观未见异常, 四肢瘫软外翻、骨细小有骨擦感, 阴茎短小、睾丸未降, 1分钟Apgar评3分, 立即清理呼吸道、行气管插管气囊加压及呼吸机辅助呼吸等抢救, X线片示双侧股骨中下段明显成角, 左肱骨下段轻度成角, 右肱骨中下段不连续, 断端错位并轻度重叠移位(图 1)。新生儿抢救1 h后无效死亡。死亡原因:新生儿重度窒息, 新生儿骨软骨发育异常并多发性骨折, 死亡原因不明确申请尸检。
|
| 图 1 X线显示新生儿双侧股骨及左侧肱骨成交, 右侧肱骨骨折, 四肢骨及肋骨发育细小、骨密度减低 |
|
|
新生儿尸检报告:(1)成骨不全病(脆骨病); (2)双侧肱骨、双侧股骨病理性骨折; (3)双侧肘关节、腕关节、膝关节脱位, 桡、尺骨骨膜分离, 骨形态细小; (4)颅骨发育不全; (5)头皮帽状腱膜下出血; (6)心脏、大血管、双肺无畸形。
2 讨论成骨不全(OI)是一种少见的先天性骨骼发育障碍性疾病, 是一种以骨骼脆性增加及胶原蛋白代谢紊乱为特征的全身结缔组织疾病, 其病变不仅限于骨骼, 还常累及眼、耳、皮肤、牙齿等, 特点是多发性骨折、蓝巩膜、进行性耳聋、牙质改变、关节松弛和皮肤异常。此病有明显的遗传性和家族史, 以常染色体显性遗传为主, 部分病例为常染色体隐性遗传, 也有少数单发病例。
根据临床表现和遗传方式的不同, 目前已确定的OI亚型有11种。OI Ⅰ、ⅡA、Ⅲ-Ⅴ型遵循常染色体显性遗传方式, ⅡB、Ⅵ-Ⅺ均为常染色体隐性遗传。Ⅰ、ⅡA、Ⅲ-Ⅳ型OI患者有COL1A1基因(位于17q21.31-q22)或COL1A2基因(位于7q22.1)的常染色体显性突变, 其会影响Ⅰ型胶原中某一条α链的结构[2]。临床表现的严重程度取决于突变的影响, 如COL1A1或COL1A2基因突变导致正常胶原量减少则会引起Ⅰ型OI中的轻度表型, 而基因突变破坏正常Ⅰ型胶原三螺旋结构的形成时会出现ⅡA型OI中的致死性表型, 导致结构蛋白缺陷的其他COL1A1和COL1A2基因突变会造成中度OI(Ⅳ型)和重度但不致死的OI(Ⅲ型)[3-7]。位于11p15.5的干扰素诱导跨膜蛋白5(IFITM5)基因显性突变导致了Ⅴ型OI[8-9]。
常染色体隐性遗传OI与Ⅰ型胶原翻译后修饰或钙稳态相关。FK506结合蛋白10(FKBP10)基因(位于17q21)突变影响Ⅰ型前胶原的分泌, 导致Ⅵ型OI, 因病情严重和具有进展性而与Ⅲ型OI最为相似[10]; 软骨关联蛋白基因(CRTAP, 位于3p22)突变导致ⅡB型OI(围生期致死类型)和Ⅶ型OI(非致死性重度类型)[11-13]; 位于1q34的LEPRE1基因突变导致Ⅷ型OI[14]; 肽酰-脯氨酰异构酶B基因(PPIB, 位于15q21-q22)突变导致Ⅸ型OI[15]; 丝氨酸肽酶抑制因子H支成员1基因(SERPINH1, 位于11q13.5)突变导致Ⅹ型OI, 丝氨酸肽酶抑制因子F支成员1基因(SERPINF1, 位于17p13.3)突变导致Ⅺ型OI, Ⅹ-Ⅺ型OI均为重型/致死型的短肢OI[16-17]。除Ⅰ型OI为部分正常身高且临床表现为轻度外, 其余各型均有不同程度短肢畸形和临床中重度至致死型表现。
产前超声诊断是预防OI患儿出生的主要方法。典型的超声图像包括:颅骨变薄, 膜状颅骨, 当超声探头向颅骨施压时, 颅骨的压缩程度增加; 肢体短小并呈弓形弯曲, 可有多处骨折(自发骨折), 骨痂呈梭型膨大; 胸腔变形、狭小, 肋骨串珠状, 骨回声不均匀性减弱, 后方无声影; 晚孕常伴羊水增多。高分辨率超声检查可于孕14~16周筛查出Ⅱ型成骨不全, 孕18~20周筛查出部分Ⅲ型成骨不全。而在无长骨变短且长骨骨折弯曲不明显的病例, 超声检查很难确诊[18]。几项回顾性研究发现, 有经验的超声医生对致死性骨骼发育不良和所有骨骼发育不良的诊断准确度分别为81%~100%和31%~78%[19-20]。故对于晚孕合并羊水过多孕妇建议再次系统性超声评估胎儿结构包括骨骼系统, 无短长骨等异常患者特别注意超声探头对颅骨的压缩程度、胎儿胸廓发育及心胸比例, 有颅骨压缩程度增加和(或)胎儿心脏大小正常但心胸比例增大患儿要考虑成骨不全可能并采取进一步评估手段。产后发现新生儿窒息合并四肢瘫软外翻(关节脱臼)及骨发育细小者要考虑OI并进一步针对性检查评估并在抢救过程中注意避免患儿骨折加重以尽早明确诊断及处理。
X线检查在成骨不全诊断方面有重要价值, 表现为骨密度降低、骨皮质变薄、四肢短特别是下肢多发性骨折, 对超声或临床评估不排除OI患儿可行辅助性诊断; 对有OI患病或生育史者再次妊娠可通过培养绒毛成纤维细胞分析胶原合成对成骨不全进行产前诊断[21]。COL1A1和COL1A2基因突变检测是最直接证实该病分子基础的方法, 但仅适用于孕前已明确先证者具体突变类型的孕妇[22]。
对有新发的OI病儿生育史夫妻, 再次妊娠是否使用分子学诊断目前尚有争议, 因产前侵入性操作相关自然流产风险要高于胎儿患病风险, 且DNA分析耗时较长, 若结果为阴性或无法明确具体突变类型时, 都不能改变超声检查结果的临床意义。故妊娠中晚期系统超声检查评估仍然是主要的OI筛查诊断手段, 当超声及其他任何诊断性评估得出OI时, 可向胎儿父母提供预后方面的信息。
该病例产前检查一直在基层医院进行, 多次超声均无长骨短、弯曲、成角和骨折等异常, 孕晚期羊水增多但无进一步系统评估胎儿颅骨压缩程度及心胸比例, 剖宫产娩出后发现患儿身高四肢长度正常, 但四肢关节脱位且骨骼发育细小并有骨摩擦感, 1分钟Apgar评3分, 抢救过程中X线检查发现右肱骨骨折, 左肱骨及双侧股骨成角, 考虑到骨软骨发育不良疾病可能, 但持续抢救无效死亡, 尸检发现严重的颅骨发育不良、四肢病理性骨折并骨发育不良, 明确诊断OI, 但未行相关基因诊断。为产前漏诊的OI患者, 虽无短长骨, 但全身成骨不全严重, 初步考虑为重度或致死性OI, 具体分型不能确定。漏诊的原因首先考虑与“无短长骨”有关, 但基层医院综合诊治能力低也是重要因素。患儿父母表型正常, 故可能为COLlAl或COL1A2基因突变所致, 不能排除患儿父母为OI隐性基因携带者。OI患者的后代具有较高的OI发病风险, 但当先证者为散发病例时, 其父母再次生育患儿的风险较小。该患者再次妊娠咨询:散发OI, 发病率低, 且无基因诊断, 再次妊娠以全面系统的超声筛查为主, 必要时结合其他方法综合评估。
| [1] | Graul A. Filling the gaps: osleogenesis imperfecta[J]. Drug News Perspect, 2005, 18(6): 400-401. |
| [2] | Prockop DJ, Kivirikko KI. Heritable diseases of collagen[J]. N Engl J Med, 1984, 311(6): 376-386. DOI:10.1056/NEJM198408093110606 |
| [3] | Sillence DO, Senn A, Danks DM. Genetic heterogeneity in osteogenesis imperfecta[J]. J Med Genet, 1979, 16(2): 101-116. DOI:10.1136/jmg.16.2.101 |
| [4] | Cohn DH, Byers PH, Steinmann B, et al. Lethal osteogenesis imperfecta resulting from a single nucleotide change in one human pro alpha 1(I) collagen allele[J]. Proc Natl Acad Sci U S A, 1986, 83(16): 6045-6047. DOI:10.1073/pnas.83.16.6045 |
| [5] | Byers PH, Starman BJ, Cohn DH, et al. A novel mutation causes a perinatal lethal form of osteogenesis imperfecta. An insertion in one alpha 1(I) collagen allele (COL1A1)[J]. J Biol Chem, 1988, 263(14): 7855-7861. |
| [6] | Cohn DH, Apone S, Eyre DR, et al. Substitution of cysteine for glycine within the carboxyl-terminal telopeptide of the alpha 1 chain of type Ⅰ collagen produces mild osteogenesis imperfecta[J]. J Biol Chem, 1988, 263(29): 14605-14607. |
| [7] | Gajko-Galicka A. Mutations in type Ⅰ collagen genes resulting in osteogenesis imperfecta in humans[J]. Acta Biochim Pol, 2002, 49(2): 433-441. |
| [8] | Cho TJ, Lee KE, Lee SK, et al. A single recurrent mutation in the 5'-UTR of IFITM5 causes osteogenesis imperfecta type Ⅴ[J]. Am J Hum Genet, 2012, 91(2): 343. DOI:10.1016/j.ajhg.2012.06.005 |
| [9] | Semler O, Garbes L, Keupp K, et al. A mutation in the 5'-UTR of IFITM5 creates an in-frame start codon and causes autosomal-dominant osteogenesis imperfecta type Ⅴ with hyperplastic callus[J]. Am J Hum Genet, 2012, 91(2): 349-357. DOI:10.1016/j.ajhg.2012.06.011 |
| [10] | Alanay Y, Avaygan H, Camacho N, et al. Mutations in the gene encoding the RER protein FKBP65 cause autosomal-recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2010, 86(4): 551-559. DOI:10.1016/j.ajhg.2010.02.022 |
| [11] | Barnes AM, Chang W, Morello R, et al. Deficiency of cartilage-associated protein in recessive lethal osteogenesis imperfecta[J]. N Engl J Med, 2006, 355(26): 2757-2764. DOI:10.1056/NEJMoa063804 |
| [12] | Ward LM, Rauch F, Travers R, et al. Osteogenesis imperfecta type Ⅶ: an autosomal recessive form of brittle bone disease[J]. Bone, 2002, 31(1): 12-18. DOI:10.1016/S8756-3282(02)00790-1 |
| [13] | Labuda M, Morissette J, Ward LM, et al. Osteogenesis imperfecta type Ⅶ maps to the short arm of chromosome 3[J]. Bone, 2002, 31(1): 19-25. DOI:10.1016/S8756-3282(02)00808-6 |
| [14] | van Dijk FS, Nikkels PG, den Hollander NS, et al. Lethal/severe osteogenesis imperfecta in a large family: a novel homozygous LEPRE1 mutation and bone histological findings[J]. Pediatr Dev Pathol, 2011, 14(3): 228-234. DOI:10.2350/10-03-0806-CR.1 |
| [15] | Pyott SM, Schwarze U, Christiansen HE, et al. Mutations in PPIB (cyclophilin B) delay type Ⅰ procollagen chain association and result in perinatal lethal to moderate osteogenesis imperfecta phenotypes[J]. Hum Mol Genet, 2011, 20(8): 1595-1609. DOI:10.1093/hmg/ddr037 |
| [16] | Christiansen HE, Schwarze U, Pyott SM, et al. Homozygosity for a missense mutation in SERPINH1, which encodes the collagen chaperone protein HSP47, results in severe recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2010, 86(3): 389-398. DOI:10.1016/j.ajhg.2010.01.034 |
| [17] | Becker J, Semler O, Gilissen C, et al. Exome sequencing identifies truncating mutations in human SERPINF1 in autosomal-recessive osteogenesis imperfecta[J]. Am J Hum Genet, 2011, 88(3): 362-371. DOI:10.1016/j.ajhg.2011.01.015 |
| [18] | Bianchi DW, Crombleholme TM, D'Alton ME. Fetology: diagnosis and management of fetal patient[M]. New York: McGrawhill Medical Publishing Division, 2000: 657-759. |
| [19] | Krakow D, Alanay Y, Rimoin LP, et al. Evaluation of prenatal-onset osteochondrodysplasias by ultrasonography: a retrospective and prospective analysis[J]. Am J Med Genet A, 2008, 146A(15): 1917-1924. DOI:10.1002/ajmg.a.v146a:15 |
| [20] | Schramm T, Gloning KP, Minderer S, et al. Prenatal sonographic diagnosis of skeletal dysplasias[J]. Ultrasound Obstet Gynecol, 2009, 34(2): 160-170. DOI:10.1002/uog.6359 |
| [21] | Pepin M, Atkinson M, Starman BJ, et al. Strategies and outcomes of prenatal diagnosis for osteogenesis imperfecta: a review of biochemical and molecular studies completed in 129 pregnancies[J]. Prenat Diagn, 1997, 17(6): 559-570. DOI:10.1002/(ISSN)1097-0223 |
| [22] | Benušiene E, Kucinskas V. Strategy for prenatal diagnosis of osteogenesis imperfecta by linkage analysis to the type Ⅰ collagen loci COL1A1 and COL1A2[J]. Med Sci Monit, 2000, 6(2): 217-226. |
 2018, Vol. 27
2018, Vol. 27




