脓毒症指由感染引起的全身炎症反应综合征, 是严重创伤、感染、休克、大手术后常见的并发症, 进一步发展可导致脓毒性休克及多脏器功能衰竭。心肌损伤是脓毒症的常见并发症之一。尽管抗生素和重症监护技术的不断改进, 但在脓毒症患者中有近50%存在左室收缩/舒张功能异常, 尤其是严重脓毒症和脓毒症休克患者常合并心功能不全, 其病死率可达70%~90%, 这与心肌损伤密切相关[1-3]。因此, 早期及时逆转心肌损伤, 恢复心脏泵血功能, 对脓毒性休克患者的抢救成功至关重要。
乌司他丁(ulinastatin, UTI)是一种广谱的蛋白酶抑制剂, 通过对胰蛋白酶、纤溶酶、激肽释放酶等抑制作用, 达到稳定溶酶体膜, 抑制多种炎性介质释放, 从而减轻组织器官损害。近年来, 乌司他丁在脓毒症领域中广泛应用并取得了较好的效果, 但对脓毒症休克患者心肌损伤的保护作用报道较少, 而且脓毒症心肌细胞损伤的分子机制仍不清楚, 有研究表明, 抑制Caspase-3蛋白的激活在脓毒症中具有保护心肌功能, 对提高患者生存率具有重要意义[4-6]。本实验研究乌司他丁对脓毒症大鼠机体炎症因子的影响并探讨其对心肌细胞抗凋亡的作用机制。
1 材料与方法 1.1 实验动物及分组健康雄性SD大鼠30只, 体质量400~500 g, 由哈尔滨医科大学动物实验中心提供, 随机(随机数字法)分为3组:假手术组(Sham组, n=10); 脓毒症组(Sepsis组, n=10); 乌司他丁组(UTI组, n=10)。乌司他丁粉剂溶于盐水中, 按照20万U/kg术后6 h尾静脉缓慢注射, 12 h后重复注射[7]; Sham组与Sepsis组于上述时间点注射等量生理盐水。
1.2 脓毒症模型制备大鼠禁食12 h后采用1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉。在腹部正中切开长约1.0 cm切口, 打开腹腔, 分离盲肠, 用3-0丝线距离盲肠根部1/3处结扎, 随后用18号注射针于盲肠末端穿刺肠壁3处, 挤压盲肠使粪便流出, 将肠管回纳于腹腔, 逐层关闭腹腔[8], 皮下注射林格液50 mL/kg补充术中丢失液体, Sham组仅做开腹分离盲肠远端, 并不做结扎与穿孔。术后大鼠分笼饲养不限制饮食水。本实验动物处死方法符合哈尔滨医科大学动物伦理学标准。
1.3 主要试剂乌司他丁(天普生化医药有限公司, 广东, 中国); 大鼠血清肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素-6(interleukin 6, IL-6)和心肌肌钙蛋白I(cardiac troponin-I, cTnI)采用酶联免疫吸附试验(ELISA)试剂盒(R & B公司, 美国); Bax/Bcl-2(博士德生物工程有限公司, 武汉, 中国); Caspase-3抗体(Cell Signaling Technology, 美国), 原位缺口末端标记法(TUNEL)凋亡检测试剂盒(罗氏公司, 美国)。
1.4 血清中炎症因子测定建模后6、12、24、36 h大鼠尾静脉取血1 mL, 皮下补充生理盐水2 mL, 3 000 r/min离心20 min, 取上清液, 保存于-80 ℃冰箱备用。取出血清后4 ℃复融, 按照ELISA试剂盒说明书操作, 计算样品浓度。每组重复3次。
1.5 ELISA检测血清中cTnI水平标本留取方法同上, 在-80℃冰箱中保存, 取出后用ELISA试剂盒检测6、12、24、36 h血清cTnI水平, 按照说明操作。
1.6 心肌组织病理学分析建模成功36 h腹腔注射戊巴比妥麻醉后处死, 切取心室肌组织, 在4℃生理盐水中清洗后一部分保存于-80℃冰箱中, 另一部分于10%多聚甲醛中固定。经过逐级乙醇脱水, 二甲苯透明、侵蜡, 石蜡包埋, 超薄切片, 备用。将石蜡包埋的心肌组织切成3 μm薄片、脱蜡、水化、蒸馏水等冲洗, 经过苏木精-伊红染色后, 在显微镜下观察心肌组织形态学改变, 包括水肿、出血、炎性细胞浸润等情况。
1.7 免疫组化法检测Bax/Bcl-2蛋白表达切取包埋的石蜡组织, 采用SABC法进行免疫组化染色和DAB显色法, 分别以抗Bax (1:200)、抗Bcl-2 (1:200)抗体为一抗, 其他操作按照试剂盒说明进行。200倍显微镜下观察胞浆中出现黄色颗粒作为判定阳性染色的标准, 用PBS代替一抗作为阴性对照。
1.8 心肌凋亡细胞TUNEL法检测取石蜡包埋的心肌组织, 于心肌中部沿心脏轴线切取5张3 μm切片, TUNEL法进行细胞凋亡原位标记检测。经二甲苯脱蜡, 梯度酒精脱水, PBS冲洗, 每片加25 μL的TUNEL反应液于孵育盒中37℃、60 min。经PBS冲洗, 每片加25 μL碱性磷酸酶抗体, 于孵育盒中37℃、30 min, 再次PBS冲洗, 每片加1~2滴BCIP/NBT, 室温下孵育10~30 min, PBS冲洗。苏木精复染, 封片, 60℃烘干。光镜下观察, 正常心肌细胞核呈蓝色, 凋亡心肌细胞核呈棕褐色或黑色。于200倍镜下随机选取10个视野, 计数每个视野中凋亡细胞数和总细胞数, 计算凋亡指数。
1.9 Western blot法测定心肌组织Caspase-3蛋白表达取心肌组织用裂解液裂解, 提取心肌组织蛋白。应用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白质分离, 上样后在12%聚丙烯酰胺凝胶中进行电泳, 以电转膜方法将蛋白质转移至醋酸纤维素膜, 考马斯亮蓝染色, 洗脱, TBS缓冲液封闭过夜。加入山羊抗大鼠Caspase-3一抗(1:150)进行杂交, 再用辣根过氧化物酶标记的兔抗山羊IgG二抗(1:500, 购自美国Sigma公司)进行免疫反应, DAB显色。结果在图像分析系统(Scion Corporation)中进行分析。
1.10 统计学方法计量资料用均数±标准差(x±s)表示, 多样本之间均数的比较采用单因素方差分析(SNK-q), 所有数据均采用SPSS 19.0统计软件进行统计分析, 以P < 0.05为差异有统计学意义。
2 结果 2.1 三组大鼠血液中细胞炎症因子TNF-α、IL-6水平的比较Sepsis组6、12、24、36 h血清TNF-α、IL-6表达明显高于Sham组, 12 h处于炎症高反应期, 而UTI组TNF-α、IL-6表达虽然高于Sham组却明显低于Sepsis组, UTI组与Sepsis组各时间点组间比较, 差异有统计学意义(P < 0.05), 见表 1。
| 组别 | TNF-α | IL-6 | |||||||
| 术后6 h | 术后12 h | 术后24 h | 术后36 h | 术后6 h | 术后12 h | 术后24 h | 术后36 h | ||
| Sham组 | 18.36±2.12 | 19.22±2.16 | 18.54±2.64 | 18.34±2.14 | 22.26±3.36 | 23.24±3.24 | 22.68±3.16 | 23.28±3.24 | |
| Sepsis组 | 47.67±3.54a | 67.56±4.43a | 41.46±3.42a | 32.42±2.84a | 62.58±4.16a | 84.54±4.72a | 62.48±4.36a | 61.42±4.16a | |
| UTI组 | 32.42±3.38ab | 44.85±3.68ab | 26.65±3.24ab | 23.24±3.15ab | 47.45±4.13ab | 58.64±4.32ab | 38.38±3.27ab | 34.82±3.63ab | |
| 注:与Sham组比较, aP < 0.05;与Sepsis组比较, bP < 0.05 | |||||||||
Sepsis组血清cTnI值在建模后6 h开始升高, 在12 h达到高峰, 术后6、12、24、36 h内各时间点cTnI值均高于Sham组(P < 0.05); 而UTI组术后各时间点对应cTnI水平均低于Sepsis组, 差异有统计学意义(P < 0.05), 见表 2。
| 组别 | cTnI(ng/mL) | |||
| 6 h | 12 h | 24 h | 36 h | |
| Sham组 | 4.5±0.6 | 4.8±0.7 | 4.7±0.6 | 4.6±0.6 |
| Sepsis组 | 72.8±5.9a | 82.5±7.2a | 80.6±6.8a | 76.4±6.4a |
| UTI组 | 55.4±4.4ab | 59.2±4.5ab | 58.5±4.5ab | 52.4±4.3ab |
| 注:与Sham组比较, aP < 0.05;与Sepsis组比较, bP < 0.05 | ||||
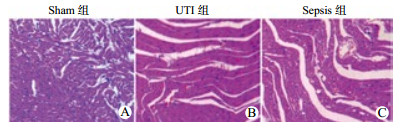
通过HE染色发现, Sepsis组可见灶性心肌纤维断裂、结构破坏、肌膜细胞增生且肌质溶解、细胞核部分消失、局部心肌坏死; 间质出现水肿及血管内淤血, 炎症细胞浸润; 心肌细胞可见嗜酸性变和空泡样变性。UTI组结构基本完整, 心肌纤维断裂减少, 血管充血, 渗出较轻, 心肌间质少量炎性细胞浸润, 病理损害较Sepsis组明显减轻, Sham组心肌结构大致正常(图 1)。
|
| A:心肌细胞及间质结构正常; B:心肌细胞排列紧密, 间质水肿; C:心肌间质水肿, 心肌细胞可见空泡变性, 嗜酸性坏死, 灶性心肌坏死, 间质血管淤血 图 1 建模后36 h大鼠心脏病理组织切片(HE×100) Figure 1 Pathological changes of myocardial tissue in rats 36 h after modeling (HE×100) |
|
|
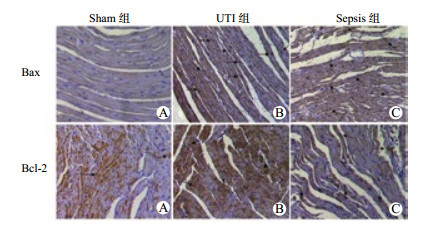
与Sham组比较, Sepsis组心肌有炎症细胞浸润, 细胞水肿及空泡形成, UTI组抑凋亡蛋白Bcl-2在Sham组和UTI组中的心肌细胞中均有阳性表达, 在Sepsis组相对减少。凋亡蛋白Bax表达在Sepsis组呈褐色(表达量越多, 颜色越深), 凋亡蛋白表达明显, 而UTI组Bax蛋白表达相对Sepsis组明显减少, 在Sham组蛋白表达不明显(图 2)。
|
| 图 2 建模后36 h免疫组化染色分析Bax/Bcl-2蛋白表达(×200) Figure 2 Expression levels of Bax/Bcl-2 protein in myocardial tissue in rats 36 h after modeling (×200) |
|
|
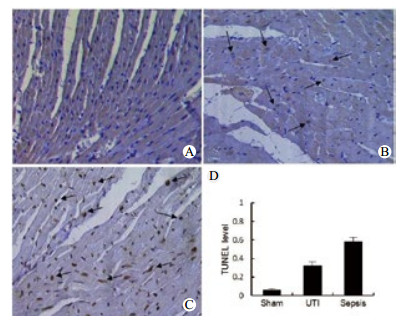
TUNEL检测心肌细胞凋亡, 正常细胞核呈淡蓝色, 形态较清晰、完整。凋亡阳性细胞核呈棕黄或棕褐色。在sham组心肌仅少数视野偶见个别凋亡细胞, 而在Sepsis组心肌细胞凋亡明显增加, UTI组较Sepsis组减少。通过凋亡指数计算, UTI组心肌细胞凋亡指数(32.2±4.8)%显著低于Sepsis组(58.4±5.6)%(P < 0.05), 见图 3。
|
| A: Sham组; B:UTI组; C:Sepsis组; D:各组心肌细胞凋亡指数 图 3 建模后36 h大鼠心肌细胞凋亡染色结果(×200) Figure 3 Comparison of apoptosis cell in rats 36 h after modeling (×200) |
|
|
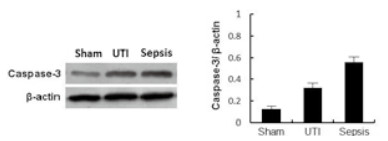
Western blot法分析心肌Caspase-3蛋白表达情况, 在Sham组Caspase-3蛋白(0.12±0.03)表达较低, 而UTI组中Caspase-3蛋白(0.32±0.05)表达却明显低于Sepsis组(0.55±0.05), UTI组与Sepsis组相比较, 差异有统计学意义(P < 0.05), 见图 4。
|
| Western blot法检测凋亡蛋白Caspase-3表达, UTI组与Sepsis组比较, P < 0.05 图 4 建模后36 h大鼠心肌组织中Caspase-3表达水平 Figure 4 Expression levels of Caspase-3 protein in myocardial tissue in rats 36 h after modeling |
|
|
脓毒症是指宿主对感染反应失控所引起危及生命的脏器功能障碍, 其病理生理过程复杂, 是危重症患者最常见的并发症之一。本研究中发现, 脓毒症早期大鼠机体细胞产生过量的炎症因子TNF-α、IL-6。TNF-α是机体炎症反应中的启动因子, 通过调节其他细胞炎症因子的产生与释放, 促使炎症信号进一步放大和加强, 产生级联放大效应。乌司他丁是一种具有广谱蛋白酶抑制作用的糖蛋白, 属于人体内源性抑炎物质。在脓毒症大鼠应用乌司他丁干预后, UTI组血清炎症因子TNF-α、IL-6较Sepsis组明显降低。同时在CLP术后6 h, 尽管Sepsis组与UTI组血清cTnI均开始升高, 术后12 h达到高峰, 但36 h内UTI组中cTnI明显低于Sepsis组, 说明乌司他丁抑制炎症因子释放同时间接降低心肌酶学指标[9]。在HE染色中发现UTI组炎症较Sepsis组明显减轻, 说明乌司他丁能够清除TNF-α、IL-6等炎症介质的过度释放, 稳定溶酶体膜, 抑制血小板聚集, 改善微循环及组织灌注, 发挥对心肌细胞的保护作用。
细胞凋亡已被证实在脓毒症疾病发生发展进程中起着重要作用。细胞凋亡与心肌损伤密切相关, 细胞凋亡的多少决定了心肌损害的程度[10]。目前研究认为, 内源性与外源性凋亡途径均参与脓毒症的发生发展过程中, 内源性途径主要依赖于促凋亡Bax和抗凋亡Bcl-2蛋白表达。在脓毒症疾病中, 通过Fas/Apo-l、TNF受体、转化生长因子受体启动凋亡信号[11-12], 最终使线粒体膜电位降低, 细胞色素C移至胞浆, 与凋亡蛋白水解酶活化因子结合后并与Caspase-9形成“凋亡小体”, 再激活下游Caspase-3等进入细胞核, 激活内源性核酸内切酶从而诱导细胞凋亡。本研究通过炎症因子检测发现, 心肌局部TNF-α浓度的降低可直接减轻心肌损伤, 在免疫组化检测中发现, 脓毒症大鼠心肌细胞水肿和空泡变性, 促凋亡蛋白Bax表达上调、抑凋亡蛋白Bcl-2表达下调, 提示大量心肌细胞凋亡, 而UTI组Bax蛋白表达较Sepsis组降低、Bcl-2蛋白表达增加, Bcl-2/Bax比值升高, 出现抑制细胞凋亡现象; 在TUNEL法检测中, UTI组大鼠心肌细胞凋亡相对Sepsis组显著减少(P < 0.05), 进一步证实乌司他丁能够保护心肌细胞具有抗凋亡作用[13]。
研究发现, TNF-α是导致脓毒症心肌损伤的始动因子, 同时也是凋亡的启动介质, 通过激活线粒体膜上Bax蛋白, 使细胞色素C得以穿过线粒体膜, 激活Caspase-9, 并进一步激活Caspase-3, 导致心肌细胞凋亡[14-17]。本研究结果表明, 在脓毒症早期乌司他丁抑制心肌细胞凋亡与下调Bax、Caspase-3和上调Bcl-2蛋白表达, 升高Bcl-2/Bax比值有关, 但对其他相关蛋白是否也有作用还需深入研究。脓毒症大鼠心肌损伤不仅是炎症激活免疫细胞所致, 细胞凋亡也参与其中[18-20]。乌司他丁抑制炎症因子释放, 又可间接通过减少心肌细胞凋亡而发挥心肌保护作用。
综上所述, 本研究通过检测炎症因子、组织病理学分析及凋亡相关蛋白测定说明大剂量乌司他丁能够减轻心肌损伤, 其机制可能与减轻心肌局部炎症和抑制Caspase-3信号通路的细胞凋亡有关。
| [1] | Li X, Li Y, Shan L, et al. Over-expression of calpastatin inhibits calpain activation and attenuates myocardial dysfunction during endotoxaemia[J]. Cardiovasc Res, 2009, 83(1): 72-79. DOI:10.1093/cvr/cvp100 |
| [2] | Lancel S, Joulin O, Favory R, et al. Ventricular myocyte caspases are directly responsible for endotoxin-induced cardiac dysfunction[J]. Circulation, 2005, 111(20): 2596-2604. DOI:10.1161/CIRCULATIONAHA.104.490979 |
| [3] | Vieillard Baron A, Caille V, Charron C, et al. Actual incidence of global left ventricular hypokinesia in adult septic shock[J]. Crit Care Med, 2008, 36(6): 1701-1706. DOI:10.1097/CCM.0b013e318174db05 |
| [4] | Court O, Kumar A, Parrillo JE, et al. Clinical review: myocardial depression in sepsis and septic shock[J]. Crit Care, 2002, 6(6): 500-508. DOI:10.1186/cc1822 |
| [5] | Carlson DL, Willis MS, White DJ, et al. Tumor necrosis factor-alpha-induced caspase activation mediates endotoxin-related cardiac dysfunction[J]. Crit Care Med, 2005, 33(5): 1021-1028. DOI:10.1097/01.CCM.0000163398.79679.66 |
| [6] | Larche J, Lancel S, Hassoun SM, et al. Inhibition of mitochondrial permeability transition prevents sepsis-induced myocardial dysfunction and mortality[J]. J Am Coll Cardiol, 2006, 48(2): 377-385. DOI:10.1016/j.jacc.2006.02.069 |
| [7] | 夏文芳, 苏镔, 邹捍东, 等. 抑制多药耐药相关蛋白4对脓毒症大鼠肺血管内皮屏障功能的保护作用[J]. 中华急诊医学杂志, 2015, 24(8): 830-833. |
| [8] | 林建东, 肖雄箭, 廖秀玉, 等. 乌司他丁对大鼠脓毒症急性肺损伤外周血淋巴细胞凋亡率及TNF-α、IL-6水平的影响[J]. 中华急诊医学杂志, 2008, 17(3): 252-255. DOI:10.3760/j.issn.1671-0282.2008.03.007 |
| [9] | 秦延军, 张新亮, 于悦卿, 等. 促红细胞生成素对脓毒症大鼠心肌损伤的保护作用[J]. 中华急诊医学杂志, 2014, 23(2): 151-156. |
| [10] | Lindsten T, Ross A J, King A, et al. The combined functions of proapoptotic Bcl-2 family members Bax are essential for normal development of multiple tissues[J]. Mol Cell, 2006, 6(6): 1389-1392. |
| [11] | Tirosh O, Aronis A, Melendez JA. Mitochondrial state 3 to 4 respiration trastition during Fas-mediated apoptosis controls celluar redox balance and rate of cell death[J]. Biochem Pharmacol, 2003, 66(8): 1331-1334. DOI:10.1016/S0006-2952(03)00481-7 |
| [12] | Garcia-Ruiz C, Colell A, Mari M, et al. Defective TNF-alpha-mediated hepatocellular apoptosis and liver damage in acidic aphingomyelinase knockout mice[J]. J Clin Invest, 2003, 111(2): 197-208. DOI:10.1172/JCI16010 |
| [13] | 史婷婷, 白建平, 梁月琴, 等. 芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白Bcl-2、Bax、Caspase-3表达的影响[J]. 中国药理学通报, 2011, 27(5): 666-671. DOI:10.3969/j.issn.1001-1978.2011.05.017 |
| [14] | Yao X, Carlson D, Sun Y, et al. Mitochondrial ROS induces cardiac inflammation via a pathway through mtDNA damage in a pneumonia-related sepsis model[J]. PLoS One, 2015, 10(10): 1-28. DOI:10.1371/journal.pone.0139416 |
| [15] | 梁艳冰, 唐皓, 翟诚顺, 等. 脓毒症大鼠心肌细胞凋亡与p53和Bcl-2基因表达的关系[J]. 中华急诊医学杂志, 2008, 17(2): 128-131. DOI:10.3760/j.issn.1671-0282.2008.02.004 |
| [16] | Zang Q, Maass DL, Tsai SJ, et al. Cardiac mitochondrial damage and inflammation responses in sepsis[J]. Surg infect, 2007, 8(1): 41-45. DOI:10.1089/sur.2006.033 |
| [17] | Pantano C, Shrivastava P, MeElhinney B, et al. Hydrogen Peroxide signaling Through tumor necrosis factor receptor leads to selective activation of c-Jun N-terminal kinase[J]. J Biol Chem, 2003, 278(45): 44091-44096. DOI:10.1074/jbc.M308487200 |
| [18] | Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction[J]. Crit Care Med, 2007, 35(6): 1599-1608. DOI:10.1097/01.CCM.0000266683.64081.02 |
| [19] | Zanotti S, Kamar A. Cytokine modulation in sepsis and septic shock[J]. Expert Opin Investig Drugs, 2002, 11(8): 1061-1075. DOI:10.1517/13543784.11.8.1061 |
| [20] | 李莉, 严静, 陈昌勤, 等. 线粒体损伤在脓毒症大鼠心肌细胞凋亡中的作用[J]. 中华急诊医学杂志, 2012, 21(11): 1221-1225. DOI:10.3760/cma.j.issn.1671-0282.2012.11.009 |
 2018, Vol. 27
2018, Vol. 27




