心脏骤停(cardiac arrest, CA)是临床最严重的急危重症,由于血压瞬间降低使大脑、心脏等重要脏器灌注不足,可致意识瞬间丧失,而及时有效的心肺复苏(cardiopulmonary resuscitation, CPR)是提高CA患者存活率的保障[1]。多巴胺是临床上常用的血管活性药物,具有升高血压、改善心脑等重要脏器血供的作用。多巴胺具有明显的剂量依赖性,小剂量多巴胺[2~5 μg/(kg·min)]以激动外周多巴胺受体和β受体为主,前一作用使肾脏、肠系膜、冠脉动脉和脑血管扩张,后一作用对心脏有轻至中等程度的正性肌力作用;中等剂量多巴胺[5~10 μg/(kg·min)]明显激动β1受体而兴奋心脏,加强心肌收缩力,同时也兴奋α受体,使外周血管轻度收缩;大剂量多巴胺[> 10 μg/(kg·min)]主要激动α受体,也兴奋β受体,发挥收缩血管效应和正性肌力作用[2]。早期研究证实多巴胺用于CPR不仅可以提高心电活动恢复率,同时可提高自主循环恢复(ROSC)率[3-4],可改善ROSC后全身及大脑血供,对早期脑复苏有益[5]。然而关于多巴胺的剂量对于CPR早期血流动力学及脑氧饱和度的影响缺少相关研究。本实验对CPR早期家兔利用不同剂量的多巴胺进行升压治疗,观察不同剂量多巴胺对CPR早期兔血流动力学变化的作用及脑氧代谢的影响,以期对临床CPR时多巴胺剂量的选择提供参考。
1 材料与方法主要仪器及试剂:PiCCO监测仪组件(PiCCO2 PC8500,德国PULSION公司);脑氧监护仪组件(EGOS-600A,苏州爱琴生物医疗电子有限公司);除颤仪(TEC-5602,日本光电工业株式会社);电刺激仪(上海变压器厂);心电监护仪(PVM-2701,上海光电医用电子仪器有限公司);呼吸机(ResMed Ellsee 260,瑞思迈医疗器械有限公司);双腔静脉导管(CV-402-10 4F,威海急危重症医疗制品有限公司);动脉导管(PVPK2013L07-A 3F,迈柯唯(上海)医疗设备有限公司);小儿气管插管(3.5 #,河南驼人医疗器械集团有限公司);小儿喉镜(TD-C-IV,浙江优异医疗器械有限公司);微量输液泵(Space注射泵,贝朗医疗(上海)国际贸易有限公司);肝素钠盐水(2 500 U肝素钠注射液加入500 mL生理盐水);20 %乌拉坦溶液(江都市新华化工有限公司)。
1.1 动物分组及给药60只健康成年雄性家兔,体质量为3.0~3.5 kg,由河南省实验动物中心提供[许可证号:SYXK(豫)2016-0002],本实验经郑州大学动物实验伦理委员会批准;实验开始前根据多巴胺的不同剂量将家兔按随机数字法分为4组:对照组(control group, CG;n=15);低剂量组(low dose group, LG;n=15):15 μg/(kg·min);中等剂量组(moderate dose group, MG;n=15):30 μg/(kg·min);大剂量组(high dose group, HG;n=15):60 μg/(kg·min)。分别建立CA模型并进行CPR直到每组ROSC家兔达到10只。
1.2 动物模型制备及实验流程健康成年雄性家兔,术前12 h禁食不禁水,经耳缘静脉注射20%乌拉坦溶液5 mL/kg诱导麻醉[6],留置静脉留置针用于补液,以家兔对疼痛刺激无反应、角膜反射消失且生命体征平稳为麻醉成功标志。连接心电监护仪;小儿喉镜明示下气管插管进行有创通气;无菌操作下分离右侧颈外静脉及股动脉,分别置入双腔静脉导管及动脉导管接PiCCO监测系统;放置脑氧监测仪探头;将两支针灸针分别置于兔皮下沿心脏长轴方向,连接电刺激仪,给予30 V 50 Hz交流电持续刺激5 s,如未出现室颤,则待心电监护恢复正常波形时,给予重复刺激,直至心电监护仪显示室颤波形,室颤3 min后给予胸外心脏按压(频率为150~200次/min,深度为胸廓前后径的1/3),同时给予呼吸机辅助呼吸(儿童容控模式;PEEP:0 cmH2O(1 cmH2O=0.098 kPa);潮气量:10 mL/kg;呼吸频率:40次/min;吸氧体积分数为100 %);如心电波形未复律则每间隔2 min推肾上腺素0.02 mg/kg[7-8]。根据分组自心脏按压开始时给予不同剂量的多巴胺持续泵入,胸外按压2 min后,如心电监护提示室颤波形则给予非同步双向波10 J进行电除颤1次,之后继续给予胸外心脏按压。ROSC指标:恢复室上性心律,并可触及股动脉搏动,平均动脉压≥60 mmHg并且维持10 min以上[9]。如经复苏15 min后未能恢复自主循环则视为复苏失败。
1.3 观察指标及方法PiCCO记录CA模型制备前、ROSC后即刻、15、30、60、120 min的血流动力学指标,即平均动脉压(MAP)、心率(HR)、心输出量(CO)、外周血管阻力指数(SVRI)。脑氧监测仪监测相应时间点的脑局部组织血氧饱和度(TOI)。并记录各组ROSC时间、复苏成功率及2 h存活率。观察终点仍存活的家兔以静脉注射10 %氯化钾的方法处死。然后小心取出家兔大脑置于配置好的甲醛溶液中固定,送至郑州大学第一附属医院病理科切片染色。
1.4 统计学方法采用SPSS 21.0统计软件进行分析,计量资料以均值±标准差(x±s)表示,各时间点组间比较采用重复测量的方差分析,多组定量资料的比较依据是否符合正态性检验采用单因素方差分析或Kruskal-Wallis H秩和检验,两两比较采用LSD-t检验;多组二分类资料采用χ2检验或Fisher确切概率法检验;利用GraphPad Prism5统计软件进行生存分析,各组生存曲线差异的比较采用Log-rank检验;应用ImageJ软件对病理图片中细胞进行计数;以P < 0.05为差异有统计学意义。
2 结果 2.1 复苏前的生理学及复苏数据各组家兔身长、体质量、ROSC率之间的差异均无统计学意义(均P > 0.05)。与CG和LG相比,MG的ROSC时间更低(277±15 vs. 190±12,P < 0.01;252±16 vs. 190±12, P=0.016),而120 min生存率更高(20% vs. 90%, χ2=9.899, P=0.005; 30% vs. 90%, χ2= 7.5, P=0.02),差异均有统计学意义;MG的ROSC时间(s)高于HG(190±12 vs. 143±11 P=0.149),同时120 min生存率高于HG(χ2=1.25 P=0.582),差异均无统计学意义(表 1)。
| 组别 | 身长 (cm) |
体质量 (kg) |
ROSC时间 (s) |
ROSC率 | 120 min生存率 |
| CG | 55.1±0.9 | 3.2±0.03 | 277±15 | 10/15 | 2/10 |
| LG | 56.0±0.7 | 3.3±0.04 | 252±16 | 10/14 | 3/10 |
| MG | 54.2±0.8 | 3.2±0.04 | 190±12ab | 10/11 | 9/10b |
| HG | 53.9±0.7 | 3.3±0.05 | 143±11ab | 10/12 | 7/10a |
| 注:与CG比较,aP < 0.05;与LG比较,bP < 0.05;与HG比较,cP < 0.05;CG为对照组;LG为低剂量组;MG为中剂量组;HG为高剂量组 | |||||
MG在ROSC即刻、15、30、60、120 min时CO均高于其余各组(均P < 0.05),差异有统计学意义;MG、HG在ROSC 15、30、60、120 min MAP均明显高于CG、LG(均P < 0.05),差异有统计学意义;MG在ROSC后各时间点HR明显高于CG、LG,差异有统计学意义(均P < 0.05);HG的SVRI在ROSC后各时间点均明显大于同时刻其余各组(均P < 0.05),差异有统计学意义;ROSC后各组TOI值均升高,在ROSC 15 min、30 min时MG的TOI值明显大于同时刻其余各组(均P < 0.05),差异有统计学意义(表 2)。
| 组别 | 时点 | CO (L/min) | MAP (mmHg) | HR (次/min) | SVRI | TOI (%) |
| CG | 基值 | 3.7±0.1 | 96.0±2.4 | 218±5 | 1 214±14 | 62.7±0.8 |
| 即刻 | 2.9±0.1 | 70.0±1.6 | 176±5 | 1 254±21 | 52.5±0.4 | |
| ROSC 15 min | 3.0±0.1 | 74.0±1.5 | 183±7 | 1 281±18 | 53.5±0.7 | |
| ROSC 30 min | 3.0±0.1 | 75.0±2.6 | 190±9 | 1 308±21 | 52.4±1.0 | |
| ROSC 60 min | 3.0±0.1 | 77.0±2.7 | 199±11 | 1 249±18 | 59.0±0.8 | |
| ROSC 120 min | 3.1±0.1 | 78.0±1.3 | 192±8 | 1 267±24 | 59.1±0.7 | |
| LG | 基值 | 3.9±0.1 | 96.0±2.4 | 219±5 | 1 194±11 | 62.2±0.8 |
| 即刻 | 2.8±0.1 | 70.0±1.9 | 172±4 | 1 286±14 | 52.7±0.5 | |
| ROSC 15 min | 3.0±0.1 | 70.0±0.8a | 192±9 | 1 244±23 | 53.9±0.7 | |
| ROSC 30 min | 3.1±0.1 | 69.0±1.8 | 188±10 | 1 256±16 | 54.4±1.2 | |
| ROSC 60 min | 3.0±0.1 | 75.0±2.1 | 192±9 | 1 264±19 | 58.2±1.4 | |
| ROSC 120 min | 3.1±0.2 | 74.0±1.7 | 199±7 | 1 279±20 | 57.6±1.3 | |
| MG | 基值 | 3.7±0.1 | 99.0±2.8 | 228±5 | 1 210±15 | 63.2±0.9 |
| 即刻 | 3.6±0.1abc | 70.0±1.5 | 226±7abc | 1 249±16c | 52.5±0.5 | |
| ROSC 15 min | 3.5±0.2abc | 85.0±1.0ab | 218±6ab | 1 251±16c | 58.9±1.1abc | |
| ROSC 30 min | 3.6±0.1abc | 88.0±3.0ab | 227±9abc | 1 231±22ac | 59.1±0.7abc | |
| ROSC 60 min | 3.6±0.1abc | 93.0±2.0ab | 221±8ab | 1 215±19c | 58.9±1.1 | |
| ROSC 120 min | 3.7±0.1abc | 91.0±1.9ab | 223±7ab | 1 291±20c | 59.2±0.7 | |
| HG | 基值 | 3.8±0.1 | 99.0±2.0 | 227±5 | 1 200±12 | 61.6±0.6 |
| 即刻 | 2.9±0.1 | 72.0±1.6 | 207±5ab | 3 299±22ab | 52.6±0.4 | |
| ROSC 15 min | 2.9±0.1 | 81.0±0.8ab | 209±10a | 3 258±28ab | 53.8±0.7 | |
| ROSC 30 min | 2.9±0.2 | 88.0±3.1ab | 200±6 | 3 005±20ab | 53.3±0.9 | |
| ROSC 60 min | 2.9±0.3 | 88.0±1.7ab | 202±11 | 2 950±22ab | 56.8±1.2 | |
| ROSC 120 min | 2.9±0.4 | 89.0±2.0ab | 208±11 | 2 866±17ab | 56.8±0.7 | |
| 注:与CG比较,aP < 0.05;与LG比较,bP < 0.05;与HG比较,cP < 0.05;CG,对照组;LG,低剂量组;MG,中剂量组;HG,高剂量组;CO,心输出量;MAP,平均动脉压;HR,心率;SVRI,血管外阻力指数;TOI,局部组织氧饱和度 | ||||||
MG和HG的中位生存时间均大于CG和LG(MG vs. CG χ2=11.62. P=0.001;MG vs. LG χ2=8.521, P=0.004;HG vs. CG χ2=8.010, P=0.005;HG vs. LG χ2=5.137, P=0.023)(均P < 0.05),生存曲线差异有统计学意义,MG和HG的生存率大于CG和LG的家兔。MG和HG家兔生存曲线比较(χ2=1.385, P=0.239),生存率差异无统计学意义(图 1)。
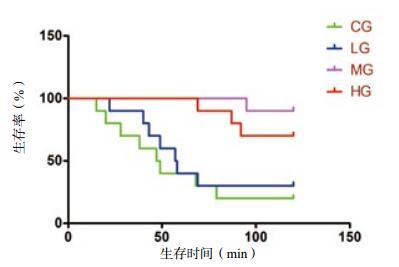
|
| 图 1 四组家兔的生存率比较(log-rank法检验) Figure 1 Survival analysis of rabbits in four groups(log-rank test) |
|
|
各组脑组织细胞均显示不同程度的水肿,胞核固缩,细胞坏死(图 2),其中平均每高倍镜视野下可见坏死细胞数为(CG: 41.2±1.5;LG:41.0±2.0;MG:28.4±1.0;HG:39.6±1.9),MG坏死细胞数显著低于其余各组(均P < 0.01),差异有统计学意义。
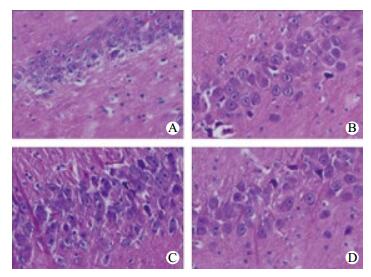
|
| A: CG组; B: LG组; C: MG组; D: HG组 图 2 四组家兔大脑海马区组织HE染色(HE×400) Figure 2 HE staining of rabbit brain hippocampus tissue in four groups(HE×400) |
|
|
尽管CA后CPR技术在不断进步[10],患者仍有较高的病死率,仅有不到20%的CPR患者可以存活到出院,而且出院后患者的短期病死率也居高不下[11-13]。肾上腺素作为CPR时的一线药物,是公认有效且应用最广泛的、提高现场复苏成功率的药物,但近年来其作为一线复苏药物的局限性已经被多次报道[14-15]。临床上,低血压尤其是长时间CA及ROSC后的低血压,常提示血流动力学不稳定及较差的心脏泵血功能,引起组织发生缺氧和代谢障碍,导致患者最终不能存活[16]。此时,血管活性药物的应用常常能起到重要的作用。
多巴胺具有剂量依赖性,不同剂量的多巴胺用于CPR时可能对血流动力学及脑氧代谢产生不同的作用。目前国内外还缺乏此方面的动物实验研究。人与动物对同一药物的耐受性相差很大。一般情况下,动物的耐受性比人大,也就是单位体质量动物的用药量比人要大。本实验对多巴胺剂量的选择参考药理学实验方法将人与兔进行等效剂量换算[17]。正常情况下大脑阻力血管具有自动调整作用,使一定范围内的血压变化并不改变大脑的灌注量[18],有的学者在研究CA复苏后患者脑血流量自动调节功能时发现,在CA复苏后的急性期,大脑的自动调节功能受损或缺失[19],有观点认为此时大脑的灌注主要取决于脑灌注压(cerebral perfusion pressure, CPP)的大小,CPP等于MAP与颅内压之差,而在CA早期颅内压升高并不明显,因此认为提高MAP可增加CPP,从而改善脑氧饱和度。而在另一个关于不同血管活性药物应用对于脑氧饱和度影响的临床研究中提示尽管苯肾上腺素可维持比多巴胺相对较高的MAP,然而其脑氧饱和度却较前降低[20],另外几项研究也得到了相似的结果[21-23]。以上结果出现的主要机制在于相关血管活性药物刺激分布于心血管系统的α受体,引起血管收缩,从而使SVRI升高,由于心脏的舒张功能受损相对较轻,而收缩功能显著下降,从而引起短暂的充血性心力衰竭,导致CO及脑血流量下降,使大脑不能得到充足的氧供,以至于脑氧饱和度较前下降[24]。以上研究表明MAP增加并不是确保脑氧饱和度的先决条件,应增加CO以维持脑氧饱和度在最佳范围。本研究结果表明MG与HG均可维持MAP在较高的水平,提高心脑重要器官的灌注,缩短ROSC时间,有助于自主循环的恢复。而HG主要作用于α肾上腺素受体,收缩外周阻力血管从而使MAP维持在较高的水平,在CPR早期可增加脑灌注,但同时升高的SVRI也增加了心脏的后负荷,使CO减少。相比较其余各组,MG可同时维持较高的CO及MAP,具有更高的120 min生存率。提示在经过室颤后应用中等剂量的多巴胺可能更有助于早期脑功能的恢复。
成功的CPR不仅要实现ROSC,更重要的是维持重要脏器的氧供。CA期间持续的大脑缺血缺氧,以及随后的CPR再灌注造成的中枢神经系统损伤是CA患者最主要的死亡原因[25]。对于CPR时脑氧饱和度的精确测量可为大脑对CPR的反应提供重要信息。而近红外光谱技术可利用氧合血红蛋白及还原血红蛋白对于红外光吸收所表现出光谱的差异来测得局部脑氧饱和度,具有便携无创的特点,成为CA这种危急情况下监测脑氧饱和度变化可能的选择[26]。研究表明近红外光谱技术可通过监测脑氧饱和度的变化来指导复苏[27],并可能成为预测ROSC的一种较好的方法[25]。另有研究表明标准CPR期间大脑局部血氧饱和度并无明显改善,而在ROSC后大脑局部血氧饱和度则升高较快[28]。本实验观察到ROSC后各组TOI值均升高,在ROSC 15 min、30 min时MG的TOI值明显较其余各组高,考虑与MG较高的CO及MAP增加了脑组织灌注相关,提示中等剂量多巴胺可能更有助于兔ROSC早期脑功能恢复。
本研究中,各组ROSC 120 min时存活家兔的脑组织标本经HE染色提示各组脑组织细胞均显示不同程度的水肿,胞核固缩,细胞坏死,而中MG较其余各组细胞水肿程度轻及坏死数量少,提示MG更有助于脑细胞损伤的恢复。
本研究的局限之处在于,由于种属差异,本实验结论仅适用于家兔室颤模型,而其他动物模型复苏所需最佳剂量有待后续实验研究;本实验可为临床CPR时中等剂量多巴胺的应用提供参考,而确定不同因素所致的CA所需多巴胺的最佳剂量仍需大量的基础及临床研究。
综上所述,中等剂量的多巴胺持续应用于家兔早期CPR,可维持较高的MAP和CO,增加脑组织灌注,减轻CA家兔ROSC早期脑细胞损伤。
| [1] | Graham R, McCoy MA, Schultz AM. Strategies to improve cardiac arrest survival: a time to act[M]. Washington, DC: The National Academies Press, 2015. |
| [2] | Part 7.4: Monitoring and medications[J]. Circulation, 2005, 112(24): 78-83.DOI:10.1161/circulationaha.105.166559. |
| [3] | 黄顺忠, 刘忠仁, 何兰燕. 多巴胺和肾上腺素合用在心脏停搏复苏中的作用[J]. 右江医学, 2004, 32(5): 412-413. DOI:10.3969/j.issn.1003-1383.2004.05.005 |
| [4] | 王建忠, 孔铭颢, 许永富. 多巴胺和肾上腺素合用在心脏复苏中的应用价值评述[J]. 中国医药导刊, 2016, 18(5): 508-509. |
| [5] | Liu Z, Wu J, Wu C, et al. The impact of dopamine on hemodynamics, oxygen metabolism, and cerebral resuscitation after restoration of spontaneous circulation in pigs[J]. J Emerg Med, 2011, 40(3): 348-354. DOI:10.1016/j.jemermed.2009.08.049 |
| [6] | 周昆, 屈彩芹. 动物实验常用麻醉剂的比较与选择[J]. 实验动物科学, 2008, 25(2): 41-43. DOI:10.3969/j.issn.1006-6179.2008.02.013 |
| [7] | 胡春林, 魏红艳, 廖晓星, 等. 兔室颤心搏骤停模型的建立[J]. 中华急诊医学杂志, 2009, 18(9): 943-947. DOI:10.3760/cma.j.issn.1671-0282.2009.09.011 |
| [8] | 曹雯, 李培杰, 张立平, 等. 亚低温疗法对复苏后家兔心肌的保护作用[J]. 中华急诊医学杂志, 2012, 21(6): 622-625. DOI:10.3760/cma.j.issn.1671-0282.2012.06.015 |
| [9] | 肖盐, 林兆奋, 管军. 颈部快速诱导脑部低温对CPR兔的脑保护作用[J]. 中国急救医学, 2015, 35(4): 361-366. DOI:10.3969/j.issn.1002-1949.2015.04.018 |
| [10] | Link MS, Berkow LC, Kudenchuk PJ, et al. Part 7: adult advanced cardiovascular life support: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2015, 132(18): 444-464. DOI:10.1161/CIR.0000000000000261 |
| [11] | Bloom HL, Shukrullah I, Cuellar JR, et al. Long-term survival after successful inhospital cardiac arrest resuscitation[J]. Am Heart J, 2007, 153(5): 831-836. DOI:10.1016/j.ahj.2007.02.011 |
| [12] | Peberdy MA, Kaye W, Ornato JP, et al. Cardiopulmonary resuscitation of adults in the hospital: a report of 14720 cardiac arrests from the National Registry of Cardiopulmonary Resuscitation[J]. Resuscitation, 2003, 58(3): 297-308. DOI:10.1016/S0300-9572(03)00215-6 |
| [13] | Jiang L, Zhang JS. Mechanical cardiopulmonary resuscitation for patients with cardiac arrest[J]. World J Emerg Med, 2011, 2(3): 165-168. DOI:10.5847/wjem.j.1920-8642.2011.03.001 |
| [14] | Nolan JP, Soar J, Wenzel V, et al. Cardiopulmonary resuscitation and management of cardiac arrest[J]. Nat Rev Cardiol, 2012, 9(9): 499-511. DOI:10.1038/nrcardio.2012.78 |
| [15] | Charalampopoulos AF, Nikolaou NI. Emerging pharmaceutical therapies in cardiopulmonary resuscitation and post-resuscitation syndrome[J]. Resuscitation, 2011, 82(4): 371-377. DOI:10.1016/j.resuscitation.2010.12.017 |
| [16] | 晏平, 陈寿权, 李章平, 等. 心肺复苏中心脏保护药物的研究进展[J]. 中华急诊医学杂志, 2008, 17(1): 105-107. DOI:10.3760/j.issn.1671-0282.2008.01.031 |
| [17] | 黄继汉, 黄晓晖, 陈志扬. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| [18] | Panerai RB. Cerebral autoregulation: from models to clinical applications[J]. Cardiovascular Eng, 2008, 8(1): 42-59. DOI:10.1007/s10558-007-9044-6 |
| [19] | Sundgreen C, Larsen FS, Herzog TM, et al. Autoregulation of cerebral blood flow in patients resuscitated from cardiac arrest[J]. Stroke, 2001, 32(1): 128-132. DOI:10.1161/01.STR.32.1.128 |
| [20] | Choi JW, Joo Ahn H, Yang M, et al. Comparison Between Phenylephrine and Dopamine in Maintaining Cerebral Oxygen Saturation in Thoracic Surgery: A Randomized Controlled Trial[J]. Medicine, 2015, 94(49): e2212. DOI:10.1097/MD.0000000000002212 |
| [21] | Nissen P, Brassard P, Jørgensen TB, et al. Phenylephrine but not ephedrine reduces frontal lobe oxygenation following anesthesia-induced hypotension[J]. Neurocrit Care, 2010, 12(1): 17-23. DOI:10.1007/s12028-009-9313-x |
| [22] | Meng L, Cannesson M, Alexander BS, et al. Effect of phenylephrine and ephedrine bolus treatment on cerebral oxygenation in anaesthetized patients[J]. Br J Anaesth, 2011, 107(2): 209-217. DOI:10.1093/bja/aer150 |
| [23] | Poterman M, Vos JJ, Vereecke HE, et al. Differential effects of phenylephrine and norepinephrine on peripheral tissue oxygenation during general anaesthesia: a randomised controlled trial[J]. Br J Anaesth, 2015, 32(8): 571-580. DOI:10.1097/EJA.0000000000000247 |
| [24] | Dunaway S, Yu Q, Larson DF. Effect of acute alpha adrenergic stimulation on cardiac function[J]. Perfusion, 2007, 22(4): 289-292. DOI:10.1177/0267659107084145 |
| [25] | Asim K, Gokhan E, Ozlem B, et al. Near infrared spectrophotometry (cerebral oximetry) in predicting the return of spontaneous circulation in out-of-hospital cardiac arrest[J]. Am J Emerg Med, 2014, 32(1): 14-17. DOI:10.1016/j.ajem.2013.09.010 |
| [26] | Bozkurt A, Rosen A, Rosen H, et al. A portable near infrared spectroscopy system for bedside monitoring of newborn brain[J]. BioMed Eng OnLine, 2005, 4: 29. DOI:10.1186/1475-925X-4-29 |
| [27] | Parnia S. Cerebral oximetry–The holy grail of non-invasive cerebral perfusion monitoring in cardiac arrest or just a false dawn[J]. Resuscitation, 2012, 83(1): 11-12. DOI:10.1016/j.resuscitation.2011.10.021 |
| [28] | Storm C, Wutzler A, Trenkmann L, et al. Good neurological outcome despite very low regional cerebral oxygen saturation during resuscitation-a prospective preclinical trial in 29 patients[J]. Scand J Trauma Resusc Emerg Med, 2016, 24(1): 43. DOI:10.1186/s13049-016-0234-3 |
 2018, Vol. 27
2018, Vol. 27




