沈阳市沈河区人民医院急诊科(权玉兰)
百草枯(paraquat,PQ)是目前使用最广泛的除草剂之一,因人群易接触,在临床上自服或误服PQ导致急性中毒的事件屡见不鲜。在临床治疗中发现服用剂量远远超过致死量时,常在24~72 h内发生多脏器功能衰竭(multiple organ failure,MOF),但PQ主要聚集在肺,肺损害最为突出,许多患者早期死于急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),晚期死于不可逆性肺间质纤维化所致的呼吸衰竭[1, 2, 3, 4]。PQ中毒机制尚不明确,无有效的救治手段。因此,从分子生物学研究阐明其发病机制,从而在临床应用中能早期有效地控制PQ中毒进展,是现代急救医学发展的新要求。 本实验从脏器保护的角度出发,用乌司他丁(ulinastatin,UTI)治疗急性PQ中毒出现的急性肺损伤和呼吸衰竭,发现上述并发症得到缓解的同时,急性PQ中毒的症状也随之减轻 。应用UTI治疗急性PQ中毒的患者,初步显示了较好的疗效,其作用机制还不确定,研究显示可能与减少肺内氧自由基与炎症介质、细胞因子对肺泡上皮细胞的损害有关[5, 6]。当细胞处于氧化应激、缺氧和外界刺激的状态时,细胞可以自我消化;同时细胞可以通过清除受损的细胞器和错误聚集蛋白对氨基酸和脂肪酸重复利用,发生细胞自噬。这种细胞自噬可能具有减轻细胞损伤的作用,但也有人认为过度活化的自噬对细胞有害[7, 8]。细胞凋亡是一种高度调节的、耗能的细胞死亡形式,且在肺部损伤中长期存在。在急性PQ中毒后,乌司他丁具体通过怎样的机制发挥减少肺损伤的作用,其保护作用是否是通过调节细胞自噬和凋亡来实现的目前尚不明确。
1 材料与方法 1.1 药品及主要试剂20%百草枯(PQ)溶液(山东大成农药股份有限公司),乌司他丁(天普生化医药股份有限公司),GRP78抗体、LC3,Bcl-2,Bax,抗体(美国 SANTA CRUZ 公司)。
1.2 实验动物健康实验用Wistar大鼠150只,雌雄各半,体质量(250±10)g,清洁级。购自吉林大学白求恩基础部实验动物中心。动物合格证号:SCXK-(吉)2008-0005。
1.3 试验方法 1.3.1 动物模型制备实验动物根据随机排列表分成3组(雌雄各半):每组50只。每次用药均稀释为1 mL。①空白对照组(Con组):一次性给予1 mL生理盐水灌胃。每日2次1 mL生理盐水腹腔注射。②PQ染毒组:一次性给予PQ溶液40 mg/kg灌胃造模。每日给予1 mL生理盐水腹腔注射。③PQ染毒UTI治疗组:大鼠PQ中毒后给予UTI(12万U/kg),每日2次腹腔注射。
1.3.2 实验步骤大鼠染毒后第7天10%水合氯醛腹腔注射麻醉大鼠。开胸,PBS-T灌流冲洗2 min,去肺组织-80 ℃保存。之后予以10%中性福尔马林缓冲液冲洗后取组织,右肺中叶在10%中性福尔马林缓冲液中固定48 h,常规脱水、浸蜡、包埋、切片(5 mm厚),行HE染色、免疫组化检测。
1.3.3 石蜡切片制作基本过程取材、固定、包埋(包埋前脱水、透明、浸蜡、包埋、修块)、切片。
1.3.4 HE染色脱蜡、 染色、逐级升浓度酒精脱水、透明、封固 。
1.3.5 免疫组织化学法检测LC3和Bcl-2的蛋白表达结果在每张切片于400倍镜下随机选择5个视野,用Motic Image Advanced 3.2图形分析系统对每张免疫组化切片所有阳性细胞进行总的灰度分析。细胞核清晰、胞质呈黄褐色为阳性细胞。细胞核呈蓝色、细胞质无色为阴性细胞。
1.3.6 Western blot检测LC3、Bax和Bcl-2的蛋白表达提取肺组织总蛋白,Bio-Rad 法测定蛋白含量,然后按BCA蛋白定量试剂盒说明书步骤操作,测定LC3,Bax和Bcl-2样品的蛋白浓度。用Image J图像处理软件计算各条带灰度值,分析LC3、 Bax和Bcl-2蛋白的表达情况。
1.4 统计学方法数据分析以SPSS 18.0统计软件进行结果以均数±标准差(x ±s)表示。组间差异采用ANOVA(SNK-q检验)比较。以P<0.05为差异具有统计学意义。
2 结果 2.1 大鼠肺部形态学观察HE染色结果显示,Con组大鼠肺组织结构清晰,肺泡壁及肺泡隔形态正常。PQ染毒组肺组织结构部分破坏,部分肺泡壁塌陷,部分肺泡腔扩大,局部炎细胞浸润;可见肺泡隔显著增厚,明显的局部出血。PQ染毒UTI治疗组肺组织结构清晰,肺泡壁轻度水肿,局部见少量炎细胞浸润,可见肺泡隔轻度增厚,未见出血、纤维化。见图 1。
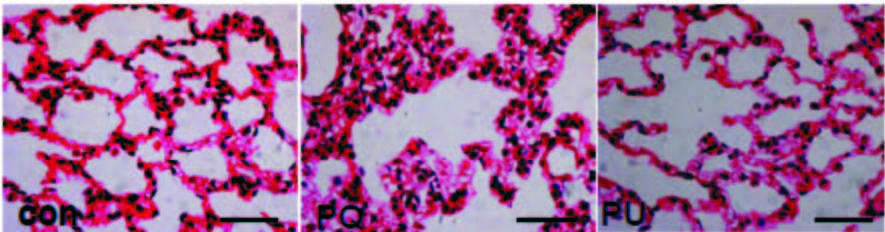
|
| 图 1 急性百草枯中毒大鼠肺组织HE染色(×40) Fig. 1 Lung cellular in the acute paraquat poisoning rats(×40) |
Western blot显示三组之间差异具有统计学意义(P<0.01):与Con组相比,PQ组LC3 A/B蛋白含量表达增高有统计学意义[LC3表达量(A值):(0.22±0.05) vs. (0.14±0.03)];PQ组相比,PU组中LC3 A/B蛋白含量表达增高有统计学意义[LC3表达量(A值):(0.36±0.08) vs. (0.22±0.05)],见图 2。

|
| 图 2 急性百草枯中毒大鼠的肺组织中LC3蛋白的表达 Fig. 2 Expression of LC3 protein in the acute paraquat poisoning rats lung cellular |
细胞定位:LC3主要表达在细支气管黏膜柱状上皮细胞、杯状细胞胞质中,肺泡细胞、巨噬细胞、中性粒细胞、肺间质细胞和血管内皮细胞胞质中均有表达。实验大鼠肺组织中LC3表达强度不同,免疫组化显示三组之间差异具有统计学意义(P<0.01):LC3蛋白表达量PQ组低于Con组差异具有统计学意义[LC3A值:(78.34±10.71) vs. (117.58±15.26)];与PQ组相比,PU组LC3蛋白表达量较高差异有统计学意义[LC3A值:(162.58±25.76) vs. (78.34±10.71)]。见图 3。
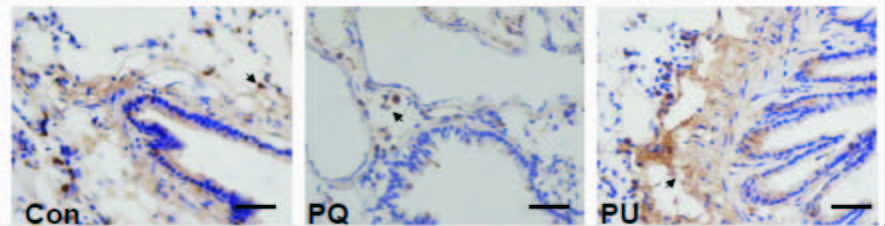
|
| 图 3 急性百草枯中毒大鼠的肺组织中LC3A/B蛋白表达(×40) Fig. 3 Expression of LC3A/B protein in the acute paraquat poisoning rats lung cellular(×40) |
Western blot显示三组之间差异具有统计学意义(P<0.01):与Con组相比,PQ组Bcl-2/Bax蛋白含量表达明显降低差异有统计学意义[Bcl-2/Bax表达量(A值):(0.11±0.04) vs. (0.83±0.21)];与PQ组相比,PU组中Bcl-2/Bax蛋白含量表达增高差异有统计学意义[Bcl-2/Bax表达量(A值):(0.63±0.18) vs. (0.11±0.04)]。见图 4。
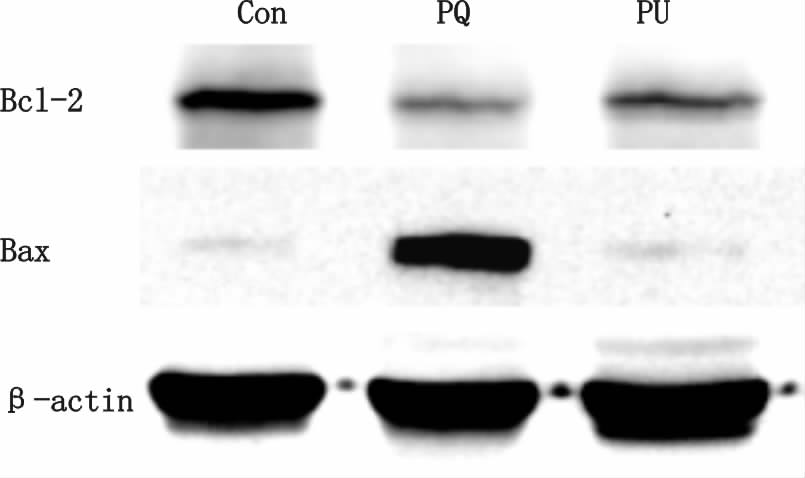
|
| 图 4 急性百草枯中毒大鼠的肺组织中Bcl-2和Bax蛋白的表达 Fig. 4 Expression of Bax and Bcl-2 protein in the acute paraquat poisoning rats lung cellular |
细胞定位:Bcl-2主要表达在细支气管黏膜柱状上皮细胞、杯状细胞胞质中,肺泡细胞、巨噬细胞、中性粒细胞、肺间质细胞和血管内皮细胞胞质中均有表达。免疫组化显示3组之间差异具有统计学意义(P<0.01):与Con组相比,PQ组Bcl-2蛋白含量表达降低差异具有统计学意义[Bcl-2A值:(62.54±9.74) vs.(136.52±19.86)]。与PQ组相比,PU组中Bcl-2蛋白含量表达增高有统计学意义[Bcl-2A值:(141.56±20.26) vs. (62.54±9.74)],见图 5。

|
| 图 5 免疫组化检测急性百草枯中毒大鼠的肺组织中Bcl-2蛋白表达(×40) Fig. 5 Immunohistochemistry: the expression of Bcl-2 protein in the acute paraquat poisoning rats lung cellular(×40) |
百草枯作为广泛使用的除草剂对人畜均有较强毒性,据统计每年成千上万的人死于PQ中毒,国外报道病死率40%~50%[9],而国内个别报道高达80%以上,在临床治疗方面,PQ中毒至今尚缺少 特异性的解毒药。UTI最早被用于治疗急性胰腺炎,近年来又被广泛用于治疗脓毒症、ALI等,均取得了良好的疗效[10]。
自噬是清除、降解、 回吸收利用细胞内生物大分子和受损细胞器的重要代谢通路。自噬能帮助细胞适应内质网应激(例如有利于清除未折叠或聚集的蛋白),或参与内质网应激诱导的细胞死亡[11, 12]。 它包括大自噬、小自噬和分子伴侣介导的自噬。当细胞处于缺血、缺氧、饥饿状态时,一方面细胞可以产生自体吞噬,另一方面细胞可以通过清除受损的细胞器和错误聚集蛋白对氨基酸和脂肪酸重复利用。在大自噬的发生过程中,最初在细胞质中形成杯状的双层膜结构的自噬前体,自噬前体在一些自噬蛋白的作用下逐渐延长,LC3不断被募集到自噬前体上,而后自噬前体与溶酶体融合形成自噬体[13];小自噬是溶酶体膜直接内凹吞噬细胞成分[14];分子伴侣介导的自噬是分子伴侣识别有KFERQ 模序的蛋白质并与溶酶体膜受体结合内吞入溶酶体发生自噬[15]。TOR(target of rapamycin)是控制细胞自噬的关键蛋白,能感受细胞的多种变化信号,增强或降低自噬的水平。细胞内ATP 含量、缺氧等细胞信号都可直接或间接通过TOR 将其整合,从而调节细胞的自噬发生。自噬的活化与多种疾病的病理过程有关,包括神经系统紊乱、结构肥大、癌、细菌引起的感染。自噬一般来说是一个适应性的机制,在ATP的产生、氨基酸和脂肪酸的重复利用、破坏细胞器、蛋白质的聚集和外源途径的产生中,这些可以导致细胞功能失常和细胞死亡的物质,可以通过自噬途径被移除。
内质网(ER)是真核细胞中生物合成和信号传递的重要细胞器,氨基多糖、膜/分泌性蛋白、胆固醇、磷脂及钙信号等的代谢均与ER功能直接相关,如蛋白质糖基化修饰、分泌性蛋白的合成与空间折叠、蛋白质分泌等均在ER内发生[16, 17]。ER内富含葡萄糖调节蛋白(GRP78/BiP),钙网织蛋白和钙粘连蛋白和几种折叠的酶类,如硫氧还蛋白二硫键异构酶(PDI)。 ER内环境的稳定是靠这些分子伴侣和Ca2+结合蛋白等调控。
虽然ER具有极强的内稳态体系,但是有很多因素,如缺氧、氧化损伤、ER中Ca2+耗竭、低血糖、高脂饮食、病毒感染等均可影响ER的功能,破坏蛋白质的合成、翻译和折叠,产生未折叠和错叠蛋白,ER处理不了过多的错误蛋白,则未折叠蛋白和错叠蛋白在ER内的堆积,即发生ERS。研究证明,ERS在许多疾病的发生、发展中起重要作用,如神经退行性病变、心血管疾病及糖尿病等[18]。ERS主要激活三条信号转导通路,即未折叠蛋白反应(unfolded protein response,UPR),ER超负荷反应和固醇调节级联反应。前两者均是蛋白质合成加工紊乱所致,ER超负荷反应的效应是激活转录因子NF-κB。固醇调节级联反应则是在ER表面合成的胆固醇损耗所致。
诱导内质网应激不同的情况也诱导自噬发生。 内质网应激反应被激活,保护细胞避免影响细胞器的不同变化。然而,当损伤的强度和持续时间不能被内质网应激反应所恢复时,内质网应激也能导致细胞死亡。同样的,自噬能帮助细胞适应内质网应激(例如有利于清除未折叠或聚集的蛋白),或参与内质网应激诱导的细胞死亡[19, 20]。
内质网应激反应的激活也被发现调节自噬。用衣霉素或用蛋白酶体抑制剂处理细胞,发现以依赖的方式诱导自噬发生,促进自噬作用,依赖蛋白与细胞浆衔接蛋白及激活。 有研究发现通过磷酸化阻止蛋白与自噬调节因子相互作用而调节自噬。目前已发现UPR 中PERK,IRE1 信号转导通路与自噬反应的激活有关。Kouroku等[21]发现在小鼠胚胎癌细胞和胚胎成纤维细胞(MEFs)中,多聚谷氨酰胺Q72(polyglutamine Q72,polyQ72)的异常表达和积聚会导致ER应激及自噬,上调自噬相关蛋白Atg12 和LC3-Ⅱ的表达,敲除PERK-eIF2α 基因可抑制ER应激诱导的自噬反应,从而证实了PERK-eIF2α 信号转导通路对于ER应激和自噬的发生是必须的。ER应激引起自噬反应的生理和病理意义尚不清楚。当细胞内错误折叠的蛋白质超过了蛋白酶降解系统降解能力时,自噬将被激活以清除这些蛋白[22, 23]。已观察到ER应激诱导自噬可减轻内质网膨胀,清除聚集过多的蛋白质,缓解内质网遭受的强烈而持久的刺激,保护细胞。在细胞内自噬反应可以抑制毒胡萝卜素或是衣霉素引起的细胞的死亡,提示自噬对于细胞是具有保护作用的。ER stress 诱导的自噬反应在清除内质网内与疾病相关的突变蛋白这个过程中起着相当重要的作用[24]。
Bcl-2和Bax是目前细胞凋亡领域研究的热点之一,Bcl-2主要功能是抑制细胞凋亡的发生,而Bax则是促进细胞凋亡的发生。动物实验发现油酸致小鼠急性肺损伤的加重与肺组织中凋亡基因Bcl-2的表达下调和凋亡基因Bad的表达上调可能有关[25]。在注射LPS的大鼠模型中,注射后12 h内随时间延长肺泡上皮细胞Bcl-2表达减弱,促凋亡基因Bax则表达增加,Bcl-2/Bax减小,凋亡增加[26]。临床研究也表明严重颅脑损伤时 Bax/Bcl-2 阳性细胞数的比值明显大于未损伤组,Bax/Bcl-2表达的比例对严重颅脑损伤后细胞凋亡可能起重要的调控作用[27]。在有关药物对Bcl-2和Bax的比例调节的研究中,发现细胞培养模型中发现,胰岛素可通过调节Bcl-2/Bax的比例,促进Bcl-2结合Bax来抑制细胞凋亡的发生[28]。而在百草枯中毒肺损伤与Bcl-2和Bax介导的细胞凋亡关系研究方面并不多见,有研究用发现维生素C能促进百草枯中毒后肺组织 Bcl-2,Bax蛋白表达,Bcl-2/Bax比例虽有升高,但与细胞凋亡率却无显著负相关[29]。
本课题组在临床上从脏器保护的角度出发,用乌司他丁(UTI)治疗急性PQ中毒出现的急性肺损伤和呼吸衰竭,发现上述并发症得到缓解的同时,急性PQ中毒的症状也随之减轻 。应用UTI治疗急性PQ中毒的患者,初步显示了较好的疗效,前期结果表明乌司他丁能降低急性PQ中毒的内质网应激,染毒组大鼠肺组织中GRP78、PDI、CHOP蛋白水平出现了不同程度的升高,表明急性PQ中毒激活了ERS与UPR反应。为了进一步验证急性PQ中毒大鼠肺细胞的转归,笔者检测了肺部细胞自噬发生情况,结果发现与PQ组相比,PU组中LC3 A/B蛋白含量表达增高,这说明UTI治疗急性PQ中毒时,激活自噬。在急性PQ中毒时,导致肺细胞的错误折叠蛋白的聚集,从而增加了细胞自噬来降解这些错误折叠蛋白,这与Lazar等[22]的理论一致。凋亡是细胞死亡的一种活化形式,是一种进化保守的生理学机制。不同的细胞内或者细胞外的刺激因素都能够引起凋亡性的细胞死亡。同时Bcl-2蛋白含量表达也增高,伴有Bcl-2/Bax比例上调,这说明在UTI治疗急性PQ中毒时可通过对Bcl-2,Bax的调节,活化体内的抗凋亡信号,来抑制细胞凋亡达到肺保护作用。总之,UTI治疗急性PQ中毒时是通过促进自噬发生,增加Bcl-2的表达,提高Bcl-2/Bax比例来保护肺组织的。
| [1] | Gawarammana IB,Buckley NA.Medical management of paraquat ingestion [J].Br J Clin Pharmacol,2011,72(5):745-757. |
| [2] | Roberts DM, Wilks MF, Roberts MS,etal.Changes in the concentrations of createnine, cystatin C and NGAL in patients with acute paraquat self-poisoning[J]. Toxicol Lett, 2011, 202(1): 69-74. |
| [3] | Kervégant M,Merigot L,Glaizal M,et al.Paraquat poisonings in France during the European Ban: experience of the poison control center in Marseille[J].J Med Toxicol,2013 Feb 23. |
| [4] | Minois N, Carmona-Gutierrez D, Bauer MA,et al.Spermidine promotes stress resistance in Drosophila melanogaster through autophagy-dependent and independent pathways[J]. Cell Death Dis,2012,3:e 401. |
| [5] | Zhang WX,Li ZJ.Effect of prostaglandin E1 combined with Xuebijing injection on transforming growth factor-β1 in rats with pulmonary interstitial fibrosis. Zhong hua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi, 2012, 30(12): 913-915. |
| [6] | Liu S, Liu K, Sun Q, et al. Consumption of hydrogen water reduces paraquatind uced acute lung injury in rats[J]. J Biomed Biotechnol, 2011,305086. |
| [7] | Levine B. Eating oneself and uninvited guests: autophagy-related pathways in cellular defense [J]. Cell, 2005, 120(2):159-162. |
| [8] | Suzuki K, Ohsumi Y. Molecular machinery of autophagosome formation in yeast, Saccharomyces cerevisiae[J]. FEBS Lett, 2007, 581(11):2156-2161. |
| [9] | Hwang KY, Lee EY, Hong SY. Paraquat intoxication in Korea[J]. Arch Envir Heal, 2002, 57(2): 162-167. |
| [10] | 方强,陈朴. 乌司他丁对重度脓毒症患者的疗效极其作用机制的研究[J].中国抗感染化疗杂志,2005,5(1):13-15. |
| [11] | Winslow A R, Rubinsztein D C. Autophagy in neurodegeneration and development[J]. Biochim Biophys Acta, 2008, 1782(12):723-729. |
| [12] | Matus S, Lisbona F, Torres M, et al. The stress rheostat: an interplay between the unfolded protein response (UPR) and autophagy in neurodegeneration [J]. Curr Mol Med, 2008, 8(3):157-172. |
| [13] | Yang ZF, Klionsky DJ. Eaten alive: A history of macroautophagy [J]. Nat Cell Biol, 2010, 12(9): 814-822. |
| [14] | Pereira L, Girardi JP, Bakovic M. Forms crosstalks and the role of phospholipid biosynthesis in autophagy [J]. Int J Cell Biol, 2012,2012: 931-956 |
| [15] | Kaushik S, Bandyopadhyay U, Sridhar S, et al. Chaperone- mediated autophagy at a glance[J]. J Cell Sci, 2011, 124(4): 495-499. |
| [16] | Grlach A, Klappa P, Kietzmann T.The endoplasmic reticulum: folding, calcium homeostasis, signaling, and redox control[J].Antioxid Redox Signal, 2006,8(9/10): 1391-1418. |
| [17] | Bánhegyi G,Baumeister P,Benedetti A,et al.Endoplasmic reticulum stress[J]. Anny Acad Sci, 2007, 1113:58-71. |
| [18] | Salazar M, Carracedo A, Salanueva IJ, et al. Cannabinoid action induces autophagy-mediated cell death through stimulation of ER stress in human glioma cells[J]. J Clin Invest, 2009, 119(5):1359-1372. |
| [19] | Winslow AR, Rubinsztein DC. Autophagy in neurodegeneration and development[J]. Biochim Biophys Acta, 2008, 1782(12):723-729. |
| [20] | Matus S, Lisbona F, Torres M, et al. The stress rheostat: an interplay between the unfolded protein response (UPR) and autophagy in neurodegeneration [J]. Curr Mol Med, 2008, 8(3):157-172. |
| [21] | Kouroku Y, Fujita E, Tanida I, et al. ER stress (PERK/eIF2alpha phosphorylation) mediates the polyglutamine-induced LC3 conversion, an essential step for autophagy formation [J]. Cell Death Differ, 2007, 14(2): 230-239. |
| [22] | Lazar C, Macovei A, Petrescu S, et al. Activation of ERAD pathway by human hepatitis B virus modulates viral and subviral particle production[J]. PLOS One, 2012, 7(3): e34169. |
| [23] | Galluzzi L, De Santi M, Crinelli R, et al. Induction of endoplasmic reticulum stress response by the indole-3-carbinol cyclic tetrameric derivative CTet in human breast cancer cell lines [J]. PLOS One,2012, 7(8): e43249. |
| [24] | Ishida Y, Nagata K. Autophagy eliminates a specific species of misfolded procollagen and plays a protective role in cell survival against ER stress [J]. Autophagy, 2009, 5(8): 1217-1219. |
| [25] | 郭强, 黄芳,王俊,等.凋亡基因Bcl-2和Bad在急性肺损伤小鼠肺组织中的表达[J].中华急诊医学杂志,2010,19(3):250-252. |
| [26] | 李立萍,张建新,李兰芳,等.LPS性肺损伤大鼠一氧化氮合酶表达和肺细胞凋亡变化[J].中国病理生理杂志,2007,23(10):1996-2000. |
| [27] | 杨小锋,李谷,刘伟国,等. 严重颅脑损伤后细胞凋亡状态及相关基因Bcl-2、Bax 的表达[J].中华急诊医学杂志,2004,13(2):100-102. |
| [28] | Ricci C, Jong CJ, Schaffer SW. Proapoptotic and antiapoptotic effects of hyperglycemia: role of insulin signaling [J]. Can J Physiol Pharmacol, 2008 , 86 (4) :166-172. |
| [29] | 荆晓明, 杨红, 朱旭光,等. 维生素 C 对百草枯中毒小鼠肺组织细胞凋亡及Bcl-2/Bax蛋白表达的影响[J].中华急诊医学杂志,2003,12(10):676-678. |
 2015, Vol. 24
2015, Vol. 24




