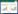2. 南通大学附属医院急诊医学中心, 南通 226200;
3. 南通大学急诊教研室, 南通 226200;
4. 首都医科大学宣武医院, 北京 100053
2. Emergency Medical Center, Affiliated Hospital of Nantong University, Nantong 226200, China;
3. Department of Emergency Medicine, Nantong University, Nantong 226200, China;
4. Xuanwu Hospital, Capital Medical University, Beijing 100053, China
急性胰腺炎(acute pancreatitis, AP)是一种常见的消化系统疾病,近年来其全球发病率呈现上升趋势[1]。胆结石和酒精是全球急性胰腺炎的两大主要危险因素[2]。高甘油三酯血症性急性胰腺炎(hypertriglyceridemia-induced acute pancreatitis, HTGAP)是急性胰腺炎的重要亚型,随着代谢综合征的流行逐年上升,高甘油三酯血症(hypertriglyceridemia,HTG)已成为我国仅次于胆源性胰腺炎的第二大病因[3]。目前HTGAP的临床特征尚未完全明确,临床上,HTGAP的治疗除降脂治疗外,仍遵循国际上普遍认同的急性胰腺炎治疗指南,缺乏针对性的治疗。因此,进一步分析HTGAP的临床特征、治疗需求、并发症及临床预后,有助于临床医生更好地识别HTGAP的发生,及时进行具有针对性、精细化、规范化的治疗,早期预防不良预后的发生,降低HTGAP的病死率,也为未来进一步更新其诊治方案提供参考证据。
临床上对HTGAP的病情严重程度根据2012年修订版亚特兰大分级[4],被分为轻度、中重度和重度三级。大部分患者为轻症急性胰腺炎(mild acute pancreatitis,MAP),1~2周内即可恢复,约20%的患者会进展为中度重症胰腺炎(moderate severe acute pancreatitis,MSAP)或重症急性胰腺炎(severe acute pancreatitis,SAP)。其中,SAP常会出现脓毒症和持续的多器官功能衰竭,其病死率在20%~40%之间[5]。但对其严重程度的预测模型及关键危险因素仍缺乏共识。Ranson评分、BISAP评分、APACHE Ⅱ评分、MCTSI评分等是急性胰腺炎传统的临床评分系统。可惜的是,这些评分普遍起源于早期急性胰腺炎的临床研究,这些研究并未区分急性胰腺炎的起病病因,所以对于HTGAP的严重程度预测的针对性比较差[6-7]。在过去十几年中,众多临床研究致力于寻找一种广泛适用、方便易得且具有高诊断价值的指标,以期早期对高甘油三酯血症性急性胰腺炎的严重程度进行客观测量和评估。然而,目前的临床评分系统或生化指标均未能发挥决定性作用[8]。
D-二聚体/纤维蛋白原(D-dimer/ fibrinogen ratio,DFR)指数在一项针对肺动脉栓塞的前瞻性研究[9]中被首次提出,反映了疾病中血块形成的程度[10]。通过减少个体差异对结果的干扰,能更敏感地反映整体失衡[11]。目前,在心血管栓塞[12]、肺栓塞[9]、心力衰竭[13]等许多疾病中逐步证实了自己的使用价值。凝血功能的改变是HTGAP进展的重要因素,本研究收集南通大学附属医院急诊医学科确诊为HTGAP患者的详细临床资料,通过回顾性研究评估DFR指数对于HTGAP患者严重程度的预测价值。此研究对于完善HTGAP严重程度早期评估手段,提高HTGAP重症患者的生存率有着重要临床意义。
1 资料与方法 1.1 研究对象本研究采用单中心回顾性研究方法,通过医院电子病历系统,收集2021年1月至2024年9月期间于南通大学附属医院确诊为AP并入住急诊科的患者468例,对于在研究期间多次入住本院的患者,仅保留首次入住的病历,根据本研究所构建的纳入和排除标准进行筛选后,最终有符合入选标准的HTGAP患者118例为本研究的研究对象。
纳入标准:符合以下所有标准的患者纳入本次研究:(1)患者年龄≥18周岁;(2)患者诊断符合AP诊断标准;(3)TG>11.3 mmol/L,或5.65 mmol/L≤TG≤11.3 mmol/L且血清呈乳糜状;(4)临床病历资料完整;(5)入院后24 h内完善实验室检验。排除标准:符合以下任意一项标准的患者予以排除:(1)患者年龄 < 18周岁;(2)慢性胰腺炎急性发作或复发的患者;(3)妊娠、哺乳期、创伤、资料不完全患者;(4)伴有恶性肿瘤、骨髓抑制或脾功能亢进病史的患者;(5)起病至入院超过48 h的患者;(6)已在外院接受治疗的患者。
本研究已获得南通大学附属医院伦理委员会的审批(审批号:2025-K063-01)。所有患者签署知情同意书,允许其临床数据及影像用于研究。
1.2 临床资料采集根据病历系统收集患者的临床资料:性别、年龄、体重、身高、既往病史、病因、亚特兰大标准下AP严重程度分级、入院时和入院24 h的生命体征、入院24 h内实验室指标(如有多次测定则选取最差值);入院48 h后的增强CT影像学报告、Ranson评分、入院24 h的急性胰腺炎床旁严重度指数(bedside index of severity in acute pancreatitis,BISAP)、24 h内的急性生理与慢性健康状况评分(acute physiology and chronic health evalution Ⅱ,APACHEⅡ)及24 h内的序贯器官衰竭评分(sequential organ failur assessment,SOFA)、使用的特殊治疗手段、出院结局、住院期间出现的并发症,炎症相关指数。
1.3 统计学方法用Excel统计相关数据及指标;采用R 4.4.2进行处理和分析。对于计数资料用例数(n)和百分比(%)来表示,它们的组间差异用χ2检验、Fisher确切概率法比较。对计量资料进行正态分布检验,满足正态分布的变量用均数±标准差(x±s)表示,不满足的以M(Q1, Q3)表示。正态分布的计量资料采用t检验进行组间比较,不符合正态分布的计量资料组间比较用Mann-Whitney U检验。对于差异性比较具有统计学意义的数据进行二元logistic逐步向前回归法筛选变量,获得HTGAP的独立风险/保护因素。计算和绘制独立危险因素的ROC曲线并计算AUC、最佳截断值,评估独立危险因素对sHTGAP的预测价值。最后对危险因素在不同并发症及结局中的差异性进行分析,并绘制出小提琴图和箱型图以可视化表达。以P < 0.05为差异具有统计学意义。
2 结果本研究采用回顾性研究方法,纳入2021年1月至2024年9月南通大学附属医院急诊医学科确诊为HTGAP的患者118例。
2.1 TG轻度升高HTGAP组和TG重度升高HTGAP组患者的比较将HTGAP组患者根据TG水平分为TG轻度升高HTGAP(5.65 mmol/L≤TG≤11.3 mmol/L)组85例患者和TG重度升高HTGAP组(TG>11.3 mmol/L)33例患者。
相较于轻度升高型HTGAP患者,重度升高型HTGAP患者的Hb、GLB水平升高,FDP、D-D、APTT水平降低(P < 0.05),其余各项生化指标、其余各项实验室指标均差异无统计学意义(P>0.05)。TG重度升高组糖尿病比例呈升高趋势(57.6% vs 37.6%,P=0.050),提示胰岛素抵抗可能参与重度高甘油三酯血症的形成,但因样本量有限,该差异处于边缘显著水平,未来需更大样本验证。两组相比,患者的性别、年龄、BMI、既往史(除糖尿病)、并发症、入院时及入院后24 h的生命体征、增强CT影像、临床评分、治疗方案和出院结局各项亦差异无统计学意义(P>0.05)。见表 1。
| 指标 | TG轻度升高HTGAP(n=85) | TG重度升高HTGAP(n=33) | χ2 / t/Z值 | P值 |
| 性别 | ||||
| 男(n, %) | 26 (30.6) | 14 (42.4) | 1.496 | 0.223 |
| 女(n, %) | 59 (69.4) | 19 (57.6) | ||
| 年龄(岁) | 40 [34, 47] | 40 [36, 51] | -0.831 | 0.406 |
| BMI | 26.8 [24.7, 30.9] | 25.7 [24.2, 28.7] | -1.541 | 0.123 |
| 既往史 | ||||
| 饮酒史/有(n, %) | 27 (31.8) | 8 (24.2) | 0.645 | 0.422 |
| 吸烟史/有(n, %) | 18 (21.2) | 8 (24.2) | 0.130 | 0.718 |
| 高血压/有(n, %) | 23 (27.1) | 12 (36.4) | 0.986 | 0.321 |
| 糖尿病/有(n, %) | 32 (37.6) | 19 (57.6) | 3.847 | 0.050 |
| 冠心病/有(n, %) | 1 (1.2) | 2 (6.1) | - | 0.189 |
| 高脂血症/有(n, %) | 65 (76.5) | 27 (81.8) | 0.396 | 0.529 |
| 胆囊切除/有(n, %) | 8 (9.4) | 3 (9.1) | 0.000 | 1.000 |
| 并发症 | ||||
| 菌血症(n, %) | 11 (12.9) | 2 (6.1) | 0.553 | 0.457 |
| DKA(n, %) | 12 (14.1) | 4 (12.1) | 0.000 | 1.000 |
| AKI(n, %) | 15 (17.6) | 4 (12.1) | 0.537 | 0.464 |
| 心肌损害(n, %) | 7 (8.2) | 1 (3.0) | 0.362 | 0.547 |
| ARDS(n, %) | 38 (44.7) | 14 (42.4) | 0.050 | 0.823 |
| 生命体征 | ||||
| 体温(℃) | ||||
| 入院时 | 36.7 [36.5, 37.2] | 36.5 [36.5, 36.8] | -1.217 | 0.224 |
| 24 h | 37.0 [36.6, 38.0] | 37.3 [36.7, 37.7] | -0.033 | 0.974 |
| 心率(次/min) | ||||
| 入院时 | 108 ± 23 | 108 ± 28 | -0.049 | 0.961 |
| 24 h | 98 ± 18 | 99 ± 19 | 0.542 | 0.589 |
| 呼吸(次/min) | ||||
| 入院时 | 20 [17, 29] | 20 [17, 27] | -0.316 | 0.752 |
| 24 h | 19 [16, 23] | 20 [16, 22] | -0.406 | 0.684 |
| 收缩压(mmHg) | ||||
| 入院时 | 132 ± 21 | 130 ± 19 | -0.207 | 0.836 |
| 24 h | 124 [116, 137] | 126 [116, 137] | -0.639 | 0.523 |
| 舒张压(mmHg) | ||||
| 入院时 | 81±15 | 78±14 | 1.294 | 0.198 |
| 24 h | 74 ± 11 | 70 ± 11 | 1.535 | 0.128 |
| 血常规 | ||||
| WBC(×109/L) | 11.90 [9.10, 15.30] | 12.12 [9.20, 15.90] | -0.057 | 0.955 |
| NEU(×109/L) | 9.84 [7.62, 13.71] | 9.96 [7.54, 13.63] | -0.021 | 0.983 |
| LYM(×109/L) | 1.14 [0.80, 1.56] | 1.41 [1.04, 1.57] | -1.508 | 0.132 |
| MONO(×109/L) | 0.50 [0.30, 0.70] | 0.47 [0.29, 0.60] | -1.047 | 0.295 |
| RBC(×109/L) | 5.06 ± 0.93 | 5.13 ± 0.76 | -0.400 | 0.690 |
| Hb(×109/L) | 154.27 ± 27.55 | 165.48 ± 25.01 | -2.034 | 0.044 |
| PLT(×109/L) | 236.00 [177.00, 280.00] | 223.00 [172.00, 272.00] | -0.462 | 0.644 |
| hsCRP(mg/L) | 207.64 [61.70, 295.88] | 110.25 [18.24, 308.45] | -1.022 | 0.307 |
| PCT(ng/mL) | 1.20 [0.36, 4.07] | 0.90 [0.19, 9.50] | 0.000 | 1.000 |
| 生化指标 | ||||
| AST(U/L) | 34.00 [26.00, 59.00] | 34.00 [25.00, 48.00] | -0.435 | 0.664 |
| ALT(U/L) | 26.00 [19.00, 44.00] | 29.00 [22.00, 37.00] | -0.408 | 0.683 |
| ALP(U/L) | 79.00 [62.00, 95.00] | 86.00 [63.00, 114.00] | -1.178 | 0.239 |
| GGT(U/L) | 64.00 [45.00, 122.00] | 51.00 [42.00, 75.00] | -1.409 | 0.159 |
| TBIL(U/L) | 19.30 [14.90, 29.70] | 17.50 [14.90, 22.00] | -1.316 | 0.188 |
| DBIL(μmol/L) | 8.90 [5.30, 12.00] | 8.30 [5.50, 11.00] | -0.780 | 0.436 |
| TP(g/L) | 67.55 ± 9.29 | 69.10 ± 9.19 | -0.820 | 0.414 |
| ALB(g/L) | 37.40 [32.10, 43.40] | 35.50 [30.80, 38.90] | -1.478 | 0.139 |
| GLB(g/L) | 29.40 [27.60, 33.50] | 34.10 [28.90, 36.50] | -2.719 | 0.007 |
| BUN(mmol/L) | 5.75 [4.30, 8.00] | 5.10 [3.90, 7.30] | -1.178 | 0.239 |
| Scr(μmol/L) | 65.00 [49.00, 102.00] | 50.00 [42.00, 88.00] | -1.835 | 0.066 |
| UA(μmol/L) | 415.00 [307.00, 535.00] | 385.00 [324.00, 469.00] | -0.432 | 0.666 |
| AMY(U/L) | 333.00 [104.00, 651.00] | 314.00 [148.00, 663.00] | -0.180 | 0.857 |
| GLU(mmol/L) | 11.45 [8.00, 14.93] | 11.60 [9.10, 16.20] | -0.999 | 0.318 |
| 电解质指标 | ||||
| K+(mmol/L) | 4.20 [3.70, 4.70] | 4.30 [4.00, 5.00] | -1.294 | 0.196 |
| Na+(mmol/L) | 136.00 [133.00, 139.00] | 135.00 [132.00, 138.00] | -0.846 | 0.397 |
| CL-(mmol/L) | 105.70 [102.00, 108.00] | 105.00 [101.00, 107.60] | -0.934 | 0.350 |
| Ca2+(mmol/L) | 1.95 [1.66, 2.21] | 1.99 [1.62, 2.15] | -0.195 | 0.845 |
| 凝血功能指标 | ||||
| FDP(μg/ml) | 8.90 [3.20, 17.40] | 4.60 [2.50, 10.40] | -2.339 | 0.019 |
| D-D(μg/ml FEU) | 2.55 [0.91, 5.03] | 1.19 [0.31, 2.73] | -2.890 | 0.004 |
| PT(s) | 12.70 [11.70, 14.20] | 12.10 [11.70, 13.60] | -1.176 | 0.240 |
| APTT(s) | 28.00 [25.60, 32.00] | 26.30 [24.80, 27.90] | -2.090 | 0.037 |
| FIB(g/L) | 6.35 [4.10, 8.29] | 5.47 [3.39, 7.05] | -1.640 | 0.101 |
| TT(s) | 16.00 [14.90, 17.90] | 17.30 [15.60, 19.80] | -1.805 | 0.071 |
| 增强CT(n, %) | ||||
| 胆囊结石 | 15 (17.6) | 6 (18.2) | 0.005 | 0.946 |
| 脂肪肝 | 65 (76.5) | 27 (81.8) | 0.396 | 0.529 |
| 胰腺出血 | 13 (15.3) | 7 (21.2) | 0.591 | 0.442 |
| 胰腺坏死 | 24 (28.2) | 11 (33.3) | 0.296 | 0.586 |
| 腹腔积液 | 60 (70.6) | 24 (72.7) | 0.053 | 0.818 |
| 盆腔积液 | 41 (48.2) | 15 (45.5) | 0.074 | 0.786 |
| 胸腔积液 | 60 (70.6) | 23 (69.7) | 0.009 | 0.924 |
| 胰周包裹 | 9 (10.6) | 7 (21.2) | 1.472 | 0.225 |
| 临床评分 | ||||
| Ranson评分(分) | 3 [2, 4] | 4 [3, 5] | -0.849 | 0.396 |
| BISAP评分(分) | 1 [0, 1] | 1 [0, 1] | -0.102 | 0.919 |
| APACHEⅡ评分(分) | 8 [5, 12] | 7 [4, 11] | -0.370 | 0.712 |
| SOFA评分(分) | 3 [1, 4] | 2 [1, 3] | -1.161 | 0.245 |
| 治疗方案(n, %) | ||||
| 机械通气 | 7 (8.2) | 2 (6.1) | 0.000 | 0.990 |
| 无创 | 3 (3.5) | 0 (0.0) | - | 0.559 |
| 高流量 | 35 (41.2) | 14 (42.4) | 0.015 | 0.902 |
| 血浆置换 | 7 (8.2) | 3 (9.1) | 0.000 | 1.000 |
| 血液灌流 | 7 (8.2) | 1 (3.0) | 0.362 | 0.547 |
| CRRT | 18 (21.2) | 4 (12.1) | 1.285 | 0.257 |
| 出院结局 | ||||
| 重症胰腺炎(n, %) | 66 (77.6) | 22 (66.7) | 1.512 | 0.219 |
| 死亡(n, %) | 5 (5.9) | 1 (3.0) | 0.028 | 0.868 |
| 住院总时长(d) | 11.00 [7.00, 18.00] | 11.00 [7.00, 14.93] | -0.345 | 0.730 |
| 监护住院时长(d) | 5.82 [1.75, 8.85] | 3.87 [0.00, 7.78] | -1.426 | 0.154 |
| 总费用(万元) | 4.67 [1.92, 7.18] | 4.08 [1.16, 7.29] | -0.600 | 0.549 |
将HTGAP组患者根据亚特兰大标准下AP严重程度分级分为MAP、MSAP和SAP,其中将SAP和MSAP患者纳入重症高甘油三酯血症性急性胰腺炎(severe hypertriglyceridemia acute pancreatitis,sHTGAP)组,共88例,将MAP患者纳入非sHTGAP组,共30例。
2.2.1 sHTGAP组和非sHTGAP组的临床资料比较与非sHTGA组相比,sHTGAP组患者的hsCRP、PCT、AST、GLU、BUN、Scr、AMY、CL-、FDP、D-D、PT、FIB、HDL、DFR指数、CAR指数、PAR指数、IBI指数、CLR指数水平较高(P<0.05),LYM、MONO、ALP、TP、ALB、Ca2+、ApoA1水平较低(P<0.05)(表 2),存在潜在临床意义。
| 指标 | sHTGAP组(n=88) | 非sHTGAP组(n=30) | χ2 / t/Z值 | P值 |
| 性别/男(n, %) | 54 (61.4) | 24 (80.0) | 2.686 | 0.101 |
| 年龄/岁 | 41 (34, 48) | 39 (37, 42) | -0.220 | 0.824 |
| BMI | 26.1 (24.2, 28.9) | 28.7 (25.4, 30.1) | -1.629 | 0.103 |
| 既往史(n, %) | ||||
| 饮酒/有 | 26 (29.5) | 9 (30.0) | 0.000 | 1.000 |
| 吸烟/有 | 21 (23.9) | 5 (16.7) | 0.321 | 0.571 |
| 高血压/有 | 30 (34.1) | 5 (16.7) | 2.474 | 0.116 |
| 糖尿病/有 | 38 (43.2) | 13 (43.3) | 0.000 | 1.000 |
| 冠心病/有 | 1 (1.1) | 2 (6.7) | 0.981 | 0.322 |
| 胆囊切除/有 | 8 (9.1) | 3 (10.0) | 0.000 | 1.000 |
| 生命体征 | ||||
| 体温(℃) | ||||
| 入院时 | 36.7 (36.5, 37.2) | 36.6 (36.5, 36.8) | -1.326 | 0.185 |
| 24 h | 37.2 (36.7, 37.9) | 37.0 (36.6, 37.6) | -0.771 | 0.441 |
| 心率(次/min) | ||||
| 入院时 | 107 ± 25 | 112 ± 22 | 1.011 | 0.314 |
| 24 h | 99 ± 19 | 97.700 ± 15 | -0.251 | 0.803 |
| 呼吸(次/min) | ||||
| 入院时 | 20 (17, 28) | 20 (16, 27) | -0.356 | 0.722 |
| 24 h | 20 (16, 23) | 19 (16, 24) | -0.701 | 0.483 |
| 收缩压(mmHg) | ||||
| 入院时 | 132 ± 21 | 131 ± 20 | -0.125 | 0.901 |
| 24 h | 126 (117, 139) | 122 (114, 135) | -1.166 | 0.244 |
| 舒张压(mmHg) | ||||
| 入院时 | 81 ± 15 | 80 ± 13 | -0.297 | 0.767 |
| 24 h | 73 ± 11 | 71 ± 11 | -0.861 | 0.391 |
| 血液常规指标 | ||||
| WBC(×109/L) | 11.70 [8.88, 15.83] | 12.30 [9.84, 16.02] | -0.457 | 0.647 |
| NUE(×109/L) | 9.90 [7.58, 13.58] | 9.88 [7.64, 14.08] | -0.012 | 0.990 |
| LYM(×109/L) | 1.14 [0.79, 1.48] | 1.47 [0.88, 1.77] | -2.080 | 0.038 |
| MONO(×109/L) | 0.47 [0.28, 0.62] | 0.58 [0.46, 0.75] | -2.324 | 0.020 |
| RBC(×109/L) | 5.02±0.93 | 5.25±0.69 | 1.431 | 0.157 |
| Hb(×109/L) | 156.43±29.42 | 160.27±19.59 | 0.806 | 0.423 |
| PLT(×109/L) | 228.50 [168.75, 281.75] | 231.50 [186.00, 264.25] | -0.003 | 0.998 |
| hsCRP(mg/L) | 241.71 [86.55, 314.79] | 47.14 [11.55, 210.91] | -3.294 | < 0.001 |
| PCT(ng/mL) | 1.65 [0.74, 7.17] | 0.20 [0.07, 0.54] | -5.492 | < 0.001 |
| 生化指标 | ||||
| AST(U/L) | 37.00 [26.00, 62.50] | 30.00 [24.00, 40.50] | -2.199 | 0.028 |
| ALT(U/L) | 26.00 [18.75, 40.00] | 32.50 [24.00, 44.75] | -1.438 | 0.151 |
| ALP(U/L) | 75.50 [58.00, 93.50] | 93.50 [75.50, 117.25] | -2.908 | 0.004 |
| GGT(U/L) | 60.00 [45.00, 112.00] | 65.00 [37.75, 119.75] | -0.056 | 0.956 |
| TBIL(U/L) | 19.10 [14.90, 29.63] | 19.40 [15.07, 24.42] | -0.093 | 0.926 |
| DBIL(μmol/L) | 8.75 [5.57, 11.80] | 8.60 [4.73, 10.40] | -0.875 | 0.382 |
| TP(g/L) | 66.04±9.28 | 73.69±6.44 | 4.978 | < 0.001 |
| ALB(g/L) | 34.60 [30.88, 38.73] | 42.30 [38.90, 44.72] | -4.901 | < 0.001 |
| GLB(g/L) | 30.25 [27.25, 34.10] | 33.45 [28.92, 35.70] | -1.826 | 0.068 |
| BUN(mmol/L) | 6.00 [4.35, 8.45] | 4.70 [3.92, 6.08] | -2.432 | 0.015 |
| Scr(μmol/L) | 66.00 [48.00, 149.50] | 50.00 [43.50, 67.00] | -2.655 | 0.008 |
| UA(μmol/L) | 422.50 [302.50, 556.00] | 356.50 [318.75, 436.50] | -1.653 | 0.098 |
| GLU(mmol/L) | 12.60 [8.95, 16.00] | 10.90 [6.88, 13.28] | -2.138 | 0.033 |
| AMY(U/L) | 388.00 [193.50, 737.25] | 101.50 [68.25, 393.75] | -3.473 | < 0.001 |
| 电解质指标 | ||||
| K+ | 4.30 [3.80, 4.93] | 4.20 [3.92, 4.38] | -0.731 | 0.465 |
| Na+ | 135.69 [133.00, 139.04] | 137.00 [134.25, 138.00] | -0.170 | 0.865 |
| CL- | 106.00 [102.83, 108.05] | 103.00 [101.00, 106.00] | -2.079 | 0.038 |
| Ca2+ | 1.79 [1.55, 2.07] | 2.19 [2.10, 2.27] | -4.818 | < 0.001 |
| 凝血功能指标 | ||||
| FDP(μg/mL) | 9.45 [4.05, 16.80] | 2.70 [2.50, 5.50] | -4.014 | < 0.001 |
| D-D(μg/mL FEU) | 2.71 [1.23, 4.95] | 0.54 [0.22, 1.94] | -4.719 | < 0.001 |
| PT(s) | 12.85 [11.90, 14.50] | 11.85 [11.40, 12.47] | -3.723 | < 0.001 |
| APTT(s) | 27.90 [24.90, 32.35] | 26.40 [25.52, 28.20] | -1.740 | 0.082 |
| FIB(g/L) | 6.52 [4.44, 8.05] | 3.99 [3.02, 7.38] | -2.256 | 0.024 |
| TT(s) | 16.05 [14.90, 18.00] | 16.60 [15.53, 18.70] | -1.113 | 0.266 |
| 血脂指标 | ||||
| TC(mmol/L) | 6.80 [5.88, 8.83] | 7.55 [6.08, 9.32] | -0.631 | 0.528 |
| TG(mmol/L) | 7.12 [6.10, 11.58] | 7.20 [6.46, 17.23] | -0.881 | 0.378 |
| HDL (mmol/L) | 0.81 [0.67, 1.02] | 1.12 [0.83, 1.32] | -3.190 | 0.001 |
| LDL (mmol/L) | 3.68±1.30 | 3.39±1.35 | -1.055 | 0.294 |
| APOA1(g/L) | 0.69±0.28 | 0.90±0.33 | 3.293 | 0.001 |
| APOB(g/L) | 1.83 [1.35, 2.48] | 1.69 [1.29, 2.18] | -1.051 | 0.293 |
| Lp(a)(g/L) | 32.40 [12.32, 69.47] | 34.20 [21.42, 93.17] | -1.400 | 0.162 |
| FFA(mmol/L) | 0.62 [0.40, 0.95] | 0.72 [0.56, 1.07] | -1.780 | 0.075 |
| 炎症相关指数 | ||||
| DFR指数 | 0.45 [0.27, 0.63] | 0.10 [0.07, 0.29] | -4.898 | < 0.001 |
| CAR指数 | 6.72 [1.68, 10.08] | 1.04 [0.30, 5.36] | -3.446 | < 0.001 |
| PAR指数 | 6.46 [5.24, 8.25] | 5.52 [4.83, 6.45] | -2.296 | 0.022 |
| SIRI指数 | 3.52 [2.27, 6.59] | 4.39 [2.57, 6.82] | -0.881 | 0.378 |
| IBI指数 | 1638.26 [706.32, 2724.42] | 521.18 [115.84, 1394.99] | -3.402 | < 0.001 |
| PIV指数 | 801.74 [439.83, 1613.12] | 1007.74 [590.02, 1789.08] | -0.720 | 0.472 |
| NLR指数 | 9.00 [6.39, 12.83] | 8.07 [5.76, 9.81] | -1.320 | 0.187 |
| LMR指数 | 2.83 [1.80, 3.98] | 2.19 [1.95, 3.12] | -1.437 | 0.151 |
| PLR指数 | 195.67 [152.75, 278.68] | 183.50 [133.71, 218.35] | -1.839 | 0.066 |
| SII指数 | 1927.26 [1360.98, 2906.30] | 1726.79 [1230.86, 2427.82] | -0.998 | 0.318 |
| CLR指数 | 196.80 [69.02, 296.64] | 37.79 [10.12, 117.83] | -3.371 | < 0.001 |
将具有组间差异有统计学意义的因素纳入单因素二元Logistic回归分析,显示其中hsCRP、PCT、TP、ALB、BUN、Scr、AMY、Ca2+、FDP、D-D、PT、FIBR、ApoA1、DFR指数、CAR指数、PAR指数、IBI指数、CLR指数是sHTGAP的危险因素(P值< 0.05)(表 3)。
| 变量 | β值 | OR | (95%CI) | P值 |
| LYM | -0.434 | 0.648 | (0.329, 1.252) | 0.192 |
| MONO | -1.003 | 0.367 | (0.090, 1.485) | 0.155 |
| hsCRP | 0.006 | 1.006 | (1.003, 1.010) | 0.001 |
| PCT | 0.239 | 1.270 | (1.074, 1.683) | 0.034 |
| AST | 0.010 | 1.010 | (1.001, 1.028) | 0.168 |
| ALP | -0.011 | 0.989 | (0.976, 1.001) | 0.085 |
| TP | -0.105 | 0.901 | (0.848, 0.949) | 0.000 |
| ALB | -0.212 | 0.809 | (0.732, 0.882) | 0.000 |
| GLU | 0.082 | 1.086 | (1.005, 1.192) | 0.057 |
| BUN | -0.214 | 0.807 | (0.663, 0.946) | 0.019 |
| Scr | 0.017 | 1.017 | (1.006, 1.033) | 0.011 |
| AMY | 0.001 | 1.001 | (1.000, 1.003) | 0.030 |
| Ca2+ | 3.363 | 28.880 | (6.247, 188.655) | 0.000 |
| CL- | 0.068 | 1.070 | (0.996, 1.161) | 0.081 |
| FDP | 0.131 | 1.140 | (1.057, 1.262) | 0.004 |
| D-D | 0.532 | 1.703 | (1.293, 2.417) | 0.001 |
| PT | 0.723 | 2.061 | (1.423, 3.234) | 0.000 |
| FIB | 0.218 | 1.243 | (1.041, 1.505) | 0.020 |
| HDL | -0.307 | 0.736 | (0.441, 1.074) | 0.151 |
| APOA1 | -2.291 | 0.101 | (0.021, 0.421) | 0.002 |
| DFR指数 | 4.115 | 61.269 | (7.535, 793.428) | 0.001 |
| CAR指数 | 0.211 | 1.235 | (1.104, 1.405) | 0.001 |
| PAR指数 | 0.258 | 1.294 | (1.065, 1.629) | 0.017 |
| IBI指数 | 0.001 | 1.001 | (1.000, 1.001) | 0.001 |
| CLR指数 | 0.006 | 1.006 | (1.003, 1.010) | 0.001 |
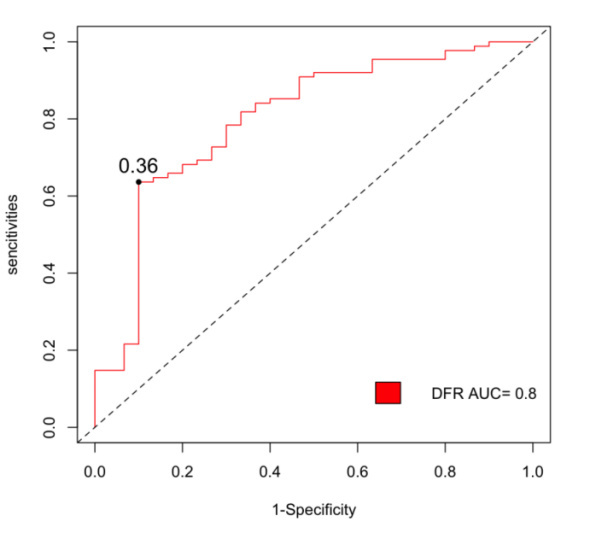
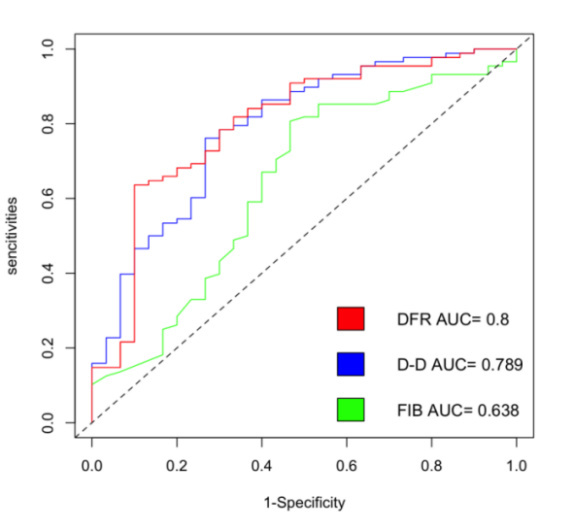
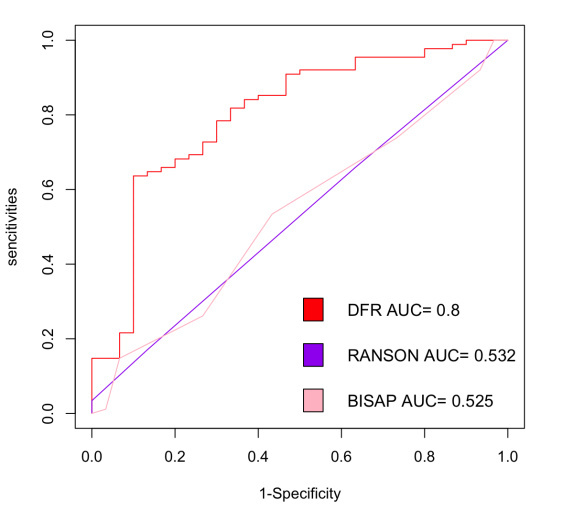
在所有危险因素中排除共线性后,根据OR值及P值,选择hsCRP、PCT、BUN、Scr、AMY、Ca2+、PT、APOA1、PAR指数、DFR指数这10个因素进行多因素二元Logistic回归分析。多因素二元Logistic回归分析显示,DFR指数是sHTGAP发生的独立危险因素[OR=12.258,95%置信区间为(1.683, 193.698)](P < 0.05)(表 4)。构建ROC曲线显示DFR值的升高对sHTGAP的发生有一定预测价值,曲线下面积(AUC)为0.800。当DFR的cut-off值为0.36时,对SAP的诊断价值最高,其敏感度为64%,特异度为90%(图 1)。同时为进一步评估DFR指数的评估能力,计算并绘制D-二聚体和纤维蛋白原对sHTGAP发生的ROC曲线,其中D-二聚体的AUC为0.789,敏感度为76.14%,特异度为73.33%;纤维蛋白原的AUC为0.638,敏感度为80.69%,特异度为53.33%(表 5)。三者比较,DFR指数的ROC曲线的AUC最高,FIB的ROC曲线的AUC最低。(图 2)。同时,DFR指数在与临床常用的评分系统(BISAP评分、Ranson评分)比较中ROC曲线的AUC最高(图 3)。
| 变量 | β值 | OR | (95%CI) | P值 |
| hsCRP | -0.004 | 0.996 | (0.989, 1.003) | 0.297 |
| Scr | 0.000 | 1.000 | (0.984, 1.028) | 0.971 |
| AMY | 0.001 | 1.001 | (1.000, 1.002) | 0.273 |
| PCT | 0.072 | 1.075 | (0.976, 1.374) | 0.375 |
| DFR指数 | 2.506 | 12.258 | (1.683, 193.698) | 0.038 a |
| PT | 0.609 | 1.838 | (1.046, 3.604) | 0.051 |
| APOA1 | -1.512 | 0.220 | (0.032, 1.271) | 0.103 |
| PAR指数 | 0.165 | 1.180 | (0.924, 1.571) | 0.213 |
| BUN | 0.044 | 1.045 | (0.759, 1.425) | 0.783 |
| Ca2+ | -1.525 | 0.218 | (0.025, 1.509) | 0.135 |
| 指标 | 截断值 | 敏感度 | 特异度 | AUC值 |
| DFR指数 | 0.36 | 63.63% | 90.00% | 0.800 |
| D-二聚体 | 1.21 | 76.14% | 73.33% | 0.789 |
| 纤维蛋白原 | 4.05 | 80.69% | 53.33% | 0.638 |
| Ranson评分 | 3.5 | 53.41% | 56.67% | 0.532 |
| BISAP评分 | 1.5 | 17.04% | 86.67% | 0.525 |
|
| 图 1 DFR指数对sHTGAP发生的ROC曲线 Fig 1 ROC curve of the DFR index for the occurrence of sHTGAP |
|
|
|
| 图 2 DFR指数、D-二聚体和纤维蛋白原的ROC曲线 Fig 2 ROC curves of DFR index, D-dimer, and fibrinogen |
|
|
|
| 图 3 DFR指数、Ranson评分和BISAP评分的ROC曲线 Fig 3 ROC curves of the DFR index, Ranson score, and BISAP score |
|
|
比较HTGAP并发症中DFR指数水平可见,DFR水平在HTGAP合并ARDS组、合并菌血症(血培养阳性)组、合并心肌损害(肌钙蛋白值高于正常参考值上限的第99百分位数)组均高于对照组(P<0.05)(图 3A-C)DFR水平在HTGAP是否合并DKA、是否死亡分别两组比较,差异无统计学意义(P>0.05)(图 4D-E)。
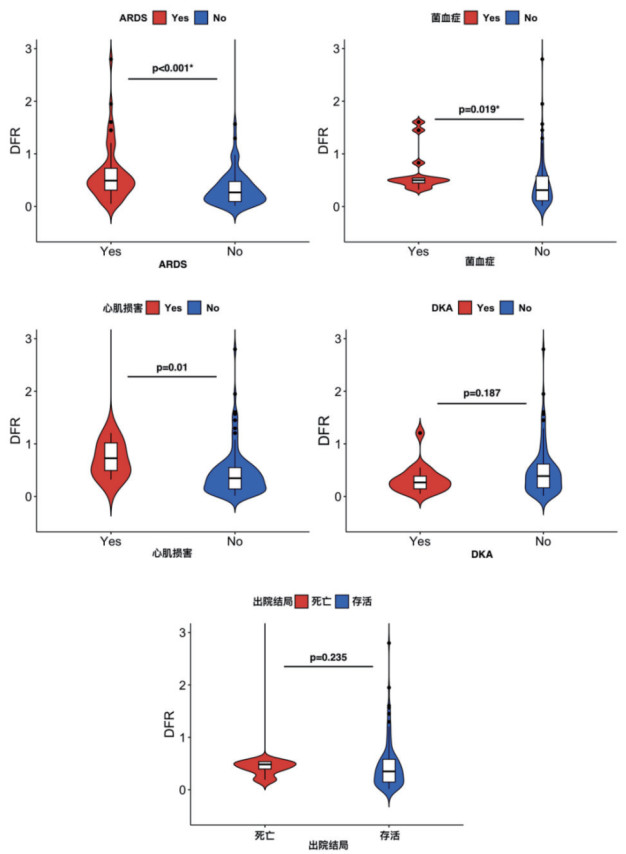
|
| 注:图 4-A:YES组=HTGAP合并ARDS组,n=52,DFR指数:0.49 [0.31, 0.73];NO组=HTGAP未合并ARDS组,n=66,DFR指数:0.27 [0.09, 0.47]。图 4-B:YES组=HTGAP合并菌血症组,n=13,DFR指数:0.50 [0.45, 0.54];NO组=HTGAP未合并菌血症组:n=105,DFR指数:0.31 [0.11, 0.58]。图 4-C:YES组=HTGAP合并心肌损害组,n=8,DFR指数:0.73 [0.49, 1.02];NO组=HTGAP未合并心肌损害组,n=110,DFR指数:0.35 [0.14, 0.55]。图 4-D:YES组=HTGAP合并DKA组,n=16,DFR指数:0.27 [0.15, 0.39];NO组=HTGAP未合并DKA组,n=102,DFR指数:0.39 [0.16, 0.62]。图 4-E:死亡组,n=6,DFR指数:0.48 [0.40, 0.53];存活组,n=112,DFR指数:0.35 [0.15, 0.58] 图 4 DFR指数水平在HTGAP是否合并并发症及出院结局中的比较 Fig 4 Comparison of DFR index levels in HTGAP patients with or without complications and at discharge outcomes |
|
|
本研究通过将HTGAP患者分为TG轻度升高组和TG重度升高组,比较两组的实验室指标、影像学资料、并发症及出院结果等多项指标,最终发现只有血红蛋白、球蛋白、纤维蛋白降解产物、D-二聚体、APTT零星几个实验室指标差异有统计学意义,并不能得出具体结论。虽然TG水平的升高是HTGAP的重要诱因,但本研究发现在TG轻度升高组和TG重度升高组相比总体差异并不显著。TG水平重度升高不直接导致HTGAP严重程度加重。近年来,也有研究指出通过血浆置换、血液灌流等血液净化手段快速降低TG水平,对疾病的预后并未产生有益作用[14],因此,本研究认为HTGAP患者的早期TG的水平不能作为病情判断的可靠指标。TG的水平变化可能并未触及HTGAP发展的核心病理机制。
在众多指标之中,本研究通过回顾性分析,筛选出拥有特殊价值的DFR指数。D-二聚体是纤维蛋白在纤溶酶作用下降解的特异度产物,反映体内纤溶系统的活化程度;纤维蛋白原是肝脏合成的凝血因子Ⅰ,直接参与凝血级联反应和血栓形成。D-二聚体的升高可能由纤溶亢进或血栓形成引起,而纤维蛋白原降低可能因消耗或合成减少。DFR指数[9]被认为与D-二聚体相比,显示出相似的敏感度和更高的特异度(57.6% vs. 29.4%)。本研究经过单因素、多因素二元logistic回归分析后,发现DFR指数是sHTGAP的独立危险因素,OR=12.258,95%置信区间为(1.683, 193.698),AUC值为0.800,cut-off值为0.36,提出DFR指数能够较好预测HTGAP中MSAP和SAP的发生。且本研究收集的实验室检验数据来源于患者入院24 h内,这或许有助于在HTGAP发病进行严重程度的早期预测,尽早识别可能会恶化进展的个体,对后续的治疗的指导提供理论依据。既往多项回顾性研究[15-17]已指出D-二聚体是AP患者发生胰腺坏死或重症HTGAP的危险因素。本研究比较了DFR指数与D-二聚体、纤维蛋白原单独预测sHTGAP的ROC曲线,显示DFR指数具有更强的特异度和预测效能,能够提高诊断的精准性。
在HTGAP中,高脂的血液使胰腺微血管内发生血流瘀滞[18],为凝血级联反应的激活提供机会,通过促进血小板活化、内皮细胞损伤[19]、上调组织因子表达等途径激活凝血途径,生成大量凝血酶将纤维蛋白原转化为纤维蛋白,但IL-6等炎症因子可以通过IL-6/JAK-STAT3通路刺激肝细胞大量合成纤维蛋白原[20],从而造成纤维蛋白原在炎症急性期的升高。此时纤溶酶原激活物抑制物(PAI-1)[21]大量释放,通过降低纤溶酶的活性,导致纤维蛋白的清除不足,相对抑制纤溶系统,此时D-二聚体的升高可能并不明显。但这种在高凝的基础上形成“纤溶抑制-纤维蛋白沉积-炎症加重”的恶性循环[22]可能是导致HTGAP容易出现多系统器官功能衰竭(multiple system organ failure,MSOF)和炎症反应综合征(systemic inflammatory response syndrome,SIRS)等严重并发症的重要原因[23]。而重症HTGAP患者往往合并严重的组织损伤,此时PAI-1耗竭,纤溶酶大量生成[24],纤溶亢进,造成D-二聚体生成明显增多,同时广泛微血栓形成,快速消耗纤维蛋白原,造成纤维蛋白原迅速减少,而肝细胞受炎症影响受损合成纤维蛋白原的能力减弱,也是导致纤维蛋白原下降的重要原因。因此,早期DFR指数的升高提示出现D-二聚体和纤维蛋白原数值上的反向改变,预示HTGAP开始发生恶化。
DFR指数的水平升高和并发症也存在关联,这验证了其作为HTGAP早期严重程度预测指标的可靠性。脂肪酸(free fatty acids,FFA)的升高是HTGAP发生的中心环节,FFA已被证实可以诱导微血管功能障碍的发生[26],这与胰腺微循环血栓形成、胰腺出血或坏死的发生存在密切相关[25]。胰腺相邻小叶的动脉彼此无交通支吻合,这样特殊的血管基础造成微血栓一旦形成就极易造成胰腺及周围组织缺血坏死。本研究发现,HTGAP出现出血坏死型的患者DFR指数显著升高。这种变化的潜在机制可能与胰腺微循环血栓形成后的纤溶亢进有关。虽然潜在机制上不完全明确,但高甘油三酯血症患者确实存在高凝状态[27],在此基础上HTGAP诱发胰腺微血管内形成微血栓,引发缺血性坏死。当纤溶亢进时,血栓快速溶解使血管再通,但在脆弱的坏死胰腺组织中,也易引发再灌注出血[28]。笔者认为DFR的升高提示了凝血与纤溶系统的严重失衡,预示了HTGAP患者微循环血栓的形成及后续发生的胰腺出血与坏死。但目前对胰腺微血管循环的针对性基础研究很少,这种猜测仍需要进一步进行基础实验证实。
同时,本研究发现DFR指数水平的升高与ARDS、心肌损害及菌血症的发生密切相关。这或许也与炎症与血栓的协同作用相关,凝血与纤溶系统的失衡可能通过引发透明膜形成和肺泡纤维化[29]、心肌灌注受损[30]等机制,造成不良并发症的高发生。此外,凝血-炎症交互作用削弱免疫应答并造成肠道屏障功能受损,这或许可以解释菌血症的患者具有更高的DFR指数水平,但考虑本研究进行血液细菌学培养往往具有如高热等剧烈的炎症反应表现,个体较少,所以此结果可能存在选择偏移,缺少普遍性,需要进行大规模临床试验进一步验证。
本研究纳入患者入院24 h内的最差值,且避免抗凝治疗影响,排除了具有转院、外院治疗经历的部分重症患者,可能导致结果偏移。在后续研究中将进一步扩展多中心多时间点HTGAP患者队列的动态DFR指数监测,并联合多指标构建预测模型优化敏感度价值,深入探索DFR指数在HTGAP病程中的变化。
综上所述,HTGAP与其他病因的急性胰腺炎具差异有统计学意义,存在更严重的病程,发生重症胰腺炎的可能较高,需要对其进行早期诊断和病情评估。DFR指数水平对HTGAP严重程度具有一定的早期预测价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 金雯沁:研究设计、数据收集、论文撰写;赵红睿、谭文龙、梁馨元、王国华:数据收集及整理、统计学分析;袁晓宇:研究设计、论文修改
| [1] | Hong WD, Zimmer V, Basharat Z, et al. Association of total cholesterol with severe acute pancreatitis: a U-shaped relationship[J]. Clin Nutr, 2020, 39(1): 250-257. DOI:10.1016/j.clnu.2019.01.022 |
| [2] | Lankisch PG, Apte M, Banks PA. Acute pancreatitis[J]. Lancet, 2015, 386(9988): 85-96. DOI:10.1016/S0140-6736(14)60649-8 |
| [3] | 王池, 段丽芳, 许小凡, 等. 高甘油三酯血症性急性胰腺炎的发病机制研究进展[J]. 解放军医学杂志, 2022, 47(5): 500-505. DOI:10.11855/j.issn.0577-7402.2022.05.0500 |
| [4] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis: 2012:revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [5] | Hu JX, Zhao CF, Wang SL, et al. Acute pancreatitis: a review of diagnosis, severity prediction and prognosis assessment from imaging technology, scoring system and artificial intelligence[J]. World J Gastroenterol, 2023, 29(37): 5268-5291. DOI:10.3748/wjg.v29.i37.5268 |
| [6] | Yang LX, Liu J, Xing Y, et al. Comparison of BISAP, ranson, MCTSI, and APACHE Ⅱ in predicting severity and prognoses of hyperlipidemic acute pancreatitis in Chinese patients[J]. Gastroenterol Res Pract, 2016, 2016: 1834256. DOI:10.1155/2016/1834256 |
| [7] | Qiu L, Sun RQ, Jia RR, et al. Comparison of existing clinical scoring systems in predicting severity and prognoses of hyperlipidemic acute pancreatitis in Chinese patients: a retrospective study[J]. Medicine (Baltimore), 2015, 94(23): e957. DOI:10.1097/MD.0000000000000957 |
| [8] | Silva-Vaz P, Abrantes AM, Castelo-Branco M, et al. Multifactorial scores and biomarkers of prognosis of acute pancreatitis: applications to research and practice[J]. Int J Mol Sci, 2020, 21(1): 338. DOI:10.3390/ijms21010338 |
| [9] | Kucher N, Kohler HP, Dornhöfer T, et al. Accuracy of D-dimer/fibrinogen ratio to predict pulmonary embolism: a prospective diagnostic study[J]. J Thromb Haemost, 2003, 1(4): 708-713. DOI:10.1046/j.1538-7836.2003.00145.x |
| [10] | Zhao TJ, Yang QK, Tan CY, et al. Prognostic value of D-dimer/fibrinogen ratio in the adverse outcomes of patients hospitalized for heart failure[J]. Biomark Med, 2020, 14(18): 1733-1745. DOI:10.2217/bmm-2020-0553 |
| [11] | 龚川江, 刘利, 刘佳佳, 等. 全身免疫炎症指数联合外周血中性粒细胞/淋巴细胞比值、D-二聚体/纤维蛋原比值检测对急性胰腺炎患者预后评估价值[J]. 临床军医杂志, 2024, 52(3) 324-326, 330. DOI:10.16680/j.1671-3826.2024.03.29 |
| [12] | Chen L, Zhang MM, Yu LJ, et al. The role of the D-dimer to fibrinogen ratio in the classification of cardioembolism and atherosclerotic stroke[J]. J Clin Neurosci, 2024, 125: 43-50. DOI:10.1016/j.jocn.2024.05.007 |
| [13] | Li SS, Yang XW, Zheng Y, et al. Correlation between D-dimer/fibrinogen ratio and bleeding in patients with newly diagnosed acute promyelocytic leukemia[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2023, 31(5): 1340-1344. DOI:10.19746/j.cnki.issn.1009-2137.2023.05.014 |
| [14] | Zhou WD, Liu QF, Wang ZJ, et al. Analysis of the clinical profile and treatment efficiency of hyperlipidemic acute pancreatitis[J]. Lipids Health Dis, 2024, 23(1): 70. DOI:10.1186/s12944-024-02057-5 |
| [15] | Wan JH, Yang XY, He WH, et al. Serum D-dimer levels at admission for prediction of outcomes in acute pancreatitis[J]. BMC Gastroenterol, 2019, 19(1): 67. DOI:10.1186/s12876-019-0989-x |
| [16] | Xue EF, Shi Q, Guo SL, et al. Preexisting diabetes, serum calcium and D-dimer levels as predictable risk factors for pancreatic necrosis of patients with acute pancreatitis: a retrospective study[J]. Expert Rev Gastroenterol Hepatol, 2022, 16(9): 913-921. DOI:10.1080/17474124.2022.2116314 |
| [17] | 尹小勇, 董科, 杨正东, 等. 乳酸、血浆D-二聚体、纤维蛋白原联合检测对高脂血症性胰腺炎严重程度及预后评价[J]. 西部医学, 2021, 33(7) 1001-1004+1014. DOI:10.3969/j.issn.1672-3511.2021.07.013 |
| [18] | Havel RJ. Pathogenesis, differentiation and management of hypertriglyceridemia[J]. Adv Intern Med, 1969, 15: 117-154. |
| [19] | Guo YY, Li HX, Zhang Y, et al. Hypertriglyceridemia-induced acute pancreatitis: progress on disease mechanisms and treatment modalities[J]. Discov Med, 2019, 27(147): 101-109. |
| [20] | Bonetto A, Aydogdu T, Kunzevitzky N, et al. STAT3 activation in skeletal muscle links muscle wasting and the acute phase response in cancer Cachexia[J]. PLoS One, 2011, 6(7): e22538. DOI:10.1371/journal.pone.0022538 |
| [21] | Brown K, et al. Coagulopathy and Systemic Inflammation in Critical Illness: Role of D-dimer/Fibrinogen Ratio[C]. Critical Care, 2019, 23(1): 410. DOI: 10.1186/s13054-016-1208-6. |
| [22] | 饶甲环, 马煜盛, 龙洁旎, 等. 血浆D-二聚体/纤维蛋白原比值及超敏C反应蛋白在急性冠脉综合征中的临床价值[J]. 解放军医学杂志, 2018, 43(11): 943-949. DOI:10.11855/j.issn.0577-7402.2018.11.07 |
| [23] | Navina S, Acharya C, DeLany JP, et al. Lipotoxicity causes multisystem organ failure and exacerbates acute pancreatitis in obesity[J]. Sci Transl Med, 2011, 3(107): 107r. DOI:10.1126/scitranslmed.3002573 |
| [24] | Brohi K, Cohen MJ, Ganter MT, et al. Acute coagulopathy of trauma: hypoperfusion induces systemic anticoagulation and hyperfibrinolysis[J]. J Trauma, 2008, 64(5): 1211-1217. DOI:10.1097/TA.0b013e318169cd3c |
| [25] | Dominguez-Muñoz JE, Malfertheiner P, Ditschuneit HH, et al. Hyperlipidemia in acute pancreatitis[J]. Int J Pancreatol, 1991, 10(3): 261-267. DOI:10.1007/BF02924164 |
| [26] | Zhang YD, Zhao J, Ren CZ, et al. Free fatty acids induce coronary microvascular dysfunction via inhibition of the AMPK/KLF2/ENOS signaling pathway[J]. Int J Mol Med, 2023, 51(4): 34. DOI:10.3892/ijmm.2023.5237 |
| [27] | Salvagno GL, Favaloro EJ, Demonte D, et al. Influence of hypertriglyceridemia, hyperbilirubinemia and hemolysis on thrombin generation in human plasma[J]. Clin Chem Lab Med, 2019, 57(11): 1784-1789. DOI:10.1515/cclm-2019-0135 |
| [28] | Wilhelm G, Mertowska P, Mertowski S, et al. The crossroads of the coagulation system and the immune system: interactions and connections[J]. Int J Mol Sci, 2023, 24(16): 12563. DOI:10.3390/ijms241612563 |
| [29] | Medcalf RL, Keragala CB, Myles PS. Fibrinolysis and COVID-19:a plasmin paradox[J]. J Thromb Haemost, 2020, 18(9): 2118-2122. DOI:10.1111/jth.14960 |
| [30] | Sit O, Oksen D, Atici A, et al. Prognostic significance of Tp-e interval and Tp-e/QTc ratio in patients with COVID-19[J]. Eur Rev Med Pharmacol Sci, 2021, 25(8): 3272-3278. DOI:10.26355/eurrev_202104_25736 |
 2025, Vol. 34
2025, Vol. 34