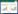2. 成都市第三人民医院急诊医学科,成都 610041;
3. 南通大学医学院,南通 226007
2. Department of Emergency Medicine, Chengdu Third People's Hospital, Chengdu, 610041 China;
3. Department of Clinical Medicine, Nantong University, Nantong 226007, China
脓毒症是危重症患者的首要死亡原因。2017年调查结果显示全球新发脓毒症病例数高达4890万,其中1100万例患者死亡,占全球死亡人数近20%[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症最常并发的器官功能障碍之一,高达1/3-2/3的脓毒症患者并发AKI,严重者需要肾脏替代治疗[2-3],显著增加了患者的住院时间以及病死率。脓毒症相关急性肾损伤(sepsis-associated acute kidney injury,SA-AKI)是指脓毒症患者发生的AKI,且没有其他重要损伤因素来解释AKI的发生[4]。目前SA-AKI中关于AKI的临床诊断仍然是基于尿量和血肌酐(serum creatinine,sCr)[5]。两者的缺点是不够敏感,诊断AKI相对滞后。因此,需要寻找新的生物标志物早期诊断SA-AKI。
分泌性白细胞蛋白酶抑制剂(SLPI)主要在黏膜上皮细胞产生的一种丝氨酸蛋白酶(如中性粒细胞弹性蛋白酶)抑制剂,具有抗细菌、抗炎症因子和凋亡因子的作用[6]。研究发现SLPI在移植后AKI患者肾活检全基因组检测中表达显著增强,并在患者尿液与血液中检测出相当水平的SLPI,表明SLPI可能是AKI潜在的生物标志物[7]。Tang等[8]对脓毒性休克患者和AKI患者的血液进行基因分析,发现SLPI是两组患者共表达基因,提示SLPI可能与SA-AKI有着较强的相关性。本实验旨在研究血清SLPI水平与SA-AKI发生的相关性,评估其在SA-AKI患者早期诊断中的价值。
1 资料与方法 1.1 研究对象 1.1.12022年10月至2023年11月入住泰州市人民医院重症医学科,入科时诊断为脓毒症/脓毒性休克的患者。
1.1.2 入选标准(1) 年龄≥18岁;(2)入院后确诊为脓毒症(满足脓毒症诊断标准)[31]。
1.1.3 排除标准(1) 妊娠期或哺乳期的妇女;(2)除脓毒症以外,其他原因所致AKI患者;(3)慢性肾功能不全患者或肾脏疾病手术后;(4)需长期接受透析的终末期肾病患者;(5)病历资料缺少或不完整者。
1.1.4本研究方案通过泰州人民医院临床研究伦理委员会批准(批件号:KY2022-190-01),所有入选患者均知情同意。
1.2 研究方法 1.2.1 样本收集经纳入排除标准筛选后入组的研究对象,于入院时留取静脉血5 mL,离心(转速:3 000 r/min,时长10 min)后,留取上层血清转置于冻存管备用,暂时存放置-80℃冰箱。
1.2.2 实验指标测定所有收集完毕后的血清标本,将被统一至南京医科大学附属泰州人民医院中心实验室进行检测,使用人分泌性白细胞蛋白酶抑制剂(SLPI)酶联免疫吸附试验(ELISA)试剂盒(上海雅吉生物科技有限公司)和人白细胞介素-18(IL-18)、人白细胞介素-10(IL-10)、人白细胞介素-6(IL-6)、人半胱氨酸蛋白酶-3(Caspase-3)以及Bcl-2的ELISA试剂盒(广州科荣生物有限公司),严格遵循试剂盒说明书流程,正确测定上述研究指标的血清浓度水平。
1.2.3 实验步骤根据购置的ELISA试剂盒说明书按依次进行SLPI、IL-18、IL-10、IL-6、Caspase-3、Bcl-2的OD值测定,绘制标准曲线好后计算出实际血清浓度水平。
1.3 统计学方法利用SPSS 26.0统计软件进行数据统计分析。计数变量应用频数(n)和百分比(%),组间分析比较使用χ2检验进行描述。正态分布的连续变量利用均数±标准差(x±s)进行表示,组间比较使用独立样本的t检验;非正态分布的连续变量利用中位数(四分位间距)进行描述,组间比较利用非参数秩和检验。使用Logistics回归模型分析SA-AKI发生的危险因素,绘制ROC曲线进一步评估血清中SLPI水平对于SA-AKI发生的早期诊断价值;使用Person相关性分析比较SLPI与IL-18、IL-10、Caspase-3、Bcl2、sCr、Lac、IL6、PCT的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料本研究最终入组脓毒症患者112例:其中SA-AKI患者64例,非SA-AKI患者48例。所有入组患者中,SA-AKI总的发生率为57.14%。对比SA-AKI组与非SA-AKI组临床基线资料(见表 1)发现,SA-AKI组尿量、Lac、PCT、IL-6、IL-18、IL-10、sCr、BUN、APACHE Ⅱ评分、SOFA评分均高于非SA-AKI,具有统计学意义(P<0.05)。血清IL-18在SA-AKI组和非SA-AKI组中入院时水平分别为:114.88±23.16 ng/L,97.03±22.06 ng/L,二者有统计学差异(P=0.005)。此外,SA-AKI组入院时IL-10(101.57±15.20 ng/L vs. 91.20±13.74 ng/L,P=0.011)、IL-6(1047.12±630.73 pg/mL vs. 542.00±336.49 pg/mL,P=0.001)水平均高于非SA-AKI组。
| 项目 | SA-AKI组 (n=64) |
非SA-AKI组 (n=48) |
t /Z/χ2值 | P值 |
| 年龄(岁) | 70.22±10.27 | 65.92±10.87 | 1.512 | 0.136 |
| 男性(n,%) | 46(71.9) | 26(54.2) | 1.873 | 0.171 |
| 高血压(n,%) | 20(31.3) | 18(37.5) | 0.239 | 0.625 |
| 糖尿病(n,%) | 22(34.4) | 14(29.2) | 0.171 | 0.68 |
| 冠心病(n,%) | 18(28.1) | 10(20.8) | 0.389 | 0.533 |
| 脓毒性休克(n,%) | 38(59.4) | 24(50.0) | 0.488 | 0.485 |
| 感染来源 | ||||
| 呼吸系统(n,%) | 28(43.8) | 32(66.7) | 2.896 | 0.089 |
| 消化系统(n,%) | 28(43.8) | 10(20.8) | 3.213 | 0.073 |
| 皮肤软组织(n,%) | 6(9.4) | 4(8.3) | 0.018 | 0.892 |
| 泌尿系统(n,%) | 2(3.1) | 2(4.2) | 0.043 | 0.835 |
| BMI(kg/m2) | 21.29±2.53 | 20.26±3.14 | 1.37 | 0.176 |
| MAP(mmHg) | 64.09±9.59 | 66.80±8.17 | -1.110 | 0.272 |
| 尿量(ml·kg-1·h-1) | 0.54±0.20 | 0.64±0.22 | -2.51 | 0.013 |
| 血管活性药物(n,%) | 50(78.1) | 32(66.7) | 0.918 | 0.328 |
| 机械通气(n,%) | 38(59.4) | 18(37.5) | 2.625 | 0.105 |
| GCS评分(分) | 10(7) | 10.5(2) | -1.162 | 0.245 |
| APACHEII评分(分) | 23.28±5.82 | 18.75±4.54 | 3.16 | 0.003 |
| SOFA评分(分) | 10(4) | 7(3) | -3.936 | 0.001 |
| ICU住院天数(d) | 8.5(11) | 12(13) | -1.117 | 0.242 |
| 动脉血PH | 7.33(0.12) | 7.35(0.11) | -0.913 | 0.361 |
| Lac(mmol/L) | 4.0(3.1) | 2.5(1.5) | -2.634 | 0.008 |
| WBC(109/L) | 18.66±3.90 | 16.99±3.26 | 1.697 | 0.095 |
| CRP(mg/L) | 193.84±59.92 | 168.86±29.74 | 1.873 | 0.066 |
| PCT(ug/mL) | 26.32(15.71) | 14.18(10.28) | -3.328 | 0.001 |
| sCr(μmol/l) | 82.92±10.27 | 75.94±13.05 | 2.238 | 0.029 |
| BUN(mmol/L) | 6.30±0.69 | 5.86±0.80 | 2.18 | 0.034 |
| IL-6(pg/mL) | 1047.12±630.73 | 542.00±336.49 | 3.357 | 0.001 |
| IL-18(ng/L) | 114.88±23.16 | 97.03±22.06 | 2.911 | 0.005 |
| IL-10(ng/L) | 101.57±15.20 | 91.20±13.74 | 2.63 | 0.011 |
| Caspase-3(pmol/L) | 56.72±11.85 | 49.67±11.96 | 3.103 | 0.003 |
| 注:BMI,体重指数;MAP,平均动脉压;GCS,格拉斯哥昏迷评分;APACHE Ⅱ,急性生理学与慢性健康评分;SOFA,序贯器官衰竭评分,Lac,乳酸;WBC,白细胞计数;CRP,C-反应蛋白;PCT,降钙素原;sCr,血肌酐;BUN,尿素氮;IL-6,白细胞介素6;IL-18,白细胞介素18;IL-10,白细胞介素10;SLPI,分泌性白细胞蛋白酶抑制剂 | ||||
入组时SA-AKI组与非SA-AKI组基线资料和实验结果有差异的变量纳入回归分析。入院时SLPI、IL-18、IL-IL-6、Caspase-3、PCT、sCr、BUN、APACHEⅡ评分、SOFA评分在两组间差异有统计学意义(P<0.05)。
上述结果纳入二元Logistics回归分析显示(见表 2),SLPI和IL-18是SA-AKI发生的独立危险因素,SLPI(OR=1.109,95%CI: 1.016-1.210,P=0.02)和IL-18(OR=1.078,95%CI: 1.007-1.154,P=0.031)血清水平越高,SA-AKI发生的可能性越大。而IL-10、PCT、IL-6、APACHEⅡ评分、SOFA评分、sCr、BUN可能与SA-AKI相关,能够一定程度上预测AKI的发生,但在多因素回归分析中差异无统计学意义(P>0.05),不是SA-AKI的独立危险因素。
| 变量 | 单因素分析 | 多因素分析 | |||||
| OR | 95%(CI) | P值 | OR | 95%(CI) | P值 | ||
| 尿量 | 1.043 | 1.004-1.102 | 0.036 | 1.028 | 0.935-1.142 | 0.503 | |
| SLPI | 1.038 | 1.017-1.06 | <0.001 | 1.109 | 1.016-1.21 | 0.020 | |
| IL-18 | 1.036 | 1.009-1.064 | 0.009 | 1.078 | 1.007-1.154 | 0.031 | |
| IL-10 | 1.051 | 1.009-1.096 | 0.017 | 0.999 | 0.92-1.084 | 0.977 | |
| Caspase-3 | 1.052 | 1.003-1.104 | 0.039 | 1.034 | 0.931-1.149 | 0.529 | |
| sCr | 1.055 | 1.004-1.108 | 0.035 | 0.863 | 0.736-1.011 | 0.069 | |
| BUN | 2.229 | 1.041-4.774 | 0.039 | 1.592 | 0.358-7.082 | 0.541 | |
| PCT | 1.076 | 1.019-1.136 | 0.008 | 1.015 | 0.938-1.097 | 0.715 | |
| IL-6 | 1.002 | 1.001-1.004 | 0.004 | 1.005 | 0.999-1.011 | 0.109 | |
| SOFA评分 | 1.647 | 1.206-2.25 | 0.002 | 1.705 | 0.931-3.123 | 0.084 | |
| APACHEⅡ评分 | 1.196 | 1.053-1.357 | 0.006 | 1.260 | 0.969-1.638 | 0.084 | |
根据所有入组患者SLPI、IL-18、sCr、BUN的血清浓度水平绘制ROC曲线,评估对SA-AKI的早期诊断价值,并计算曲线下面积(AUC)。结果显示:SLPI、IL-18有着较高的早期诊断价值。SLPI的AUC最大(0.819),IL-18也具有较大的AUC(0.724),而sCr(0.669)和BUN(0.656)较小。其中,SLPI的Cut-Off为161.72,敏感度为76.7%,特异度为79.2%;IL-18的Cut-Off为104.66,敏感度为71.9%,特异度为70.8%,对于SA-AKI有着较大的早期诊断效能。而sCr和BUN的AUC、敏感度与特异度均低于SLPI和IL-18(见表 3、图 1)。
| 变量 | Cut-off | Se(%) | Sp(%) | AUC | P | 95%CI |
| SLPI | 161.72 | 0.767 | 0.792 | 0.819 | < 0.001 | 0.708-0.930 |
| IL-18 | 104.66 | 0.719 | 0.708 | 0.724 | 0.004 | 0.589-0.859 |
| sCr | 71.25 | 0.938 | 0.417 | 0.669 | 0.031 | 0.521-0.818 |
| BUN | 6.22 | 0.594 | 0.708 | 0.656 | 0.048 | 0.509-0.802 |
| 注:Cut-off,截断值;Se,敏感度;Sp,特异度;AUC,受试者工作特征曲线下面积;95%CI,95%可信区间 | ||||||
|
| 图 1 SLPI、IL-18、sCr、BUN预测SA-AKI发生的Roc曲线 Fig 1 ROC curves for predicting SA-AKI with SLPI, IL-18, sCr and BUN |
|
|
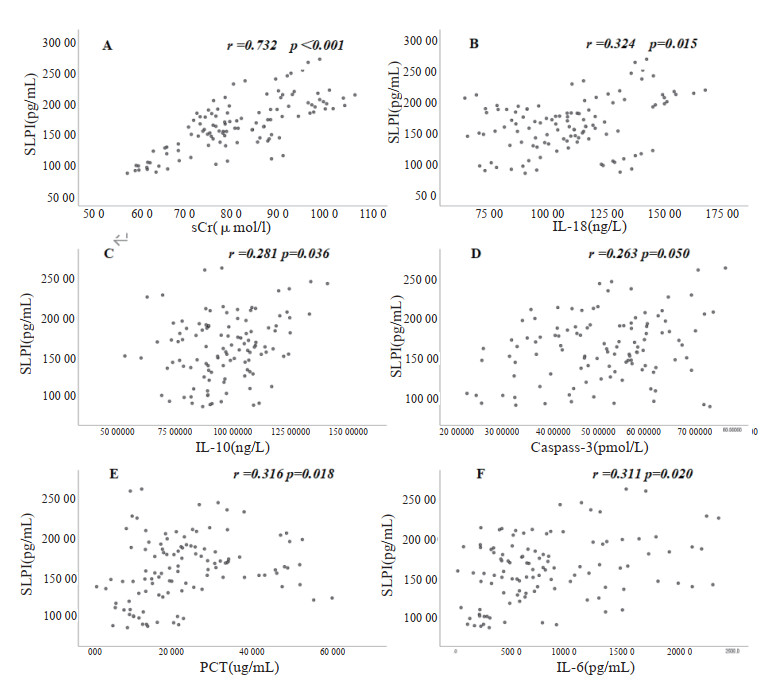
运用Person分析比较SLPI与IL-18、IL-10、Caspase-3、Bcl-2、sCr、BUN、Lac、PCT、IL-6的相关性。相关性分析结果显示(见表6、图 2):入院时的SLPI与IL-18、IL-10、Caspase-3、sCr、PCT、IL-6有着明显相关性(P<0.05),其中SLPI与sCr(r=0.732,P<0.001)有着较强的相关性(见图 2A)。而与Bcl-2、BUN则无明显相关(P>0.05)。
| 变量 | SLPI | |
| r值 | P值 | |
| IL-18 | 0.324 | 0.015 |
| IL-10 | 0.281 | 0.036 |
| Caspase-3 | 0.263 | 0.050 |
| Bcl-2 | 0.198 | 0.144 |
| sCr | 0.732 | <0.001 |
| BUN | 0.245 | 0.068 |
| PCT | 0.316 | 0.018 |
| IL-6 | 0.311 | 0.020 |
| Lac | 0.222 | 0.100 |
|
| 图 2 SLPI与IL-18、IL-10、Caspase-3、sCr、PCT、IL-6的相关性 Fig 2 correlation between SLPI and IL-18, IL-10, Caspase-3, sCr, PCT, IL-6 |
|
|
脓毒症/脓毒性休克是一种高病死率的临床综合征,伴有AKI的脓毒症病死率更是居高不下。SA-AKI的早期诊断、早期治疗对降低病死率起着至关重要的作用。近年来关于AKI生物标志物的成为研究热点,SLPI作为心脏大血管术后发生AKI早期诊断的新型生物标志物已经得到证实[10-11],但是在SA-AKI中的临床研究却鲜有开展。本研究旨在探讨血清SLPI水平SA-AKI发生的相关性,并评估其早期诊断价值。
本研究中,SA-AKI组与非SA-AKI组入院时的SLPI浓度水平均明显高于健康对照组(P<0.05),表明SLPI可在脓毒症患者血清中升高。Grobmyer等[12]的实验显示,与接受重大外科手术的非脓毒败血症患者以及健康志愿者相较,脓毒症患者的血清SLPI升高。同时Lange等[13]的实验也证实了血培养阳性的脓毒症患者SLPI浓度高于非血流感染患者,且脓毒症患者的SLPI浓度与sCr浓度、SOFA评分呈正相关。一项来自德国的前瞻性观察性研究发现[10],心脏大血管术后发生AKI的患者中,术后12 h的SLPI水平显著升高,ROC曲线显示对AKI的早期诊断具有良好的诊断效能(AUC=0.838,敏感度76.47%,特异度87.5%),显示SLPI可作为心脏大血管术后AKI早期诊断的生物标志物。本研究发现SA-AKI组入院时血清SLPI浓度显著高于非SA-AKI组患者[(181.18±35.85)pg/mL) vs. (135.83±34.12) pg/mL],P<0.001],提示SLPI可用于SA-AKI的早期诊断。回归分析显示,SLPI是SA-AKI发生的独立危险因素:SLPI(OR=1.109,95%CI: 1.016~1.210,P=0.02),ROC曲线的结果显示,当SLPI > 161.72 pg/mL时,诊断SA-AKI具有较好的敏感度(76.7%)和特异度(79.2%)。
白细胞介素-1超家族成员之一的IL-18,在缺血-再灌注损伤时,可以通过NF-κB信号通路诱导大量炎症介质的上调,从而导致急性肾脏损伤[14]。一项Meta分析尿液中IL-18是一种相对较好的生物标志物,对AKI具有中等预测价值,在儿科患者中预测价值更高[15]。Guerrieri等[16]的研究中提及:在应激作用下,肾小管细胞会急性释放IL-18,IL-18募集并激活中性粒细胞,中性粒细胞通过脱颗粒破坏肾组织,释放弹性蛋白酶。而SLPI可以通过其抗蛋白酶活性抑制蛋白酶,减缓了对肾小管细胞的进一步损伤。由此可见,SLPI与IL-18一定程度上参与了肾脏损伤的发生,二者可能具有相关性。本研究中血清IL-18在SA-AKI组和非SA-AKI组的入院时水平差异有统计学意义[(14.88±23.16) ng/L vs. (97.03±22.06)ng/L, P=0.005],回归分析显示IL-18也是SA-AKI发生的独立危险因素。Liu等[17]的研究发现血清IL-18水平在心脏术后有无AKI的患者组间没有差异,与本研究结论不一致,考虑系纳入的研究人群不同所致。由于IL-18对于SA-AKI中等诊断价值,但有研究提出将IL-18与新的生物标志物(如SLPI)联合评估,可能会进一步提高肾脏功能评估的准确性[18]。
除了IL-18,本研究还发现与健康对照组相比,脓毒症患者的血清IL-6和IL-10水平显著升高。SA-AKI和非SA-AKI组中IL-6、IL-10浓度也有差异(P<0.05),说明IL-6、IL-10对于SA-AKI的有一定的识别价值,然而在危险因素分析时发现IL-6和IL-10不是SA-AKI发生的独立危险因素(P>0.05)。IL-6是促炎因子,脓毒症时可加重肾损伤,而IL-10是抗炎因子,可以抑制IL-6,起到减轻肾脏炎症和抑制细胞凋亡的作用[19]。研究发现,在确诊AKI的患者中,血清IL-6、IL-18、和IL-10水平均显著升高,与死亡风险增加有关[20-21]。Greenberg等[22]心脏术后患者中,发现IL-6和IL-10可作为患儿术后的急性肾损伤生物标志物。Zhang等[23]也在成人中有类似的发现,IL-6和IL-10可预测成人心脏术后AKI发生和病死率。
本研究发现SLPI与IL-18、sCr有着较好的相关性(P<0.05)。既往脓毒症的观察性研究发现[13],最大SLPI浓度与最大sCr浓度呈正相关,这与我们的结果不谋而合,而且在本实验队列中,SLPI与sCr(r=0.732,P<0.001)相关性较为强烈。目前sCr因为其特异度较强,仍然是作为AKI诊断的金指标。sCr检测手段简单、易获取、费用低,在临床肾脏疾病的诊治中已被广泛应用。本研究中SLPI在肾脏发生损伤早期会上升,提示SLPI具有较好的早期诊断价值。此外本研究还发现SLPI与细胞因子IL-18(r=0.324,P=0.015)有着较强的相关性。IL-18与SLPI在肾脏中均有表达,肾脏损伤时肾小管细胞释放IL-18,IL-18可以募集中性粒细胞从而释放相关蛋白酶,而SLPI可通过抑制蛋白酶活性,发挥对肾脏的保护作用[16],两者共同参与了AKI发生发展的过程。
本研究存在一定的局限性:①未能与已被证实具有良好诊断效能的AKI相关生物标志物的对比,例如:尿NGAL、[TIMP-2]·[IGFBP-7]等,对于SLPI的临床预测价值缺少对比研究;②本研究是单中心、观察性研究,样本量少,由于临床个体差异,可能存在偏倚,需要更多更大的实验队列来进一步验证和解释。研究结果需要大样本量的多中心临床研究来验证。
作者贡献 侯斌、吴德章:设计研究方案,实施研究过程,论文撰写;揭红英、李天昊:设计研究思路,论文审核;徐晓雨、杨方园:文献查阅,数据分析;濮雪华:研究设计,论文修改
利益冲突 所有作者声明无利益冲突
| [1] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [2] | Jacobi J. The pathophysiology of sepsis - 2021 update: part 2, organ dysfunction and assessment[J]. Am J Health Syst Pharm, 2022, 79(6): 424-436. DOI:10.1093/ajhp/zxab393 |
| [3] | 王跃胜, 周晓莎, 陈剑平, 等. 脓毒症伴急性肾损伤患者48 h内有创通气风险的预测模型的建立与验证[J]. 中华急诊医学杂志, 2024, 33(4): 549-557. DOI:10.3760/cma.j.issn.1671-0282.2024.04.016 |
| [4] | Manrique-Caballero CL, Del Rio-Pertuz G, Gomez H. Sepsis-associated acute kidney injury[J]. Crit Care Clin, 2021, 37(2): 279-301. DOI:10.1016/j.ccc.2020.11.010 |
| [5] | Pais T, Jorge S, Lopes JA. Acute kidney injury in sepsis[J]. Int J Mol Sci, 2024, 25(11): 5924. DOI:10.3390/ijms25115924 |
| [6] | Nugteren S, Samsom JN. Secretory leukocyte protease inhibitor (SLPI) in mucosal tissues: protects against inflammation, but promotes cancer[J]. Cytokine Growth Factor Rev, 2021, 59: 22-35. DOI:10.1016/j.cytogfr.2021.01.005 |
| [7] | Wilflingseder J, Sunzenauer J, Toronyi E, et al. Molecular pathogenesis of post-transplant acute kidney injury: assessment of whole-genome mRNA and miRNA profiles[J]. PLoS One, 2014, 9(8): e104164. DOI:10.1371/journal.pone.0104164 |
| [8] | Tang Y, Yang XB, Shu HQ, et al. Bioinformatic analysis identifies potential biomarkers and therapeutic targets of septic-shock-associated acute kidney injury[J]. Hereditas, 2021, 158(1): 13. DOI:10.1186/s41065-021-00176-y |
| [9] | 曹钰, 柴艳芬, 邓颖, 等. 中国脓毒症/脓毒性休克急诊治疗指南(2018)[J]. 临床急诊杂志, 2018, 19(09): 567-588. DOI: CNKI:SUN:ZZLC.0.2018-09-001. |
| [10] | Averdunk L, Fitzner C, Levkovich T, et al. Secretory leukocyte protease inhibitor (SLPI)-a novel predictive biomarker of acute kidney injury after cardiac surgery: a prospective observational study[J]. J Clin Med, 2019, 8(11): E1931. DOI:10.3390/jcm8111931 |
| [11] | Averdunk L, Rückbeil MV, Zarbock A, et al. SLPI - a biomarker of acute kidney injury after open and endovascular thoracoabdominal aortic aneurysm (TAAA) repair[J]. Sci Rep, 2020, 10(1): 3453. DOI:10.1038/s41598-020-60482-9 |
| [12] | Grobmyer SR, Barie PS, Nathan CF, et al. Secretory leukocyte protease inhibitor, an inhibitor of neutrophil activation, is elevated in serum in human sepsis and experimental endotoxemia[J]. Crit Care Med, 2000, 28(5): 1276-1282. DOI:10.1097/00003246-200005000-00003 |
| [13] | Lange AN, Cajander S, Magnuson A, et al. Plasma concentrations of secretory leukocyte protease inhibitor (SLPI) differ depending on etiology and severity in community-onset bloodstream infection[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(8): 1425-1434. DOI:10.1007/s10096-019-03567-2 |
| [14] | Wu H, Craft ML, Wang P, et al. IL-18 contributes to renal damage after ischemia-reperfusion[J]. J Am Soc Nephrol, 2008, 19(12): 2331-2341. DOI:10.1681/asn.2008020170 |
| [15] | Qin Z, Li H, Jiao P, et al. The value of urinary interleukin-18 in predicting acute kidney injury: a systematic review and meta-analysis[J]. Ren Fail, 2022, 44(1): 1717-1731. DOI:10.1080/0886022x.2022.2133728 |
| [16] | Guerrieri D, Ambrosi NG, Romeo H, et al. Secretory leukocyte proteinase inhibitor protects acute kidney injury through immune and non-immune pathways[J]. Shock, 2021, 56(6): 1019-1027. DOI:10.1097/SHK.0000000000001785 |
| [17] | Liu KD, Siew ED, Reeves WB, et al. Storage time and urine biomarker levels in the ASSESS-AKI study[J]. PLoS One, 2016, 11(10): e0164832. DOI:10.1371/journal.pone.0164832 |
| [18] | Camper N, Glasgow AMA, Osbourn M, et al. A secretory leukocyte protease inhibitor variant with improved activity against lung infection[J]. Mucosal Immunol, 2016, 9(3): 669-676. DOI:10.1038/mi.2015.90 |
| [19] | Feng MC, Sun TT, Zhao YX, et al. Detection of serum interleukin-6/10/18 levels in sepsis and its clinical significance[J]. J Clin Lab Anal, 2016, 30(6): 1037-1043. DOI:10.1002/jcla.21977 |
| [20] | Simmons EM, Himmelfarb J, Tugrul Sezer M, et al. Plasma cytokine levels predict mortality in patients with acute renal failure[J]. Kidney Int, 2004, 65(4): 1357-1365. DOI:10.1111/j.1523-1755.2004.00512.x |
| [21] | 樊恒, 孙敏, 朱建华. SENP2调控NLRP3炎症小体活化对脓毒症小鼠急性肾损伤中的保护作用[J]. 中华急诊医学杂志, 2025, 34(2): 187-192. DOI:10.3760/cma.j.issn.1671-0282.2025.02.009 |
| [22] | Greenberg JH, Whitlock R, Zhang WR, et al. Interleukin-6 and interleukin-10 as acute kidney injury biomarkers in pediatric cardiac surgery[J]. Pediatr Nephrol, 2015, 30(9): 1519-1527. DOI:10.1007/s00467-015-3088-4 |
| [23] | Zhang WR, Garg AX, Coca SG, et al. Plasma IL-6 and IL-10 concentrations predict AKI and long-term mortality in adults after cardiac surgery[J]. J Am Soc Nephrol, 2015, 26(12): 3123-3132. DOI:10.1681/ASN.2014080764 |
 2025, Vol. 34
2025, Vol. 34