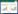2. 南京医科大学连云港临床医学院急诊医学科,连云港 222000;
3. 徐州医科大学附属连云港医院超声科,连云港 222000;
4. 连云港市第一人民医院灌南院区超声科,连云港 222000
2. Department of Emergency Medicine, Lianyungang Clinical Medical College, Nanjing Medical University, Lianyungang 222000, China;
3. Department of Ultrasound, Affiliated Lianyungang Hospital of Xuzhou Medical University, Lianyungang 222000, China;
4. Department of Ultrasound, Guannan Campus of Lianyungang First People's Hospital, Lianyungang 222000, China
SCM为一种可逆性的急性心功能障碍综合征,这种综合征的特点在于其急性发作,且心功能的损害并非由心肌缺血直接导致,而是在脓毒症的背景下出现,并具备潜在的恢复能力,其病死率可高达70%~90%。脓毒症心肌病这一概念最早由Parker[1]于1984年提出,其核心病理生理学改变表现为LVEF降低及舒张末期容积增加。然而,当前关于SCM的诊断标准,尚缺乏统一的指南或专家共识。许多学者普遍认同Martin等[2]在2019年于《Chest》杂志上发表的研究,其中提出的SCM主要特征如下:首先需排除由于冠脉缺血等急性心功能障碍或既往心功能不全等慢性病史,即发生在脓毒症的基础上,并且需满足以下至少一项或多项要求:①左心室出现扩张表现,而充盈压处于正常区间或呈偏低水平;②心肌收缩功能呈降低趋势;③右心室舒张功能受损或左心室[收缩和(或)舒张]功能异常,并伴有容量反应性降低。鉴于当前关于SCM的诊断标准主要依赖于左室收缩功能指标(如LVEF、GLS),因此早期评估左心室收缩功能障碍对SCM的诊断具有重大意义。有研究表明[3-4],临床上目前常用的左心室射血分数及应变参数等评价左心室收缩功能的指标均会收到负荷的影响,导致评估的准确性变低。无创MW超声显像技术[5-6]是近年来新兴的一种评估心肌收缩功能的技术,该技术通过结合左心室的GLS和左心室压力,进而得出压力-应变环(pressure-strain loop, PSL),这能有效排除负荷的干扰,据此获得更加可靠的评估依据。有前瞻性的多中心研究[7]已深入验证,左室MW的各项参数与心肌收缩功能、心肌应变参数之间,均展现出了显著的关联性。这一结论在Galli等[8]的研究中亦得到了有力的支持。然而,无创MW目前大部分是关于心肌梗死[9]、脓毒症休克[10]、糖尿病[11]等疾病的研究,国内外缺少无创心肌做功在脓毒症心肌病方面的研究。因此,本研究旨在探索无创心肌做功评估及诊断脓毒症心肌病患者早期左室收缩功能障碍的临床价值。
1 资料与方法 1.1 研究对象本研究为前瞻性观察性队列研究,选取了2024年9月至2025年5月在连云港市第一人民医院EICU住院的脓毒症患者为研究对象。纳入标准:(1)诊断符合脓毒症3.0最新定义及诊断标准[12];(2)既往无冠心病、心力衰竭、心律失常等心血管疾病史,且未接受过心脏手术;(3)入院24 h内行超声检查,且图像质量达标;(4)年龄≥18岁;排除标准:(1)不符合脓毒症3.0诊断标准;(2)妊娠期、哺乳期患者;(3)中途转院,试验无法进行或资料不全者;(4)年龄<18岁。
1.2 伦理学本研究遵循医学伦理学的规范性原则,并获得连云港市第一人民医院伦理委员的审批,已获所有参与者知情同意。审批号:KY-20220809001-01.F01。
1.3 研究分组2015年欧美两大权威影像学组织——欧洲心血管影像协会(EACVI)和美国超声心动图学会(ASE)联合发布的相关文献[13]表明,随着超声技术的显著进步(如三维超声、斑点追踪应变技术)和临床实践需求,GLS已被纳入左心室收缩功能的评估体系,正常值为-20%左右,绝对值越大表明心功能越好,其对早期心肌功能障碍的敏感度显著高于LVEF。Boissier等[14]在对脓毒症患者进行的一项队列研究中发现,左心室GLS异常率显著高于LVEF(70% vs. 32%,P < 0.001),且在LVEF保留亚组中仍检测到58%的GLS下降。目前针对GLS诊断脓毒症心肌病的阈值尚未统一,有文献指出[15],GLS≥-15% 对脓毒症心肌功能障碍的诊断敏感度为72%,特异度为68%。有研究在530例冠心病患者中随访7.5年发现,GLS>-15%的患者事件发生率比GLS<-15%高2.3倍(HR=2.3, 95%CI: 1.6~3.4)[16]。且有关于SCM的最新综述指出[17],GLS可检测心肌纤维的变形能力,能比LVEF更早、更敏感地检测出亚临床心肌功能障碍,并且提出GLS>-15%是脓毒症心肌病患者不良预后的独立预测因子,其价值优于LVEF。因此结合既往文献[18-19],本研究以GLS≥-15%界定脓毒症心肌病组(研究组),GLS<-15%为脓毒症非心肌病组(对照组)。
1.4 仪器与图像采集 1.4.1 仪器研究中所采用的检测设备是GE Vivid E95心血管超声系统(配备M5S宽频相控阵探头,1.5-4.5MHz自适应变频),图像数据均通过EchoPAC 204工作站完成离线处理与分析。
1.4.2 图像采集所有受试者于入院24 h内完成标准化经胸超声心动图评估,数据采集时同步完成心电图设备的连接,优化声窗参数(宽度、增益、深度及角度等),使超声图像能够清楚呈现心肌内外膜的边界结构,二维图像采集速率维持于(57±8)帧/s。左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)及LVEF的具体测量流程遵循经改良的双平面Simpson测量方法;在超声检查过程中同步获取心尖四腔心、三腔心及两腔心切面的二维动态影像(均包含≥3个连续心动周期),并导入系统后进行分析。
1.4.3 图像分析首先将受检者超声心动图数据载入EchoPAC 204影像分析平台,通过工作站操作界面激活心肌自动功能成像(automated function imaging,AFI)定量分析模块,系统可自动识别上述3个切面动态图像,并筛选出图像质量最优的心动周期以追踪心肌运动轨迹,若追踪过程中出现偏差,操作人员可调整感兴趣区域的位置与尺寸,从而确保整个心动周期内斑点信号追踪效果达到最佳。完成心尖三腔心切面的追踪后,需分析并确认主动脉瓣关闭时间,再按顺序对其余切面进行分析,最终,系统自动生成17节段牛眼图,并根据各节段收缩期纵向应变峰值加权平均值,通过数据分析处理最终获取GLS指标。进入Myocardiac Work分析模式,输入血压后点击“Advanced”后获取LV-PSL(left ventricular-pressure strain loop)和心肌做功参数,当点击牛眼图中任一单个节段时,系统会显示该节段对应的LV-PSL数值。本研究中,针对所有受检者的超声图像采集,均由具备规范化培训资质的超声医师执行;而图像分析工作则统一由不了解患者资料的超声医师完成。所有参数均重复测量3次取平均值。
1.5 资料收集与统计学方法 1.5.1 资料收集一般临床资料收集:收集患者的年龄、性别、身高、体重、体重指数(body mass index,BMI)、呼吸频率(respiratory rate,RR)、体温(temperature,T)、心率(heart rate,HR)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、血液酸碱度(blood pH,血PH)、降钙素原(procalcitonin,PCT)、血乳酸(blood lactate,血Lac)、高敏肌钙蛋白I(high-sensitivity cardiac troponin I,Hs-cTnI)、脑钠肽(b-type natriuretic peptide,BNP)、肌酐、胆红素、序贯器官衰竭评分(sequential organ failure assessment,SOFA评分)等。
常规超声心动图资料收集:入院24 h内行经胸超声心动图检查,记录的参数包括:LAAD(left atrial anterior-posterior diameter,左心房前后径)、LVIDd(left ventricular internal dimension at end-diastole,左心室舒张末期内径)、LVIDs(left ventricular internal dimension at end-systole,左心室收缩末期内径)、IVSd(interventricular septal thickness at diastole,室间隔舒张期厚度)、LVPWd(left ventricular posterior wall thickness at diastole,左心室后壁舒张期厚度)、LVEDV、LVESV、LVEF、SV(stroke volume,每搏输出量)、CO(cardiac output,心输出量)、VTI(velocity time integral,速度时间积分)、PASP(pulmonary artery systolic pressure,肺动脉收缩压)。
斑点追踪超声心动图资料收集:入院24 h内行斑点追踪超声心动图检查,纳入的有:(1)GWI:定义为心肌在二尖瓣关闭至开放时段内所完成的总做功量,即LV-PSL所围成的面积;(2)GCW:指心肌在收缩期产生缩短并于等容舒张期出现延长时所完成的做功,此类做功对左室射血过程具有促进作用;(3)GWW:指心肌在收缩期呈现延长状态且于等容舒张期出现缩短现象时所产生的做功,该类做功会对左室射血功能形成不利影响;(4)GWE:反映单个心动周期中的做功效率情况;(5)GLS:左心室整体心肌在长轴方向(心尖至基底)收缩时的相对缩短率;(6)PSD(peak strain delay,峰值应变延迟):评估心肌机械或电活动的同步性。
1.5.2 统计学方法采集数据借助SPSS 26.0统计学软件进行分析:计量资料的正态分布特征通过Kolmogorov-Smirnov检验进行评估。当数据呈现正态分布特征时,其描述方式为均数±标准差(x±s);当方差呈现齐性时,组间差异分析使用独立样本t检验方法进行统计学比较;方差不齐时,组间差异分析改用Welch法进行方差分析。对于偏态分布的计量资料,其统计描述采用中位数(四分位数间距)表示,记为[M(Q1,Q3)],组间差异分析则运用非参数Mann - Whitney U检验。计数资料的统计描述采用例数与百分比结合的方式呈现,组间差异分析则应用χ2检验方法。若P < 0.05,则判定组间差异存在统计学意义。计量资料的相关性分析,采用Pearson相关性分析方法探讨心肌做功参数与LVEF、GLS的相关性,以P < 0.05作为差异具备统计学意义的判定标准。通过绘制受试者工作特征曲线分析心肌做功参数对脓毒症心肌病患者的诊断价值。
1.5.3 样本量估算本研究使用G*power3.1软件计算研究所需样本量,根据预实验结果,效应量设置为0.79,α设置为0.05,计算结果表明,为了达到0.95的统计检验力,研究至少需要84个样本量。
2 结果 2.1 两组患者一般临床资料比较2024年9月至2025年5月共收集脓毒症患者84例。根据分组标准将所有入组患者分为研究组(n = 42)和对照组(n = 42)。与对照组相比,研究组HR、Hs-cTnI明显升高(P均<0.05,表 1);研究组与对照组在年龄、性别、身高、体重、BMI、RR、T、SBP、DBP、PCT、血pH、PCT、血Lac、BNP、肌酐、胆红素、SOFA评分差异无统计学意义(均P>0.05,表 1)。
| 指标 | 研究组(n=42) | 对照组(n=42) | t/F/χ2/z | P值 |
| 年龄[岁, M(Q1, Q3)] | 68.00(55.8, 73.3) | 67.00(54.0, 77.0) | -0.322 | 0.747 |
| 男性[例(%)] | 21(50.00) | 27(64.29) | 1.75 | 0.186 |
| 身高[cm, M(Q1, Q3)] | 168.00(160.0, 175.3) | 170.00(163.0, 175.5) | -0.601 | 0.548 |
| 体重[kg, M(Q1, Q3)] | 69.00(60.0, 70.0) | 65.00(59.0, 73.5) | -0.794 | 0.427 |
| BMI(kg/m2, x±s) | 23.77±2.18 | 23.08±2.56 | 1.329 | 0.188 |
| RR[次/min, M(Q1, Q3)] | 20.50(16.0, 27.0) | 18.00(15.0, 23.0) | -1.372 | 0.17 |
| T[℃, M(Q1, Q3)] | 36.70(36.4, 37.3) | 36.75(36.2, 37.6) | -0.143 | 0.886 |
| HR(bpm, x±s) | 101.81±20.76 | 92.19±18.71 | 2.231 | 0.028a |
| SBP[mmHg, M(Q1, Q3)] | 124.00(112.8, 132.8) | 122.50(113.0, 133.3) | -0.027 | 0.979 |
| DBP(mmHg, x±s) | 68.07±12.56 | 65.31±8.37 | 1.406 | 0.240 |
| 血pH[M(Q1, Q3)] | 7.39(7.3, 7.4) | 7.42(7.3, 7.5) | -0.672 | 0.502 |
| PCT[ng/mL, M(Q1, Q3)] | 13.92(4.3, 28.5) | 3.67(1.0, 27.6) | -1.691 | 0.091 |
| 血Lac[mmol/L, M(Q1, Q3)] | 2.82(1.9, 5.2) | 2.25(1.7, 3.6) | -1.884 | 0.060 |
| Hs-TnⅠ[pg/mL, M(Q1, Q3)] | 219.90(56.1, 1494.8) | 49.30(19.1, 268.5) | -2.594 | 0.009b |
| BNP[pg/mL, M(Q1, Q3)] | 1508.00(615.2, 3758.6) | 640.00(189.1, 3063.2) | -1.837 | 0.066 |
| 肌酐[umol/L, M(Q1, Q3)] | 112.00(80.0, 198.7) | 95.50(53.8, 202.9) | -1.082 | 0.279 |
| 胆红素[umol/L, M(Q1, Q3)] | 21.00(13.9, 37.4) | 24.70(10.7, 40.5) | -0.031 | 0.975 |
| SOFA评分(x±s) | 13.14±3.30 | 12.45±3.74 | 0.897 | 0.372 |
| 注:BMI为体重指数、RR为呼吸频率、T为体温、HR为心率、SBP为收缩压、DBP为舒张压、血PH为血液酸碱度、PCT为降钙素原、血Lac为血乳酸、Hs-cTnⅠ为高敏肌钙蛋白I、BNP为脑钠肽,SOFA评分为序贯器官衰竭评分。aP < 0.05,bP < 0.01 | ||||
两组患者LVIDs、LVEF、SV、CO、VTI差异均有统计学意义(P均<0.05,表 2),两组间其余参数的比较均差异无统计学意义(P均>0.05,表 2)。
| 指标 | 研究组(n=42) | 对照组(n=42) | t/z | P值 |
| LAAD[mm, M(Q1, Q3)] | 41.00(37.0, 44.0) | 40.50(36.0, 42.3) | -0.885 | 0.376 |
| LVIDd[mm, M(Q1, Q3)] | 50.00(47.0, 53.3) | 50.00(45.0, 52.0) | -0.956 | 0.339 |
| LVIDs[mm, M(Q1, Q3)] | 29.50(25.0, 35.3) | 26.00(23.0, 30.3) | -2.376 | 0.017a |
| IVSd[mm, M(Q1, Q3)] | 9.00(9.0, 10.0) | 9.00(8.0, 10.0) | -0.458 | 0.647 |
| LVPWd[mm, M(Q1, Q3)] | 9.00(9.0, 10.0) | 9.00(8.0, 10.0) | -0.45 | 0.653 |
| LVEDV[ml, M(Q1, Q3)] | 78.50(60.5, 96.3) | 82.50(64.0, 100.3) | -0.796 | 0.426 |
| LVESV[ml, M(Q1, Q3)] | 35.00(28.0, 55.3) | 32.50(25.8, 39.0) | -1.822 | 0.069 |
| LVEF[%, M(Q1, Q3)] | 50.50(37.8, 58.0) | 61.00(58.0, 64.0) | -5.786 | < 0.001b |
| SV(mL, x±s) | 37.12±12.01 | 50.10±16.08 | -4.191 | < 0.001b |
| CO(L/min, x±s) | 3.82±1.60 | 4.49±1.48 | -2.007 | 0.048a |
| VTI(cm, x±s) | 21.40±5.84 | 26.99±7.68 | -3.755 | < 0.001b |
| PASP[mmHg, M(Q1, Q3)] | 33.50(29.8, 40.3) | 30.00(25.0, 42.0) | -1.224 | 0.221 |
| 注:LAAD代表左心房前后径、LVIDd代表左心室舒张末期内径、LVIDs代表左心室收缩末期内径、IVSd代表室间隔舒张期厚度、LVPWd代表左心室后壁舒张期厚度、LVEDV代表左心室舒张末期容积、LVESV代表左心室收缩末期容积、LVEF代表左心室射血分数、SV代表每搏输出量、CO代表心输出量、VTI代表速度时间积分、PASP代表肺动脉收缩压。aP < 0.05,bP < 0.01 | ||||
与对照组相比,研究组GLS、GWI、GCW、GWE的绝对值均明显降低(P均<0.01,表 3,图 1);研究组的GWW较对照组明显升高(P<0.05,表 3,图 1);PSD在两组之间差异无统计学意义(P>0.05,表 3)。
| 指标 | 研究组(n=42) | 对照组(n=42) | t/ F/z | P值 |
| GLS(%, x±s) | -11.35±3.09 | -18.10±2.18 | 133.397 | < 0.001b |
| GWI(mmHg%, x±s) | 980.64±348.69 | 1543.81±368.86 | -7.19 | < 0.001b |
| GCW(mmHg%, x±s) | 1514.79±422.99 | 2049.26±473.57 | -5.455 | < 0.001b |
| GWW(mmHg%, x±s) | 300.45±126.83 | 237.02±161.60 | 2.001 | 0.049a |
| GWE(%, x±s) | 81.64±6.80 | 89.02±5.82 | -5.348 | < 0.001b |
| PSD[ms, M(Q1, Q3)] | 67.79(56.3, 81.9) | 55.86(44.9, 79.2) | -1.677 | 0.093 |
| 注:GLS指整体纵向应变,GWI指整体做功指数,GCW指整体有效做功,GWW指整体无效做功,GWE指整体做功效率,PSD指峰值应变延迟;aP < 0.05,bP < 0.01 | ||||
|
| 图 1 压力应变环及心肌做功参数牛眼图 Fig 1 Bull's-eye Plots of Pressure-Strain Loops and Myocardial Work Parameters |
|
|
A:研究组(男,43岁,GLS -4%)B:研究组(女,72岁,GLS -10%)C:对照组(男,59岁,GLS -25%)D:对照组(女,55岁,GLS -21%);相较于对照组,研究组GLS、GWI、GCW及GWE的绝对值明显降低,GWW明显升高;左上角红色曲线为左心室压力应变曲线,X轴用于表示应变,Y轴用来表示左室压力,曲线下所代表的面积是整体做功指数(GWI);图表的左下角为左心室整体有效做功(GCW)和整体无效做功(GWW)的柱状图;图表的右上角代表的是17节段心肌做功指数牛眼图;GLS为整体纵向应变,GWI为整体做功指数,GCW为整体有效做功,GWW为整体无效做功,GWE为整体做功效率。
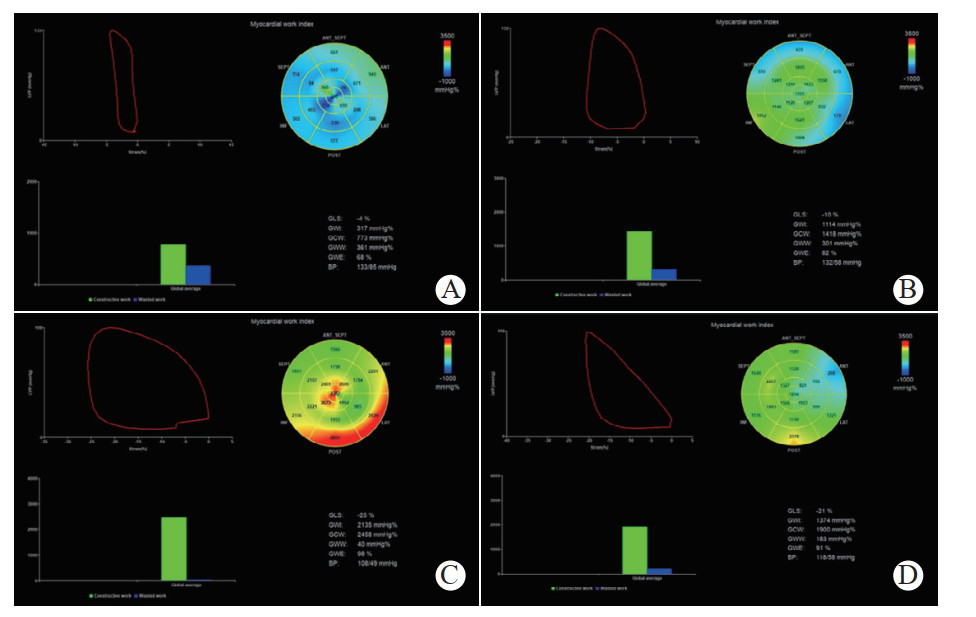
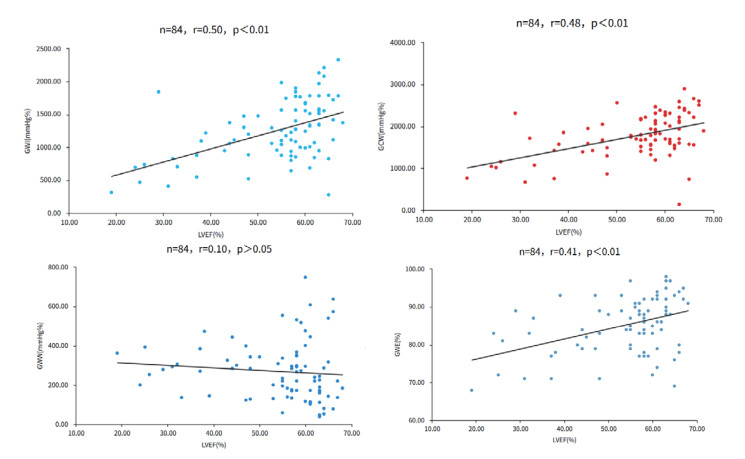
2.4 相关性分析运用Pearson相关分析法探讨各心肌做功参数与LVEF的相关性,结果显示LVEF与GWI、GCW及GWE三个参数均存在显著的正相关(r=0.50、0.48、0.41,P均<0.01,图 2),LVEF与GWW无明显相关性(r=0.10,P>0.05,图 2);分别评估GLS与各心肌做功参数之间的相关性,分析结果显示GWI、GCW及GWE与GLS间均存在明显负相关(r分别为-0.81、-0.71、-0.70,P均<0.01,图 2),GLS与GWW的相关性不显著(r=0.28,P<0.05,图 3)。
|
| 注:LVEF为左心室射血分数,GWI为整体做功指数,GCW为整体有效做功,GWW为整体无效做功,GWE为整体做功效率 图 2 LVEF与GWI、GCW、GWW、GWE的相关性 Fig 2 Correlation between LVEF and GWI, GCW, GWW, GWE |
|
|
|
| 注:GWI为整体做功指数,GCW为整体有效做功,GWW为整体无效做功,GWE为整体做功效率,GLS为整体纵向应变 图 3 GLS与GWI、GCW、GWW、GWE的相关性 Fig 3 Correlation between GLS and GWI, GCW, GWW, GWE |
|
|
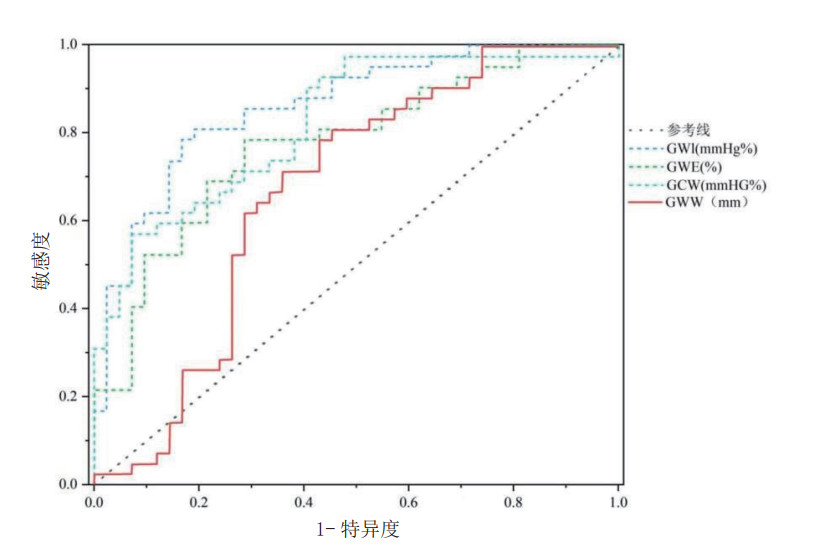
GWI、GCW、GWW、GWE均对脓毒症心肌病具有较高的诊断价值(AUC分别为0.863,0.826,0.672,0.793,图 4),其对应的截断值、敏感度和特异度见表 4。
|
| 注:GWI为整体做功指数,GCW为整体有效做功,GWW为整体无效做功,GWE为整体做功效率,ROC曲线为受试者工作特征曲线,AUC为ROC曲线下面积 图 4 GWI、GCW、GWW、GWE诊断脓毒症心肌病的ROC曲线 Fig 4 ROC curves of GWI, GCW, GWW, and GWE for diagnosing septic cardiomyopathy |
|
|
| 心肌做功参数 | AUC | 约登指数 | 敏感度(%) | 特异度(%) | Cut-off | 95% CI | P值 |
| GWI(mmHg%) | 0.863 | 0.619 | 79 | 83% | 1268.000 | 0.785 ~ 0.940 | 0.000a |
| GCW(mmHg%) | 0.826 | 0.500 | 57% | 93% | 2060.000 | 0.738 ~ 0.913 | 0.000a |
| GWW(mmHg%) | 0.672 | 0.357 | 71% | 64% | 227.000 | 0.553 ~ 0.792 | 0.007a |
| GWE(%) | 0.793 | 0.500 | 79% | 71% | 85.000 | 0.698 ~ 0.889 | 0.000a |
| 注:GWI为整体做功指数,GCW为整体有效做功,GWW为整体无效做功,GWE为整体做功效率,AUC为ROC曲线下面积,Cut-off为截断值,CI为置信区间,aP < 0.01 | |||||||
脓毒症发生时,患者体内会出现免疫细胞激活与炎症介质级联反应、程序细胞死亡、线粒体功能障碍等一系列病理生理改变,这些机制共同作用,进而引发心脏功能障碍[20]。根据有关文献研究,约有25%的脓毒症休克患者在早期(24 h内)可出现心肌功能障碍[21]。最新综述汇总了25项观察性研究发现,脓毒症患者主要心血管事件的合并累计发生率高达9.0%(95%CI: 6.1%-11.9%)[22]。所以,当下迫切需要探寻更多生物标志物或检测方法,以对SCM的早期诊断加以补充。
临床实践中,通过常规超声心动图检测的LVEF是预测心血管疾病的常用指标[23]。有社论[24]和前瞻性研究[25]指出,作为左心室收缩评估功能,GLS相较于LVEF具有更高的可靠性。然而,GLS作为评估指标易受压力负荷影响,其后负荷升高时该参数会随之降低,这种变化可能被误认为是心肌收缩力下降,而实际仅反映后负荷的改变。与之不同,LV-PSL通过整合心肌形变与左室压力参数,实现对心肌做功的综合评估[26]。Russell团队[4-5]的研究揭示,通过LV-PSL评估得到的左心室MW节段性差异与正电子发射计算机断层扫描(PET)技术测得的心肌葡萄糖代谢率紧密相关。这与先前的研究一致[27-28]。后有研究在此基础上指出,脓毒症患者中,GWW升高与乳酸水平(反映组织缺氧)显著相关(r=0.45),提示无效做功增加可能与线粒体功能障碍有关,而LVEF和GLS无法直接反映能量代谢异常[29]。随着无创MW的提出,其临床应用越来越多,一篇对早期冠状动脉疾病(coronary artery disease,CAD)患者的综述中提出[30],GWI诊断早期CAD的敏感度非常高,其AUC值可达0.86,显著高于GLS的AUC值(0.79)。针对其他相关疾病领域,为了进一步深入地探究心肌淀粉样变性(cardiac amyloidosis,CA)患者的心肌功能,有研究[31]巧妙地运用了无创MW来评估其左室收缩功能,结果显示,在静息状态下,CA患者的GWI呈现出明显下降的趋势,在运动以后,GWI指标又有所回升。近年来,也有研究探讨了转甲状腺素蛋白淀粉样变心肌病的患者,其指出心肌做功参数(尤其是GWI)更能准确反映该患者的疾病进展和能量代谢效率[32]。上述这些研究充分证实了无创心肌做功超声显像技术在评估不同类型心肌病患者早期左室收缩功能上的临床价值,这为开展早期的干预措施以及实施针对性治疗提供了坚实且可靠的依据。
本研究中分析了脓毒症心肌病组患者和脓毒症非心肌病组患者的临床资料及超声数据,探讨了两组患者之间的差异性,通过组间比较发现,除了HR、Hs-cTnⅠ,两组患者之间的其他一般临床资料差异均无明显统计学意义,脓毒症心肌病组患者的GWI、GCW、GWE的绝对值较非心肌病组明显降低,说明脓毒症心肌病组患者的有效心肌做功减少,表明心脏整体收缩能力下降或有效射血减少;GWW的绝对值较非心肌病组患者明显升高,说明脓毒症心肌病组患者的无效心肌做功增多,表明心脏在能量转化和利用方面效率低下,这些参数的变化模式(GWI绝对值的下降、GCW绝对值的下降、GWE绝对值的下降、GWW绝对值的升高)共同构成了一幅SCM特征性的“心肌能量-机械转化障碍”图谱,深刻揭示了其收缩功能障碍的病理生理基础—不仅仅是收缩力下降,更是能量利用效率的全面恶化。相关性分析提示LVEF与GWI、GCW及GWE均存在显著的正相关(r=0.50、0.48、0.41,均P<0.01),GLS与GWI、GCW、GWE具有显著的负相关关系(r=-0.81、-0.71、-0.70,均P<0.01),这些指标从不同角度反映了左心室的收缩功能状态,表明心肌纤维的纵向收缩能力是驱动心脏整体机械做功和决定做功效率的关键基础。在ROC曲线中也进一步证明了GWI、GCW、GWE对脓毒症心肌病患者的早期诊断价值较高(AUC分别为0.863,0.826,0.793),其中以GWI的诊断价值最高,敏感度为79%,特异度为83%。且MW参数(特别是GWI)能在传统指标(如LVEF)尚未出现显著异常时,更敏感地捕捉到心肌收缩功能和效率的早期、细微损害。本研究中部分SCM患者LVEF>50%,但其MW参数已显著异常,即可证明上述这一点。
Witthaut等[33]的研究显示,脓毒症早期对心肌影响相对较轻, 此时检测的BNP水平并无显著升高,而当病情进展至严重脓毒症或脓毒性休克时,BNP水平可呈现明显升高趋势。这可能是由于BNP同时也存在于脊髓、脑、肺组织中,也可见于肾功能不全、炎症、肿瘤等疾病中。所以,BNP的特异度比较低,只能用于心功能不全的排除诊断,不适用于脓毒症心肌病的早期诊断。而在本研究结果中也显示了脓毒症心肌病组与脓毒症非心肌病组患者在BNP方面的差异无统计学意义(P>0.05),与既往研究结果一致。
脓毒症时,炎症介质直接损伤心肌细胞,导致肌钙蛋白释放。一项前瞻性研究[34]纳入了116例脓毒症患者,结果发现脓毒症患者亚临床左室收缩功能障碍(left ventricular systolic dysfunction,LVSD)的Hs-cTnⅠ水平显著高于无LVSD患者(中位数:28.5 vs. 18.7 ng/L,P < 0.001)。Kim等[35]的研究报告也指出,在脓毒症合并心肌收缩力减退的患者中,Hs-cTnⅠ峰值水平呈现显著升高趋势(P < 0.05),并且通过心室功能分层分析发现,该生物标志物在左室收缩功能异常亚组的表达强度较之收缩功能保留亚组差异有统计学意义(P < 0.01)。本研究也得到了类似的结果,脓毒症心肌病组患者的Hs-cTnⅠ浓度明显高于脓毒症非心肌病组患者,这为SCM组的划分提供了重要的生物标志物层面的支持,进一步佐证了该组患者存在明确的心肌损害。因此,对于脓毒症患者,在排除其他可导致肌钙蛋白Ⅰ升高的因素后,应警惕发生脓毒症心肌病的可能性。
本研究的一个潜在局限性是选择用于定义SCM的GLS阈值。由于目前GLS在国际上并没有明确的关于诊断脓毒症心肌病的阈值,本研究结合以往文献采取-15%为阈值,该阈值可能会高估SCM的频率,因为本研究中脓毒症心肌病组中有一部分患者LVEF>50%,这可能是由于LVEF的变化主要受到了负荷条件的影响,动脉张力的保留或恢复可能会掩盖LVEF的降低[3],然而,这恰恰凸显了MW参数的价值—即使在LVEF保留的患者中,MW参数已能有效识别出存在收缩功能和效率障碍的个体,提示能发现更早期的心肌损害。其次,无创心肌做功技术在临床实践中的应用也存在着某些局限性。特别在涉及主动脉与左室间压力梯度升高的疾病中,由于周围收缩期动脉压难以精准反映左室峰值压力的实际状况,这为我们理解左室功能的真实状态带来了挑战。因此,在评估此类疾病时,需要寻找更为精确和可靠的方法来测量和解析左室峰值压力。第三,本研究属于单中心小样本量的前瞻性研究,可能限制结果的普遍性,建议后续研究纳入更多受试者以增强研究结论的可信度。第四,ICU/EICU患者往往存在神志不清、无法配合超声检查的情况,且通常需要依赖气管插管、机械通气、心电监护等设备,这些因素共同导致获取标准超声图像难度较大。第五,本研究未分析MW参数与患者预后的关系,是未来值得探索的方向。
无创心肌做功超声显像技术具有以下优势:非侵入性特征及可床旁操作、高时间分辨率可精准捕捉心肌收缩模式动态变化,而且可通过标准化后负荷校正算法,有效消除外周血管阻力波动对心室形变参数的影响,其对心脏局部和整体收缩功能的评价更全面、更准确。本研究中,在LVEF尚正常的情况下,部分脓毒症患者的左心室心肌做功参数已出现不同程度异常,且心肌做功参数诊断脓毒症心肌病的AUC值较高。这也证明了心肌做功有助于早期识别脓毒症心肌损害,在评估心肌收缩功能方面展现出了独特的价值,为除了LVEF和GLS之外,提供了新的评估手段。
致谢: 感谢本次科研及论文协作过程中导师团队的指导和大力支持
利益冲突 所有作者声明无利益冲突
作者贡献声明 李亚南:数据收集、研究设计、统计学分析、论文撰写;谢永鹏:研究指导、论文修改、经费支持;颜瑶:论文修改、工作支持;陈允安、侯婧婧:数据收集、图像采集;洪琪翔、张宇华和孟宇浩贡献相同:数据收集、研究设计、统计学分析;李小民:研究指导、论文审阅、经费支持
| [1] | Parker MM, Shelhamer JH, Bacharach SL, et al. Profound but reversible myocardial depression in patients with septic shock[J]. Ann Intern Med, 1984, 100(4): 483-490. DOI:10.7326/0003-4819-100-4-483 |
| [2] | Martin L, Derwall M, Al Zoubi S, et al. The septic heart: current understanding of molecular mechanisms and clinical implications[J]. Chest, 2019, 155(2): 427-437. DOI:10.1016/j.chest.2018.08.1037 |
| [3] | Ehrman RR, Sullivan AN, Favot MJ, et al. Pathophysiology, echocardiographic evaluation, biomarker findings, and prognostic implications of septic cardiomyopathy: a review of the literature[J]. Crit Care, 2018, 22(1): 112. DOI:10.1186/s13054-018-2043-8 |
| [4] | Hubert A, Le Rolle V, Leclercq C, et al. Estimation of myocardial work from pressure-strain loops analysis: an experimental evaluation[J]. Eur Heart J Cardiovasc Imaging, 2018, 19(12): 1372-1379. DOI:10.1093/ehjci/jey024 |
| [5] | Russell K, Eriksen M, Aaberge L, et al. Assessment of wasted myocardial work: a novel method to quantify energy loss due to uncoordinated left ventricular contractions[J]. Am J Physiol Heart Circ Physiol, 2013, 305(7): H996-1003. DOI:10.1152/ajpheart.00191.2013 |
| [6] | Russell K, Eriksen M, Aaberge L, et al. A novel clinical method for quantification of regional left ventricular pressure-strain loop area: a non-invasive index of myocardial work[J]. Eur Heart J, 2012, 33(6): 724-733. DOI:10.1093/eurheartj/ehs016 |
| [7] | Manganaro R, Marchetta S, Dulgheru R, et al. Correlation between non-invasive myocardial work indices and main parameters of systolic and diastolic function: results from the EACVI NORRE study[J]. Eur Heart J Cardiovasc Imaging, 2020, 21(5): 533-541. DOI:10.1093/ehjci/jez203 |
| [8] | Galli E, Vitel E, Schnell F, et al. Myocardial constructive work is impaired in hypertrophic cardiomyopathy and predicts left ventricular fibrosis[J]. Echocardiography, 2019, 36(1): 74-82. DOI:10.1111/echo.14210 |
| [9] | Coisne A, Fourdinier V, Lemesle G, et al. Clinical significance of myocardial work parameters after acute myocardial infarction[J]. Eur Heart J Open, 2022, 2(3): oeac037. DOI:10.1093/ehjopen/oeac037 |
| [10] | 赖丽玲, 陈宝泉, 吴珠娥, 等. 多参数构建脓毒性休克预测模型[J]. 中华急诊医学杂志, 2025, 34(06): 852-857. DOI:10.3760/cma.j.issn.1671-0282.2025.06.017 |
| [11] | Huang DQ, Cui CY, Zheng Q, et al. Quantitative analysis of myocardial work by non-invasive left ventricular pressure-strain loop in patients with type 2 diabetes mellitus[J]. Front Cardiovasc Med, 2021, 8: 733339. DOI:10.3389/fcvm.2021.733339 |
| [12] | Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [13] | Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. J Am Soc Echocardiogr, 2015, 28(1): 1-39.e14. DOI:10.1016/j.echo.2014.10.003 |
| [14] | Boissier F, Razazi K, Seemann A, et al. Left ventricular systolic dysfunction during septic shock: the role of loading conditions[J]. Intensive Care Med, 2017, 43(5): 633-642. DOI:10.1007/s00134-017-4698-z |
| [15] | De Geer L, Engvall J, Oscarsson A. Strain echocardiography in septic shock - a comparison with systolic and diastolic function parameters, cardiac biomarkers and outcome[J]. Crit Care, 2015, 19(1): 122. DOI:10.1186/s13054-015-0857-1 |
| [16] | Gaibazzi N, Lorenzoni V, Tuttolomondo D, et al. Association between resting global longitudinal strain and clinical outcome of patients undergoing stress echocardiography[J]. J Am Soc Echocardiogr, 2022, 35(10): 1018-1027.e6. DOI:10.1016/j.echo.2022.05.012 |
| [17] | Torres JSS, Tamayo-Giraldo FJ, Bejarano-Zuleta A, et al. Sepsis and post-sepsis syndrome: a multisystem challenge requiring comprehensive care and management-a review[J]. Front Med (Lausanne), 2025, 12: 1560737. DOI:10.3389/fmed.2025.1560737 |
| [18] | Voigt JU, Pedrizzetti G, Lysyansky P, et al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging[J]. J Am Soc Echocardiogr, 2015, 28(2): 183-193. DOI:10.1016/j.echo.2014.11.003 |
| [19] | 袁佳辉, 蔡国龙. 左心室整体纵向应变在脓毒性心肌病诊断中的研究进展[J]. 心脑血管病防治, 2018, 18(5): 410-414. DOI:10.3969/j.issn.1009-816x.2018.05.017 |
| [20] | Nong YX, Wei XB, Yu DQ. Inflammatory mechanisms and intervention strategies for sepsis-induced myocardial dysfunction[J]. Immun Inflamm Dis, 2023, 11(5): e860. DOI:10.1002/iid3.860 |
| [21] | Singam A. Myocardial injury as a harbinger of multi-organ failure in septic shock: a comprehensive review[J]. Cureus, 2024, 16(2): e55021. DOI:10.7759/cureus.55021 |
| [22] | Wu ZS, Chen FH, Xiao C, et al. Long-term cardiovascular outcomes and risk factors in adult sepsis survivors: a systematic review and meta-analysis[J]., 2025, 16(5): 423-430. DOI: 10.5847/wjem.j.1920-8642.2025.098. |
| [23] | Yang ZY, Liu HR, Lu DZ, et al. Effects of high-dose glucose-insulin-potassium on acute coronary syndrome patients receiving reperfusion therapy: a meta-analysis[J]., 2024, 15(3): 181-189. DOI: 10.5847/wjem.j.1920-8642.2024.048. |
| [24] | Maslove DM. Echocardiography in the management of sepsis: not all black and white[J]. Crit Care Med, 2024, 52(2): 348-350. DOI:10.1097/CCM.0000000000006125 |
| [25] | 窦丽稳, 叶菁菁, 黄伟, 等. 床旁斑点追踪超声心动图能早期发现重症创伤患者左室收缩功能不全——一项来自一级创伤救治中心的前瞻性研究[J]. 中华急诊医学杂志, 2025, 34(07): 953-958. DOI:10.3760/cma.j.cn114656-20241122-00816 |
| [26] | Chan J, Edwards NFA, Khandheria BK, et al. A new approach to assess myocardial work by non-invasive left ventricular pressure-strain relations in hypertension and dilated cardiomyopathy[J]. Eur Heart J Cardiovasc Imaging, 2019, 20(1): 31-39. DOI:10.1093/ehjci/jey131 |
| [27] | Bergman BC, Tsvetkova T, Lowes B, et al. Myocardial glucose and lactate metabolism during rest and atrial pacing in humans[J]. J Physiol, 2009, 587(Pt 9): 2087-2099. DOI:10.1113/jphysiol.2008.168286 |
| [28] | Wehrl HF, Wiehr S, Divine MR, et al. Preclinical and translational PET/MR imaging[J]. J Nucl Med, 2014, 55(Supplement 2): 11S-11S. DOI:10.2967/jnumed.113.129221 |
| [29] | Meng XY, Feng BY, Yang CG, et al. Association between the triglyceride-glucose index and left ventricular myocardial work indices in patients with coronary artery disease[J]. Front Endocrinol (Lausanne), 2024, 15: 1447984. DOI:10.3389/fendo.2024.1447984 |
| [30] | Parlavecchio A, Vetta G, Caminiti R, et al. Which is the best Myocardial Work index for the prediction of coronary artery disease?A data meta-analysis[J]. Echocardiography, 2023, 40(3): 217-226. DOI:10.1111/echo.15537 |
| [31] | Clemmensen TS, Eiskjær H, Mikkelsen F, et al. Left ventricular pressure-strain-derived myocardial work at rest and during exercise in patients with cardiac amyloidosis[J]. J Am Soc Echocardiogr, 2020, 33(5): 573-582. DOI:10.1016/j.echo.2019.11.018 |
| [32] | Antonelli J, Neveu A, Kosmala W, et al. Evolution and prognostic value of left ventricular deformation and myocardial work parameters in transthyretin amyloid cardiomyopathy[J]. Eur Heart J Cardiovasc Imaging, 2024, 25(4): 469-479. DOI:10.1093/ehjci/jead318 |
| [33] | Witthaut R, Busch C, Fraunberger P, et al. Plasma atrial natriuretic peptide and brain natriuretic peptide are increased in septic shock: impact of interleukin-6 and sepsis-associated left ventricular dysfunction[J]. Intensive Care Med, 2003, 29(10): 1696-1702. DOI:10.1007/s00134-003-1910-0 |
| [34] | Hai PD, Binh NT, Tot NH, et al. Diagnostic value of high-sensitivity troponin T for subclinical left ventricular systolic dysfunction in patients with sepsis[J]. Cardiol Res Pract, 2021, 2021: 8897738. DOI:10.1155/2021/8897738 |
| [35] | Kim JS, Kim M, Kim YJ, et al. Troponin testing for assessing sepsis-induced myocardial dysfunction in patients with septic shock[J]. J Clin Med, 2019, 8(2): 239. DOI:10.3390/jcm8020239 |
 2025, Vol. 34
2025, Vol. 34