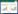急性肾损伤(acute kidney injury, AKI)是重症颅脑损伤患者常见的并发症之一,其发生与患者的高病死率和不良预后密切相关[1]。AKI的及时诊断和早期治疗能有效提高患者的生存率,改善预后情况。然而,由于AKI的早期症状不典型,传统的诊断方法如血肌酐和尿素氮往往存在滞后性,无法满足早期诊断的需求[2]。据数据显示[3],颅脑损伤患者中AKI的发生率高达30%~50%,这一比例显著高于其他疾病患者。AKI的发生不仅增加了患者的死亡风险,还可能导致多器官功能衰竭、住院时间延长以及增加医疗费用。因此,寻找一种能够早期、准确诊断AKI的方法对于重症颅脑损伤患者的治疗及预后非常重要。近年来,随着生物标志物研究的不断深入,多种新型生物标志物在AKI早期诊断中展现出巨大潜力。其中,胱抑素C(cystatin C, Cys-C)、血清中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin, NGAL)、胰岛素样生长因子结合蛋白-7(insulin-like growth factor-binding protein 7, IGFBP-7)和肾损伤分子-1(kidney injury molecule 1, KIM-1)等生物标志物因其高度的敏感度和特异度而备受关注[4]。研究表明[5],血清中NGAL、KIM-1和Cys-C生物标志物水平在肾脏损伤早期显著升高,是AKI患者预后的危险因素。此外,肾动脉血流阻力指数(renal resistive index, RRI)作为反映肾脏血流动力学变化的指标,在AKI早期诊断中亦具有潜在价值,且彩色多普勒超声技术可以无创、实时地监测肾动脉血流情况,为RRI的测定提供了便捷的方法[6]。因此,本研究旨在探究血清NGAL、Cys-C、KIM-1、IGFBP-7联合RRI在重症颅脑损伤患者AKI早期诊断中的价值,通过比较相关指标的变化情况,及其与AKI的相关性,以期为AKI的早期诊断和治疗提供新的思路和方法,进一步改善重症颅脑损伤患者的预后。
1 资料与方法 1.1 研究对象研究选取2022年1月至2024年12月仙居县人民医院重症监护室收治的重症颅脑损伤患者作为本次研究对象,根据AKI诊断标准将患者5 d内是否发生AKI将其分为AKI组和非AKI组。AKI的相关诊断标准参考(2012版改善全球肾脏病预后组织KDIGO)[7]:①48 h内,血清肌酐(SCr)升高≥0.3 mg/kg,≥26.5 µmol/L(或0.3 mg/dL);②确认或推测7 d内,SCr较基础值升高≥50%(或1.5倍);(2)尿量减少:尿量 < 0.5 mL/(kg·h),且持续时间≥6 h;纳入标准:(1)所有患者年龄均≥18岁且≤90岁;(2)符合重症颅脑损伤标准且(Glasgow Coma Scale, GCS)评分[8]≤8分;(3)患者或家属签署知情同意书。排除标准:(1)入科48 h内死亡患者;(2)合并伴有泌尿系统损伤;(3)既往存在基础肾脏疾病(慢性肾脏病3期及以上)或长期依赖肾脏替代治疗者;(4)合并恶性肿瘤患者;(5)临床资料信息不完整;(6)患者或家属治疗检查不配合;(7)妊娠期妇女。本研究已通过仙居县人民医院医学伦理委员会审核批准。
1.2 研究方法 1.2.1 一般资料收集收集所有患者的一般临床资料,包括年龄、性别、身体质量指数(body mass index, BMI)、合并基础疾病(高血压、糖尿病、冠心病、肾脏疾病)以及GCS评分等。
1.2.2 检测时间点选择本研究选择入科后0 h、12 h、24 h及48 h四个时间点进行动态监测,主要基于以下考虑:① 0 h用于获取基线值;② AKI生物标志物(如NGAL、KIM-1等)常在损伤后6~12 h开始显著升高,故设置12 h点以期捕获早期损伤信号;③24 h和48 h点则覆盖了KDIGO标准诊断AKI的关键时间窗,用于评估损伤进展及最终确认AKI发生。该时间点设计参考了危重症患者急性肾损伤生物标志物研究领域中广泛采用的动态监测方案(0-12~24 h节点),其有效性已得到多项国内外研究的验证[9-11]。该方案亦符合ICU临床工作节奏,具有良好的可行性。
1.2.3 血液相关检测指标所有患者于入科时(0 h,即30 min内)及入科后12 h、24 h和48 h分别留取一次标本,采用迈瑞BC-5000全自动血细胞分析仪(生产厂家:深圳迈瑞生物医疗电子股份有限公司,产地:中国广东)进行血常规检测,包括白细胞计数(white blood cell count, WBC)、红细胞计数(red blood cell count, RBC)、血小板计数(platelet count, PLT)等。采用贝克曼库尔特AU5400全自动生化分析系统(生产厂家:Beckman Coulter Inc.,产地:美国)检测血清肌酐(serum creatinine, SCr)、血尿素氮(blood urea nitrogen, BUN)、估算的肾小球滤过率(estimating glomerular filtration rate, eGFR)。采用乳胶免疫比浊法检测血清Cys-C水平,设备使用贝克曼库尔特AU5400全自动生化分析系统,检测试剂盒(生产厂家:浙江夸克生物科技有限公司,产地:中国浙江)。采用酶联免疫吸附法(ELISA)检测血清NGAL、KIM-1及IGFBP-7水平,ELISA比色仪器(生产厂家:上海科华实验系统有限公司,产地:中国上海),ELISA检测试剂盒(生产厂家:上海瓦兰生物科技有限公司,产地:中国上海),上述所有检测步骤均严格依照说明书进行操作。
1.2.4 RRI值超声测定在患者入科后0 h(30 min内)、12 h、24 h和48 h进行采血并进行超声检查,超声检查均由具备超声资质的熟练的超声操作者进行。超声设备为急重症移动型超声VenueTM(生产厂家:GE Healthcare,产地:美国),测定时选择肾小叶间动脉进行,探头频率为3.5~6.0 MHz,测定指标包括收缩期峰值流速(peak systolic velocity, PSV)、舒张末期流速(end-diastolic flow velocity, EDV),通过计算公式RRI=(PSV-EDV)/PSV,计算得到RRI值,经由系统可自动计算数值,左右肾各测量3次后取平均值。超声检测见图 1。
|
| 注:PSV为收缩期峰值流速=Vmax;EDV为舒张末期流速=Vmin;RRI为肾动脉阻力指数 图 1 RRI超声测定 |
|
|
采用SPSS 25.0软件对数据进行统计分析,符合正态分布的计量资料采用均数±标准差(x±s)表示,组间比较用两样本t检验;偏态分布资料以中位数(四分位数)[M(Q1, Q3)]表达,组间比较运用Mann-Whitney U检验;计数资料用n(%)表示,采用χ2检验或Fisher确切概率法。以是否发生AKI作为因变量,将五个指标(血清NGAL, Cys-C, KIM-1, IGFBP-7和RRI)作为自变量(连续变量)纳入模型,构建二元Logistic回归模型。绘制受试者工作特征曲线(receiver operating characteristic, ROC)并计算曲线下面积(areas under curve, AUC),评估各指标单独检测和联合检测对AKI的早期诊断价值,比较各个时间段联合检测的诊断效能,并且绘制了各指标随时间变化的趋势图。所有统计图形均使用R语言(版本4.2.1)及ggplot2包绘制。以P < 0.05为差异有统计学意义。
2 结果 2.1 入组情况本研究共收集了218例重症颅脑损伤患者,其中12例患者部分数据缺失予以排除,最终纳入病例206例,其中男性128例,女性78例,年龄18~90岁,年龄(64.25 ± 13.58)岁,根据患者5 d内AKI发生情况将其分为AKI组72例和非AKI组134例,统计结果显示重症颅脑损伤术后早期AKI的发生率约为35%。
2.2 两组患者一般资料比较两组患者在年龄、性别、BMI,高血压、糖尿病、冠心病、GCS评分、WBC、RBC和PLT等方面对比均差异无统计学意义(P >0.05),其中AKI组患者在肾脏疾病史、SCr和BUN方面指标高于非AKI组,eGFR指标低于非AKI组,差异具有统计学意义(P < 0.05),见表 1。
| 项目 | 总计(n=206) | 非AKI组(n=134) | AKI组(n=72) | χ2/t/z值 | P值 |
| 一般情况 | |||||
| 年龄(岁)a | 64.25 ± 13.58 | 64.99 ± 13.28 | 62.89 ± 14.11 | 1.065 | 0.292 |
| 男性b | 128 (62.1) | 80 (59.7) | 48 (66.7) | 0.976 | 0.326 |
| BMI(kg/m2)a | 23.54 ± 3.36 | 23.36 ± 3.22 | 23.87 ± 3.60 | -1.037 | 0.302 |
| 既往史 | |||||
| 高血压史b | 70 (33.9) | 50 (37.3) | 20 (27.8) | 1.903 | 0.168 |
| 糖尿病史b | 50 (24.2) | 33 (24.6) | 17 (23.6) | 0.037 | 0.871 |
| 冠心病史b | 37 (17.9) | 26 (19.4) | 11 (15.3) | 0.542 | 0.462 |
| 肾脏病史b | 14 (6.8) | 1 (0.7) | 13 (18.1) | 19.501 | < 0.001 |
| GCS评分(分)a | 5.98 ± 2.68 | 5.81 ± 2.50 | 6.28 ± 2.98 | -1.192 | 0.236 |
| WBC(×109/mL)a | 13.45 ± 5.33 | 13.42 ± 5.65 | 13.51 ± 4.73 | -0.126 | 0.909 |
| RBC(×1012/mL)a | 2.61 ± 0.66 | 2.61 ± 0.65 | 2.63 ± 0.68 | -0.234 | 0.818 |
| PLT(×109/L)a | 167.82 ± 75.25 | 162.99 ± 63.08 | 176.81 ± 93.65 | -1.265 | 0.210 |
| SCr(μmol/L)a | 77.66 ± 23.93 | 70.37 ± 19.40 | 91.24 ± 25.71 | -6.037 | < 0.001 |
| BUN(mmol/L)a | 5.74 ± 1.91 | 5.32 ± 1.64 | 6.51 ± 2.13 | -4.105 | < 0.001 |
| eGFR[mL/(min·1.73 m2)]a | 89.55 ± 18.74 | 95.42 ± 15.21 | 78.63 ± 19.87 | 6.257 | < 0.001 |
| 注:BMI为身体质量指数,GCS评分为格拉斯哥昏迷评分,WBC为白细胞计数,RBC为红细胞,PLT为血小板计数,SCr为血清肌酐,BUN为血尿素氮,eGFR为估算的肾小球滤过率;a为x±s,b为n(%) | |||||
比较两组患者入科后0 h、12 h、24 h和48 h的血清Cys-C、IGFBP-7、KIM-1、NGAL水平以及超声RRI水平;结果显示AKI组患者在0 h、12 h、24 h和48 h时间段血清NGAL水平几乎均高于非AKI组,大部分差异具有统计学意义(P < 0.05),见表 2。
| 时间 | 总计 (n=206) |
非AKI组 (n=134) |
AKI组 (n=72) |
χ2/t/z值 | P值 |
| Cys-c(mg/L)a | |||||
| 0 h | 0.76 ± 0.36 | 0.67 ± 0.20 | 0.94 ± 0.51 | -4.392 | < 0.001 |
| 12 h | 0.92 ± 0.51 | 0.74 ± 0.32 | 1.24 ± 0.63 | -6.233 | < 0.001 |
| 24 h | 0.99 ± 0.66 | 0.78 ± 0.44 | 1.37 ± 0.81 | -5.744 | < 0.001 |
| 48 h | 1.05 ± 0.76 | 0.81 ± 0.48 | 1.51 ± 0.95 | -5.905 | < 0.001 |
| IGFBP-7(ng/mL)a | |||||
| 0 h | 20.97± 6.26 | 19.06 ± 4.05 | 24.53 ± 7.91 | -5.507 | < 0.001 |
| 12 h | 23.59 ± 1.21 | 21.93 ± 1.37 | 26.67 ± 7.44 | -2.723 | 0.007 |
| 24 h | 22.82 ± 7.00 | 20.85 ± 4.85 | 26.48 ± 8.75 | -5.067 | < 0.001 |
| 48 h | 22.99 ± 7.42 | 20.99 ± 4.71 | 26.71± 9.79 | -4.673 | < 0.001 |
| KIM-1(pg/mL)a | |||||
| 0 h | 55.37 ± 22.13 | 50.15 ± 17.66 | 65.07 ± 26.12 | -4.346 | < 0.001 |
| 12 h | 59.00 ± 26.14 | 52.83 ± 21.44 | 70.50 ± 30.10 | -4.422 | < 0.001 |
| 24 h | 63.72 ± 25.79 | 58.49 ± 23.35 | 73.46 ± 27.42 | -3.937 | < 0.001 |
| 48 h | 67.31 ± 27.05 | 61.18 ± 23.53 | 78.73 ± 29.52 | -4.365 | < 0.001 |
| NGAL(µg/mL)a | |||||
| 0 h | 0.78 ± 0.35 | 0.71 ± 0.28 | 0.93 ± 0.41 | -4.013 | < 0.001 |
| 12 h | 0.87 ± 0.36 | 0.78 ± 0.31 | 1.06 ± 0.38 | -5.740 | < 0.001 |
| 24 h | 0.91 ± 0.41 | 0.79 ± 0.33 | 1.12 ± 0.46 | -5.448 | < 0.001 |
| 48 h | 0.89 ± 0.45 | 0.76 ± 0.30 | 1.14 ± 0.57 | -5.376 | < 0.001 |
| RRIa | |||||
| 0 h | 0.68 ± 0.08 | 0.67 ± 0.07 | 0.70 ± 0.09 | -1.995 | 0.049 |
| 12 h | 0.69 ± 0.07 | 0.67 ± 0.07 | 0.71 ± 0.07 | -3.966 | < 0.001 |
| 24 h | 0.68 ± 0.07 | 0.66 ± 0.06 | 0.72 ± 0.07 | -5.503 | < 0.001 |
| 48 h | 0.69 ± 0.08 | 0.66 ± 0.07 | 0.74 ± 0.08 | -6.423 | < 0.001 |
| 注:Cys-C为胱抑素C;IGFBP-7为胰岛素样生长因子结合蛋白-7;KIM-1为肾损伤分子-1;NGAL为中性粒细胞明胶酶相关载脂蛋白;RRI为肾动脉血流阻力指数;a为 x±s | |||||
本研究旨在验证血清NGAL、Cys-C、KIM-1、IGFBP-7和RRI这五个基于前期文献和生物学通路预先设定的指标的联合诊断价值。具体建模流程如下:以是否发生AKI作为因变量(是为1,否为0)。将同一时间点的五个指标(血清NGAL, Cys-C, KIM-1, IGFBP-7和RRI)作为自变量(连续变量)同时纳入模型。为每个时间点(0 h, 12 h, 24 h, 48 h)分别建立了独立的Logistic回归模型。通过模型得到每个患者的AKI发生预测概率,该预测概率即为“联合检测”的值。以0 h模型为例,其线性预测因子的计算公式为:Z = -9.5332+(0.1837×IGFBP-7)+(0.0203×KIM-1) + (1.3938×NGAL) + (2.202×Cys-C) + (1.5445×RRI);预测概率P=1 /[1 + e^(-Z)]。
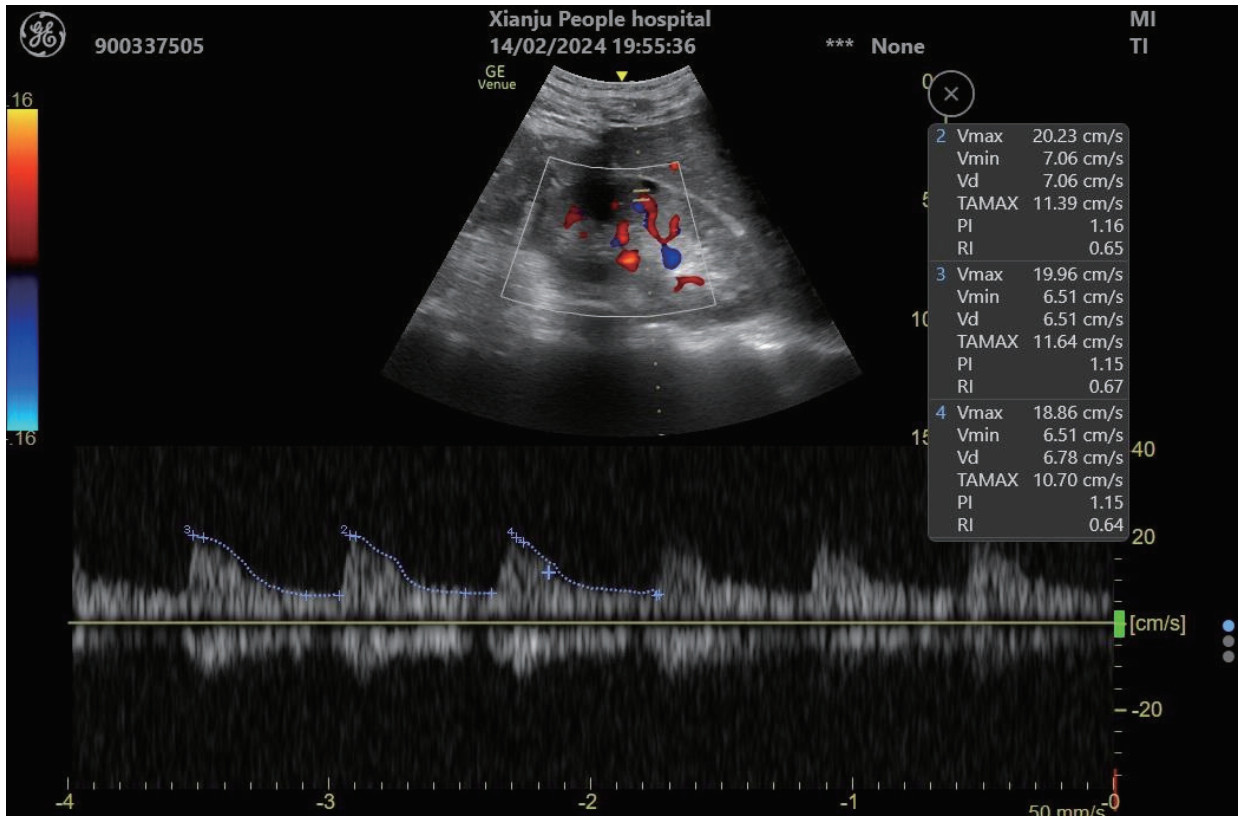
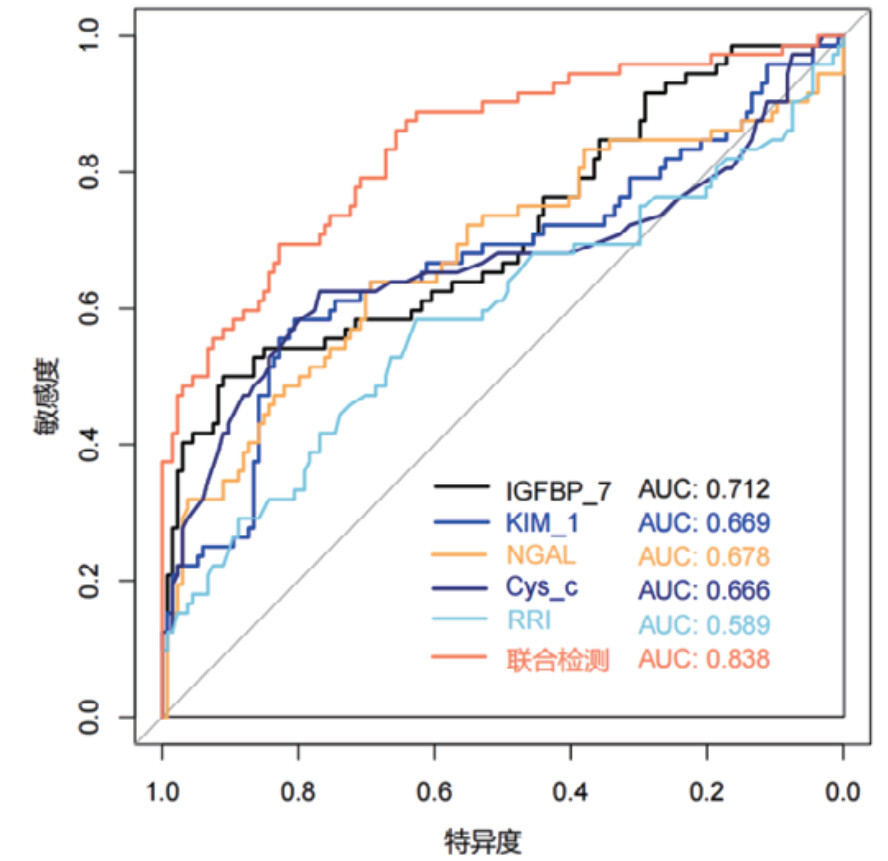
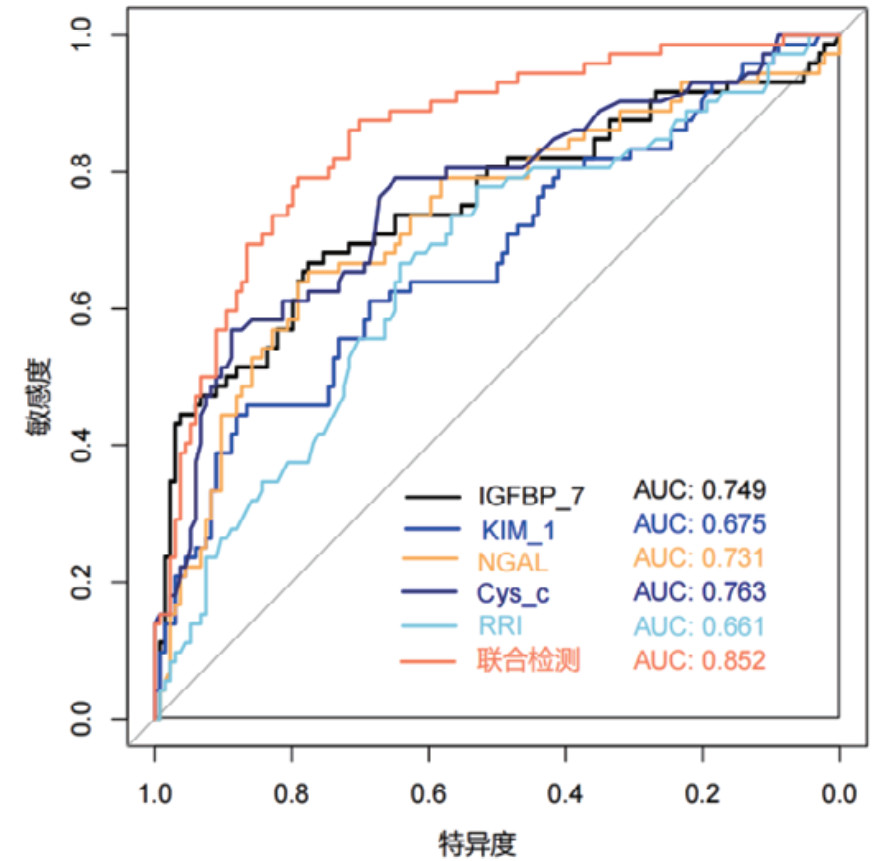
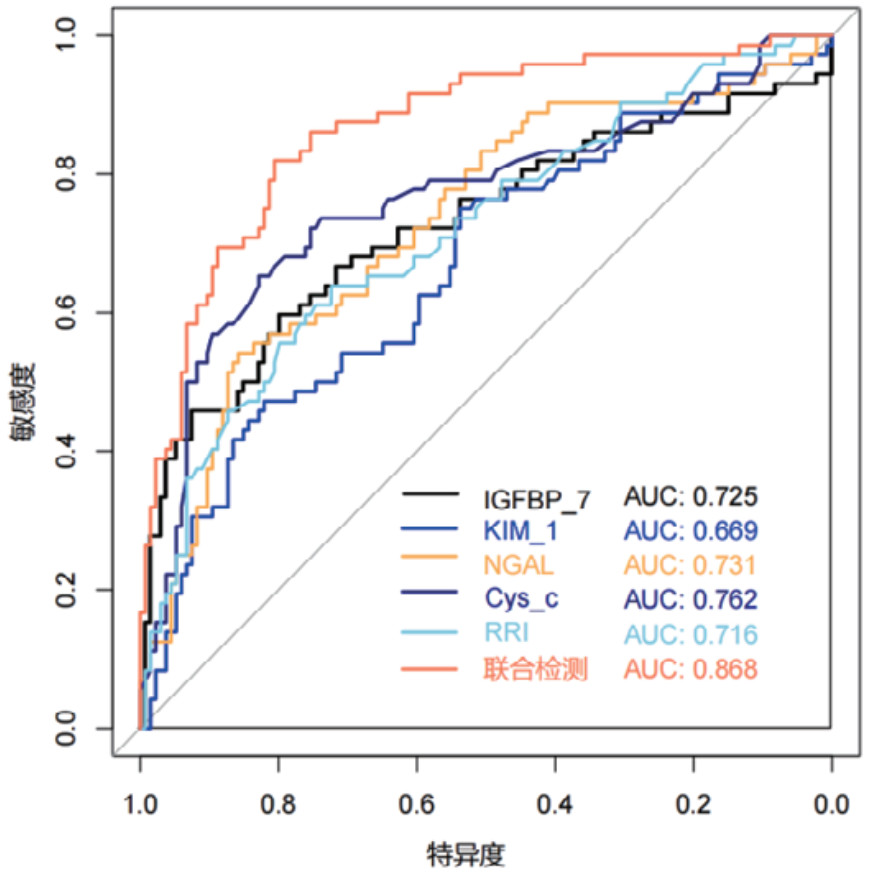
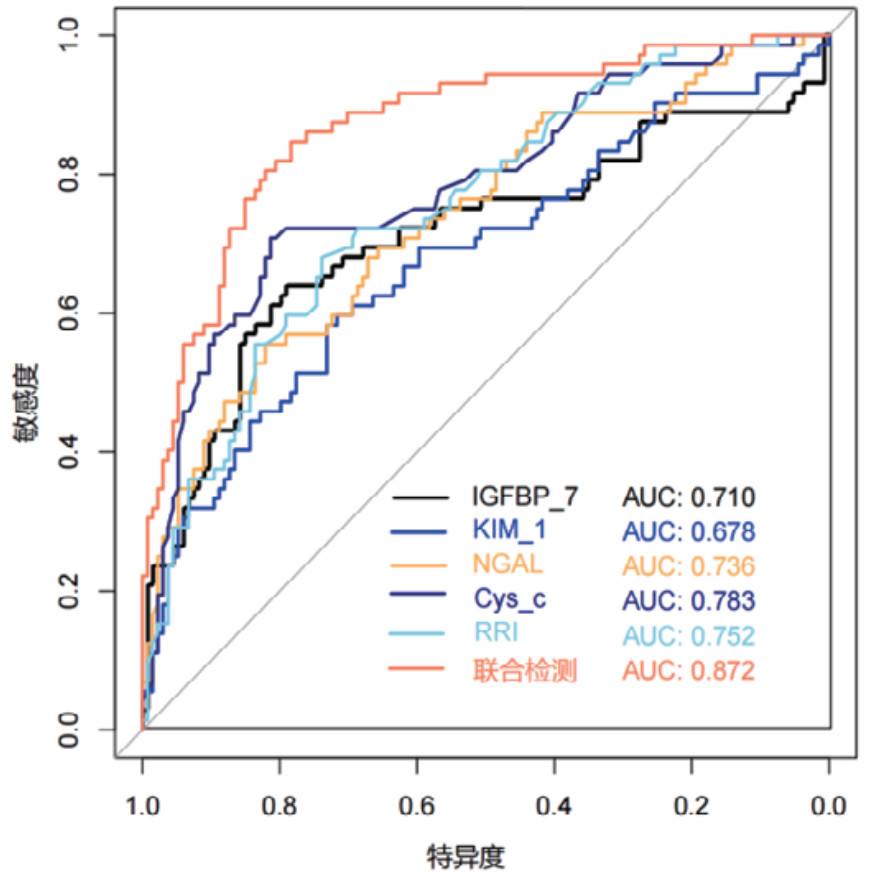
对各时间段血清Cys-C、IGFBP-7、KIM-1、NGAL和超声RRI水平及联合检测进行ROC曲线绘制,计算不同时间段联合检测的AUC值、最佳截断值、敏感度、特异度和约登指数。结果显示,联合检测0 h、12 h、24 h和48 h的AUC值分别为0.838(95%CI: 0.778~0.897)、0.852(95%CI: 0.797~0.907)、0.868(95%CI: 0.816~0.921)和0.872(95%CI: 0.820~0.924),见表 3。不同时段的AUC值提示联合检测的诊断效能要高于单项指标检测,结果见图 2、图 3、图 4和图 5。各指标各时间段的详细回归系数、标准误、P值、比值比(OR)及其95%置信区间见补充表S1。
| 检测变量 | AUC | 95%CI | 截断值 | 敏感度 | 特异度 | 约登指数 |
| 联合检测(0 h) | 0.838 | 0.778~0.897 | 0.403 | 69.44% | 82.83% | 0.523 |
| 联合检测(12 h) | 0.852 | 0.797~0.907 | 0.316 | 79.17% | 79.10% | 0.583 |
| 联合检测(24 h) | 0.868 | 0.816~0.921 | 0.309 | 81.94% | 80.60% | 0.625 |
| 联合检测(48 h) | 0.872 | 0.820~0.924 | 0.272 | 84.72% | 78.36% | 0.631 |
|
| 图 2 单项和联合检测0 h的ROC曲线 |
|
|
|
| 图 3 单项和联合检测12 h的ROC曲线 |
|
|
|
| 图 4 单项和联合检测24 h的ROC曲线 |
|
|
|
| 图 5 单项和联合检测48h的ROC曲线 |
|
|
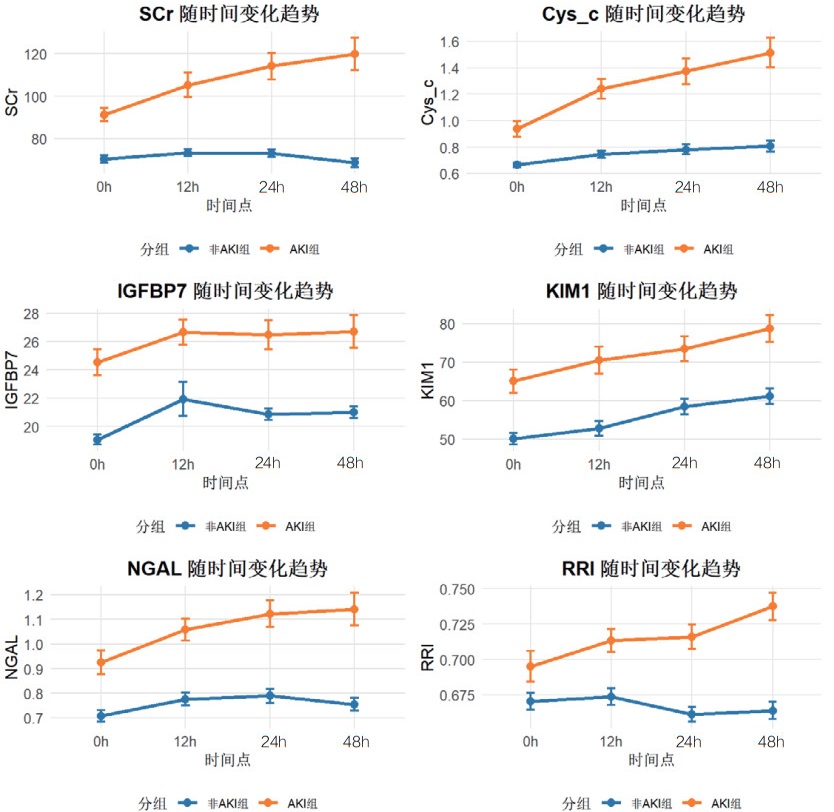
为了动态观察急性肾损伤相关生物标志物及肾阻力指数的变化,绘制了AKI组与非AKI组在0 h、12 h、24 h和48 h四个时间点的血清Cys-C、IGFBP-7、KIM-1、NGAL和超声RRI水平的变化趋势图,见图 6。动态监测显示,AKI组患者血清Cys-C、IGFBP-7、KIM-1、NGAL水平及超声RRI值在各时间点均显著高于非AKI组,且呈现不同的时间变化模式。
|
| 图 6 各指标随时间变化的趋势图 |
|
|
AKI是一种由各种原因引起的急性综合征,在ICU危重症患者中较为常见,特别是脓毒症患者和重症颅脑损伤患者。研究表明AKI患者发生慢性肾病和终末期肾病的可能性增加,且AKI持续时间与预后密切相关,其中AKI持续时间 > 48 h的患者病死率显著增高[12-13]。因此早期识别持续性高危AKI对改善患者肾功能及预后非常重要。相关文献表明,国内研究发现重症颅脑损伤患者AKI的发生率约为29.6%,AKI会导致患者不良预后,且AKI组患者病死率要明显高于非AKI组(31.3% vs. 10.5%)[14]。AKI的发展受多方面因素影响,如血管内容量不足、腹内压升高、横纹肌溶解或脓毒症,以及患者自身的年龄、缺血性心脏病或动脉硬化疾病等[15]。其中脑-肾串扰机制较为复杂,脑损伤可能通过激活交感神经系统、肾素-血管紧张素-醛固酮和糖皮质激素的神经内分泌通路,损害肾脏的自动调节功能,进而诱发AKI[16]。此外,全身炎症反应和特定大脑区域的直接病变也被认为是AKI发展的核心机制。在诊断与预防方面,近年来,临床对AKI生物标志物的研究取得了显著进展,如尿中性粒细胞明胶酶相关脂质运载蛋白(uNAGL)在预测AKI发生和预后中展现出良好的效能,为早期诊断提供了新工具[17]。同时,通过优化颅内压管理、避免使用肾毒性药物、调整药物剂量等措施,可以有效预防AKI的发生。对于已发生AKI的重症颅脑损伤患者,肾脏替代治疗是重要的治疗手段,但需注意其对脑血流量、颅内压和脑组织氧合的潜在影响,未来的研究应继续探索更优化的治疗方案,以减轻AKI相关并发症,提高患者预后。
近年来,通过对各种生物标志物研究的深入,发现血清NGAL、Cys-C、KIM-1、IGFBP-7以及床旁肾脏超声测定的RRI在AKI早期诊断中展现出巨大的潜力。血清NGAL是肾脏损伤后发生AKI时在血液和尿液中发现的一种关键多肽,可作为肾小管上皮细胞损伤的早期敏感标志物,其机制可能与肾小管上皮细胞的应激反应和损伤修复过程有关[18]。国外研究发现,在与万古霉素相关的AKI患者中NGAL水平变化平均要比肌酐水平早3 d,在顺铂化疗相关的AKI中则为4.5 d,早期NGAL水平的变化可在一定程度上预测AKI的发生[19]。Cys-C是反映肾小球滤过功能的内源性标志物,其水平升高与肾功能下降有关,在AKI早期诊断和临床预后中都具有良好的预测价值[20-21]。另有相关文献表明,NGAL、Cys-C在肾移植术前后肾功能指标检测中敏感度、准确性和时效性方面要优于传统的肌酐和尿素氮指标[22]。KIM-1是一种1型跨膜糖蛋白,是肾小管上皮细胞损伤的特异度标志物,其表达上调与肾小管上皮细胞的去分化和再生密切相关,KIM-1不仅能监测AKI的病程演变,还能预测患者发生AKI的风险[23]。IGFBP-7是一种胰岛素样生长因子结合蛋白,参与调节细胞增殖、分化和凋亡等生物过程,和TIMP-2都属于G1细胞周期阻滞的诱导剂。TIMP-2是一种基质金属蛋白酶抑制因子,它能够特异度抑制金属蛋白酶的胶原和明胶分解活性,减少细胞外基质的代谢降解,进而维护肾脏结构的完整性。在AKI发生时,肾脏受到缺血、缺氧、毒性物质等多种因素的损伤,导致肾小管上皮细胞受损和功能障碍,此时IGFBP-7和TIMP-2的表达水平会发生变化,成为反映肾脏损伤程度和预测疾病进展结局的重要指标。床旁肾脏超声测定的RRI是反映肾脏灌注状态的重要指标,其变化早于尿量和血肌酐的变化,对于预测AKI风险具有较高的价值。RRI的优势在于低成本和动态监测,它有助于及早发现肾脏功能损害趋势,为早期干预提供依据。
由于AKI发病机制复杂多样,依靠单一标志物检测难以准确全面的反映AKI的各种变化,尽管目前已有很多研究证实了这些生物标记物存在诊断价值,但是其综合诊断效能仍难以满足临床需要,特别是在重症颅脑损伤合并早期AKI这一领域。本研究发现,单一生物标志物在诊断AKI时存在局限性,而通过联合检测可弥补不足,提高诊断的敏感度和特异度。血NGAL、Cys-C、KIM-1、IGFBP-7联合RRI可从不同角度反映肾脏损伤情况,反映肾脏损伤的多方面特征。其中,NGAL在肾小管上皮细胞受损后迅速升高,能够反映肾脏的急性损伤情况;Cys-C能通过肾小球滤过并在近曲小管重吸收,其水平变化与肾小球滤过率密切相关;KIM-1在肾小管上皮细胞受损后表达增加,能够反映肾小管的损伤程度;IGFBP-7是细胞周期阻滞因子,能促进肾小管细胞基因的整合修复,RRI指标能监测肾脏血流灌注情况,这些指标联合检测可更加全面地评估肾脏损伤的严重程度和类型。
本研究结果显示,既往存在肾脏疾病是发生AKI的危险因素,AKI患者早期SCr和BUN水平显著高于非AKI组患者,AKI组患者的eGFR指标更低。其次,AKI组患者在0 h、12 h、24 h和48 h时间段内,血清NGAL、Cys-C、KIM-1、IGFBP-7水平及超声RRI值均高于非AKI组更高。这一结果提示,该生物标志物和RRI值的变化可以作为AKI早期诊断的敏感指标。此外,RRI值的升高也反映了肾脏血管阻力的增加和肾脏血流灌注的减少,是AKI发生的重要预测因素。但是单一指标的检测存在局限性,各项指标绘制的ROC曲线AUC值相对偏低,联合检测的AUC值优于各单项指标检测,其中联合检测48 h的AUC值最高为0.872(95%CI: 0.820~0.924),且敏感度和特异度相对较高。对各时间段联合检测指标显示各时间段预测性能比较接近,AUC值均大于0.8,提示联合检测稳定性和预测性能良好。此外,对各指标随时间变化的动态监测显示,Cys-C和KIM-1呈持续上升趋势,IGFBP-7在12 h达峰值后略有下降,NGAL在早期即显著升高并维持高水平,RRI随时间推移逐渐上升。这些指标的动态监测为AKI的早期识别、严重程度评估和预后判断提供了重要依据。不同指标在时间维度上的变化特征也反映了AKI发生发展过程中不同的病理生理机制。
本研究存在一些创新性和局限性。本研究中NGAL,Cys-C,KIM-1,IGFBP-7这些指标作为早期诊断AKI的指标在既往文献中有广泛报道[24],但是既往研究多侧重于单一或少数几个生物标志物的组合,大多数研究集中于脓毒症、心脏术后等群,而专门针对重症颅脑损伤这一AKI高发人群的研究相对较少,并且缺少动态监测的变化趋势。此外,本研究首次在重症颅脑损伤这一特定高危人群中,将反映不同病理生理维度的五个关键指标进行联合。这种生物标志物联合影像学指标的多模态联合诊断模式,相对于其他诊断模型更加全面立体。然而,本研究仍存在一些局限性。首先从经济方面分析,本研究检测指标较多,花费较多人力物力,虽然预测性能良好,但成本较高,后续可能需要进一步优化成本,距离实际临床应用仍有差距。其次本研究受限于医院规模及人力经济成本,各项指标监测时间偏短,未能跟进各指标48 h后的趋势变化情况,因此联合检测的效能对比肾脏损伤金标准(KDIGO标准)仍有较大的差距,模型仍需进一步完善。另外本研究入组病种相对单一,未纳入脓毒症相关AKI及其他疾病继发AKI患者样本,后续需进一步研究不同AKI情况下联合检测的诊断效能。
综上所述,血NGAL、Cys-C、KIM-1、IGFBP-7联合RRI对重症颅脑损伤患者AKI的早期诊断具有一定的诊断预测价值,能从不同角度评估肾脏功能变化,早期联合检测能够提高AKI诊断的敏感度和特异度。因此,在对重症颅脑损伤患者的治疗中,医务人员应加强对此类生物标志物和RRI值的监测和评估,以便及时发现并治疗AKI,从而进一步降低重症颅脑损伤患者的病死率和并发症发生率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张晓明:研究设计,论文审阅、指导;张添添:数据收集,统计分析,起草文章;蒋王莹、陈妍如:采集数据、解释数据;杨梅玉:数据整理核对、技术和材料支持;方帅:数据分析、论文审阅、指导
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
| [1] | de Cássia Almeida Vieira R, de Barros GL, Paiva WS, et al. Severe traumatic brain injury and acute kidney injury patients: factors associated with in-hospital mortality and unfavorable outcomes[J]. Brain Inj, 2024, 38(2): 108-118. DOI:10.1080/02699052.2024.2304885 |
| [2] | 李晓玲, 李芳芳, 尹佳萌, 等. 血清中性粒细胞明胶酶相关载脂蛋白、核转录因子-κB及血清肌酐对重症急性胰腺炎伴急性肾损伤的预测价值[J]. 中华生物医学工程杂志, 2022, 28(1): 49-53. DOI:10.3760/cma.j.cn115668-20211018-00103 |
| [3] | Luu D, Komisarow J, Mills BM, et al. Association of severe acute kidney injury with mortality and healthcare utilization following isolated traumatic brain injury[J]. Neurocrit Care, 2021, 35(2): 434-440. DOI:10.1007/s12028-020-01183-z |
| [4] | 刘瑞清, 孟志云, 褚洪光, 等. 脓毒症患者血清NGAL、KIM-1、Cys-C对急性肾损伤的诊断能效[J]. 中国医药导报, 2019, 16(29): 128-131. |
| [5] | 厉兆春, 张树立, 张勇. 脓毒症急性肾损伤NGAL、KIM-1、Cys-C联检对肾脏替代治疗预后的预测价值研究[J]. 临床和实验医学杂志, 2019, 18(6): 619-623. DOI:10.3969/j.issn.1671-4695.2019.06.018 |
| [6] | 周文杰, 张楠, 马斯荣, 等. 肾动脉阻力指数及尿血管紧张素原对脓毒症急性肾损伤患者早期诊断的临床价值[J]. 中华危重病急救医学, 2022, 34(11): 1183-1187. DOI:10.3760/cma.j.cn121430-20220302-00194 |
| [7] | Levey AS, Eckardt KU, Dorman NM, et al. Nomenclature for kidney function and disease: report of a Kidney Disease: Improving Global Outcomes (KDIGO) Consensus Conference[J]. Kidney Int, 2020, 97(6): 1117-1129. DOI:10.1016/j.kint.2020.02.010 |
| [8] | Bodien YG, Barra A, Temkin NR, et al. Diagnosing level of consciousness: the limits of the Glasgow Coma Scale total score[J]. J Neurotrauma, 2021, 38(23): 3295-3305. DOI:10.1089/neu.2021.0199 |
| [9] | Haase M, Devarajan P, Haase-Fielitz A, et al. The outcome of neutrophil gelatinase-associated lipocalin-positive subclinical acute kidney injury: a multicenter pooled analysis of prospective studies[J]. J Am Coll Cardiol, 2011, 57(17): 1752-1761. DOI:10.1016/j.jacc.2010.11.051 |
| [10] | Kashani K, Al-Khafaji A, Ardiles T, et al. Discovery and validation of cell cycle arrest biomarkers in human acute kidney injury[J]. Crit Care, 2013, 17(1): R25. DOI:10.1186/cc12503 |
| [11] | 李萍珠, 徐炜新. 脓毒血症并发急性肾损伤早期诊断标志物的研究[J]. 中华检验医学杂志, 2010, 33(6): 492-496. DOI:10.3760/cma.j.issn.1009-9158.2010.06.003 |
| [12] | Ferenbach DA, Bonventre JV. Acute kidney injury and chronic kidney disease: From the laboratory to the clinic[J]. Nephrol Ther, 2016, 12((Suppl 1): S41-S48. DOI:10.1016/j.nephro.2016.02.005 |
| [13] | Xia WH, Yi F, Wang QB. Mortality and differential predictive factors of transient and persistent sepsis-associated acute kidney injury[J]. Clin Nephrol, 2023, 99(3): 119-127. DOI:10.5414/CN110926 |
| [14] | 池锐彬, 邹启明, 叶铨秋, 等. 急性重型颅脑损伤并发急性肾损伤患者临床预后分析[J]. 临床急诊杂志, 2018, 19(7): 472-475. DOI:10.13201/j.issn.1009-5918.2018.07.013 |
| [15] | 高田, 王淦楠, 王巍, 等. 横纹肌溶解综合征相关的急性肾损伤的危险因素分析[J]. 中国中西医结合肾病杂志, 2023, 24(3): 252-253. DOI:10.3969/j.issn.1009-587X.2023.03.017 |
| [16] | 耿强, 如克艳木·吾斯曼, 张静静, 等. 糖尿病合并急性肾损伤相关心肾综合征发病机制的研究进展[J]. 中国现代医生, 2023, 61(20) 119-121, 135. DOI:10.3969/j.issn.1673-9701.2023.20.027 |
| [17] | 田爱民, 王美蓉, 车吉忠, 等. 尿中性粒细胞明胶酶相关脂质运载蛋白、肝型脂肪酸结合蛋白对成人泌尿系统疾病致急性肾损伤诊断价值及检测临床意义[J]. 陕西医学杂志, 2023, 52(11): 1588-1592. DOI:10.3969/j.issn.1000-7377.2023.11.030 |
| [18] | Barreto R, Elia C, Solà E, et al. Urinary neutrophil gelatinase-associated lipocalin predicts kidney outcome and death in patients with cirrhosis and bacterial infections[J]. J Hepatol, 2014, 61(1): 35-42. DOI:10.1016/j.jhep.2014.02.023 |
| [19] | Yoon SY, Kim JS, Jeong KH, et al. Acute kidney injury: biomarker-guided diagnosis and management[J]. Medicina, 2022, 58(3): 340. DOI:10.3390/medicina58030340 |
| [20] | Yang H, Lin CL, Zhuang CY, et al. Serum Cystatin C as a predictor of acute kidney injury in neonates: a meta-analysis[J]. J Pediatr, 2022, 98(3): 230-240. DOI:10.1016/j.jped.2021.08.005 |
| [21] | 戴成才, 程振兴, 涂倩倩. 血清胱抑素C联合床旁肾脏超声对脓毒症急性肾损伤患者预后情况的评估价值[J]. 实用医学杂志, 2024, 40(22): 3226-3231. DOI:10.3969/j.issn.1006-5725.2024.22.018 |
| [22] | 丁修冬, 张翼, 白光亮, 等. 肾移植术前、后的NGAL、补体C1q、sd-LDL、Cys-C等各指标化及其临床意义[J]. 标记免疫分析与临床, 2021, 28(5): 773-778. DOI:10.11748/bjmy.issn.1006-1703.2021.05.012 |
| [23] | 金婷婷, 蔺雪, 尤伟艳, 等. 脓毒症急性肾损伤患者THBS1、TRAF-6、KIM-1、NLRP3水平及其与病情程度的关系[J]. 中华医院感染学杂志, 2025, 35(4): 518-522. DOI:10.11816/cn.ni.2025-240823 |
| [24] | 张杨. TIMP2和IGFBP7的生物学功能及其在肾脏损伤过程中作用的研究进展[J]. 复旦学报(医学版), 2021, 48(5): 671-679. DOI:10.3969/j.issn.1672-8467.2021.05.016 |
 2025, Vol. 34
2025, Vol. 34