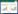2. 河北医科大学附属沧州市中心医院急诊医学部, 沧州 061000
2. Department of Emergency Medicine, Cangzhou Central Hospital of Hebei Medical University, Cangzhou 061000, China
心搏骤停是全球范围内的重大公共卫生事件,病死率高,且存活患者常面临较差的神经功能预后[1-3]。据统计,中国心搏骤停总体发病率为97.1/10万,尽管心肺复苏(cardiopulmonary resuscitation,CPR)技术和急救资源的不断改进,但心搏骤停患者出院良好神经功能率仅为0.8%[4]。因此,心搏骤停患者神经功能预后的准确评估及预测仍是一个亟待解决的难题。脑电图(electroencephalogram,EEG)作为一种非侵入性的诊断工具,是ICU重要的神经功能监测的神经电生理技术[5]。而振幅整合脑电图(amplitude-integrated EEG,aEEG)是基于传统脑电监测技术发展的一种改进方法,其通过多通道电极在特定脑区采集神经电生理信号,经数据压缩处理后以可视化振幅曲线反映大脑皮层的功能状态[6]。该技术通过优化电极布局和信号处理方式,以更直观地呈现皮质神经元活动的整体趋势特征[7],可规避EEG需依赖于专业技术人员的操作和解读的弊端[8],且aEEG的使用不受镇静药物及肌肉麻痹药物影响,可在治疗过程中持续监测脑功能[9]。目前,aEEG已逐渐应用于脑损伤患者神经功能预后的评估[10]。本研究旨在探讨早期aEEG振幅变异度动态监测在心搏骤停患者神经功能预后中的预测价值,通过计算入院时即刻、12 h及24 h 3个时间节点的aEEG振幅变异度动态评估心搏骤停患者的神经功能预后,为心搏骤停患者的早期神经功能预后提供更为精准的评估手段。
1 资料与方法 1.1 研究对象本研究为回顾性分析。选择2020年12月至2024年10月在沧州市中心医院急诊ICU收治的52例心搏骤停患者作为研究对象。纳入标准:①心搏骤停后接受CPR患者;②年龄≥18岁;③接受aEEG监测;④临床资料完整。排除标准:①因颅脑外伤或既往中枢性神经系统疾病引起心搏骤停患者;②恶性肿瘤患者;③中途转院或放弃治疗;④入院后存活时间 < 24 h;⑤妊娠或哺乳期。
本研究遵循临床医学伦理准则,并经沧州市中心医院伦理委员会批准(伦理审批文号:2024-1216-01), 豁免知情同意。
1.2 资料收集与患者分组收集患者年龄、性别,既往病史(高血压、糖尿病、冠心病及脑卒中),心搏骤停发病原因、初始心律、旁观者CPR、无复流时间、低复流时间、肾上腺素用量及入院时的化验指标,包括丙氨酸氨基转移酶、血乳酸、血肌酐及神经元特异度烯醇化酶(neuron-specific enolase,NSE)。无复流时间定义为:从心搏骤停到开始CPR的时间;低复流时间定义为:从CPR到自主循环恢复时间[11]。
根据心搏骤停后90 d时的格拉斯哥-匹兹堡神经功能(Glasgow-Pittsburgh cerebral performance categories,CPC)分级将患者分为良好神经功能组(1~2级)和不良神经功能组(3~5级)。CPC 1级为清醒警觉,有工作和正常生活能力,轻微后遗症;CPC 2级为清醒,可在特定环境中部分时间工作或独立完成日常活动,可能存在偏瘫、癫痫发作等后遗症;CPC 3级为清醒,需要依赖他人日常帮助,至少存在有限的认知力,脑功能异常;CPC 4级为无知觉,对环境无意识,无认知力,与周围的人无交流;CPC 5级为脑死亡。
1.3 aEEG变异度计算所有患者均在心搏骤停后24 h内接受连续aEEG(制造商:Natus Neurology Incorporated,美国)监测,并记录其连接aEEG即刻及12 h、24 h三个时间点的振幅上下边界,分别计算12 h、24 h相对于入院时即刻的上/下边界振幅变异度。振幅变异度计算方法举例如下:12 h上边界振幅变异度=(12 h上边界振幅-入院时即刻上边界振幅)/入院时即刻上边界振幅×100%。在采集过程中,观察aEEG波形,排除伪迹较多的时间段,在波形稳定时连续监测3~5 min,选取波形稳定且频次最高的边界振幅值。
1.4 样本量计算本研究根据每个变量事件指标计算样本量,根据已发表文献的结果,预期心搏骤停良好神经功能率约为10~40%[12-13],进入Logistic回归分析的因素有5个,依据样本量计算公式:样本量=变量数×10÷事件发生率,本研究所需最小样本量为200例(5×10÷0.25=200例)[14]。
1.5 统计学方法使用R语言软件进行统计学处理。计量资料以均数±标准差(x±s)或中位数(四分位数间距)M(Q1,Q3)表示,组间采用成组t检验或Mann-Whitney U检验,计数资料以构成比表示,采用χ2检验或Fisher确切概率法。将单因素Logistic回归分析中P < 0.05的变量纳入多因素Logistic回归分析筛选心搏骤停患者良好神经功能的危险因素。选取患者入院时即刻、12 h及24 h 3个时间节点,采用受试者工作特征曲线(receiver operator characteristic curve,ROC曲线)评价3个时间节点aEEG振幅变异度对心搏骤停患者神经功能预后的预测价值,同时基于12 h aEEG联合NSE构建列线图模型,用10倍交叉验证方式评估模型的泛化能力,通过校准曲线评估列线图模型的预测价值。以P < 0.05为差异具有统计学意义。
2 结果 2.1 两组患者的一般资料。本研究共纳入52例心搏骤停复苏成功患者,其中12例患者具有良好神经功能预后,患者90 d良好神经功能率为23.1%(12/52)。良好神经功能预后组患者年龄24~72岁,平均年龄54.8岁;不良神经功能预后组患者年龄33~97岁,平均年龄63.6岁。两组患者在年龄、高血压史、初始可除颤心律、低复流时间、肾上腺素用量、丙氨酸氨基转移酶、血肌酐、NSE、12 h上边界振幅变异度、12 h下边界振幅变异度、24 h上边界振幅变异度、24 h下边界振幅变异度比较差异均有统计学意义(均P < 0.05),见表 1。
| 临床特征 | 不良神经功能组(n=40) | 良好神经功能组(n=12) | Z/χ2值 | P值 |
| 年龄(岁)a | 66(56.5,73.0) | 56.5(54.3,63.0) | 2.15 | 0.031 |
| 男性(n, %) | 27(67.5) | 10(83.3) | — | 0.470b |
| 高血压史(n, %) | 20(50.0) | 2(16.7) | 4.20 | 0.040 |
| 糖尿病史(n, %) | 14(35.0) | 3(25.0) | — | 0.729b |
| 冠心病史(n, %) | 16(40.0) | 6(50.0) | 0.38 | 0.539 |
| 脑卒中史(n, %) | 7(17.5) | 1(8.3) | — | 0.663b |
| 心源性心搏骤停(n, %) | 22(55.0) | 8(66.7) | 0.52 | 0.473 |
| 脑源性心搏骤停(n, %) | 8(20.0) | 1(8.3) | — | 0.666b |
| 旁观者CPR(n, %) | 27(67.5) | 9(75.0) | — | 0.733b |
| 初始可除颤心律(n, %) | 9(22.5) | 8(66.7) | — | 0.011b |
| 无复流时间(min)a | 3(1,6) | 2(1,2.75) | 1.78 | 0.076 |
| 低复流时间(min)a | 19(13.3,30) | 8(5.3,15.5) | 2.86 | 0.004 |
| 肾上腺素用量(mg)a | 9(6.3,12.8) | 2.5(0.0,7.0) | 2.93 | 0.003 |
| 丙氨酸氨基转移酶(U/L)a | 90.8(38.2,199.1) | 40.5(22.2,59.6) | 2.47 | 0.014 |
| 血乳酸(mmol/L)a | 10.3(5.1,13.7) | 5.6(1.5,11.3) | 1.55 | 0.120 |
| 血肌酐(μmol/L)a | 113(96.8,174.8) | 83.5(67.8,107.5) | 2.96 | 0.003 |
| NSE(ng/mL)a | 48.8(22.3,98.0) | 15.3(8.3,34.9) | 2.80 | 0.005 |
| 12 h上边界振幅变异度(%)a | 0(-35.42,16.67) | 90.0(31.6,154.2) | 3.82 | < 0.001 |
| 12 h下边界振幅变异度(%)a | -4.6(-40.6,33.3) | 50.0(25.9,158.3) | 3.21 | 0.001 |
| 24 h上边界振幅变异度(%)a | -16.7(-35.1,24.1) | 33.3(3.9,160.4) | 2.72 | 0.007 |
| 24 h下边界振幅变异度(%)a | -15.5(-60.2,30.6) | 36.1(-7.5,95.8) | 2.55 | 0.011 |
| 注:CPR为心肺复苏,NSE为神经元特异烯醇化酶,:a 为M(Q1,Q3),b为Fisher确切概率法 | ||||
单因素Logistic回归分析结果显示,初始可除颤心律、低复流时间、肾上腺素用量、NSE、12 h上/下边界振幅变异度、24 h上边界振幅变异度为心搏骤停患者良好神经功能预后的独立危险因素(均P < 0.05),见表 2。多因素Logistic回归分析结果显示,NSE、12 h上边界振幅变异度、12 h下边界振幅变异度及24 h上边界振幅变异度为心搏骤停患者良好神经功能预后的独立危险因素(均P < 0.05),见表 3。
| 指标 | OR | 95%CI | P值 |
| 年龄 | 0.957 | 0.913~1.003 | 0.068 |
| 男性 | 2.407 | 0.460~12.612 | 0.298 |
| 高血压史 | 0.200 | 0.039~1.031 | 0.054 |
| 糖尿病史 | 0.619 | 0.144~2.664 | 0.519 |
| 冠心病史 | 1.071 | 0.289~3.973 | 0.918 |
| 脑卒中史 | 0.429 | 0.047~3.882 | 0.451 |
| 心源性心搏骤停 | 1.636 | 0.423~6.326 | 0.475 |
| 脑源性心搏骤停 | 0.364 | 0.041~3.245 | 0.365 |
| 旁观者CPR | 1.138 | 0.259~4.997 | 0.864 |
| 初始可除颤心律 | 6.889 | 1.680~28.249 | 0.007 |
| 无复流时间 | 0.708 | 0.489~1.024 | 0.067 |
| 低复流时间 | 0.896 | 0.820~0.979 | 0.015 |
| 肾上腺素用量 | 0.792 | 0.669~0.937 | 0.006 |
| 丙氨酸氨基转移酶 | 0.982 | 0.964~1.001 | 0.058 |
| 血乳酸 | 0.902 | 0.794~1.025 | 0.115 |
| 血肌酐 | 0.981 | 0.962~1.000 | 0.052 |
| NSE | 0.974 | 0.950~0.999 | 0.045 |
| 12 h上边界振幅变异度 | 1.007 | 1.001~1.014 | 0.025 |
| 12 h下边界振幅变异度 | 1.007 | 1.001~1.014 | 0.033 |
| 24 h上边界振幅变异度 | 1.007 | 1.001~1.013 | 0.025 |
| 24 h下边界振幅变异度 | 1.005 | 0.999~1.012 | 0.121 |
| 注:CPR为心肺复苏,NSE为神经元特异烯醇化酶 | |||
| 指标 | OR | 95%CI | P值 |
| 初始可除颤心律 | 3.839 | 0.556~26.493 | 0.172 |
| NSE | 0.974 | 0.950~0.999 | 0.038 |
| 肾上腺素用量 | 0.946 | 0.759~1.178 | 0.619 |
| 低复流时间 | 0.940 | 0.846~1.044 | 0.250 |
| 12 h上边界振幅变异度 | 1.014 | 1.002~1.027 | 0.026 |
| 注:NSE为神经元特异烯醇化酶 | |||
aEEG中,12 h上/下边界振幅变异度、24h上边界振幅变异度对良好神经功能预后均有预测价值(均P < 0.05),其中,12 h上边界振幅变异度预测价值最优,AUC为0.866(95%CI:0.756~0.976),当最佳临界值为26.4%时,敏感度为83.3%,特异度为80%。见表 4。
| 指标 | AUC(95%CI) | 最佳临界值 | 敏感度(%) | 特异度(%) |
| 12 h上边界振幅变异度 | 0.866(95%CI: 0.756~0.976) | 26.4% | 83.3 | 80 |
| 12 h下边界振幅变异度 | 0.807(95%CI: 0.677~0.938) | 5.0% | 91.7 | 67.5 |
| 24 h上边界振幅变异度 | 0.760(95%CI: 0.611~0.910) | 13.9% | 75 | 72.5 |
| NSE | 0.769(95%CI: 0.617~0.920) | 18.3 | 80 | 75 |
| 注:AUC为曲线下面积 | ||||
基于12 h aEEG上边界振幅变异度联合NSE指标构建列线图模型,见图 1。

|
| 图 1 52例心搏骤停患者神经功能预后良好的列线图预测模型 Fig 1 Nomogram prediction model for good neurological function prognosis in 52 patients with cardiac arrest |
|
|
ROC曲线显示,NSE预测良好神经功能预后的AUC为0.769(95%CI: 0.613~0.924),12 h上边界振幅变异度预测良好神经功能预后的AUC为0.866(95%CI: 0.756~0.976),列线图模型预测的心搏骤停后良好神经功能预后的AUC为0.873(95%CI: 0.739~1.007)见图 2。
|
| ROC为受试者工作特征曲线,NSE为神经元特异度烯醇化酶 图 2 列线图模型12 h上边界变异度及NSE的ROC曲线比较 Fig 2 Comparison of nomogram model, 12 h boundary variation, and NSE by ROC curve |
|
|
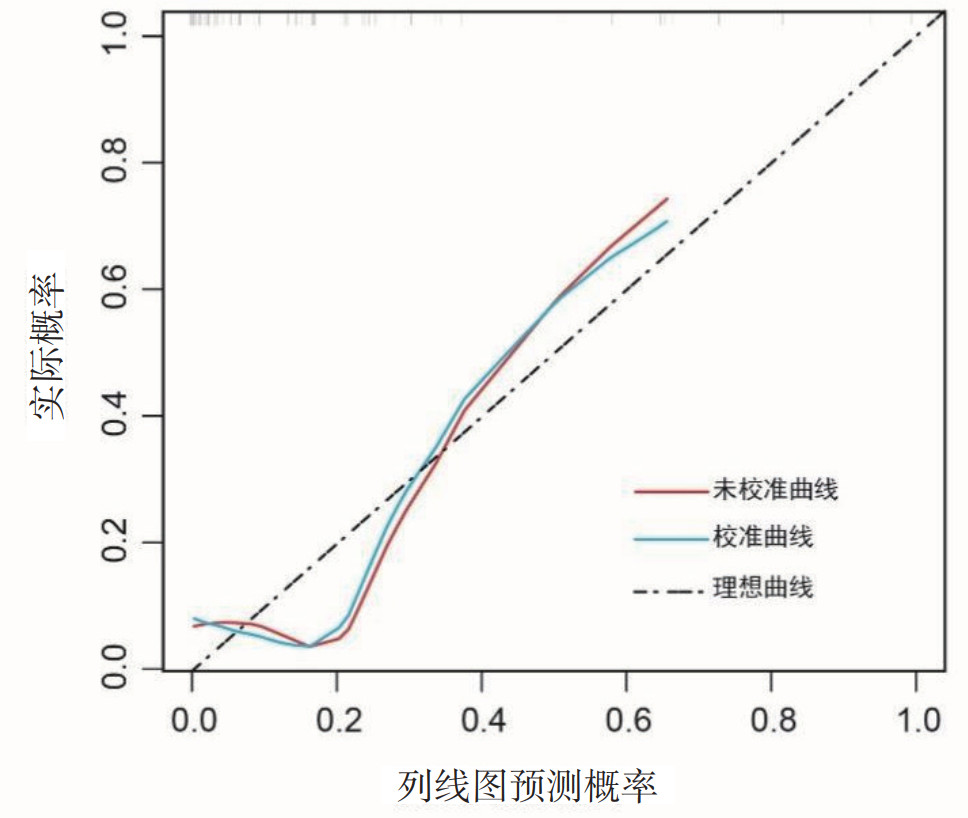
校准曲线显示,列线图模型的预测结果与观察结果之间均具有良好的一致性,见图 3。
|
| 图 3 列线图预测模型的校准曲线 Fig 3 Calibration curve of nomogram prediction model |
|
|
52例心搏骤停患者中,院内心搏骤停34例,院外心搏骤停18例。10倍交叉验证预测的AUC平均值为0.838。院内及院外心搏骤停患者预测价值的亚组分析,见表 5。ROC曲线显示,院内心搏骤停患者中,12 h上边界振幅变异度预测良好神经功能预后的AUC为0.884(95%CI:0.754~1.000),列线图模型预测良好神经功能预后的AUC为0.889(95%CI: 0.749~1.000);院外心搏骤停患者中,12 h上边界振幅变异度预测良好神经功能预后的AUC为0.878(95%CI: 0.711~1.000),列线图模型预测良好神经功能预后的AUC为0.889(95%CI: 0.656~1.000)。
| 指标 | AUC | 最佳临界值 | 敏感度(%) | 特异度(%) |
| 院内心搏骤停 | ||||
| 12 h上边界振幅变异度 | 0.884(95%CI: 0.754~1.000) | 26.4% | 77.8 | 84.0 |
| 列线图模型 | 0.889(95%CI: 0.749~1.000) | — | 77.8 | 88.0 |
| 院外心搏骤停 | ||||
| 12 h上边界振幅变异度 | 0.878(95%CI: 0.711~1.000) | 38.1% | 100 | 80.0 |
| 列线图模型 | 0.889(95%CI: 0.656~1.000) | — | 66.7 | 100 |
| 年龄 > 60岁的心搏骤停 | ||||
| 12 h上边界振幅变异度 | 0.825(95%CI: 0.581~1.000) | 83.3% | 75.0 | 92.0 |
| 列线图模型 | 0.840(95%CI: 0.547~1.000) | — | 75.0 | 96.0 |
| 年龄≤60岁的心搏骤停 | ||||
| 12 h上边界振幅变异度 | 0.875(95%CI: 0.732~1.000) | 26.4% | 87.5 | 73.3 |
| 列线图模型 | 0.892(95%CI: 0.759~1.000) | — | 75.0 | 86.7 |
| 注:AUC为曲线下面积 | ||||
52例心搏骤停患者中,年龄 > 60岁的心搏骤停29例,年龄≤60岁的心搏骤停23例。ROC曲线显示,年龄 > 60岁的心搏骤停患者中,12 h上边界振幅变异度预测良好神经功能预后的AUC为0.825(95%CI: 0.581~1.000),列线图模型预测良好神经功能预后的AUC为0.840(95%CI: 0.547~1.000);年龄≤60岁的心搏骤停患者中,12 h上边界振幅变异度预测良好神经功能预后的AUC为0.875(95%CI: 0.732~1.000), 列线图模型预测良好神经功能预后的AUC为0.892(95%CI: 0.759~1.000),见表 5。
3 讨论据统计,全世界范围内,心搏骤停发生率在0.05%~0.11%之间[15]。在中国,每年约有105万人发生院外心搏骤停,约21万人发生院内心搏骤停[16]。院外心搏骤停患者良好神经功能预后率为0.8%,院内心搏骤停患者良好神经功能预后率为6.7%[17]。研究表明,复苏成功的ICU住院患者,其良好神经功能预后率约10%~40%[12-13],这与本研究的结果相一致。
目前,aEEG已逐步应用于ICU神经功能损伤患者。心搏骤停发生后,脑组织因缺血-再灌注损伤导致神经元代谢紊乱[18-19],脑电活动受抑,振幅降低。动物实验表明,在脑损伤后72 h内aEEG振幅持续降低,特别是最初24 h内表现为aEEG振幅的严重异常[20]。早期低振幅与脑损伤患者较差预后相关。董鑫等[21]研究显示,aEEG高振幅与良好神经功能预后中度相关(r=0.78),预测心搏骤停患者良好神经功能的敏感度为95.7%,特异度为75%[21]。一项纳入17篇文献671例缺血缺氧性脑病患者的Meta分析结果表明,aEEG预测死亡或中度/重度残疾的阳性预测概率为97.9%[22],这表明aEEG有助于评估神经功能预后。
振幅变异度作为动态参数,可同时反映神经网络恢复潜力和脑血流自动调节功能状态[23],其背后的神经生理学机制可能在于:振幅的增加反映了大脑皮层神经网络同步化能力和复杂性的恢复,是神经可塑性过程的有效电生理标志。在严重脑损伤急性期,弥漫性神经元功能障碍导致神经网络去同步化,表现为aEEG背景活动单调、低振幅、无变异。随着脑损伤的修复,残存的神经元集群开始重建连接和同步化振荡能力,使得脑电背景活动振幅升高并出现正常的生理性波动[24]。
Ihara等[25]通过将aEEG模式分连续模式与非连续模式,证实连续模式与良好神经功能预后显著相关(阳性预测率为84.6%)。此外,Wu等[8]进一步量化上边界振幅、下边界振幅及电压跨度等静态参数,发现良好神经功能良好组的各项指标均显著高于不良神经功能组,但此研究仍未突破离散时间点测量的局限,且忽略脑电活动的时序演变特征。而本研究通过动态监测入院时即刻至24 h上/下边界振幅变化,量化脑电动态演变过程,发现12 h上边界振幅变异度的预测价值最优,能够有效弥补传统分级在时间维度上的信息缺失,对平衡心搏骤停患者的精准识别与医疗资源合理配置具有重要临床意义。
在生物标志物层面,NSE主要存在于神经元和神经内分泌细胞中,脑缺血缺氧时大量释放入血,血清水平与神经元损伤程度呈正相关[26]。NSE虽被证实具有预后价值,但敏感度(26%~57.8%)与时效性(最佳预测时间为72 h)存在局限[27]。本研究表明,12 h上边界振幅变异度的预测价值(AUC=0.866)高于NSE(AUC=0.769),同时整合NSE指标及12 h上边界振幅变异度两个指标,构建心搏骤停患者神经功能预后列线图预测模型,将AUC提升至0.873,显著优于单一指标。这一结果与夏卫平等提出的“多模态监测”理念一致,即联合电生理与神经元损伤标志物可更全面地评估脑损伤程度,指导脑保护治疗[28]。
初始可除颤心律、肾上腺素用量、低复流时间为心搏骤停患者预后的重要变量。续国武等研究显示,初始可除颤心律、肾上腺素用量、低复流时间与心搏骤停患者神经功能的密切相关[29]。相反,另外两篇研究显示,初始可除颤心律、低复流时间、肾上腺素用量与心搏骤停患者神经功能预后无关[11, 26],这与本研究的结果相一致。推测原因可能是初始可除颤心律、肾上腺素用量、低复流时间与自主循环恢复的关联更为密切,对神经功能预后的重要程度不及12 h上边界振幅变异度和NSE。
本研究存在一定的局限性。首先,本研究的样本量仅为52例,而预期最小样本量为200例,且本研究为单中心回顾性研究,可能影响研究结果的统计效力。其次,因心搏骤停患者aEEG研究较少,特别是上下边界振幅变异度的研究更少,Dryad、NCMI等公共数据库无相关的外部数据,因此本研究无法进行外部数据验证。其次,aEEG上下边界值的记录可能因为时间偏差而发生改变,尤其是下边界振幅较小,数据的偏倚容易造成一定的误差。第三,虽然aEEG可提高预测的准确性,但aEEG设备昂贵,设备本身便携性及操作复杂性亦有待改善,国内83%的心搏骤停发生在院外,救护车设备配置以生命支持为主、专业人员脑功能监测技能普遍不足,且生存链各环节(如旁观者CPR率、自动体外除颤仪覆盖率、送医时效等)尚不完善,更无法在现场进行aEEG的评估,aEEG目前仅适合在具备条件的医院内使用,难以在院外急救中普及。最后,当前24 h监测可能遗漏后期关键变化,未来研究计划将监测时间延长至48~72 h,以期探讨更多时间节点的振幅变异度在心搏骤停患者神经功能预后中的预测价值,并开展多中心前瞻性研究验证模型的普适性。
| [1] | 陈植炜, 官运杰, 张舒娇, 等. 初始复苏时不同通气方式对院内心脏骤停患者短期预后的影响[J]. 中华急诊医学杂志, 2025, 34(3): 382-388. DOI:10.3760/cma.j.issn.1671-0282.2025.03.015 |
| [2] | Hirsch KG, Abella BS, Amorim E, et al. Critical care management of patients after cardiac arrest: a scientific statement from the American heart association and neurocritical care society[J]. Circulation, 2024, 149(2): e168-e200. DOI:10.1161/CIR.0000000000001163 |
| [3] | 付钰, 张江涛, 范晓甜, 等. 心肺复苏术后神经功能预后不良相关研究进展[J]. 临床急诊杂志, 2023, 24(3): 160-166. |
| [4] | Zheng JQ, Lv CZ, Zheng W, et al. Incidence, process of care, and outcomes of out-of-hospital cardiac arrest in China: a prospective study of the BASIC-OHCA registry[J]. Lancet Public Health, 2023, 8(12): e923-e932. DOI:10.1016/S2468-2667(23)00173-1 |
| [5] | Dini G, Dell'Isola GB, Mencaroni E, et al. The impact of anti-seizure medications on electroencephalogram (EEG) results[J]. Expert Rev Neurother, 2023, 23(6): 559-565. DOI:10.1080/14737175.2023.2214315 |
| [6] | El-Dib M, Abend NS, Austin T, et al. Neuromonitoring in neonatal critical care part Ⅰ: neonatal encephalopathy and neonates with possible seizures[J]. Pediatr Res, 2023, 94(1): 64-73. DOI:10.1038/s41390-022-02393-1 |
| [7] | Zhang XM, Dai GH, Li K. Effectiveness of amplitude-integrated electroencephalography combined with neuron-specific enolase level in predicting neonatal brain injury and prognosis[J]. Am J Transl Res, 2024, 16(10): 5398-5408. DOI:10.62347/IXFJ7762 |
| [8] | Wu CI, Hsu PF, Lee IH, et al. Utilization of amplitude-integrated electroencephalography to predict neurologic function after resuscitation in adults with cardiogenic cardiac arrest[J]. Acta Cardiol Sin, 2021, 37(6): 632-642. DOI:10.6515/ACS.202111_37(6).20210630B |
| [9] | Cho SM, Farrokh S, Whitman G, et al. Neurocritical care for extracorporeal membrane oxygenation patients[J]. Crit Care Med, 2019, 47(12): 1773-1781. DOI:10.1097/CCM.0000000000004060 |
| [10] | Wang YP, Jiang Y, Mi L, et al. Developing predictive nomogram models using quantitative electroencephalography for brain function in type a aortic dissection: a prospective observational study[J]. Int J Surg, 2025, 111(3): 2398-2413. DOI:10.1097/JS9.0000000000002235 |
| [11] | 杨风梅, 马宝重, 孙强, 等. 血清神经丝轻链对院外心搏骤停患者神经功能的预测价值[J]. 中华急诊医学杂志, 2023, 32(3): 371-376. DOI:10.3760/cma.j.issn.1671-0282.2023.03.016 |
| [12] | Sun ZP, Yu DP, Li PJ, et al. Serum transactive response DNA binding protein 43 associates with poor short-term neurologic outcome after return of spontaneous circulation following cardiac arrest[J]. Shock, 2024, 62(3): 310-318. DOI:10.1097/SHK.0000000000002378 |
| [13] | Wang SL, Li N, Feng SY, et al. Serum neurofilament light chain as a predictive marker of neurologic outcome after cardiac arrest: a meta-analysis[J]. BMC Cardiovasc Disord, 2023, 23(1): 193. DOI:10.1186/s12872-023-03220-z |
| [14] | 贺星云, 刘晨, 杜俊泽, 等. 基于增强静脉期CT放射组学的甲状腺乳头状癌中央区淋巴结转移预测模型构建与验证[J]. 陆军军医大学学报, 2025, 47(12): 1367-1375. DOI:10.16016/j.2097-0927.202503007 |
| [15] | 吴仔弦, 杨思敏, 周保纯. 心搏骤停后综合征患者神经功能预后评估研究进展[J]. 中华脑血管病杂志(电子版), 2022, 16(3): 202-205. DOI:10.11817/j.issn.1673-9248.2022.03.011 |
| [16] | 浙江省急诊医学质量控制中心, 浙江省院前医疗急救质量控制中心, 浙江省心血管疾病介入诊疗质控中心, 等. 复苏中心建设浙江共识[J]. 中华急诊医学杂志, 2023, 32(4): 455-463. DOI:10.3760/cma.j.issn.1671-0282.2023.04.003 |
| [17] | 中国心脏骤停与心肺复苏报告编写组, 徐峰, 陈玉国. 中国心脏骤停与心肺复苏报告(2022年版)概要[J]. 中国循环杂志, 2023, 38(10): 1005-1017. DOI:10.3969/j.issn.1000-3614.2023.10.002 |
| [18] | Marasini S, Jia XF. Neuroprotective approaches for brain injury after cardiac arrest: current trends and prospective avenues[J]. J Stroke, 2024, 26(2): 203-230. DOI:10.5853/jos.2023.04329 |
| [19] | Yu SH, Xu JF, Wu CH, et al. Multi-omics study of hypoxic-ischemic brain injury after cardiopulmonary resuscitation in swine[J]. Neurocrit Care, 2025, 42(1): 59-76. DOI:10.1007/s12028-024-02038-7 |
| [20] | Barata L, Cabañas A, Lafuente H, et al. aEEG and neurologic exam findings correlate with hypoxic-ischemic brain damage severity in a piglet survival model[J]. Pediatr Res, 2019, 85(4): 539-545. DOI:10.1038/s41390-019-0282-2 |
| [21] | 董鑫, 邵换璋, 杨亚南, 等. 心肺脑复苏后患者振幅整合脑电图对脑功能预后的早期评价[J]. 中华危重病急救医学, 2017, 29(10): 887-892. DOI:10.3760/cma.j.issn.2095-4352.2017.10.005 |
| [22] | Del Río R, Ochoa C, Alarcon A, et al. Amplitude integrated electroencephalogram as a prognostic tool in neonates with hypoxic-ischemic encephalopathy: a systematic review[J]. PLoS One, 2016, 11(11): e0165744. DOI:10.1371/journal.pone.0165744 |
| [23] | Ameloot K, Meex I, Genbrugge C, et al. Hemodynamic targets during therapeutic hypothermia after cardiac arrest: a prospective observational study[J]. Resuscitation, 2015, 91: 56-62. DOI:10.1016/j.resuscitation.2015.03.016 |
| [24] | Massimini M, Corbetta M, Sanchez-Vives MV, et al. Sleep-like cortical dynamics during wakefulness and their network effects following brain injury[J]. Nat Commun, 2024, 15(1): 7207. DOI:10.1038/s41467-024-51586-1 |
| [25] | Ihara S, Sakurai A, Kinoshita K, et al. Amplitude-integrated electroencephalography and brain oxygenation for postcardiac arrest patients with targeted temperature management[J]. Ther Hypothermia Temp Manag, 2019, 9(3): 209-215. DOI:10.1089/ther.2018.0051 |
| [26] | 王淦楠, 张忠满, 张华忠, 等. 神经元特异度烯醇化酶、S-100b蛋白对体外心肺复苏患者神经功能预后的预测价值[J]. 中华急诊医学杂志, 2024, 33(12): 1704-1709. DOI:10.3760/cma.j.issn.1671-0282.2024.12.007 |
| [27] | Sandroni C, D'Arrigo S, Cacciola S, et al. Prediction of good neurological outcome in comatose survivors of cardiac arrest: a systematic review[J]. Intensive Care Med, 2022, 48(4): 389-413. DOI:10.1007/s00134-022-06618-z |
| [28] | Xia WP, Ai ML, Ma XH, et al. Application of high-quality targeted temperature management guided by multimodal brain monitoring in brain protection of patients with cardiac arrest: a case series[J]. Medicine (Baltimore), 2024, 103(51): e40943. DOI:10.1097/MD.0000000000040943 |
| [29] | 续国武, 王晋祥, 靳衡. 早期多指标监测预测心脏骤停后脑损伤患者神经功能预后的价值[J]. 中华急诊医学杂志, 2023, 32(12): 1674-1679. DOI:10.3760/cma.j.issn.1671-0282.2023.12.017 |
 2025, Vol. 34
2025, Vol. 34