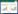急性脑损伤是由外部机械力(创伤)或内部病理生理过程(缺血、缺氧、代谢、中毒等因素)引起的脑组织结构和(或)功能紊乱。这种损伤可导致一系列继发性病理生理级联反应,并最终表现为中枢神经系统的急性功能障碍。本共识所关注的急性脑损伤类型包括创伤性颅脑损伤(traumatic brain injury,TBI)、心脏骤停(cardiac arrest,CA)后脑损伤、脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)、急性脑卒中和急性中毒性脑损伤等[1-7]。根据其病理生理机制可分为直接脑损伤(如TBI)、缺血性/缺氧性脑损伤(如CA、脑卒中等)和代谢性/中毒性脑损伤(SAE、急性中毒)。其起病急、进程快,临床表现多样,预后差异显著,早期、精准的病情评估对改善患者结局至关重要。临床评估、生物标志物、颅脑影像学检查以及序贯或同时监测颅内压、神经电生理、脑代谢、脑组织氧分压及脑血流动力学的多模态神经监测等是评估脑损伤严重程度、治疗反应及预后的常用手段[8-9]。然而,临床查体和影像学检查易受多种因素干扰,而脑功能监测、颅内压监测等技术存在操作相对复杂、有一定创伤性及时效性不足等局限。在急性脑损伤救治的“黄金时间窗”内,亟需客观、快速的生物学评估指标。近年来,急性脑损伤生物标志物在诊断分型、危险分层、预后评估等方面体现出重要价值[1-7]。为规范其临床应用,中国医师协会急诊医师分会组织急诊医学、神经病学及检验学科等领域的多位专家,基于循证医学证据撰写本共识,旨在为临床决策提供科学依据,改善急性脑损伤患者预后。
1 方法学本专家共识采用系统性文献综述方法,全面检索了PubMed、中国知网(CNKI)、万方等中英文数据库中关于脑损伤生物标志物在急性脑损伤研究领域的已发表文献。检索时限为建库至2025年10月。专家组系统整合了国内外循证医学证据及指南共识,并结合国内临床实践特点和多学科专家经验,围绕TBI、CA后脑损伤、SAE、急性脑卒中及急性中毒所致脑损伤等临床应用场景的关键问题进行了深入讨论。通过现场讨论和线上会议等方式反复修改,最终形成一致性较高的推荐意见。本共识采用2011版英国牛津循证医学中心(Oxford Centre for Evidence-based Medicine,OCEBM)的证据分级和推荐强度标准(附表1、附表2)对推荐意见的支持证据进行评级[10],将循证等级由高到低分为1、2、3、4、5共5个级别,并基于证据等级将推荐强度由强到弱分为A、B、C、D四个等级(表 1)。本专家共识在国际实践指南注册平台(http://www.guidelines-registry.cn)进行注册(注册号:PREPARE-2025CN1577)。
| 损伤类型/细胞来源 | 生物标志物 | 血液半衰期 | 血液浓度变化的时序规律 | 主要临床意义及注意事项 |
| 星形胶质细胞损伤 | S100B | 0.5~2 h[24-25] | 超急性期标志物。损伤后几分钟内急剧上升,数小时内(如6 h)达到早期峰值。在24 h内迅速下降。若24~48 h出现二次峰值,提示可能存在继发性损伤[24-25] | 临床意义:反映脑损伤严重程度继发性脑损伤及预后,可提示血脑屏障破坏[24-25]。注意事项:在恶性黑色瘤中可异常升高[26],解读需谨慎 |
| GFAP | 24~48 h[27] | 损伤后 < 1 h即可检测。峰值通常出现在约20~24 h[28-30]。半衰期较长,适用于急性期脑损伤的动态监测[27] | 临床意义:反映脑损伤严重程度继发性脑损伤和不良预后[30] | |
| 神经元胞体损伤 | NSE | 24~30 h | 6~24 h达到明显峰值。48~72 h测定常作为预测不良结局的最常用时点[29, 31-32] | 临床意义:动态变化与脑损伤严重程度继发性脑损伤和预后密切相关[2, 30]。注意事项:红细胞和血小板富含NSE,血液溶血可导致假性升高;胰腺肿瘤和小细胞肺癌也可能引起血NSE异常升高[33] |
| UCH-L1 | 7~10 h | 早峰标志物。损伤后1 h内检出,约8 h达到峰值。通常在48 h内浓度显著下降[28, 30, 34] | 临床意义:反映脑损伤严重程度和预后[30] | |
| 轴突损伤 | NfL | 约3周[23] | 上升较慢且持续时间长。常在伤后1~14 d开始上升,常在1~6周达到峰值[35-36] | 临床意义:血液水平的动态变化与脑损伤严重程度和不良预后相关[23, 37];对神经退行性疾病炎性脱髓鞘疾病及缺血性脑损伤中具有特异度诊断价值[21]。 |
| Tau蛋白(tTau) | 约19~30 d[23] | 血液tTau早期升高(0~24 h常见峰值),随后快速下降[38-40]。代谢周转较慢[23] | 临床意义:动态监测血液Tau水平与脑损伤的严重程度和预后密切相关[41] | |
| 注:S100B,S100钙结合蛋白B;GFAP,胶质纤维酸性蛋白;NSE,神经元特异度烯醇化酶;UCH-L1,泛素C末端水解酶-L1;NfL,神经丝轻链 | ||||
问题1:脑损伤生物标志物在急性脑损伤评估中有哪些临床应用价值?
推荐意见1:脑损伤生物标志物具有重要的临床应用价值,可用于解析病理生理机制、早期识别高危患者、监测病程演变、辅助治疗决策及评估预后转归。作为急性脑损伤多模态监测策略的辅助手段,它能弥补传统诊断方法的不足,助力临床实现及早、精准决策。
临床上,急性脑损伤常用的评估方法包括临床评估、颅脑影像学检查、生物标志物、颅内压监测、脑组织氧分压、脑代谢、连续脑电、脑血流动力学监测。然而,没有任何一种方法可以单独准确评估,目前推荐应用多模态的神经功能评估策略,以提供评估准确性[9, 11]。影像学检查如经颅多普勒超声、计算机断层扫描(CT)和核磁共振成像(MRI)是诊断和病情评估的主要手段,能直观显示脑组织形态改变,但在早期敏感度较低。此外,它受操作和设备限制,在病情动态监测和预后评估方面存在时效性不足的局限[12]。功能评分量表也是评估急性脑损伤的常用工具。例如,格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)和格拉斯哥预后评分(Glasgow Outcome Score,GOS)可直接反映脑损伤的严重程度及功能预后,全面无反应性量表(full outline of unresponsiveness,FOUR)弥补了传统GCS的一些不足,也常被用于评估患者的神经功能缺损程度和预后;其他如序贯器官衰竭评分(sequential organ-failure assessment,SOFA)和急性生理学与慢性健康状况评分(acute physiology and chronic health evaluation,APACHE)系统等,则通过GCS评分间接评估神经系统功能受损程度[12-13]。然而,在急危重症患者中,镇静镇痛治疗或神经肌肉阻滞剂使用可能影响这些评分的客观性[14]。
生物标志物作为一种客观的生物学指标,能够反映正常生理过程、病理状态或对治疗干预的响应。脑损伤生物标志物是指在脑损伤发生后,可在血液、脑脊液等体液中检测到的生物活性物质,且与脑损伤的病理生理过程密切相关[15]。通过检测体液中特定生物标志物的表达变化,可从宏观影像学层面转向基于细胞和分子机制的微观层面,进而更好地理解脑损伤的发生、发展及转归[16-17]。
脑损伤生物标志物的检测具有微创、快速和可持续监测等优势。其检测不受镇静剂、止痛药或肌松药等因素的干扰,且在标准化方法下,可实现早期病变的识别,弥补了影像学检查的不足[1, 2, 18]。因此,生物标志物在急性脑损伤的初筛、病情分层、动态监测和辅助治疗决策中具有重要价值,尤其在高危患者的早期识别和预后评估方面。
2.2 急性脑损伤生物标志物的分类与特征急性脑损伤的诊断、病情分层和预后评估中常用的生物标志物,可根据其反映的结构损伤细胞类型,划分为以下三类:(1)星型胶质细胞损伤生物标志物:①S100钙结合蛋白B(S100 calcium-binding protein B,S100B)是一种钙结合蛋白,在中枢神经系统中主要富集于星型胶质细胞,在周围神经系统中常见于施万细胞,但在脂肪细胞、软骨细胞、黑色素细胞等细胞中有一定表达,主要参与细胞生长和能量代谢等过程[15, 19]。②胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是一种特异度表达于星形胶质细胞胞质中的中间丝蛋白,主要功能是参与维持细胞形态及物质交换[15]。(2)神经元胞体损伤生物标志物:①神经元特异度烯醇化酶(neuron specific enolase,NSE)是一种广泛存在于神经元和神经内分泌细胞中的酶,参与神经元的能量代谢[15]。②泛素羧基末端水解酶L1(ubiquitin carboxyl-terminal hydrolase-L1,UCH-L1)是一种神经元特异度去泛素化酶,参与维持蛋白质稳态,清除氧化或错误折叠的蛋白质[20]。(3)轴突损伤生物标志物:①神经丝轻链(neurofilament light chain,NfL)蛋白是神经元轴突细胞骨架的主要中间成分,主要在脑白质的大口径有髓轴突中表达,参与轴突结构稳定性、直径调节及神经信号传导[21]。②Tau蛋白是一种微管相关蛋白,主要分布于皮质层无髓鞘轴突,参与微管结构稳定、轴突运输及细胞骨架维持[22]。脑损伤后,Tau蛋白能以裂解Tau蛋白(c- Tau)、磷酸化Tau蛋白(p-Tau)和总Tau蛋白(tTau)等多种形式被检测到[23]。各类标志物在脑损伤后的血液浓度时序变化特征和临床意义见表 1。
3 急性脑损伤生物标志物在不同疾病中的临床应用 3.1 直接脑损伤traumatic brain injury, TBI是由机械性外力直接或间接作用于头部所致的器质性损伤。TBI是发病率最高的神经系统疾病之一,同时也是创伤相关死亡和残疾的主要原因[42]。流行病学数据显示,我国TBI每年新发病例约77~89万例,总体病死率约5%,其中sTBI患者的病死率可高达20%[43-44]。TBI的临床表现呈高度异质性,范围广,从短暂的意识模糊、长期意识丧失或遗忘,到更严重的昏迷甚至死亡[45]。目前,临床上通常采用GCS评分来评估患者伤后的意识水平,并将TBI的严重程度分为轻型(13~15分)、中型(9~12分)和重型(3~8分)[46]。当前,脑损伤生物标志物在TBI的急诊分诊、严重程度评估、继发性脑损伤预测和预后评估等方面,已展现出重要的临床价值。
问题2:对轻型TBI(mild traumatic brain injury,mTBI)患者是否常规行颅脑CT检查仍存争议,急性脑损伤生物标志物能否用于筛选低风险mTBI患者?
推荐意见2:建议将血清S100B检测整合至mTBI患者的临床决策流程中,以期筛选出低风险患者,从而减少不必要的颅脑CT检查。其中对于无其他并发症危险因素的成人mTBI患者,若伤后6 h内采用电化学发光免疫分析法(electrochemiluminescence immunoassay,ECLIA)检测的S100B浓度<0.1 μg/L,可作为颅脑CT检查的补充指标,用于预测CT检查的阴性结果(证据级别:2;推荐级别:B)。
尽管颅脑CT被视为TBI诊断的金标准,但临床实践数据显示,超过90%的mTBI患者的CT检查结果并未显示结构性损伤[47-48]。因此,常规对所有mTBI患者进行CT检查,所带来的辐射暴露风险和医疗资源浪费问题日益突出。现有证据表明,血清S100B可作为mTBI患者脑损伤的有效筛选指标[49-54]。Meta分析证实,S100B(临界值设为0.10 μg/L、0.105 μg/L或0.11 μg/L时)预测mTBI脑损伤灶的敏感度可达96%(95% CI: 92%~98%)[51]。临床研究显示,将S100B检测整合入临床决策流程中,可使CT检查需求降低约30%[49, 55],同时有助于节省医疗支出[56]。针对儿童TBI患者的系统评价显示,血清S100B具有高敏感度(达95%),联合颅脑CT有助于识别低风险患者,辅助临床决策,减少不必要的CT扫描和辐射暴露[57]。
现有证据表明,在创伤后6 h内进行血液S100B检测可获得最佳诊断效能,而伤后3 h内检测则可进一步提高其敏感度[50-51]。不同检测方法对血清S100B的测定结果差异有统计学意义,ECLIA因其高度敏感度和标准化优势被多数研究采用,其临界值通常设定在0.10 μg/L、0.105 μg/L或0.11 μg/L[51]。其他较少采用的检测方法还包括化学发光免疫分析法(临界值0.10~0.56 μg/L)、放射免疫测定法(临界值0.20 μg/L)和酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)(临界值0.020 μg/L)[51]。相关国际指南建议,对于符合低风险状态(GCS评分14分,且无抗凝治疗或凝血障碍、创伤后癫痫发作、凹陷性或颅底骨折的临床征象、局灶性神经功能受损等并发症危险因素;或者GCS评分15分,伴有意识丧失或重复≥2次呕吐,但无其他并发症危险因素)的mTBI成人患者,当采用ECLIA在伤后6 h内测得S100B<0.1 μg/L时,可作为颅脑CT检查的补充指标,预测CT检查阴性结果[51, 53-54]。
问题3:通常依据颅脑影像学、GCS结合临床经验评估TBI严重程度,能否联合急性脑损伤生物标志物进行评估?
推荐意见3:血清S100B、NSE水平升高与TBI的严重程度密切相关,建议在伤后24 h内检测这两种生物标志物,并将其结果联合GCS评分、颅脑影像学以及其他实验室指标,共同用于评估TBI的严重程度,以优化诊疗决策,但其最佳检测阈值因方法学差异尚待确定(证据级别:3;推荐级别:B)。
早期、快速地判断TBI损伤程度,对于患者的危险分层及临床管理至关重要。目前临床上主要依赖颅脑CT和GCS评分结合临床经验进行评估,但这种方式仍存在一定的主观性。多项研究显示,血清S100B和NSE水平的升高与TBI严重程度之间存在密切关联[58-59]。研究报道sTBI患者伤后24 h内检测到的S100B和NSE中位水平高于中型TBI和mTBI患者,即使在mTBI组内,GCS评分13~14分亚组的血清S100B和NSE中位水平也高于GCS评分15分亚组[58]。另有研究数据显示,入院24 h内检测的血清S100B水平在不同严重程度组间差异有统计学意义(重型为0.18 μg/L、中型为0.17 μg/L、轻型为0.078 μg/L,P < 0.01)[60]。此外,在儿童TBI的诊治过程中,S100B的表达水平与临床症状密切相关。有研究表明,伤后0 h的血清S100B水平能够区分TBI的严重程度[61]。与儿童TBI患者GCS评分>12分组相比,GCS评分<12分的儿童TBI组,其血清NSE水平高于GCS评分>12分的患儿,但NSE水平的高低与CT扫描是否异常无关[62]。尽管S100B和NSE表现出良好的区分度,但目前现有研究中对于TBI后血液脑损伤生物标志物的最佳检测阈值仍存在异质性。
问题4:临床上常通过GCS、GOS和构建多因素临床预后模型评估TBI预后,能否联合急性脑损伤生物标志物进行评估?
推荐意见4.1:血清S100B和NSE水平升高与TBI预后不良密切相关。建议在伤后24 h内及48 h检测,作为预后评估的补充指标;与其他预后指标结合使用,可提高TBI预后预测模型的效能(证据级别:3;推荐级别:B)。
推荐意见4.2:创伤后24 h的血清S100B对预测sTBI患者的脑死亡具有潜在价值(证据级别:3;推荐级别:B)。
TBI预后目前在临床上主要通过GCS、GOS和构建多因素临床预后模型评估[63],但这些方法在指导临床诊疗决策时仍存在一定局限性。近年来,多项研究表明,脑损伤生物标志物对TBI患者的预后评估具有较高的临床价值:Meta分析显示血清S100B水平(至少在伤后24 h内检测一次)与中型TBI和sTBI患者的短期(<3个月)、中期(3~6个月)或长期(≥6个月)预后不良,包括病死率增加(阈值范围1.38 μg/L~10.5 μg/L)和GOS≤3分(阈值范围2.16 μg/L~14.0 μg/L)密切相关[64]。较高的血清NSE水平(入院时及部分研究在伤后24 h、48 h或72 h检测)与TBI患者病死率增加和预后不良(GOS≤3分或扩展版GOS≤4分)相关,以20 μg/L时为临界值,NSE预测病死率的合并敏感度为71%(95% CI: 52%~86%),特异度为63%(95% CI: 41%~81%);对于不良神经预后,合并敏感度和特异度分别为67%(95% CI: 55%~77%)和63%(95% CI: 41%~81%);为实现100%敏感度(即无假阴性),预测病死率的血清临界值范围为11.62~20.00 μg/L,预测不良预后的临界值为20 μg/L[31]。另有研究显示,sTBI患者脑死亡后血清S100B水平显著升高,入院24 h时的血清S100B水平,若取临界值0.372 μg/L,其预测患者脑死亡的敏感度和特异度分别为85.7%和79.3%,提示S100B在预测sTBI患者脑死亡方面的潜在价值,但仍有待进一步研究证实[65]。
S100B和NSE水平可能提高TBI预后预测模型的预测效能。有研究报道将TBI后24 h内的血清S100B和NSE水平整合到现有的TBI预后预测模型[国际颅脑损伤预后临床测试研究(international mission on prognosis and analysis of clinical trial,IMPACT)]模型和重型颅脑损伤后皮质类固醇的随机化研究(corticosteroid randomisation after significant head injury,CRASH]模型),可显著提高这些模型对中重型TBI患者预后的预测效能[66-67]。
推荐意见4.3:新型生物标志物NfL、GFAP、UCH-L1和tTau蛋白在TBI预后评估中均显示出较好的临床应用价值,但仍需大规模的临床研究以评估其各自的敏感度和特异度,才能常规应用于临床(证据级别:3;推荐级别:B)。
新型急性脑损伤生物标志物NfL、GFAP、UCH-L1和tTau蛋白在TBI预后评估中也显示出较好的临床应用价值[41, 68-73]。研究显示,TBI后当天采集血浆样本检测GFAP(AUC分别达0.87和0.86)和UCH-L1(AUC分别达0.89和0.86),对预测患者6个月死亡和不良预后(扩展版GOS评分≤4分)具有较高的效能[68]。将这些新型生物标志物水平添加至TBI预后预测模型(IMPACT模型和CRASH模型),可进一步提高模型对中重型TBI患者预后的预测效能[66-67]。
问题5:TBI患者继发性脑损伤需要综合颅脑影像学和临床评估结果进行早期识别,急性脑损伤生物标志物可否用于预测继发性脑损伤?
推荐意见5:S100B水平在下降后再次升高与TBI继发性脑损伤的发生相关。对于sTBI患者,建议在入院时以及入院后每间隔12 h连续监测血清S100B水平。若创伤48 h后再次出现S100B水平高峰,应行颅脑影像学检查,以及时发现是否存在血肿进展、脑水肿或缺血性损伤等继发性病变(证据级别:4;推荐级别:C)。
血清S100B因其半衰期短的特性,其浓度变化与近期的脑损伤事件相对应,因此能够敏感地反映急性期脑损伤的动态变化。S100B水平的二次峰值可能意味着是持续性或新发的脑损伤[24]。S100B在TBI发生后几分钟内急剧上升,6 h内达到的浓度峰值主要反映原发性脑损伤的严重程度。随后,其浓度在接下来的数小时内迅速下降,通常在24 h内恢复正常水平;若S100B在24~48 h出现二次峰值,则可能提示患者发生了继发性损伤,如脑梗死、颅内血肿进展或脑水肿[24-25]。研究报道证实了TBI连续监测的临床价值,对TBI患者实施入院后每日两次(入院时和每间隔12 h)采集血样检测血清S100B水平,结果显示,TBI发生48 h后S100B水平的继发性升高(增幅≥0.05 μg/L)与颅脑影像学检查(CT/MRI)结果再次出现异常密切相关(P < 0.0001),预测继发性脑损伤的受试者工作特征曲线下面积(area under the curve,AUC)达0.855,提示S100B的连续动态监测有助于及时发现sTBI继发性脑损伤程度的变化[74]。
基于目前TBI诊疗过程中的现有临床问题,急性脑损伤生物标志物在TBI中的应用价值和检测建议见图 1。
|
| 图 1 急性脑损伤生物标志物在TBI中的应用价值和检测建议 |
|
|
CA是导致全球范围内急性死亡和致残的主要原因。最新数据显示,我国院外心脏骤停(out-of-hospital cardiac arrest,OHCA)和院内心脏骤停(in-hospital cardiac arrest,IHCA)的发病率分别为95.7/10万人和840/10万人,但出院时神经功能良好率分别仅有0.8%和9.4%[75-76]。CA后脑损伤又称CA后缺血缺氧性脑病(hypoxic ischaemic encephalopathy,HIE),是影响患者神经功能预后和生存率的关键因素[77]。多数患者因全脑缺血-再灌注损伤,遗留不同程度的认知、记忆或行为功能障碍,给社会和患者家庭带来沉重负担[78]。目前,神经功能评估仍是CA患者临床救治中的一大难题与挑战。神经系统查体、神经电生理(如脑电图、躯体感觉诱发电位)、颅脑影像学(CT、MRI)和血清生物标志物等[79-80]评估手段各有局限性,尚无单一指标可独立且准确地预测预后。鉴于此,国际共识推荐采用多模态策略,将上述方法有机结合[9]。血清脑损伤生物标志物(如S100B与NSE)具有无创、可床旁早期检测等优势,使其成为多模态策略的重要组成部分,能够助力临床及早做出精准决策。然而,在接受目标体温管理(target temperature management,TTM)患者中,这两项指标的动力学可能发生改变(如峰值出现时间延迟或清除速率改变),因此单次早期检测的结果易产生误判或低估[81]。尽管如此,多项前瞻性队列研究与亚组分析显示,低体温组与常温组在24~72 h的血清S100B和NSE水平没有显著差别,即低体温本身并不必然导致这两种血清指标系统性升高或下降[82-84]。
问题6:通过颅脑影像学和神经功能量表评估CA后脑损伤及其严重程度仍存在局限,能否联合急性脑损伤生物标志物进行评估?
推荐意见6:S100B和NSE水平的升高与CA后脑损伤的严重程度增加相关,可作为CA患者脑损伤诊断和严重程度的补充评估指标,建议在入院后24 h、48 h和72 h动态监测血清S100B和NSE水平的变化(证据级别:3;推荐级别:B)。
越来越多研究提示脑损伤生物标志物具有重要的补充评估价值:研究通过检测CA后接受低体温治疗的患者在入院时、复苏后第6、12、24、48和72 h的血清NSE和S100B水平,发现其动态变化与匹兹堡心脏骤停类别(pittsburgh cardiac arrest category,PCAC)分级呈正相关。这表明NSE和S100B水平的升高程度可反映HIE的严重程度[85]。一项前瞻性研究检测CA后昏迷患者在目标体温管理过程中24 h和48 h的血清NSE、NfL、GFAP和tTau蛋白水平,发现复苏后48 h血清NSE、NfL、GFAP和tTau蛋白水平的升高均与CT评估的较低的灰白质比(grey-white-matter ratio,GWR)显著相关。GWR是HIE严重程度的影像学指标之一,进一步说明这些生物标志物在评估脑损伤及其严重程度方面具有重要价值[86]。
问题7:CA后神经功能预后尚无法通过临床评估、神经电生理或脑部影像学等任何单一方法进行单独准确评估,该如何联合急性脑损伤生物标志物进行评估?
推荐意见7.1:建议使用CA后48 h或72 h的血清NSE水平、CA后24 h的血清S100B水平,在多模式策略下(结合功能评分量表、神经电生理指标等)进行综合评估,以预测神经功能预后(证据级别:2;推荐级别:B)。
NSE是目前CA后神经功能预后评估中研究最多的生物标志物。研究显示,CA后血清NSE水平会升高,通常在48~72 h达峰值[2]。多项研究已证实NSE的预后评估价值:Meta分析显示,CA后24~48 h和48~72 h血清NSE水平预测不良神经功能预后的AUC分别为0.82和0.83(阈值分别为70.4 ng/mL和58.6 ng/mL)[87];国内研究表明,住院24 h内血清NSE>26.75 ng/mL预测出院时不良神经功能预后的AUC可达0.905[88];另有研究报道,CA后72 h血清NSE能显著提升现有预后评分模型(CAHP评分和OHCA评分)的评估效能(AUC分别从0.81提升至0.91,和从0.79提升至0.89)[89]。基于现有证据,欧洲复苏委员会和欧洲危重病医学会发布的复苏后管理指南(2021)推荐将CA后48 h或72 h血清NSE水平 > 60 ng/mL作为不良预后的重要依据[9],但国际上对此阈值尚未达成完全共识[90]。
血清S100B水平通常在CA后24 h达峰值,被视为早期预后评估指标[84]。研究显示,CA后24 h血清S100B>0.193 ng/mL预测3个月不良神经功能预后的AUC达0.93,同时具有较高的敏感度(78%)和特异度(100%)[91]。Meta分析证实,S100B在自主循环恢复后24、48和72 h均保持较好的预测效能(AUC分别为0.85、0.85和0.82),特异度均超过75%,但不同研究间的最佳阈值存在差异[92]。鉴于其可靠的预后评估价值,国内两项CA相关共识均推荐动态监测S100B水平,并结合其他临床指标进行综合评估,以提高神经功能预后判断的准确性[79, 93]。
推荐意见7.2:CA患者入院时NfL水平对出院不良神经功能具有较高预测价值(证据级别:4;推荐级别:C);CA后24 h、48 h和72 h的NfL对6个月不良神经功能预后有较高价值,其中CA后48 h的NfL预测价值最高(证据级别:2;推荐级别:B)。CA后24 h、48 h和72 h的tTau蛋白对6个月不良神经功能预后均有较高价值(证据级别:2;推荐级别:B);CA后72~96 h的tTau蛋白对预测患者出院时不良神经功能预后的效能较高(证据级别:3;推荐级别:B)。
NfL、GFAP、UCH-L1和Tau蛋白等新型脑损伤生物标志物在CA后神经功能预后评估中展现出良好的应用前景。多项研究证实:①NfL具有卓越的预测价值:国内单中心研究显示,入院时血清NfL>0.08 ng/mL预测出院不良预后的AUC达0.95(敏感度84.5%,特异度100%)[94];在CA后24、48和72 h持续保持高预测效能(AUC介于0.95~0.97,特异度为98%时,敏感度分别为72.4%、80%和73.9%)[95];最新Meta分析表明,CA后48 h内NfL的预测效能(AUC 0.92)显著优于NSE、S100B、GFAP、tTau和UCH-L1[92];②GFAP在CA后12 h即表现出良好的预测能力,对OHCA和IHCA患者不良预后的AUC分别为0.86和0.83[96];③UCH-L1在CA后24、48和72 h预测6个月不良预后的AUC稳定在0.85~0.87[97];④tTau蛋白在CA后24 h、48 h和72 h预测6个月不良神经功能预后的AUC分别为0.81、0.9和0.91[98],而在复苏后72~96 h达峰值,此时预测出院时不良神经功能预后的效能最高(AUC=0.848)[99]。这些新型标志物各具独特的时序特性,联合检测有望构建更精准的多时间点预后评估体系。
问题8:CA患者复苏后死亡风险较高,急性脑损伤生物标志物可否用于预测患者复苏后死亡风险?
推荐意见8.1:NSE和S100B水平升高与CA患者复苏后死亡相关,建议在入院后48 h检测血清NSE水平、在入院后72 h同时检测血清S100B和NSE水平,用于预测患者的出院死亡风险(证据级别:2;推荐级别:B)。
推荐意见8.2:NfL具有良好的CA后死亡风险预测潜力(证据级别:3;推荐级别:B)。
多项研究显示,CA患者复苏后血清脑损伤生物标志物水平与病死率存在显著相关性。其中,NSE和S100B作为经典的脑损伤生物标志物,其升高程度与死亡风险密切相关[85, 100-101]。通过检测CA后接受低体温治疗患者在不同时间点(入院时、复苏后第6、12、24、48和72 h)的血清NSE和S100B水平,发现48 h血清NSE > 49.5 ng/mL和72 h血清NSE > 10.59 ng/mL均可较好预测出院病死率;而72 h血清S100B > 0.414 ng/mL则对出院病死率具有一定的预测价值[85]。在新型生物标志物中,NfL表现尤为突出,具有更高的死亡风险预测潜力,研究显示CA后1个月时死亡患者的中位血清NfL水平显著高于存活患者(P=0.003),其对1个月死亡状态的预测效能显著优于NSE(AUC:0.98 vs. 0.80)[102]。
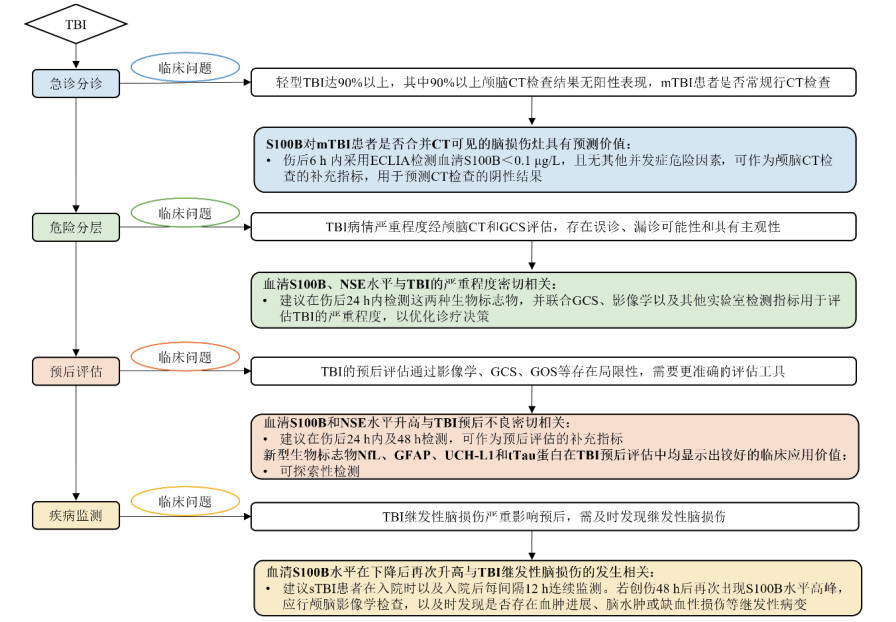
基于目前CA后神经功能预后评估过程中的现有临床问题,急性脑损伤生物标志物在CA中的应用价值和检测建议见图 2。
|
| 图 2 急性脑损伤生物标志物在CA中的应用价值和检测建议 |
|
|
急性脑卒中是我国居民的首位死亡原因和成人首位的残疾病因。急性脑卒中主要包括急性缺血性脑卒中(acute ischemic stroke,AIS),其约占我国所有脑卒中的80%以上[103];以及出血性脑卒中,后者主要包括自发性脑出血和蛛网膜下腔出血(subarachnoid hemorrhage,SAH),分别约占15%和3%[103-104]。急性脑卒中以起病急骤、持续性、局灶性神经功能缺损为临床特征,具有高发病率、高致死率、高致残率、高复发率和高经济负担的特点[103]。鉴于脑卒中的高危特性,其早期诊断和干预治疗对患者的预后及转归至关重要。目前临床上通常采用CT、MRI等影像学检查方法和神经功能量表评估脑卒中的严重程度和预后,对生物标志物的应用相对较少。近年来,越来越多的研究证实脑损伤生物标志物在AIS和SAH评估中具有极其重要的临床意义。
3.2.2.1 acute ischemic stroke, AIS问题9:AIS病情严重程度常采用神经功能评价量表评估神经功能缺损程度,能否联合急性脑损伤生物标志物进行评估?
推荐意见9:血清S100B和NSE可辅助评估AIS的神经功能缺损程度,建议在患者入院时、入院后24 h、48 h、72 h连续检测这两种生物标志物,并结合影像学检查和神经功能检查量表,共同用于评估AIS的神经功能缺损程度,以协助诊疗决策(证据级别:2;推荐级别:B)。
S100B和NSE已初步用于临床,对AIS神经功能缺损程度评估具有一定的临床价值[105-106]。多项研究证实S100B和NSE水平与AIS严重程度的相关性:采用ECLIA检测AIS患者入院时、24 h和72 h的血清S100B和NSE水平,入院后24 h的S100B水平和72 h的NSE水平与美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分和第4~7天CT评估的脑梗死体积均显著相关(P < 0.0001)[107]。AIS后72 h内的血清NSE水平相较于对照组显著升高[(17.95±4.54) ng/mL vs.(7.48±1.51) ng/mL,P≤0.05],且与NIHSS评估的神经功能缺损程度显著相关(P≤0.001)[108]。
此外,新型生物标志物NfL、GFAP和Tau蛋白在AIS的神经功能缺损程度评估中显示出临床应用潜力。研究显示,AIS患者入院后24 h内的血清NfL水平与NIHSS评分呈正相关(P < 0.001);中重度AIS患者(NIHSS评分>5分)的NfL水平高于轻度AIS患者(NIHSS评分0~5分)[(17.95±4.54)ng/mL vs.(7.48±1.51)ng/mL][109]。AIS后血清GFAP和tTau蛋白水平与NIHSS评估的神经功能缺损程度均呈正相关(P=0.002和P=0.001)[110-111]。
问题10:采用脑部影像学和神经功能量表等评估方法在评估AIS神经功能预后方面仍存在局限性,能否联合急性脑损伤生物标志物进行评估?
推荐意见10.1:S100B和NSE水平升高与AIS的神经功能预后不良密切相关,可作为AIS的预后评估指标,建议使用入院后24 h的血清S100B水平和72 h的血清NSE水平,并结合影像学检查和神经功能检查量表,用于综合评估患者的预后(证据级别:2;推荐级别:B)。
S100B和NSE在AIS功能预后评估方面具有较高的临床应用价值,目前也已初步应用于临床预后评估[105-106]。研究采用ECLIA检测AIS患者,结果显示入院后24 h的血清S100B水平和72 h的NSE水平与改良Rankin量表(modified Rankin Scale,mRS)评估的神经功能预后呈显著负相关(均P < 0.0001)。具体而言,预后不良组的S100B水平和NSE水平(0.28 μg/L和13.7 ng/mL)均显著高于良好预后组0.11 μg/L和8.9 ng/mL),且被证实是神经功能预后不良的独立预测指标(P < 0.0001和P=0.032)[107]。入院时检测的血清S100B水平在AIS后死亡患者中显著高于存活患者(P=0.003)[112]。在合并高血压的AIS患者中,入院后次日检测的血清NSE水平与1年时的mRS评分呈正相关(P=0.017),多变量分析进一步确立NSE为1年时mRS评估的神经功能预后不良的独立危险因素(P=0.027)[113]。
推荐意见10.2:新型生物标志物NfL、GFAP和tTau蛋白对AIS的神经功能预后评估显示出较好的临床应用价值,但仍需大规模的临床研究以评估其各自的敏感度和特异度才可常规应用于临床(证据级别:3;推荐级别:B)。
NfL、GFAP和tTau蛋白在AIS的功能预后评估方面显示出良好的临床应用前景[114-117]。一项针对急性前循环大血管闭塞性缺血性卒中患者的研究发现,在血管内机械取栓治疗前、治疗后2 h、24 h、48 h、72 h和3个月中至少1个时间点,血液GFAP、tTau蛋白和NfL水平与24 h NIHSS评分和3个月mRS评分均相关,其中72 h的GFAP、48 h的tTau蛋白和3个月的NfL水平与预后相关性最好(均P≤0.0001),将24 h的NIHSS评分与48 h的GFAP、tTau蛋白和NfL水平联合起来,对患者的神经功能预后具有良好的预测效果(AUC为0.89)[115]。
3.2.2.2 subarachnoid hemorrhage, SAH问题11:SAH的病情严重程度常采用神经功能评价量表(如世界神经外科医师联盟量表WFNS)和影像学分级(如基于CT的Fisher分级量表)进行评估,能否联合急性脑损伤生物标志物评估SAH的神经功能缺损程度?
推荐意见11:S100B和NSE可辅助评估SAH的神经功能缺损程度,建议在患者入院时检测血清S100B水平;在入院时以及入院后24 h、48 h连续检测血清NSE水平,并将检测结果结合影像学检查和神经功能检查量表,共同用于评估SAH神经功能缺损程度,以协助诊疗决策(证据级别:2;推荐级别:B)。
研究显示,采用ECLIA检测SAH患者入院时的血清S100B水平(临界值0.12 μg/L)相较于实验室参考范围上限值升高了2.8倍,其浓度水平随着WFNS评分和Fisher分级量表评分的增加而升高,提示其可反映初始损伤的严重程度[118]。SAH患者在入院当天、入院后24 h和48 h连续检测的平均血清NSE水平显示,病情更重的患者组(WFNS评分4~5级和Fisher量表评分级4级)相比病情较轻的患者组(WFNS评分级1~3级和Fisher量表评分级1~3级)显著更高(P=0.003和P=0.03)[119]。在新型生物标志物方面,研究显示,动脉瘤性SAH后血清NfL水平在急性期持续增加,在9~14 d达峰值,并与WFNS评分和Fisher分级量表评估的病情严重程度呈正相关(P < 0.001和P=0.006)[120]。这表明NfL可能主要反映SAH导致的轴突和白质损伤程度。
问题12:采用脑部影像学和神经功能量表等评估方法在评估SAH神经功能预后方面仍存在局限性,能否联合急性脑损伤生物标志物进行评估?
推荐意见12:S100B和NSE水平升高与SAH的神经功能预后不良密切相关,建议在患者入院后24 h、48 h、72 h连续检测这两种标志物,可作为SAH的预后评估指标,并结合神经功能检查量表和影像学检查,用于综合评估患者的预后(证据级别:2;推荐级别:B)。
研究采用ECLIA对动脉瘤性SAH患者入院后连续7 d每日的血浆S100B和NSE水平进行检测,结果显示,入院后7 d内的S100B水平和第5~7天的NSE水平升高与6个月时GOS评估的神经功能预后不良显著相关(P < 0.05),其中第5天S100B>0.13 μg/L和第7天NSE>14.5 μg/L被确定为预测神经功能预后不良的最佳阈值[121]。动脉瘤性SAH后入院第1、2和3天的血液S100B水平(5.7 ng/mL vs. 1.5 ng/mL,P=0.031)和NSE水平(6.1 ng/mL vs. 1.4 ng/mL,P=0.011)在死亡患者中显著高于存活患者[122]。在新型生物标志物方面,研究报道SAH后第1~3天的血清NfL水平升高是患者6个月时神经功能预后不良(mRS评估)的强预测指标(OR=2.3,P=0.04)[123]。这进一步提示了轴突损伤标志物在预测长期神经功能缺损中的潜在作用。
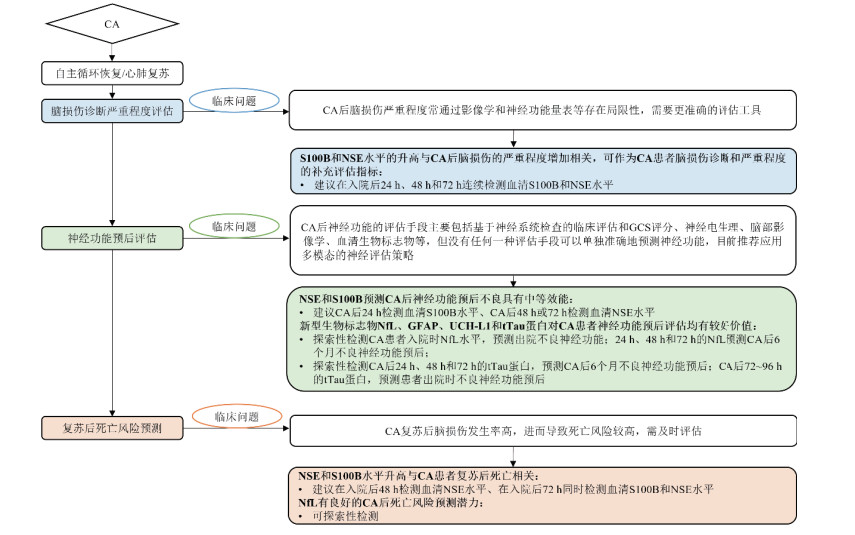
基于目前AIS和SAH诊疗过程中的现有临床问题,急性脑损伤生物标志物在脑卒中中的应用价值和检测建议见图 3。
|
| 图 3 急性脑损伤生物标志物在急性脑卒中患者中的应用价值和检测建议 |
|
|
SAE是脓毒症患者最常见的神经系统并发症,其特征是在排除直接中枢神经系统感染的情况下,由全身炎症反应导致的弥散性脑功能障碍。SAE的临床表现为意识状态改变(GCS < 15分)、认知障碍或谵妄等症状[124-125]。严重程度不等,从轻度谵妄(发生率约33%)[126]至深度昏迷均有报道。流行病学研究显示SAE的发生率差异有统计学意义:法国多中心队列研究报道的发生率为53%[127],而基于美国大型数据库(MIMIC-Ⅳ和eICU)的研究则高达68%[128]。SAE与患者预后密切相关。多项研究证实,SAE可显著增加脓毒症患者病死率[127-129]。鉴于SAE的发病机制复杂且缺乏特异度诊疗手段,目前迫切需要在临床研究中开发基于生物标志物的快速、准确诊断方法。这对于实现SAE的早期干预和改善患者预后具有重要意义。
问题13:SAE尚缺乏早期特异度诊断方法,急性脑损伤生物标志物是否可用于SAE诊断?
推荐意见13.1:S100B对SAE的诊断价值较高,建议在脓毒症患者入ICU后24 h和72 h检测监测其血清水平变化,并联合功能评分量表进行综合诊断(证据级别:2;推荐级别:B)。
多项Meta分析及临床研究证实,脑损伤生物标志物在SAE的诊断评估中具有重要价值。研究数据显示,SAE患者的血清S100B和NSE水平显著高于非SAE患者(P < 0.01)[4, 5, 130]。其中,S100B展现出更优的诊断效能:入ICU 24 h内检测,以0.131 μg/L为临界值,AUC达0.824(敏感度85.4%,特异度67.2%),显著高于NSE(以24.15 ng/mL为临界值,AUC=0.66;敏感度54.2%,特异度82.8%)[131]。值得注意的是,S100B的动态变化特征尤为关键,与脓毒症患者入ICU第1天相比,第3 d的血清S100B水平,以及第3天和第1天的S100B水平差值,与SAE的发生和病死率具有更大的相关性[132]。此外,血清S100B水平还被发现与脓毒症幸存者的焦虑、抑郁和创伤后应激障碍等神经精神后遗症显著相关[133],提示其可能在长期预后评估中具有额外价值。
推荐意见13.2:血清NfL、GFAP、UCH-L1和tTau蛋白对于SAE具有潜在的诊断价值(证据级别:3;推荐级别:B)。
NfL、GFAP、UCH-L1和tTau蛋白在SAE诊断中的应用研究仍处于初步阶段,但已显示出潜力:研究数据显示,血清NfL水平与SAE的发生显著相关,当临界值设定为38 pg/mL时,其对预测意识障碍的AUC为0.73(敏感度63%,特异度81%)[134]。脓毒症患者进入ICU后24 h内检测的血清GFAP和UCH-L1水平升高与SAE相关,且诊断效能相当(AUC分别为0.824和0.812)[135]。严重脓毒症或脓毒性休克患者入院时血清tTau蛋白水平在SAE组显著高于非SAE组(P < 0.001),多因素分析证实其为SAE的独立预测因子(P=0.001)[136]。尽管新型标志物表现出较好的诊断效能,其临床价值仍有待更大样本量的研究进一步验证。
问题14:脓毒症谵妄持续时间和严重程度是患者长期认知损害发生的预测因素,目前对其尚缺乏特异度评估手段,急性脑损伤生物标志物是否可联合用于脓毒症谵妄预测?
推荐意见14:S100B和NSE可作为脓毒症患者谵妄发生的预测指标,建议在脓毒症患者入ICU时检测血清NSE水平、入ICU后72 h内检测血清S100B水平,并联合功能评分量表预测谵妄的发生(证据级别:3;推荐级别:B)。
多项研究表明,脑损伤生物标志物对脓毒症相关性谵妄具有重要的预测价值。患者进入ICU后72 h内检测的血浆S100B水平对谵妄的预测效能优于脑脊液NSE(AUC:0.729 vs. 0.711)[137]。以0.15 μg/L作为临界值时,血清S100B水平升高预测脓毒性休克患者发生谵妄的风险比值比高达18(P=0.011),具有较高的敏感度(90%)和中等的特异度(67%)[138]。同时,入ICU时血浆NSE > 12.5 µg/L的患者,其谵妄发生风险增加29.3%(P=0.005),且NSE水平每增加1倍,患者住院期间谵妄发生风险增加5.2%(P < 0.001)[139]。在新型生物标志物方面,血清NfL水平被发现与脓毒症患者谵妄的严重程度和持续时间相关。鉴于谵妄的持续时间是长期认知功能障碍的重要预测因素,这提示NfL在SAE的长期神经功能评估中具有潜在作用[140]。
问题15:神经系统检查、脑电图和脑部影像学等传统评估手段在脓毒症及SAE患者的预后评估效能方面存在不足,急性脑损伤生物标志物是否可联合用于相关预后评估?
推荐意见15.1:血清S100B和NSE对脓毒症及SAE患者的预后评估具有一定的临床应用价值,建议在患者入ICU时检测血清NSE水平、在入ICU后24 h内检测血清S100B水平,作为脓毒症及SAE的预后评估指标(证据级别:2;推荐级别:B)。
多项Meta分析和研究显示,预后不良(死亡或神经功能受损)的脓毒症及SAE患者血清S100B(P < 0.01)和NSE(P < 0.001)水平均显著高于预后良好者,表明两者与不良预后密切相关[5, 130, 141]。具体而言,入ICU时血浆NSE > 12.5 µg/L与脓毒症患者死亡风险增加23.3%独立相关(P=0.006),且浓度每升高1倍,30 d死亡风险增加7.3%(P=0.003)[139];入ICU 24 h内检测的血清S100B水平预测SAE患者院内死亡的效能显著优于NSE(AUC:0.730 vs. 0.590)[131]。
推荐意见15.2:血清NfL、GFAP、UCH-L1和tTau蛋白对脓毒症及SAE患者预后具有潜在的预测价值(证据级别:3;推荐级别:C)。
多项研究表明,脓毒症患者的NfL在ICU住院第1~7天持续升高,其水平变化与临床症状严重程度、MRI异常表现及患者生存率显著相关(P < 0.01)[142-144],并对预测脓毒症患者长期认知障碍具有一定价值[142, 145];入ICU 24 h血清GFAP和UCH-L1预测患者半年存活的AUC分别为0.773和0.746[135];而tTau蛋白对患者28 d死亡的预测敏感度和特异度分别达到81.1%和86.1%[136]。尽管这些新型标志物展现了预测价值,但现有临床证据仍有限,还需通过更大样本、多中心研究进一步验证其应用价值,并为建立标准化的预后评估体系提供依据。
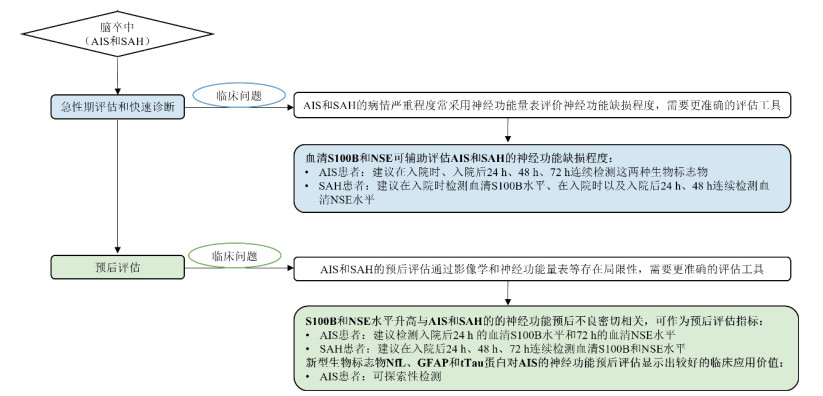
基于目前脓毒症及SAE诊疗过程中的现有临床问题,急性脑损伤生物标志物在SAE中的应用价值和检测建议见图 4。
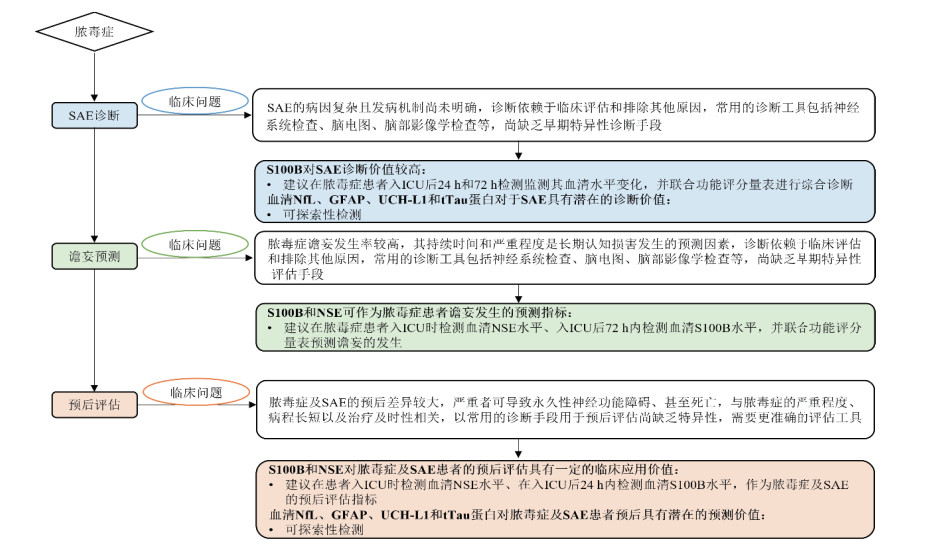
|
| 图 4 急性脑损伤生物标志物在SAE中的应用价值和检测建议 |
|
|
问题16:对急性中毒脑损伤严重程度和预后目前尚缺乏明确有效的评估手段,脑损伤生物标志物可否用于急性中毒脑损伤严重程度和预后评估?
推荐意见16:S100B、NSE、NfL在急性中毒脑损伤的严重程度及预后评估方面显示出一定的临床价值(证据级别:2;推荐级别:B)。
急性中毒可累及中枢神经系统,导致脑损伤,如急性一氧化碳中毒主要引起缺氧性脑损伤,而某些农药(如有机磷农药、百草枯、敌草快)和过量药物(如镇静药、麻醉药)则因对中枢神经系统细胞的直接毒性作用而引发脑损伤。目前,临床上尚缺乏有效的早期预警和准确评估急性中毒所致脑损伤严重程度的方法。近年来,脑损伤生物标志物已在急性一氧化碳中毒和有机磷中毒等领域进行了探索。有研究报道,急性一氧化碳中毒昏迷患者(GCS评分<13分)入院24 h内检测的血清S100B和NSE水平显著高于清醒患者,提示其可作为评估缺氧性脑损伤的有用指标,有助于急诊科判断病情严重程度[146-147]。S100B以0.10 μg/L为临界值,预测昏迷的敏感度和特异度分别为69.2%和56.1%;NSE以12.7 μg/L为临界值,预测昏迷的敏感度和特异度分别为77.0%和72.0%[146]。NSE(临界值13 μg/L)预测昏迷持续时间≥72 h的AUC为0.754(敏感度80%,特异度64%);S100B(以0.43 μg/L为临界值)预测的AUC为0.791(敏感度70%,特异度88%)[147]。系统评价表明,急性一氧化碳中毒早期,较高的血清NSE水平与后续发生迟发性神经精神后遗症的风险增加相关,具体结果为NSE每增加1 ng/mL,发生迟发性神经精神后遗症的优势比为1.10(95% CI: 1.06~1.15,P < 0.001)[148]。血清S100B和NfL水平均被证实与急性一氧化碳中毒迟发性神经系统后遗症的发生独立相关[149-150]。研究显示,较严重的急性有机磷中毒者入院时的血清S100B水平高于较轻者;同时,死亡患者的S100B水平高于存活患者[151]。上述研究提示S100B、NSE、NfL等急性脑损伤生物标志物可能是评估急性中毒脑损伤程度及预后的潜在指标,但仍其临床应用价值仍有待进一步开展大样本、高质量的临床研究进行验证。
3.3.3 热射病脑损伤问题17:对热射病脑损伤评估常采用颅脑影像学检查,脑损伤生物标志物可否用于热射病脑损伤诊断和预后评估?
推荐意见17:S100B和NSE在热射病脑损伤预后评估方面显示出一定的临床价值,入院时检测血清S100B水平升高与预后不良相关,入院时及入院后1、3、7 d检测的血清NSE、S100B水平升高与脑损伤程度增加相关(证据级别:4;推荐级别:C)。
热射病是一种由高温及相关热损伤因素所致的致死性疾病,临床特征为热代谢调节紊乱,进而导致多器官功能障碍。中枢神经系统功能障碍是热射病的核心表现,常在早期即出现谵妄、嗜睡、癫痫样发作或昏迷等严重神经学损害,并可能遗留长期认知与运动功能受损。影像学方面,颅脑CT是临床常用评估方法,但早期CT常呈阴性或仅见脑水肿的间接征象,限制了其早期诊断价值[152]。近年来,S100B和NSE被提出可作为热射病神经系统结局的潜在生物标志物[153]。研究显示,相比热射病预后良好组,入院时检测的血清S100B水平在预后不良组显著更高(中位水平:0.95 μg/L vs. 0.20 μg/L,P < 0.001),S100B水平升高是热射病不良预后的独立预测因子,以0.610 μg/L为临界值,预测不良预后的敏感度为86%,特异度为86%[154]。重症热射病脑损伤患者入院时及入院后1、3、7 d检测的血清NSE、S100B水平相比健康对照组显著升高,这些标志物在一定程度上能反映脑组织的损伤程度(GCS评估),提示NSE和S100B可作为热射病脑损伤临床诊治和预后评估的重要参考指标[155]。
4 结语心脑血管、呼吸和代谢性疾病及癌症是当前威胁我国居民健康的“四大慢病”,防治任务艰巨,已被列为国家“科技创新2030”重大科技项目重点专项,旨在推动这“四大慢病”领域的科技创新,提升我国重大疾病防治水平,助力健康中国建设。在心脑血管疾病领域,特别是脑卒中,脑损伤生物标志物在病情严重程度和预后评估中的重要临床意义已逐渐得到认可。然而,目前脑损伤生物标志物用于代谢性疾病(如高钠血症)及其他急危重症(如严重肝肾疾病引发的肝性脑病、尿毒症;呼吸系统急危重症引发的急性呼吸窘迫综合征、呼吸衰竭)的临床证据仍然有限。这些标志物是否与继发性脑损伤的发生发展相关,以及其对神经功能预后的临床价值,有待未来进一步研究。
急性脑损伤的精准化管理亟需突破传统评估模式的局限性。本共识系统梳理和总结了急性脑损伤生物标志物在疾病管理中的三大主要临床价值,包括早期预警、动态监测和预后评估。S100B等标志物可在影像学改变出现之前前提示,血脑屏障破坏,为超急性期干预争取时间窗;对S100B、NSE等脑损伤生物标志物水平进行动态监测,可提供连续量化评估依据,反映病情演变过程。标志物水平与远期神经功能预后显著相关,有利于临床制定个体化康复方案。本共识中急性脑损伤生物标志物的临床应用推荐见附表2。然而,脑损伤生物标志物的临床应用仍面临检测标准化不足、颅外干扰因素等挑战。本共识倡导建立”影像学-生物标志物-临床量表”三位一体的综合评估体系,建议临床科室优先开展循证支持充分的检测项目,如S100B(用于mTBI分诊)、NSE(用于CA预后评估)。未来仍需通过多中心、高质量研究来完善检测的特异度时间和最佳阈值体系,探索NfL、GFAP等新型标志物在脑损伤精准医疗中的应用潜力。
执笔人 姚鹏(四川大学华西医院)郑梓煜(中山大学附属第一医院)胡鑫(四川大学华西医院)
共识专家组成员(按姓氏汉语拼音字母排序) 曹炬(重庆医科大学附属第一医院)曹钰(四川大学华西医院)曹阳(解放军总医院第四医学中心)陈旭岩(清华大学附属北京清华长庚医院)陈锋(福建省立医院)陈宏毅(福建省立医院)陈之光(中国医科大学附属盛京医院)杜工亮(陕西省人民医院)邓颖(哈尔滨医科大学附属第二医院)窦清理(深圳市宝安区人民医院)龚平(北京大学深圳医院)郭睿(重庆医科大学附属第一医院)贺勇(四川大学华西医院)胡北(广东省人民医院)胡恩喜(哈尔滨医科大学附属第一医院)何小军(浙江大学医学院附属第二医院)蒋龙元(中山大学孙逸仙纪念医院)赖晓霏(重庆医科大学附属第一医院)兰超(郑州大学第一附属医院)李湘民(中南大学湘雅医院)李燕(山西医科大学第二医院)李宏伟(云南省曲靖中心医院)李铁刚(中国医科大学附属盛京医院)梁璐(河北大学附属医院)刘明华(陆军军医大学第一附属医院)刘雪兰(宁波市医疗中心李惠利医院)卢中秋(温州医科大学附属第一医院)马青变(北京大学第三医院)马潞(四川大学华西医院)毛恩强(上海交通大学医学院附属瑞金医院)聂时南(中国人民解放军东部战区总医院)倪军(南京大学医学院附属鼓楼医院)欧阳艳红(海南省人民医院)裴俏(中国急救医学杂志)裴红红(西安交通大学第二附属医院)潘曙明(上海交通大学医学院附属新华医院)宋伟(四川大学华西医院)宋艳丽(上海市同济医院)宋志俊(邢台医学院附属医院)孙明伟(四川省人民医院)单爱军(香港大学深圳医院)唐建国(上海市第五人民医院)田兆兴(北京积水潭医院)屠苏(无锡市第二人民医院)吴利东(南昌大学第二附属医院)王彤(中山大学附属第八医院)王青(南方医科大学珠江医院)王彦军(西安市红会医院)王永(徐州医科大学附属医院)王海霞(山东省威海市市立医院)魏平波(绵竹市中医医院)谢筱琪(四川大学华西医院)邢金燕(青岛大学附属医院)徐军(北京协和医院)徐银海(徐州医科大学附属医院)熊艳(南方医科大学南方医院)闫乐媛(解放军总医院第四医学中心)余海放(四川大学华西医院)于学忠(北京协和医院)詹红(中山大学附属第一医院)尹文(空军军医大学西京医院)杨立山(宁夏医科大学总医院)张新超(北京医院)张剑锋(广西医科大学附属武鸣医院)张式鸿(中山大学附属第一医院)赵晓东(解放军总医院第四医学中心)赵龙(川北医学院附属医院)朱海燕(中国人民解放军总医院)朱建军(苏州大学附属第二医院)周宁(湛江中心人民医院)
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
利益冲突 所有作者声明无利益冲突
| [1] | Huang Y, Wang ZZ, Huang ZX, et al. Biomarkers and the outcomes of ischemic stroke[J]. Front Mol Neurosci, 2023, 16: 1171101. DOI:10.3389/fnmol.2023.1171101 |
| [2] | Humaloja J, Ashton NJ, Skrifvars MB. Brain injury biomarkers for predicting outcome after cardiac arrest[J]. Crit Care, 2022, 26(1): 81. DOI:10.1186/s13054-022-03913-5 |
| [3] | Shahim P, Zetterberg H. Neurochemical markers of traumatic brain injury: relevance to acute diagnostics, disease monitoring, and neuropsychiatric outcome prediction[J]. Biol Psychiatry, 2022, 91(5): 405-412. DOI:10.1016/j.biopsych.2021.10.010 |
| [4] | Pei MQ, Yang YS, Zhang CY, et al. Role of serum neuron-specific enolase levels in the early diagnosis and prognosis of sepsis-associated encephalopathy: a systematic review and meta-analysis[J]. Front Neurol, 2024, 15: 1353063. DOI:10.3389/fneur.2024.1353063 |
| [5] | Hu JY, Xie SC, Li WC, et al. Diagnostic and prognostic value of serum S100B in sepsis-associated encephalopathy: a systematic review and meta-analysis[J]. Front Immunol, 2023, 14: 1102126. DOI:10.3389/fimmu.2023.1102126 |
| [6] | Zhang Y, Gao N, Wang YB, et al. Association between serum neuron-specific enolase at admission and the risk of delayed neuropsychiatric sequelae in adults with carbon monoxide poisoning: a meta-analysis[J]. Biomol Biomed, 2024, 24(6): 1482-1490. DOI:10.17305/bb.2024.10757 |
| [7] | Liu H, Zhang Y, Ren YB, et al. Serum S100B level may be correlated with carbon monoxide poisoning[J]. Int Immunopharmacol, 2015, 27(1): 69-75. DOI:10.1016/j.intimp.2015.04.027 |
| [8] | Peacock SH, Tomlinson AD. Multimodal neuromonitoring in neurocritical care[J]. AACN Adv Crit Care, 2018, 29(2): 183-194. DOI:10.4037/aacnacc2018632 |
| [9] | Nolan JP, Sandroni C, Böttiger BW, et al. European resuscitation council and European society of intensive care medicine guidelines 2021: post-resuscitation care[J]. Intensive Care Med, 2021, 47(4): 369-421. DOI:10.1007/s00134-021-06368-4 |
| [10] | Group OLoEW. Oxford center for evidence-based medicine 2011 levels of evidence[EB/OL]. (2020-01-07)[2024-06-24]. https://www.cebm.ox.ac.uk/resources/levels-of-evidence/ocebm-levels-of-evidence. |
| [11] | Ruhatiya RS, Adukia SA, Manjunath RB, et al. Current status and recommendations in multimodal neuromonitoring[J]. Indian J Crit Care Med, 2020, 24(5): 353-360. DOI:10.5005/jp-journals-10071-23431 |
| [12] | Hossain I, Marklund N, Czeiter E, et al. Blood biomarkers for traumatic brain injury: a narrative review of current evidence[J]. Brain Spine, 2023, 4: 102735. DOI:10.1016/j.bas.2023.102735 |
| [13] | Quintairos A, Pilcher D, Salluh JIF. ICU scoring systems[J]. Intensive Care Med, 2023, 49(2): 223-225. DOI:10.1007/s00134-022-06914-8 |
| [14] | Riker RR, Fugate JE, Participants in the International Multi-disciplinary Consensus Conference on Multimodality Monitoring. Clinical monitoring scales in acute brain injury: assessment of Coma, pain, agitation, and delirium[J]. Neurocrit Care, 2014, 21(Suppl 2): S27-S37. DOI:10.1007/s12028-014-0025-5 |
| [15] | Zhang H, Wang J, Qu Y, et al. Brain injury biomarkers and applications in neurological diseases[J]. Chin Med J (Engl), 2025, 138(1): 5-14. DOI:10.1097/CM9.0000000000003061 |
| [16] | Kim DS, Kim GW. Biofluid-based biomarkers in traumatic brain injury: a narrative review[J]. Brain Neurorehabil, 2024, 17(1): e8. DOI:10.12786/bn.2024.17.e8 |
| [17] | 冯华, 陈渝杰, 黄苏娜. 生物标志物在创伤性颅脑损伤救治中的应用现状及展望[J]. 中华神经医学杂志, 2022, 21(1): 2-5. DOI:10.3760/cma.j.cn115354-20210902-00567 |
| [18] | Diaz-Arrastia R, Shahim P, Sandsmark DK. Molecular biomarkers in the neurological ICU: is there a role?[J]. Curr Opin Crit Care, 2020, 26(2): 103-108. DOI:10.1097/MCC.0000000000000703 |
| [19] | Oris C, Kahouadji S, Durif J, et al. S100B, actor and biomarker of mild traumatic brain injury[J]. Int J Mol Sci, 2023, 24(7): 6602. DOI:10.3390/ijms24076602 |
| [20] | Gong B, Leznik E. The role of ubiquitin C-terminal hydrolase L1 in neurodegenerative disorders[J]. Drug News Perspect, 2007, 20(6): 365-370. DOI:10.1358/dnp.2007.20.6.1138160 |
| [21] | Khalil M, Teunissen CE, Lehmann S, et al. Neurofilaments as biomarkers in neurological disorders: towards clinical application[J]. Nat Rev Neurol, 2024, 20(5): 269-287. DOI:10.1038/s41582-024-00955-x |
| [22] | Hossain I, Blennow K, Posti JP, et al. Tau as a fluid biomarker of concussion and neurodegeneration[J]. Concussion, 2022, 7(2): CNC98. DOI:10.2217/cnc-2022-0004 |
| [23] | Hier DB, Obafemi-Ajayi T, Thimgan MS, et al. Blood biomarkers for mild traumatic brain injury: a selective review of unresolved issues[J]. Biomark Res, 2021, 9(1): 70. DOI:10.1186/s40364-021-00325-5 |
| [24] | Thelin EP, Nelson DW, Bellander BM. A review of the clinical utility of serum S100B protein levels in the assessment of traumatic brain injury[J]. Acta Neurochir (Wien), 2017, 159(2): 209-225. DOI:10.1007/s00701-016-3046-3 |
| [25] | Stroick M, Fatar M, Ragoschke-Schumm A, et al. Protein S-100B: a prognostic marker for cerebral damage[J]. Curr Med Chem, 2006, 13(25): 3053-3060. DOI:10.2174/092986706778521751 |
| [26] | Deckers EA, Kruijff S, Brouwers AH, et al. The association between active tumor volume, total lesion glycolysis and levels of S-100B and LDH in stage Ⅳ melanoma patients[J]. Eur J Surg Oncol, 2020, 46(11): 2147-2153. DOI:10.1016/j.ejso.2020.07.011 |
| [27] | Diaz-Arrastia R, Wang KKW, Papa LD, et al. Acute biomarkers of traumatic brain injury: relationship between plasma levels of ubiquitin C-terminal hydrolase-L1 and glial fibrillary acidic protein[J]. J Neurotrauma, 2014, 31(1): 19-25. DOI:10.1089/neu.2013.3040 |
| [28] | Papa LD, Brophy GM, Welch RD, et al. Time course and diagnostic accuracy of glial and neuronal blood biomarkers GFAP and UCH-L1 in a large cohort of trauma patients with and without mild traumatic brain injury[J]. JAMA Neurol, 2016, 73(5): 551-560. DOI:10.1001/jamaneurol.2016.0039 |
| [29] | Adrian H, Mårten K, Salla N, et al. Biomarkers of traumatic brain injury: temporal changes in body fluids[J]. eNeuro, 2016, 3(6): ENEURO. 0294-16.2016. DOI:10.1523/ENEURO.0294-16.2016 |
| [30] | Thelin EP, Zeiler FA, Ercole A, et al. Serial sampling of serum protein biomarkers for monitoring human traumatic brain injury dynamics: a systematic review[J]. Front Neurol, 2017, 8: 300. DOI:10.3389/fneur.2017.00300 |
| [31] | Cheng F, Yuan Q, Yang J, et al. The prognostic value of serum neuron-specific enolase in traumatic brain injury: systematic review and meta-analysis[J]. PLoS One, 2014, 9(9): e106680. DOI:10.1371/journal.pone.0106680 |
| [32] | Woertgen C, Rothoerl RD, Brawanski A. Neuron-specific enolase serum levels after controlled cortical impact injury in the rat[J]. J Neurotrauma, 2001, 18(5): 569-573. DOI:10.1089/089771501300227378 |
| [33] | Babkina AS, Lyubomudrov MA, Golubev MA, et al. Neuron-specific enolase-what are we measuring?[J]. Int J Mol Sci, 2024, 25(9): 5040. DOI:10.3390/ijms25095040 |
| [34] | Shahim P, Politis A, van der Merwe A, et al. Time course and diagnostic utility of NfL, tau, GFAP, and UCH-L1 in subacute and chronic TBI[J]. Neurology, 2020, 95(6): e623-e636. DOI:10.1212/WNL.0000000000009985 |
| [35] | Graham NSN, Zimmerman KA, Moro F, et al. Axonal marker neurofilament light predicts long-term outcomes and progressive neurodegeneration after traumatic brain injury[J]. Sci Transl Med, 2021, 13(613): eabg9922. DOI:10.1126/scitranslmed.abg9922 |
| [36] | Tuure J, Mohammadian M, Tenovuo O, et al. Late blood levels of neurofilament light correlate with outcome in patients with traumatic brain injury[J]. J Neurotrauma, 2024, 41(3/4): 359-368. DOI:10.1089/neu.2023.0207 |
| [37] | Posti JP, Tenovuo O. Blood-based biomarkers and traumatic brain injury-a clinical perspective[J]. Acta Neurol Scand, 2022, 146(4): 389-399. DOI:10.1111/ane.13620 |
| [38] | Shahim P, Tegner Y, Marklund N, et al. Neurofilament light and tau as blood biomarkers for sports-related concussion[J]. Neurology, 2018, 90(20): e1780-e1788. DOI:10.1212/WNL.0000000000005518 |
| [39] | Clarke GJB, Skandsen T, Zetterberg H, et al. One-year prospective study of plasma biomarkers from CNS in patients with mild traumatic brain injury[J]. Front Neurol, 2021, 12: 643743. DOI:10.3389/fneur.2021.643743 |
| [40] | Rubenstein R, Chang BG, Yue JK, et al. Comparing plasma phospho tau, total tau, and phospho tau-total tau ratio as acute and chronic traumatic brain injury biomarkers[J]. JAMA Neurol, 2017, 74(9): 1063-1072. DOI:10.1001/jamaneurol.2017.0655 |
| [41] | Gonzalez-Ortiz F, Dulewicz M, Ashton NJ, et al. Association of serum brain-derived tau with clinical outcome and longitudinal change in patients with severe traumatic brain injury[J]. JAMA Netw Open, 2023, 6(7): e2321554. DOI:10.1001/jamanetworkopen.2023.21554 |
| [42] | Maas AIR, Menon DK, Manley GT, et al. Traumatic brain injury: progress and challenges in prevention, clinical care, and research[J]. Lancet Neurol, 2022, 21(11): 1004-1060. DOI:10.1016/S1474-4422(22)00309-X |
| [43] | Gao GY, Wu X, Feng JF, et al. Clinical characteristics and outcomes in patients with traumatic brain injury in China: a prospective, multicentre, longitudinal, observational study[J]. Lancet Neurol, 2020, 19(8): 670-677. DOI:10.1016/S1474-4422(20)30182-4 |
| [44] | Jiang JY, Gao GY, Feng JF, et al. Traumatic brain injury in China[J]. Lancet Neurol, 2019, 18(3): 286-295. DOI:10.1016/S1474-4422(18)30469-1 |
| [45] | American College of Emergency Physicians Clinical Policies Subcommittee on Mild Traumatic Brain Injury, Valente JH, Anderson JD, et al. Clinical policy: critical issues in the management of adult patients presenting to the emergency department with mild traumatic brain injury: approved by ACEP board of directors, February 1, 2023 clinical policy endorsed by the emergency nurses association (April 5, 2023)[J]. Ann Emerg Med, 2023, 81(5): e63-e105. DOI:10.1016/j.annemergmed.2023.01.014 |
| [46] | 何磊磊, 丁礼, 陆士奇, 等. 轻度创伤性脑损伤评估及管理的研究进展[J]. 中华急诊医学杂志, 2016, 25(7) 959-963, 964. DOI:10.3760/cma.j.issn.1671-0282.2016.07.025 |
| [47] | Silvestro S, Raffaele I, Quartarone A, et al. Innovative insights into traumatic brain injuries: biomarkers and new pharmacological targets[J]. Int J Mol Sci, 2024, 25(4): 2372. DOI:10.3390/ijms25042372 |
| [48] | Undén J, Romner B. Can low serum levels of S100B predict normal CT findings after minor head injury in adults?: an evidence-based review and meta-analysis[J]. J Head Trauma Rehabil, 2010, 25(4): 228-240. DOI:10.1097/HTR.0b013e3181e57e22 |
| [49] | Allouchery G, Moustafa F, Roubin J, et al. Clinical validation of S100B in the management of a mild traumatic brain injury: issues from an interventional cohort of 1449 adult patients[J]. Clin Chem Lab Med, 2018, 56(11): 1897-1904. DOI:10.1515/cclm-2018-0471 |
| [50] | Laribi S, Kansao J, Borderie D, et al. S100B blood level measurement to exclude cerebral lesions after minor head injury: the multicenter STIC-S100 French study[J]. Clin Chem Lab Med, 2014, 52(4): 527-536. DOI:10.1515/cclm-2013-0621 |
| [51] | Mondello S, Sorinola A, Czeiter E, et al. Blood-based protein biomarkers for the management of traumatic brain injuries in adults presenting to emergency departments with mild brain injury: a living systematic review and meta-analysis[J]. J Neurotrauma, 2021, 38(8): 1086-1106. DOI:10.1089/neu.2017.5182 |
| [52] | Heidari K, Vafaee A, Rastekenari AM, et al. S100B protein as a screening tool for computed tomography findings after mild traumatic brain injury: Systematic review and meta-analysis[J]. Brain Inj, 2015, 29(10): 1146-1157. DOI:10.3109/02699052.2015.1037349 |
| [53] | Undén J, Ingebrigtsen T, Romner B, et al. Scandinavian guidelines for initial management of minimal, mild and moderate head injuries in adults: an evidence and consensus-based update[J]. BMC Med, 2013, 11: 50. DOI:10.1186/1741-7015-11-50 |
| [54] | Jagoda AS, Bazarian JJ, Bruns JJ, et al. Clinical policy: neuroimaging and decisionmaking in adult mild traumatic brain injury in the acute setting[J]. J Emerg Nurs, 2009, 35(2): e5-e40. DOI:10.1016/j.jen.2008.12.010 |
| [55] | Undén L, Calcagnile O, Undén J, et al. Validation of the Scandinavian guidelines for initial management of minimal, mild and moderate traumatic brain injury in adults[J]. BMC Med, 2015, 13: 292. DOI:10.1186/s12916-015-0533-y |
| [56] | Calcagnile O, Anell A, Undén J. The addition of S100B to guidelines for management of mild head injury is potentially cost saving[J]. BMC Neurol, 2016, 16(1): 200. DOI:10.1186/s12883-016-0723-z |
| [57] | Marzano LAS, Batista JPT, de Abreu Arruda M, et al. Traumatic brain injury biomarkers in pediatric patients: a systematic review[J]. Neurosurg Rev, 2022, 45(1): 167-197. DOI:10.1007/s10143-021-01588-0 |
| [58] | Czeiter E, Amrein K, Gravesteijn BY, et al. Blood biomarkers on admission in acute traumatic brain injury: Relations to severity, CT findings and care path in the CENTER-TBI study[J]. EBioMedicine, 2020, 56: 102785. DOI:10.1016/j.ebiom.2020.102785 |
| [59] | Whitehouse DP, Monteiro M, Czeiter E, et al. Relationship of admission blood proteomic biomarkers levels to lesion type and lesion burden in traumatic brain injury: a CENTER-TBI study[J]. EBioMedicine, 2022, 75: 103777. DOI:10.1016/j.ebiom.2021.103777 |
| [60] | Koivikko P, Posti JP, Mohammadian M, et al. Potential of heart fatty-acid binding protein, neurofilament light, interleukin-10 and S100 calcium-binding protein B in the acute diagnostics and severity assessment of traumatic brain injury[J]. Emerg Med J, 2022, 39(3): 206-212. DOI:10.1136/emermed-2020-209471 |
| [61] | Munoz Pareja JC, de Rivero Vaccari JP, Chavez MM, et al. Prognostic and diagnostic utility of serum biomarkers in pediatric traumatic brain injury[J]. J Neurotrauma, 2024, 41(1/2): 106-122. DOI:10.1089/neu.2023.0039 |
| [62] | Fridriksson T, Kini N, Walsh-Kelly C, et al. Serum neuron-specific enolase as a predictor of intracranial lesions in children with head trauma: a pilot study[J]. Acad Emerg Med, 2000, 7(7): 816-820. DOI:10.1111/j.1553-2712.2000.tb02276.x |
| [63] | Gao JX, Zheng ZC. Development of prognostic models for patients with traumatic brain injury: a systematic review[J]. Int J Clin Exp Med, 2015, 8(11): 19881-19885. |
| [64] | Mercier E, Boutin A, Lauzier F, et al. Predictive value of S-100β protein for prognosis in patients with moderate and severe traumatic brain injury: systematic review and meta-analysis[J]. BMJ, 2013, 346: f1757. DOI:10.1136/bmj.f1757 |
| [65] | Egea-Guerrero JJ, Murillo-Cabezas F, Gordillo-Escobar E, et al. S100B protein may detect brain death development after severe traumatic brain injury[J]. J Neurotrauma, 2013, 30(20): 1762-1769. DOI:10.1089/neu.2012.2606 |
| [66] | Retel Helmrich IRA, Czeiter E, Amrein K, et al. Incremental prognostic value of acute serum biomarkers for functional outcome after traumatic brain injury (CENTER-TBI): an observational cohort study[J]. Lancet Neurol, 2022, 21(9): 792-802. DOI:10.1016/S1474-4422(22)00218-6 |
| [67] | Richter S, Czeiter E, Amrein K, et al. Prognostic value of serum biomarkers in patients with moderate-severe traumatic brain injury, differentiated by Marshall computer tomography classification[J]. J Neurotrauma, 2023, 40(21/22): 2297-2310. DOI:10.1089/neu.2023.0029 |
| [68] | Korley FK, Jain S, Sun XY, et al. Prognostic value of day-of-injury plasma GFAP and UCH-L1 concentrations for predicting functional recovery after traumatic brain injury in patients from the US TRACK-TBI cohort: an observational cohort study[J]. Lancet Neurol, 2022, 21(9): 803-813. DOI:10.1016/S1474-4422(22)00256-3 |
| [69] | Shemilt M, Boutin A, Lauzier F, et al. Prognostic value of glial fibrillary acidic protein in patients with moderate and severe traumatic brain injury: a systematic review and meta-analysis[J]. Crit Care Med, 2019, 47(6): e522-e529. DOI:10.1097/CCM.0000000000003728 |
| [70] | Shahim P, Gren M, Liman V, et al. Serum neurofilament light protein predicts clinical outcome in traumatic brain injury[J]. Sci Rep, 2016, 6: 36791. DOI:10.1038/srep36791 |
| [71] | Hossain I, Mohammadian M, Takala RSK, et al. Early levels of glial fibrillary acidic protein and neurofilament light protein in predicting the outcome of mild traumatic brain injury[J]. J Neurotrauma, 2019, 36(10): 1551-1560. DOI:10.1089/neu.2018.5952 |
| [72] | Thelin E, Al Nimer F, Frostell A, et al. A serum protein biomarker panel improves outcome prediction in human traumatic brain injury[J]. J Neurotrauma, 2019, 36(20): 2850-2862. DOI:10.1089/neu.2019.6375 |
| [73] | Åkerlund CAI, Holst A, Bhattacharyay S, et al. Clinical descriptors of disease trajectories in patients with traumatic brain injury in the intensive care unit (CENTER-TBI): a multicentre observational cohort study[J]. Lancet Neurol, 2024, 23(1): 71-80. DOI:10.1016/S1474-4422(23)00358-7 |
| [74] | Thelin EP, Nelson DW, Bellander BM. Secondary peaks of S100B in serum relate to subsequent radiological pathology in traumatic brain injury[J]. Neurocrit Care, 2014, 20(2): 217-229. DOI:10.1007/s12028-013-9916-0 |
| [75] | Zheng JQ, Lv CZ, Zheng W, et al. Incidence, process of care, and outcomes of out-of-hospital cardiac arrest in China: a prospective study of the BASIC-OHCA registry[J]. Lancet Public Health, 2023, 8(12): e923-e932. DOI:10.1016/S2468-2667(23)00173-1 |
| [76] | 中国心脏骤停与心肺复苏报告编写组. 中国心脏骤停与心肺复苏报告(2022年版)概要[J]. 中国循环杂志, 2023, 38(10): 1005-1017. DOI:10.3969/j.issn.1000-3614.2023.10.002 |
| [77] | 中华医学会急诊医学分会复苏学组, 中国医药教育协会急诊专业委员会, 成人心脏骤停后综合征诊断和治疗中国急诊专家共识组. 成人心脏骤停后综合征诊断和治疗中国急诊专家共识[J]. 中华急诊医学杂志, 2021, 30(7): 799-808. DOI:10.3760/cma.j.issn.1671-0282.2021.07.002 |
| [78] | Chen XL, Li DZ, He L, et al. The prevalence of anxiety and depression in cardiac arrest survivors: a systematic review and meta-analysis[J]. Gen Hosp Psychiatry, 2023, 83: 8-19. DOI:10.1016/j.genhosppsych.2023.03.013 |
| [79] | Ma QB, Feng LQ, Wang T, et al. 2020 expert consensus statement on neuro-protection after cardiac arrest in China[J]. Ann Transl Med, 2021, 9(2): 175. DOI:10.21037/atm-20-7853 |
| [80] | 姚鹏, 马雯, 王智渊, 等. 心肺复苏后脑损伤的研究进展[J]. 中国科学: 生命科学, 2022, 52(11): 1715-1730. |
| [81] | Storm C, Nee J, Jörres A, et al. Serial measurement of neuron specific enolase improves prognostication in cardiac arrest patients treated with hypothermia: a prospective study[J]. Scand J Trauma Resusc Emerg Med, 2012, 20: 6. DOI:10.1186/1757-7241-20-6 |
| [82] | Pfeifer R, Franz M, Figulla HR. Hypothermia after cardiac arrest does not affect serum levels of neuron-specific enolase and protein S-100b[J]. Acta Anaesthesiol Scand, 2014, 58(9): 1093-1100. DOI:10.1111/aas.12386 |
| [83] | Duez CHV, Grejs AM, Jeppesen AN, et al. Neuron-specific enolase and S-100b in prolonged targeted temperature management after cardiac arrest: a randomised study[J]. Resuscitation, 2018, 122: 79-86. DOI:10.1016/j.resuscitation.2017.11.052 |
| [84] | Stammet P, Dankiewicz J, Nielsen N, et al. Protein S100 as outcome predictor after out-of-hospital cardiac arrest and targeted temperature management at 33 ℃ and 36 ℃[J]. Crit Care, 2017, 21(1): 153. DOI:10.1186/s13054-017-1729-7 |
| [85] | Calderon LM, Guyette FX, Doshi AA, et al. Combining NSE and S100B with clinical examination findings to predict survival after resuscitation from cardiac arrest[J]. Resuscitation, 2014, 85(8): 1025-1029. DOI:10.1016/j.resuscitation.2014.04.020 |
| [86] | Lagebrant A, Lang M, Nielsen N, et al. Brain injury markers in blood predict signs of hypoxic ischaemic encephalopathy on head computed tomography after cardiac arrest[J]. Resuscitation, 2023, 184: 109668. DOI:10.1016/j.resuscitation.2022.12.006 |
| [87] | Sharma K, John M, Zhang S, et al. Serum neuron-specific enolase thresholds for predicting postcardiac arrest outcome: a systematic review and meta-analysis[J]. Neurology, 2022, 98(1): e62-e72. DOI:10.1212/WNL.0000000000012967 |
| [88] | 续国武, 王晋祥, 靳衡. 早期多指标监测预测心脏骤停后脑损伤患者神经功能预后的价值[J]. 中华急诊医学杂志, 2023, 32(12): 1674-1679. DOI:10.3760/cma.j.issn.1671-0282.2023.12.017 |
| [89] | Luescher T, Mueller J, Isenschmid C, et al. Neuron-specific enolase (NSE) improves clinical risk scores for prediction of neurological outcome and death in cardiac arrest patients: Results from a prospective trial[J]. Resuscitation, 2019, 142: 50-60. DOI:10.1016/j.resuscitation.2019.07.003 |
| [90] | Soar J, Berg KM, Andersen LW, et al. Adult advanced life support: 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations[J]. Resuscitation, 2020, 156: A80-A119. DOI:10.1016/j.resuscitation.2020.09.012 |
| [91] | Jang JH, Park WB, Lim YS, et al. Combination of S100B and procalcitonin improves prognostic performance compared to either alone in patients with cardiac arrest: a prospective observational study[J]. Medicine (Baltimore), 2019, 98(6): e14496. DOI:10.1097/MD.0000000000014496 |
| [92] | Hoiland RL, Rikhraj KJK, Thiara S, et al. Neurologic prognostication after cardiac arrest using brain biomarkers: a systematic review and meta-analysis[J]. JAMA Neurol, 2022, 79(4): 390-398. DOI:10.1001/jamaneurol.2021.5598 |
| [93] | 心肺复苏后昏迷患者早期神经功能预后评估专家共识组. 心肺复苏后昏迷患者早期神经功能预后评估专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 156-162. DOI:10.3760/cma.j.issn.1671-0282.2019.02.006 |
| [94] | 杨风梅, 马宝重, 孙强, 等. 血清神经丝轻链对院外心搏骤停患者神经功能的预测价值[J]. 中华急诊医学杂志, 2023, 32(3): 371-376. DOI:10.3760/cma.j.issn.1671-0282.2023.03.016 |
| [95] | Klitholm M, Jeppesen AN, Christensen S, et al. Neurofilament Light Chain and Glial Fibrillary Acidic Protein as early prognostic biomarkers after out-of-hospital cardiac arrest[J]. Resuscitation, 2023, 193: 109983. DOI:10.1016/j.resuscitation.2023.109983 |
| [96] | Arctaedius I, Levin H, Thorgeirsdóttir B, et al. Plasma glial fibrillary acidic protein and tau: predictors of neurological outcome after cardiac arrest[J]. Crit Care, 2024, 28(1): 116. DOI:10.1186/s13054-024-04889-0 |
| [97] | Ebner F, Moseby-Knappe M, Mattsson-Carlgren N, et al. Serum GFAP and UCH-L1 for the prediction of neurological outcome in comatose cardiac arrest patients[J]. Resuscitation, 2020, 154: 61-68. DOI:10.1016/j.resuscitation.2020.05.016 |
| [98] | Mattsson N, Zetterberg H, Nielsen N, et al. Serum tau and neurological outcome in cardiac arrest[J]. Ann Neurol, 2017, 82(5): 665-675. DOI:10.1002/ana.25067 |
| [99] | Hasslacher J, Rass V, Beer R, et al. Serum tau as a predictor for neurological outcome after cardiopulmonary resuscitation[J]. Resuscitation, 2020, 148: 207-214. DOI:10.1016/j.resuscitation.2020.01.022 |
| [100] | Kurek K, Swieczkowski D, Pruc M, et al. Predictive performance of neuron-specific enolase (NSE) for survival after resuscitation from cardiac arrest: a systematic review and meta-analysis[J]. J Clin Med, 2023, 12(24): 7655. DOI:10.3390/jcm12247655 |
| [101] | Stammet P, Collignon O, Hassager C, et al. Neuron-specific enolase as a predictor of death or poor neurological outcome after out-of-hospital cardiac arrest and targeted temperature management at 33℃ and 36℃[J]. J Am Coll Cardiol, 2015, 65(19): 2104-2114. DOI:10.1016/j.jacc.2015.03.538 |
| [102] | Disanto G, Prosperetti C, Gobbi C, et al. Serum neurofilament light chain as a prognostic marker in postanoxic encephalopathy[J]. Epilepsy Behav, 2019, 101(Pt B): 106432. DOI:10.1016/j.yebeh.2019.07.033 |
| [103] | Tu WJ, Wang LD, Yan F, et al. China stroke surveillance report 2021[J]. Mil Med Res, 2023, 10(1): 33. DOI:10.1186/s40779-023-00463-x |
| [104] | Wang YJ, Li ZX, Gu HQ, et al. China stroke statistics: an update on the 2019 report from the national center for healthcare quality management in neurological diseases, China national clinical research center for neurological diseases, the Chinese stroke association, national center for chronic and non-communicable disease control and prevention, Chinese center for disease control and prevention and institute for global neuroscience and stroke collaborations[J]. Stroke Vasc Neurol, 2022, 7(5): 415-450. DOI:10.1136/svn-2021-001374 |
| [105] | Nash DL, Fernanda Bellolio M, Stead LG. S100 as a marker of acute brain ischemia: a systematic review[J]. Neurocrit Care, 2008, 8(2): 301-307. DOI:10.1007/s12028-007-9019-x |
| [106] | Mochetti MM, Silva EGP, Correa AAF, et al. Neuron-specific enolase at admission as a predictor for stroke volume, severity and outcome in ischemic stroke patients: a prognostic biomarker review[J]. Sci Rep, 2024, 14(1): 2688. DOI:10.1038/s41598-024-53080-6 |
| [107] | Brea D, Sobrino T, Blanco M, et al. Temporal profile and clinical significance of serum neuron-specific enolase and S100 in ischemic and hemorrhagic stroke[J]. Clin Chem Lab Med, 2009, 47(12): 1513-1518. DOI:10.1515/CCLM.2009.337 |
| [108] | Singh HV, Pandey A, Shrivastava AK, et al. Prognostic value of neuron specific enolase and IL-10 in ischemic stroke and its correlation with degree of neurological deficit[J]. Clin Chim Acta, 2013, 419: 136-138. DOI:10.1016/j.cca.2013.02.014 |
| [109] | Wang P, Fan J, Yuan L, et al. Serum neurofilament light predicts severity and prognosis in patients with ischemic stroke[J]. Neurotox Res, 2020, 37(4): 987-995. DOI:10.1007/s12640-019-00159-y |
| [110] | Amalia L. Glial fibrillary acidic protein (GFAP): neuroinflammation biomarker in acute ischemic stroke[J]. J Inflamm Res, 2021, 14: 7501-7506. DOI:10.2147/JIR.S342097 |
| [111] | Wunderlich MT, Lins H, Skalej M, et al. Neuron-specific enolase and tau protein as neurobiochemical markers of neuronal damage are related to early clinical course and long-term outcome in acute ischemic stroke[J]. Clin Neurol Neurosurg, 2006, 108(6): 558-563. DOI:10.1016/j.clineuro.2005.12.006 |
| [112] | ÜstündağM, OrakM, GüloğluC, 等. The role of serum osteoprotegerin and S-100 protein levels in patients with acute ischaemic stroke: determination of stroke subtype, severity and mortality[J]. J Int Med Res, 2011, 39(3): 780-789. DOI:10.1177/147323001103900310 |
| [113] | Gao LF, Xie JL, Zhang HQ, et al. Neuron-specific enolase in hypertension patients with acute ischemic stroke and its value forecasting long-term functional outcomes[J]. BMC Geriatr, 2023, 23(1): 294. DOI:10.1186/s12877-023-03986-z |
| [114] | Barba L, Vollmuth C, Abu-Rumeileh S, et al. Serum β-synuclein, neurofilament light chain and glial fibrillary acidic protein as prognostic biomarkers in moderate-to-severe acute ischemic stroke[J]. Sci Rep, 2023, 13(1): 20941. DOI:10.1038/s41598-023-47765-7 |
| [115] | Pujol-Calderón F, Zetterberg H, Portelius E, et al. Prediction of outcome after endovascular embolectomy in anterior circulation stroke using biomarkers[J]. Transl Stroke Res, 2022, 13(1): 65-76. DOI:10.1007/s12975-021-00905-5 |
| [116] | Correia M, Silva I, Gabriel D, et al. Early plasma biomarker dynamic profiles are associated with acute ischemic stroke outcomes[J]. Eur J Neurol, 2022, 29(6): 1630-1642. DOI:10.1111/ene.15273 |
| [117] | Stanne TM, Gonzalez-Ortiz F, Brännmark C, et al. Association of plasma brain-derived tau with functional outcome after ischemic stroke[J]. Neurology, 2024, 102(4): e209129. DOI:10.1212/WNL.0000000000209129 |
| [118] | Vos PE, van Gils M, Beems T, et al. Increased GFAP and S100beta but not NSE serum levels after subarachnoid haemorrhage are associated with clinical severity[J]. Eur J Neurol, 2006, 13(6): 632-638. DOI:10.1111/j.1468-1331.2006.01332.x |
| [119] | Oertel M, Schumacher U, McArthur DL, et al. S-100B and NSE: markers of initial impact of subarachnoid haemorrhage and their relation to vasospasm and outcome[J]. J Clin Neurosci, 2006, 13(8): 834-840. DOI:10.1016/j.jocn.2005.11.030 |
| [120] | Johansson C, Aineskog H, Koskinen LD, et al. Serum neurofilament light as a predictor of outcome in subarachnoid haemorrhage[J]. Acta Neurochir (Wien), 2023, 165(10): 2793-2800. DOI:10.1007/s00701-023-05673-9 |
| [121] | Quintard H, Leduc S, Ferrari P, et al. Early and persistent high level of PS 100β is associated with increased poor neurological outcome in patients with SAH: is there a PS 100β threshold for SAH prognosis?[J]. Crit Care, 2016, 20: 33. DOI:10.1186/s13054-016-1200-1 |
| [122] | Kedziora J, Burzynska M, Gozdzik W, et al. Brain-specific biomarkers as mortality predictors after aneurysmal subarachnoid haemorrhage[J]. J Clin Med, 2020, 9(12): 4117. DOI:10.3390/jcm9124117 |
| [123] | Garland P, Morton M, Zolnourian A, et al. Neurofilament light predicts neurological outcome after subarachnoid haemorrhage[J]. Brain, 2021, 144(3): 761-768. DOI:10.1093/brain/awaa451 |
| [124] | Ren C, Yao RQ, Zhang H, et al. Sepsis-associated encephalopathy: a vicious cycle of immunosuppression[J]. J Neuroinflammation, 2020, 17(1): 14. DOI:10.1186/s12974-020-1701-3 |
| [125] | Sonneville R, Benghanem S, Jeantin L, et al. The spectrum of sepsis-associated encephalopathy: a clinical perspective[J]. Crit Care, 2023, 27(1): 386. DOI:10.1186/s13054-023-04655-8 |
| [126] | Fleischmann-Struzek C, Kesselmeier M, Ouart D, et al. Mid-German sepsis cohort (MSC): a prospective observational study of sepsis survivorship[J]. BMJ Open, 2021, 11(3): e043352. DOI:10.1136/bmjopen-2020-043352 |
| [127] | Sonneville R, de Montmollin E, Poujade J, et al. Potentially modifiable factors contributing to sepsis-associated encephalopathy[J]. Intensive Care Med, 2017, 43(8): 1075-1084. DOI:10.1007/s00134-017-4807-z |
| [128] | Lu X, Qin MB, Walline JH, et al. Clinical phenotypes of sepsis-associated encephalopathy: a retrospective cohort study[J]. Shock, 2023, 59(4): 583-590. DOI:10.1097/SHK.0000000000002092 |
| [129] | Eidelman LA, Putterman D, Putterman C, et al. The spectrum of septic encephalopathy. Definitions, etiologies, and mortalities[J]. JAMA, 1996, 275(6): 470-473. DOI:10.1001/jama.1996.03530300054040 |
| [130] | Hu JY, Li WC, Xie SC, et al. Unveiling neurogenic biomarkers for the differentiation between sepsis patients with or without encephalopathy: an updated meta-analysis[J]. Syst Rev, 2025, 14(1): 38. DOI:10.1186/s13643-025-02784-5 |
| [131] | Yao B, Zhang LN, Ai YH, et al. Serum S100β is a better biomarker than neuron-specific enolase for sepsis-associated encephalopathy and determining its prognosis: a prospective and observational study[J]. Neurochem Res, 2014, 39(7): 1263-1269. DOI:10.1007/s11064-014-1308-0 |
| [132] | Wu L, Feng Q, Ai ML, et al. The dynamic change of serum S100B levels from day 1 to day 3 is more associated with sepsis-associated encephalopathy[J]. Sci Rep, 2020, 10(1): 7718. DOI:10.1038/s41598-020-64200-3 |
| [133] | Sanfilippo F, Palumbo GJ, Noto A, et al. Prevalence of burnout among intensive care physicians: a systematic review[J]. Rev Bras Ter Intensiva, 2020, 32(3): 458-467. DOI:10.5935/0103-507X.20200076 |
| [134] | Chung HY, Wickel J, Oswald M, et al. Neurofilament light chain levels predict encephalopathy and outcome in community-acquired pneumonia[J]. Ann Clin Transl Neurol, 2023, 10(2): 204-212. DOI:10.1002/acn3.51711 |
| [135] | Wu L, Ai ML, Feng Q, et al. Serum glial fibrillary acidic protein and ubiquitin C-terminal hydrolase-L1 for diagnosis of sepsis-associated encephalopathy and outcome prognostication[J]. J Crit Care, 2019, 52: 172-179. DOI:10.1016/j.jcrc.2019.04.018 |
| [136] | Zhao T, Xia Y, Wang DW, et al. Association between elevated serum tau protein level and sepsis-associated encephalopathy in patients with severe sepsis[J]. Can J Infect Dis Med Microbiol, 2019, 2019: 1876174. DOI:10.1155/2019/1876174 |
| [137] | Zhang NN, Xie KL, Yang F, et al. Combining biomarkers of BNIP3 L, S100B, NSE, and accessible measures to predict sepsis-associated encephalopathy: a prospective observational study[J]. Curr Med Res Opin, 2024, 40(4): 575-582. DOI:10.1080/03007995.2024.2322059 |
| [138] | Erikson K, Ala-Kokko TI, Koskenkari J, et al. Elevated serum S-100β in patients with septic shock is associated with delirium[J]. Acta Anaesthesiol Scand, 2019, 63(1): 69-73. DOI:10.1111/aas.13228 |
| [139] | Anderson BJ, Reilly JP, Shashaty MGS, et al. Admission plasma levels of the neuronal injury marker neuron-specific enolase are associated with mortality and delirium in sepsis[J]. J Crit Care, 2016, 36: 18-23. DOI:10.1016/j.jcrc.2016.06.012 |
| [140] | Smeele PJ, Vermunt L, Blok S, et al. Neurofilament light increases over time in severe COVID-19 and is associated with delirium[J]. Brain Commun, 2022, 4(4): fcac195. DOI:10.1093/braincomms/fcac195 |
| [141] | Zhi ML, Huang J, Jin XL. Clinical value of serum neuron-specific enolase in sepsis-associated encephalopathy: a systematic review and meta-analysis[J]. Syst Rev, 2024, 13(1): 191. DOI:10.1186/s13643-024-02583-4 |
| [142] | Bircak-Kuchtova B, Chung HY, Wickel J, et al. Neurofilament light chains to assess sepsis-associated encephalopathy: Are we on the track toward clinical implementation?[J]. Crit Care, 2023, 27(1): 214. DOI:10.1186/s13054-023-04497-4 |
| [143] | Ehler J, Petzold A, Wittstock M, et al. The prognostic value of neurofilament levels in patients with sepsis-associated encephalopathy - A prospective, pilot observational study[J]. PLoS One, 2019, 14(1): e0211184. DOI:10.1371/journal.pone.0211184 |
| [144] | Ehler J, Barrett LK, Taylor V, et al. Translational evidence for two distinct patterns of neuroaxonal injury in sepsis: a longitudinal, prospective translational study[J]. Crit Care, 2017, 21(1): 262. DOI:10.1186/s13054-017-1850-7 |
| [145] | Orhun G, Esen F, Yilmaz V, et al. Elevated sTREM2 and NFL levels in patients with sepsis associated encephalopathy[J]. Int J Neurosci, 2023, 133(3): 327-333. DOI:10.1080/00207454.2021.1916489 |
| [146] | Yardan T, Cevik Y, Donderici O, et al. Elevated serum S100B protein and neuron-specific enolase levels in carbon monoxide poisoning[J]. Am J Emerg Med, 2009, 27(7): 838-842. DOI:10.1016/j.ajem.2008.04.016 |
| [147] | Zhang LT, Zhao J, Hao QQ, et al. Serum NSE and S100B protein levels for evaluating the impaired consciousness in patients with acute carbon monoxide poisoning[J]. Medicine (Baltimore), 2021, 100(25): e26458. DOI:10.1097/MD.0000000000026458 |
| [148] | Zhang Y, Gao N, Wang YB, et al. Association between serum neuron-specific enolase at admission and the risk of delayed neuropsychiatric sequelae in adults with carbon monoxide poisoning: a meta-analysis[J]. Biomol Biomed, 2024, 24(6): 1482-1490. DOI:10.17305/bb.2024.10757 |
| [149] | Park E, Ahn J, Min YG, et al. The usefulness of the serum s100b protein for predicting delayed neurological sequelae in acute carbon monoxide poisoning[J]. Clin Toxicol (Phila), 2012, 50(3): 183-188. DOI:10.3109/15563650.2012.658918 |
| [150] | Liang XZ, Feng SY. Serum neurofilament light chain for predicting delayed neurological sequelae after acute carbon monoxide poisoning[J]. Acta Neurol Belg, 2024, 124(1): 73-79. DOI:10.1007/s13760-023-02334-7 |
| [151] | Yardan T, Baydin A, Acar E, et al. The role of serum cholinesterase activity and S100B protein in the evaluation of organophosphate poisoning[J]. Hum Exp Toxicol, 2013, 32(10): 1081-1088. DOI:10.1177/0960327112474850 |
| [152] | 宋景春, 宋青, 张伟, 等. 中国热射病诊断与治疗指南(2025版)[J]. 解放军医学杂志, 2025, 50(4): 367-386. DOI:10.11855/j.issn.0577-7402.0506.2025.0328 |
| [153] | Yoneda K, Hosomi S, Ito H, et al. How can heatstroke damage the brain?A mini review[J]. Front Neurosci, 2024, 18: 1437216. DOI:10.3389/fnins.2024.1437216 |
| [154] | Chun JK, Choi S, Kim HH, et al. Predictors of poor prognosis in patients with heat stroke[J]. Clin Exp Emerg Med, 2019, 6(4): 345-350. DOI:10.15441/ceem.18.081 |
| [155] | 李冰, 贾晔然, 高伟, 等. 重症中暑脑损伤患者神经元特异度烯醇化酶及脑活性肽100B蛋白的表达及意义[J]. 解放军医学杂志, 2020, 45(12): 1282-1287. DOI:10.11855/j.issn.0577-7402.2020.12.12 |
 2025, Vol. 34
2025, Vol. 34