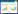2. 遵义医科大学附属医院肾脏内科,遵义 563000
2. Nephrology department, Affiliated Hospital of Zunyi Medical University, Zunyi 563000, China
在我国,致死性蘑菇中以α-鹅膏毒肽(α-amanitin,α-AMA)的鹅膏菌素类毒菇最为常见[1-2]。α-AMA中毒后,主要引起肝脏、肾脏和胃肠道等器官的功能损害,其中肝脏损害尤为显著[3]。然而,国内外针对α-AMA引起的急性肝损伤机制和治疗研究较少,目前缺乏统一的治疗建议和规范。α-AMA造成的食源性中毒发病率和病死率依然是一个亟需应对的公共卫生问题。
研究表明,α-AMA中毒可引起线粒体功能障碍,线粒体产生过量活性氧(reactive oxygen species,ROS),发生氧化应激,使线粒体形态和数量改变及腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)生成减少,最终损害包括线粒体在内的细胞成分[4-6]。线粒体融合及分裂蛋白的改变导致线粒体功能障碍,氧化应激加剧ROS增加,破坏线粒体结构与功能,最终引发细胞死亡和功能障碍,这在α-AMA中毒引起肝脏线粒体损害中起着重要作用[1, 7]。因此进一步探讨α-AMA中毒后肝脏细胞线粒体形态结构及功能变化对指导α-AMA中毒治疗具有重要指导意义。
N-乙酰半胱氨酸(N- acetylcysteine, NAC)是一种谷胱甘肽(glutathione, GSH)前体,在体内迅速代谢为GSH,并且可作为自由基清除剂,具有抗氧化作用,防止细胞生物膜脂质过氧化[8-9]。NAC作为一种肝细胞的抗氧化剂,已在临床中广泛应用。据《中国含鹅膏毒肽蘑菇中毒临床诊断治疗专家共识》指出,NAC是治疗α-AMA中毒药物之一,NAC给药能有效降低因含α-AMA的蘑菇中毒导致的病死率[10]。一项回顾性研究发现,与共识中其他药物单一治疗或联合治疗相比,予以NAC给药的病死率最低[11]。然而,其具体的作用机制及治疗仍有待深入研究。
1 材料与方法 1.1 实验动物实验小鼠购自斯贝福(北京)生物技术有限公司的雄性健康ICR小鼠,6~8周龄,体重(36~42)g,具有合法许可证编号:SCXK(京)2019-0010。在遵义医科大学附属医院临床医学公共实验中心饲养,环境恒温(23±2)℃,光照12 h,通风良好,定期更换饲料和水,实验前进行7 d适应性喂养。研究经过遵义医科大学动物实验伦理委员会批准,伦理审查编号:ZMU21-2301-047,合乎伦理标准。
1.2 主要仪器和试剂动物手术器械(中国Kinsey Ride金赛骑器械设)、透射电子显微镜(日本电子JEOL)、流式分析仪(美国Beckman公司)、生物显微镜(中国麦克奥迪实业集团有限公司)、酶标仪(美国Thermo Fisher Scientific公司)、倒置荧光显微镜(日本Olympus公司)、凝胶成像仪(美国Bio-Rad公司)。α-AMA、NAC药物(美国Med Chem Express公司),小鼠ALT、AST试剂盒(中国南京建成生物工程研究所),MDA、SOD、CAT试剂盒(美国Sigma公司),兔抗DRP1、OPA1、MFN1、MFN2及VDAC多克隆抗体(英国Abcam公司),HE染色试剂盒及ROS试剂盒(中国北京索莱宝生物有限公司)。
1.3 动物分组及模型构建课题组前期通过观察生成率确定小鼠α-AMA的造模剂量为0.35 mg/kg。研究通过腹腔注射0.35 mg/kg α-AMA构建中毒模型,观察并检测建模后24 h、48 h、72 h的小鼠行为学变化和肝脏病理及电镜改变,选择行为变化最明显和肝细胞损伤最严重的时间点作为取材时间。
将32只雄性健康ICR小鼠适应性喂养7 d后,随机(随机数字法)分为4组:健康对照组、NAC对照组、α-AMA中毒组和NAC单独给药组,每组8只。NAC对照组连续3 d腹腔注射NAC溶液[100 mg/(kg·d)];NAC单独给药组先注射0.35 mg/kg α-AMA,1 h后再注射100 mg/kg NAC,持续3 d。造模成功后,留取小鼠血液及肝脏组织标本检测相关指标变化。
1.4 检测指标及方法 1.4.1 观察小鼠5 d生存率建模后观察每组小鼠5 d生存率及行为学变化,并绘制生存曲线及计算生存率。
1.4.2 小鼠肝功能指标测定通过眼眶取血的方式收集小鼠血液,室温静置0.5 h后离心吸取上层血清,按照试剂盒说明书的指导,使用酶联免疫吸附法(ELISA)来检测ALT和AST的变化。
1.4.3 ELISA法检测肝脏组织MDA、SOD、CAT含量将组织搅碎离心收集上清液,使用小鼠酶联免疫分析试剂盒采用ELISA法检测肝脏组织中MDA、SOD、CAT含量变化,按照说明书指导进行操作。
1.4.4 观察小鼠肝脏组织病理变化取适当大小的肝脏组织块,固定于4%多聚甲醛溶液中24 h。随后进行梯度酒精脱水、二甲苯透明、浸蜡和包埋处理,制备3~5μm切片。对切片进行苏木精-伊红(hematoxylin-eosin,HE)染色,采集图像以观察和分析肝脏病理学改变。
1.4.5 观察小鼠肝脏细胞线粒体变化取材后,快速用戊二醛固定、漂洗并再固定,随后用不同浓度的酒精与丙酮进行脱水、渗透和包埋,制备60~90 nm超薄切片并染色。使用JEM-1400FLASH透射电镜观察肝脏线粒体结构变化,并随机选择5个视野,根据Flameng评分标准对线粒体损伤进行评分。具体评分标准见表 1。
制备肝脏单细胞悬液,按照膜电位试剂盒说明书操作,通过流式细胞仪检测细胞,并利用分析软件整理实验数据。
1.4.7 免疫荧光技术检测ROS将冷冻肝脏切片复温、固定、洗涤后,用Triton X-100处理增强抗体渗透性并封闭。加入MitoSOXTM形成抗原-抗体复合物,DAPI染色增强荧光信号。最后在荧光显微镜下观察ROS分布,并用图像分析软件定量数据。
1.4.8 WB方法检测小鼠肝脏中DRP1、OPA1、MFN1、MFN2蛋白表达提取肝细胞线粒体并进行蛋白定量和变性,后进行电泳和转膜。用5 g脱脂奶粉封闭,1:1 000稀释一抗过夜孵育,1:5 000稀释二抗孵育2 h。
1.5 统计学方法使用SPSS 29.0及GraphPad Prism 8.3统计软件对数据进行统计分析。对于所有的研究计量资料,以均数±标准差(x±s)表示。采用Kaplan-Meier法进行生存率分析。单因素方差分析用于比较多个组之间的差异,组间比较采用最小显著差异(least significant difference,LSD-t) 检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 α-AMA中毒造模时间选择 2.1.1 α-AMA中毒后各组小鼠行为学变化课题组前期通过通过观察低(0.18 mg/kg)、中(0.35 mg/kg)、高(0.53 mg/kg)剂量组α-AMA各组小鼠的5 d生存率确定最终剂量为0.35 mg/kg。α-AMA中毒后各组小鼠出现呼吸急促、反应差、嗜睡、活动减少等表现, 随着时间的推移上述症状越明显, 其中以72 h最为明显。
2.1.2 α-AMA中毒后各组小鼠病理改变正常肝组织被膜完整,小叶结构规则(图 1A)。中毒后24 h,肝细胞轻度水肿,基质少许空泡化(图 1B)。48 h,肝索紊乱,水肿加重,有炎细胞浸润和点状坏死(图 1C)。72 h,组织损伤最明显,肝细胞广泛变性肿胀,灶状坏死和基质空泡化(图 1D)。
|
| A:control组;B:0.35 mg/kg α-AMA染毒后24 h组;C:0.35 mg/kg α-AMA染毒后48 h组;D:0.35 mg/kg α-AMA染毒后72 h组 图 1 α-AMA中毒后不同时间小鼠肝脏病理变化(HE×200) Fig 1 Pathological changes of liver in mice at different times after α-AMA poisoning(HE×200) |
|
|
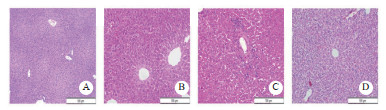
健康对照组肝细胞线粒体形态结构正常(图 2A)。中毒后,线粒体逐渐出现肿胀、嵴断裂、基质不均,随时间推移,肿胀加重,嵴和基质溶解,胞浆空泡化,数量减少(图 2B-D)。各组小鼠肝细胞线粒体损伤评分均较正常值加重,且中毒时间越长,损伤越明显(P < 0.05)。
|
| A:control组;B:0.35 mg/kg α-AMA染毒后24 h组;C:0.35 mg/kg α-AMA染毒后48 h组;D:0.35 mg/kg α-AMA染毒后72 h组;E:各组小鼠肝细胞线粒体Flameng评分。与正常组相比,aP<0.05 图 2 α-AMA中毒后不同时间小鼠肝细胞线粒体形态结构改变及线粒体损伤评分(6000×) Fig 2 Morphological changes and damage score of mouse hepatocytes at different times after α-AMA poisoning(6000×) |
|
|
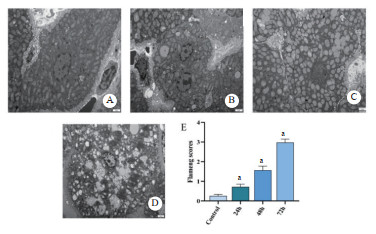
如图 3所示,α-AMA中毒小鼠呼吸急促、嗜睡、毛发干枯,5 d生存率40%。NAC给药后症状改善,5 d生存率升至70%。正常及NAC对照组小鼠状态良好,无死亡。
|
| 图 3 各组小鼠5 d生存率变化 Fig 3 Changes of 5-day survival rate of mice in each group |
|
|
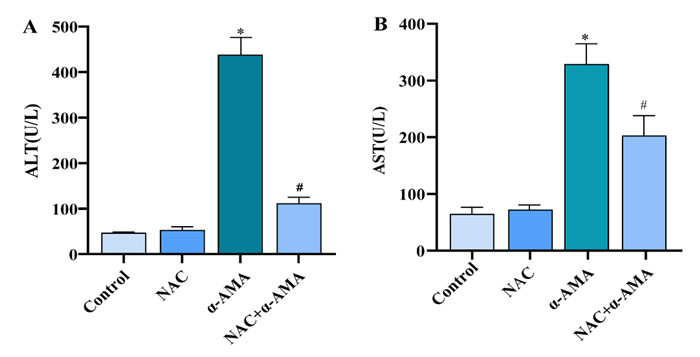
如图 4所示,与正常对照相比,α-AMA中毒小鼠血清ALT、AST显著增高(P < 0.05)。NAC给药后,ALT、AST降低(P < 0.05)。正常与NAC对照组间,ALT、AST差异无统计学意义(P > 0.05)。
|
| A:小鼠血清中ALT含量变化;B:小鼠血清中AST含量变化。与正常组相比,aP<0.05;与α-AMA中毒组相比,bP<0.05 图 4 各组小鼠肝功能指标变化 Fig 4 Changes of liver function indexes of mice in each group |
|
|
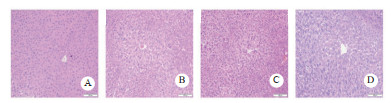
正常组与NAC对照组小鼠肝脏组织结构正常(图 5A、B)。α-AMA中毒组肝索排列紊乱、水肿,少量炎细胞浸润和基质空泡化(图 5C)。与α-AMA中毒组相比,NAC给药后肝细胞水肿改善,肝索排列紊乱及空泡化也有所改善(图 5D)。
|
| A:control组;B:NAC对照组;C:α-AMA中毒组;D:NAC单独给药组 图 5 各组小鼠肝脏病理变化(HE×200) Fig 5 Pathological changes of liver in mice in each group(HE×200) |
|
|
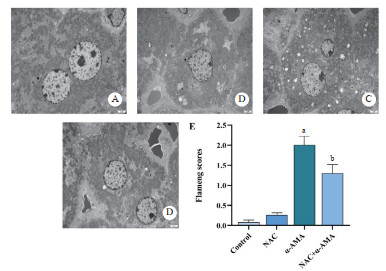
正常组与NAC对照组小鼠肝细胞线粒体形态及结构正常(图 6A、B)。α-AMA中毒组肝细胞水肿,基质溶解、嵴断裂,出现空泡化,损伤评分增加(图 6C、E,P < 0.05)。NAC给药后肝细胞水肿、基质溶解、嵴断裂均较中毒组改善,线粒体损伤评分降低(图 6D、E,P < 0.05)。
|
| A:control组;B:NAC对照组;C:α-AMA中毒组;D:NAC单独给药组;E:各组小鼠肝细胞线粒体Flameng评分。与正常组相比,aP<0.05;与α-AMA中毒组相比,bP<0.05 图 6 各组小鼠肝细胞线粒体形态结构改变及线粒体损伤评分(6000×) Fig 6 Morphological and structural changes and mitochondrial damage score of hepatocytes in mice in each group(6000×) |
|
|
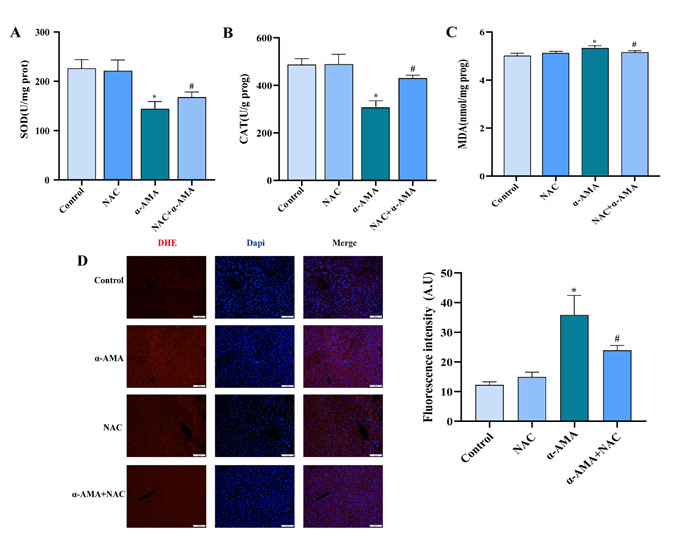
如图 7所示,α-AMA中毒导致SOD、CAT含量降低,MDA含量增加(P < 0.05)。NAC给药后SOD、CAT含量较α-AMA中毒组增加,MDA含量降低(图 7A-C,P < 0.05)。免疫荧光显示α-AMA中毒组ROS表达增强(P < 0.05)。NAC给药后ROS荧光强度较α-AMA中毒组减弱(图 7D,P < 0.05)。正常组与NAC对照组SOD、CAT、MDA、ROS含量均差异无统计学意义(P > 0.05)。
|
| A:各组小鼠肝脏组织SOD含量变化;B:各组小鼠肝脏组织CAT含量变化;C:各组小鼠肝脏组织MDA含量变化;D:免疫荧光观察各组小鼠肝脏组织ROS表达。与正常组相比,aP<0.05;与α-AMA中毒组相比,bP<0.05 图 7 各组小鼠肝脏组织SOD、CAT、MDA及ROS含量变化 Fig 7 Changes of SOD, CAT, MDA and ROS in liver tissue of mice in each group |
|
|
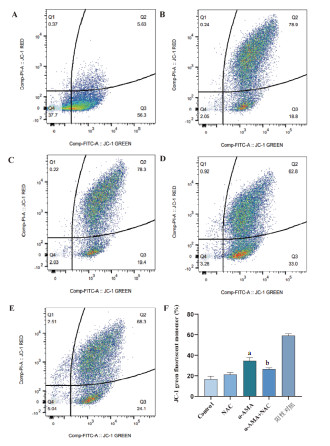
如图 8所示,经线粒体解偶联剂羰基氰化物3-氯苯腙(CCCP)处理过后的线粒体作为阳性对照组线粒体膜电位已基本丧失活性。与正常组与NAC对照组相比,α-AMA中毒组小鼠肝脏线粒体活性明显丧失(P < 0.05)。与α-AMA中毒组相比,NAC给药后线粒体活性明显改善(P < 0.05)。
|
| A:CCCP阳性对照组;B:Control组;C:NAC对照组;D:α-AMA中毒组;E:NAC单独给药组;F各组小鼠肝细胞线粒体JC-1绿色荧光单体占比。与正常组相比,aP<0.05;与α-AMA中毒组相比,bP<0.05 图 8 各组小鼠肝细胞线粒体膜电位变化 Fig 8 Changes of mitochondrial membrane potential in liver cells of mice in each group |
|
|
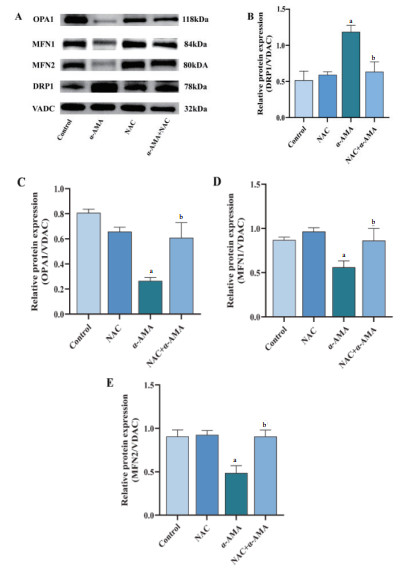
如图 9所示,α-AMA中毒组小鼠肝脏线粒体分裂蛋白DRP1表达增多,线粒体融合蛋白OPA1、MFN1、MFN2表达减少;与α-AMA中毒组相比,NAC给药后线粒体分裂蛋白DRP1表达减少,线粒体融合蛋白OPA1、MFN1、MFN2表达增多,差异均具有统计学意义(P < 0.05)。
|
| A:各组小鼠线粒体蛋白表达;B:各组小鼠肝脏线粒体DRP1蛋白含量变化;C:各组小鼠线粒体OPA1蛋白含量变化;D:各组小鼠线粒体MFN1蛋白含量变化;E:各组小鼠线粒体MFN2蛋白含量变化。与正常组相比,aP<0.05;与α-AMA中毒组相比,bP<0.05 图 9 各组小鼠肝脏组织线粒体动力学相关蛋白含量变化 Fig 9 Changes of mitochondrial dynamics-related proteins in liver tissue of mice in each group |
|
|
本研究通过建立α-AMA中毒小鼠模型,发现α-AMA中毒后产生过量的ROS,发生氧化应激,引起肝脏线粒体形态结构改变,线粒体出现不同程度肿胀,线粒体数量减少,基质空泡化,甚至出现嵴断裂等改变,导致急性肝功能损害。予以抗氧化剂NAC给药后,可以通过减少ROS的产生,减少氧化应激的发生,改善线粒体形态及结构变化,减少对线粒体的损伤,进而对α-AMA中毒至肝损伤起保护作用。
氧化应激源于细胞内ROS产生与清除失衡[13-14]。作为肝毒性主要驱动力,氧化应激和脂质过氧化导致肝细胞坏死[15]。α-AMA中毒破坏氧化还原平衡,线粒体ROS过量,损害呼吸链活性,加剧自由基形成,消耗谷胱甘肽。此过程导致线粒体蛋白和DNA氧化损伤,降低膜电位,影响ROS清除,最终引发线粒体功能障碍和细胞坏死[16-17]。最新研究显示,氧化应激及线粒体功能障碍在α-AMA中毒中起关键作用,与本实验结果相符,表明α-AMA中毒通过氧化应激机制导致线粒体损害和肝细胞坏死[18]。
线粒体作为细胞“能量源”,通过融合与裂变平衡保障功能,影响ATP生成及细胞存活[5, 19]。裂变蛋白Drp1在ROS过量时经历氧化磷酸化,迁移至线粒体表面诱导裂变;Mfn1/2和OPA1则分别促进外膜和内部融合,维护线粒体结构。肝损伤时,Drp1活性增强,导致线粒体数量减少、功能下降[20-21]。α-AMA中毒引发氧化应激,线粒体成为主要靶点,ROS过量导致肝脏线粒体功能障碍。抗氧化剂治疗能减少ROS,减轻氧化损伤,保护线粒体形态结构,维持动力学平衡。因此,抗氧化剂在改善α-AMA中毒线粒体损害中作用关键,成为减轻器官损伤的有效治疗策略。
NAC具有显著的自由基清除能力。其功能广泛,不仅能预防DNA损伤、调节细胞代谢活性和减少过量ROS,还能精确调控基因表达与信号转导,维持线粒体动力学的稳态[22]。NAC因抗氧化和抗凋亡特性而备受瞩目,尤其在肝细胞保护方面。其通过促进谷胱甘肽合成,增强抗炎抗氧化效果,减少线粒体ROS产生,维护肝脏健康[23]。研究显示,NAC能减轻Cu引起的氧化应激和线粒体自噬与裂变,改善线粒体融合[24]。在α-AMA中毒模型中,NAC有效清除自由基,减轻肝细胞损伤,改善线粒体功能。本研究发现,NAC可能通过清除氧自由基,减少DNA损伤、调节细胞代谢活性,使ROS的生成减少,从而减轻氧化应激,以维持线粒体动力学稳态。此外,NAC给药还可能通过直接抑制DRP1活性、增强MFN1、MFN2和OPA1的表达,维持线粒体动力学平衡,从而改善α-AMA中毒所引起的线粒体功能紊乱,并减轻肝损伤,最终发挥其对肝脏的保护作用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 程云、詹江珊:研究设计、论文撰写、论文修改、实验操作;吴瑾、陆元兰:数据整理、统计学分析;倪宇、胡杰:材料准备、论文指导
| [1] | Xu Y, Wang S, Leung CK, et al. α-amanitin induces autophagy through AMPK-mTOR-ULK1 signaling pathway in hepatocytes[J]. Toxicol Lett, 2023, 383(89): 97. DOI:10.1016/j.toxlet.2023.06.004 |
| [2] | 方英莲, 蒲艳, 钟加菊, 等. 21 155例急性中毒患者流行病学及预后影响因素分析[J]. 中华急诊医学杂志, 2025, 34(3): 376-381. DOI:10.3760/cma.j.issn.1671-0282.2025.03.014 |
| [3] | Xue JF, Lou XR, Ning DY, et al. Mechanism and treatment of α-amanitin poisoning[J]. Arch Toxicol, 2023, 97(1): 121-131. DOI:10.1007/s00204-022-03396-x |
| [4] | Wang M, Chen Y, Guo Z, et al. Changes in the mitochondrial proteome in human hepatocytes in response to alpha-amanitin hepatotoxicity[J]. Toxicon, 2018, 156: 34-40. DOI:10.1016/j.toxicon.2018.11.002 |
| [5] | Chen P, Yao LC, Yuan MQ, et al. Mitochondrial dysfunction: a promising therapeutic target for liver diseases[J]. Genes Dis, 2024, 11(3): 101115. DOI:10.1016/j.gendis.2023.101115 |
| [6] | Chen TH, Wang HC, Chang CJ, et al. Mitochondrial glutathione in cellular redox homeostasis and disease manifestation[J]. Int J Mol Sci, 2024, 25(2): 1314. DOI:10.3390/ijms25021314 |
| [7] | Wang KY, Liu ZH, Zhao MN, et al. κ-opioid receptor activation promotes mitochondrial fusion and enhances myocardial resistance to ischemia and reperfusion injury via STAT3-OPA1 pathway[J]. Eur J Pharmacol, 2020, 874: 172987. DOI:10.1016/j.ejphar.2020.172987 |
| [8] | He J, Ma YY, Niu XD, et al. Silver nanoparticles induce endothelial cytotoxicity through ROS-mediated mitochondria-lysosome damage and autophagy perturbation: The protective role of N-acetylcysteine[J]. Toxicology, 2024, 502: 153734. DOI:10.1016/j.tox.2024.153734 |
| [9] | Aparicio-Trejo OE, Reyes-Fermín LM, Briones-Herrera A, et al. Protective effects of N-acetyl-cysteine in mitochondria bioenergetics, oxidative stress, dynamics and S-glutathionylation alterations in acute kidney damage induced by folic acid[J]. Free Radic Biol Med, 2019, 130: 379-396. DOI:10.1016/j.freeradbiomed.2018.11.005 |
| [10] | 中华医学会急诊医学分会中毒学组, 中国医师协会急诊医师分会, 中国毒理学会中毒与救治专业委员会. 中国含鹅膏毒肽蘑菇中毒临床诊断治疗专家共识[J]. 中华危重症医学杂志(电子版), 2020, 13(1): 20-28. DOI:10.3877/cma.j.issn.1674-6880.2020.01.005 |
| [11] | Poucheret P, Fons F, Doré JC, et al. Amatoxin poisoning treatment decision-making: pharmaco-therapeutic clinical strategy assessment using multidimensional multivariate statistic analysis[J]. Toxicon, 2010, 55(7): 1338-1345. DOI:10.1016/j.toxicon.2010.02.005 |
| [12] | 陶小根: 川芎嗪改善脓毒症大鼠肝细胞线粒体功能障碍及其分子机制的研究[DJ]. 济南: 山东大学, 2017. |
| [13] | Sies H. Oxidative stress: from basic research to clinical application[J]. Am J Med, 1991, 91(3C): 31S-38S. DOI:10.1016/0002-9343(91)90281-2 |
| [14] | 杨登会, 吴瑾, 胡杰, 等. 辅酶Q10抑制IL-17/NF-κB蛋白表达对敌草快中毒大鼠肾损伤保护作用[J]. 中华急诊医学杂志, 2024, 33(9): 1249-1256. DOI:10.3760/cma.j.issn.1671-0282.2024.09.006 |
| [15] | 刘翼, 李昌平. 氧应激、脂质过氧化及肝细胞凋亡在非酒精性脂肪肝病中的作用[J]. 西南军医, 2008, 10(4): 3-6. DOI:10.3969/j.issn.1672-7193.2008.04.002 |
| [16] | Chen X, Shao B, Yu CM, et al. The cyclopeptide-amatoxin induced hepatic injury via the mitochondrial apoptotic pathway associated with oxidative stress[J]. Peptides, 2020, 129: 170314. DOI:10.1016/j.peptides.2020.170314 |
| [17] | Murphy MP. How mitochondria produce reactive oxygen species[J]. Biochem J, 2009, 417(1): 1-13. DOI:10.1042/bj20081386 |
| [18] | Zorov DB, Juhaszova M, Sollott SJ. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiol Rev, 2014, 94(3): 909-950. DOI:10.1152/physrev.00026.2013 |
| [19] | Rovira-Llopis S, Bañuls C, Diaz-Morales N, et al. Mitochondrial dynamics in type 2 diabetes: pathophysiological implications[J]. Redox Biol, 2017, 11: 637-645. DOI:10.1016/j.redox.2017.01.013 |
| [20] | Moore MP, Cunningham RP, Meers GM, et al. Compromised hepatic mitochondrial fatty acid oxidation and reduced markers of mitochondrial turnover in human NAFLD[J]. Hepatology, 2022, 76(5): 1452-1465. DOI:10.1002/hep.32324 |
| [21] | Li YJ, Cao YL, Feng JX, et al. Structural insights of human mitofusin-2 into mitochondrial fusion and CMT2A onset[J]. Nat Commun, 2019, 10(1): 4914. DOI:10.1038/s41467-019-12912-0 |
| [22] | Cheng CF, Li WX, Ye YQ, et al. Lactate induces C2C12 myoblasts differentiation by mediating ROS/p38 MAPK signalling pathway[J]. Tissue Cell, 2024, 87: 102324. DOI:10.1016/j.tice.2024.102324 |
| [23] | Sun J, Chen Y, Wang T, et al. Role of mitochondrial reactive oxygen species-mediated chaperone-mediated autophagy and lipophagy in baicalin and N-acetylcysteine mitigation of cadmium-induced lipid accumulation in liver[J]. Antioxidants (Basel), 2024, 13(1): 115. DOI:10.3390/antiox13010115 |
| [24] | Gao XL, Su Q, Pan H, et al. Arsenic-induced ferroptosis in chicken hepatocytes via the mitochondrial ROS pathway[J]. Biol Trace Elem Res, 2024, 202(9): 4180-4190. DOI:10.1007/s12011-023-03968-7 |
 2025, Vol. 34
2025, Vol. 34