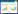脓毒症是由细菌等病原微生物感染引起的以机体早期的过度炎症反应和随后继发的免疫抑制为主要特征的一种免疫应答失调性疾病[1]。脓毒症的病情极其凶险,病死率高,如不及时治疗可迅速恶化,导致患者出现休克、多器官功能障碍、甚至死亡[2]。
嗜碱性粒细胞(basophil,Bas)虽然无吞噬细菌的活性,在人体外周静脉血液白细胞中的数量也较低(< 1%),但却是免疫系统的重要组成部分,在机体的抗感染应答中起重要作用[3]:Bas可释放抗菌物质如抗菌肽等发挥抗感染免疫应答,炎症介质诱导活化的Bas所形成的胞外陷阱具有抗大肠杆菌和金黄色葡萄球菌的功能,Bas还可增强机体对细菌感染的天然免疫应答进而预防脓毒症,耗竭Bas可降低机体的体液免疫应答并增加机体对肺炎链球菌诱导的脓毒症的易感性。
更重要的是,Bas活化后可通过释放一系列的细胞因子等调节机体的免疫应答,同时伴随胞膜表面分子表达水平的变化:活化的Bas脱颗粒后其胞膜表面CD63的表达水平上调[4]、FcεRIα的表达水平降低[5],并可释放大量IL-9[6-7]。值得注意的是,IL-9可通过增强人B细胞IL-4介导的IgE和IgG的产生,进而调节感染性疾病中的免疫应答[8-9]。此外,升高的脐血IL-9在早发脓毒症新生儿诊断中具有潜在价值[10],IL-9还可通过促进脓毒症大鼠肠黏膜屏障损伤进而诱导或加重机体的炎症反应,最终增加其病死率[10]。上述研究提示脱颗粒的Bas和IL-9可能在诱导和促进脓毒症的急性炎症反应中起重要作用。
笔者最近的研究发现人外周血单个核细胞群(peripheral blood mononuclear cell,PBMC)和粒细胞群中均有Bas[11],鉴于此,本研究检测了脓毒症患者PBMC和粒细胞群中Bas的比例及其脱颗粒水平。此外,本研究还探究了脓毒症患者血浆IL-9的水平及其与粒细胞群中脱颗粒的Bas比例的相关性。
1 材料与方法 1.1 材料人红细胞裂解液、BV510-小鼠抗人CCR3单克隆抗体及其同型抗体BV510耦合的小鼠IgG2b κ、BV421-小鼠抗人CD203c单克隆抗体及其同型抗体BV421耦合的小鼠IgG1 κ、PE/Cy7-小鼠抗人CD63单克隆抗体及其同型抗体PE/Cy7耦合的小鼠IgG1 κ、PerCP-小鼠抗人FcεRIα单克隆抗体及其同型抗体PerCP耦合的小鼠IgG2b κ、人Fc受体阻断剂、Zombie NIRTM活细胞染料购自美国Biolegend;人多因子检测试剂盒(含IL-1β、IL-9和IL-10)购自美国R & D Systems;青链霉素混合液、FBS和RPMI 1640培养液购自美国Gibco BRL;Trizol试剂购自美国Invitrogen;人Bas分选试剂盒Ⅱ和MACS洗涤缓冲液购自德国Miltenyi Biotec;Lymphoprep购自挪威AXIS-SHIELD PoC AS。
1.2 募集志愿者募集自2023年1月1日至2023年6月30日于河南省人民医院重症医学部就诊的脓毒症患者及体检中心的体检的健康人(无炎症、代谢和器质性疾病)。根据脓毒症和感染性休克第三次国际共识的定义(Sepsis-3)诊断脓毒症[2]。本研究获得了河南省人民医院医学伦理委员会的批准(2021伦审新技术1-158号),并募集了63例健康人和18例脓毒症患者(志愿者的一般信息见表 1),与每位志愿者签署知情同意书后纳入本研究。健康人于体检中心收集血液标本,患者转入重症医学病房后确诊脓毒症的30 min内收集其血液标本。每位志愿者采集2 mL外周静脉血于含K2EDTA抗凝剂的采血管中,离心后下层血细胞用含1%青链霉素混合液和3% FBS的RPMI 1640培养液重悬至原体积,上层血浆分装后冻存于-80℃备用。
| 人群 | 例数 | 性别(女/男) | 年龄(岁) | APACHE-Ⅱ评分 | 基础疾病 |
| 健康人 | 63 | 24/39 | 48(28~65) | 不适用 | 不适用 |
| 脓毒症患者 | 18 | 8/10 | 66(51~90) | 15.5(5~30) | 腹腔脏器手术 |
| 注:数据表示为中位值(极小值-极大值) | |||||
志愿者的血细胞中加入人Fc受体阻断剂和Zombie NIR活细胞染料孵育5 min,实验管加入BV510-CCR3、BV421-CD203c、PE/Cy7-CD63、PerCP-FcεRIα,同型对照管分别加入一种与实验管等量的下列抗体:BV510耦合的小鼠IgG2b κ、BV421耦合的小鼠IgG1 κ、PE/Cy7耦合的小鼠IgG1 κ、PerCP耦合的小鼠IgG2b κ,其他抗体同实验管,孵育10 min后裂解红细胞。洗涤后用BD FACSVerse流式细胞仪(美国)检测PBMC和粒细胞群中CCR3+CD203c+Bas[11]表达CD63和FcεRIα的比例及单个Bas表达CD63和FcεRIα的强度(mean fluorescence intensity,MFI)。
1.4 转录组测序分析志愿者PBMC中Bas的差异表达基因密度梯度离心法富集志愿者PBMC,免疫磁珠阴性选择法分选PBMC中的Bas,将分选的Bas重悬于Trizol试剂中,进行转录组测序(北京诺禾致源有限公司)和分析(R包1.12.0)。
1.5 人多因子检测试剂盒检测人血浆IL-1β、IL-9和IL-10的水平根据人多因子检测试剂盒的说明书用Flex MAP 3D多重分析检测仪(美国)检测志愿者血浆IL-1β、IL-9和IL-10的水平。
1.6 统计学方法GraphPad Prism 9.0处理统计数据:散点图展示相关数据的中位数、四分位数、最大值和最小值,Kruskal-Wallis检验分析各组间数据整体是否存在差异,如果组间差异有统计学意义,用Mann-Whitney U检验进一步比较;Pearson相关分析细胞因子水平与细胞比例之间的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 脓毒症患者PBMC中Bas和FcεRIα+ Bas的比例和数量减少与健康人相比,脓毒症患者PBMC中Bas的比例和数量分别减少了94.8%(Z=-6.441,P < 0.01;图 1A、B)和85.7%(Z=-5.725,P < 0.01;图 1C)。分别有97.8%和96.9%的健康人和脓毒症患者的Bas表达CD63,且其表达比例在健康人和脓毒症患者间差异无统计学意义(Z=-0.727,P=0.472;图 1D、E),而脓毒症患者PBMC中CD63+ Bas的数量减少了85.7%(Z=-5.737,P < 0.0001;图 1F)。此外,脓毒症患者PBMC中FcεRIα+Bas的比例和数量较健康人分别减少了6.58%(Z=-2.164,P=0.0298;图 1G、H)和86.6%(Z=-5.805,P < 0.0001;图 1I)。
|
| 注:人PBMC中Bas的流式细胞术设门方法(A)及其在白细胞中百分比(B)和数量(C)的统计图;PBMC中Bas表达CD63(D、E、F)和FcεRIα(G、H、I)比例和数量的流式细胞仪代表图和统计图 图 1 脓毒症患者PBMC中Bas及CD63+和FcεRIα+Bas的比例和数量 Fig 1 Percentages and counts of Bas, CD63+ and FcεRIα+Bas in PBMC of sepsis patients |
|
|
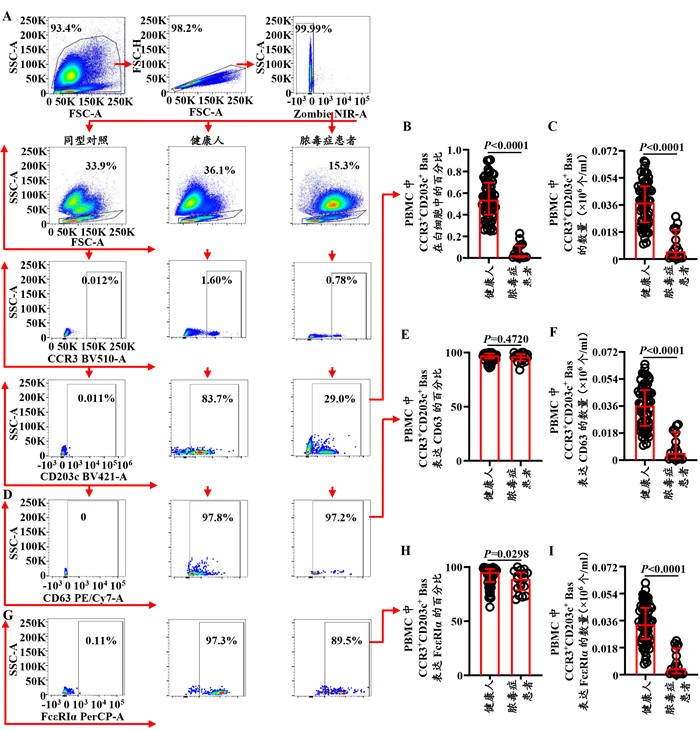
就PBMC中单个Bas CD63和FcεRIα表达的MFI而言,脓毒症患者CD63的MFI的表达水平较健康人增加了14.8%(Z=-5.351,P < 0.01;图 2A、C),而FcεRIα MFI表达水平虽然较健康人降低了22.3%,但差异无统计学意义(Z=-1.636,P=0.1030;图 2B、D)。
|
| 注:人PBMC中Bas表达CD63(A、C)和FcεRIα(B、D)MFI水平的流式细胞仪代表图和统计图 图 2 脓毒症患者PBMC中Bas表达CD63和FcεRIα MFI的水平 Fig 2 The MFI levels of CD63 and FcεRIα expression on Bas in PBMC of patients with sepsis |
|
|
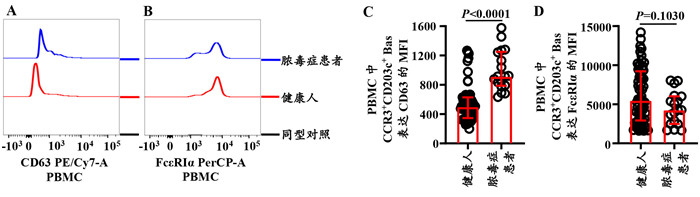
火山图结果显示脓毒症患者和健康人PBMC中的Bas共检测到34 338个基因,其中有6 418个基因(3 661个下调基因和2 757个上调基因)的表达水平在脓毒症患者PBMC中的Bas发生了显著变化(图 3A)。更重要的是,脓毒症患者Bas表达CD63 mRNA水平显著上调,表达FcεRIα mRNA水平显著下调(图 3B)。
|
| 注:脓毒症患者和健康人PBMC中Bas差异表达基因的火山图(A);B:脓毒症患者PBMC中Bas CD63和FCER1A mRNA的表达水平;脓毒症患PBMCBas差异表达上调(C、E)和下调(D、F)基因的GO功能和KEGG信号通路富集分析图 图 3 转录组学分析脓毒症患者PBMC中的Bas Fig 3 RNA-seq analysis of Bas in PBMC of patients with sepsis |
|
|
GO注释分别对脓毒症患者PBMC中Bas所有表达上调和下调的基因分析其10个富集最显著的分子功能、细胞成分和生物学过程。基于脓毒症患者Bas表达上调的基因富集结果显示(图 3C),分子功能异常包括解旋酶活性(如DNA解旋酶活性、ATP依赖性解旋酶活性)和ATP酶活性(如单链DNA依赖性ATP酶活性、DNA依赖性ATP酶活性);此外,脓毒症患者Bas的细胞成分(如特异性颗粒、溶酶体、嗜碱性颗粒和管腔)也发生了显著变化;在富集的生物学过程中,脓毒症感染可诱导Bas内磷酸代谢异常,并显著影响DNA复制。基于脓毒症患者Bas表达下调的基因富集结果显示(图 3D),分子功能异常包括胞外基质结构成分、抗原结合、细胞因子、趋化因子和免疫球蛋白受体结合;此外,脓毒症患者Bas的细胞成分胞膜、胞外基质、免疫球蛋白复合物等也发生了显著变化;在富集的生物学过程中,脓毒症感染可诱导免疫应答活化。
KEGG富集分析脓毒症患者PBMC中Bas所有表达上调基因前20个最显著富集通路(图 3E)主要涉及溶酶体、氧化磷酸化和p53信号通路。此外,DNA复制、细胞周期和营养物质代谢(如碳、脂肪酸、果糖和甘露糖)也显著富集。脓毒症患者PBMC中Bas所有表达下调基因前20个最显著富集通路(图 3F)主要涉及NFκB、NOD样受体和FcεRI。此外,造血细胞系、细胞因子和细胞因子受体、Th1和Th2细胞分化和B细胞受体信号通路也显著富集。
2.4 脓毒症患者血液粒细胞群中Bas的比例减少而数量增加,CD63+Bas的比例和数量增加与健康人相比,脓毒症患者血液粒细胞群中Bas的比例减少了37.9%(Z=-2.681,P=0.0066;图 4A、B),但其数量增加了69.7%(Z=-4.215,P < 0.01;图 4C),而CD63+Bas的比例和数量分别增加了5.0%(Z=-2.034,P=0.0416;图 4D、E)和97.7%(Z=-4.192,P < 0.01;图 4F)。另外,分别有88.9%和90.9%的健康人和脓毒症患者粒细胞群的Bas表达FcεRIα,且其表达比例在健康人和脓毒症患者间差异无统计学意义(Z=-1.795,P=0.0729;图 4G、H),但脓毒症患者粒细胞群中FcεRIα+ Bas的数量增加了94.4%(Z=-4.317,P < 0.01;图 4C)。
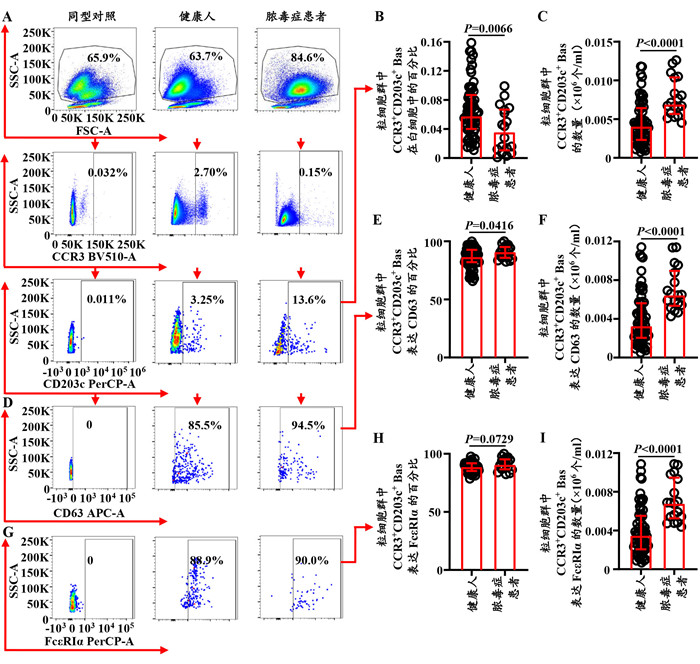
|
| 注:人粒细胞群中Bas的流式细胞术设门方法(A)及其在白细胞中百分比(B)和数量(C)的统计图;粒细胞群中Bas表达CD63(D、E、F)和FcεRIα(G、H、I)比例和数量的流式细胞仪代表图和统计图 图 4 脓毒症患者粒细胞群中Bas及CD63+和FcεRIα+Bas的比例和数量 Fig 4 Percentages and counts of Bas, CD63+ and FcεRIα+Bas in granulocytes of sepsis patients |
|
|
就粒细胞群中单个Bas表达CD63和FcεRIα MFI的水平而言,脓毒症患者CD63的MFI的表达水平较健康人增加了67.4%(Z=-3.294,P=0.0007;图 5A、C),而健康人和脓毒症患者FcεRIα MFI表达水平差异无统计学意义(Z=-0.523,P=0.6062;图 5B、D)。
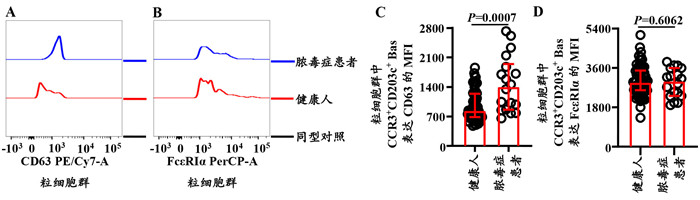
|
| 注:人粒细胞群中Bas表达CD63(A、C)和FcεRIα(B、D)MFI水平的流式细胞仪代表图和统计图 图 5 脓毒症患者粒细胞群中Bas表达CD63和FcεRIα MFI的水平 Fig 5 The MFI levels of CD63 and FcεRIα expression on Bas in granulocytes of patients with sepsis |
|
|
与健康人相比,脓毒症患者血浆IL-1β、IL-10和IL-9的水平分别增加了80.6%(Z= -4.258,P < 0.0001;图 6A)、11.9倍(Z=-4.814,P=0.0001;图 6B)和36.7%(Z=-3.606,P=0.0001;图 6C)。此外,脓毒症患者血浆IL-9的水平与粒细胞群中CD63+Bas的比例(R=0.785,P=0.001;图 6D)和数量(R=0.833,P < 0.001;图 6E)均高度正相关。
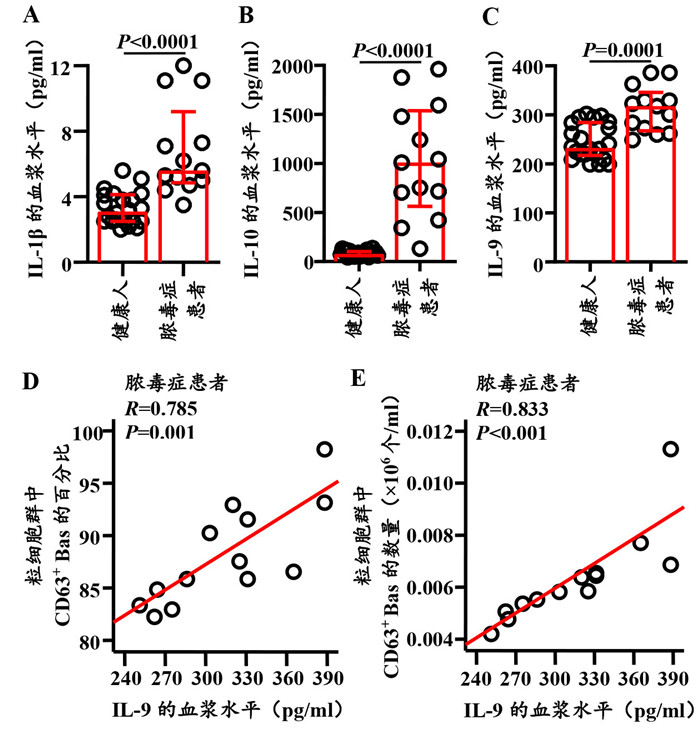
|
| 注:脓毒症患者血浆IL-1β(A)、IL-10(B)和IL-9(C)水平的统计图及其与粒细胞群中CD63+Bas比例(D)和数量(E)的相关性 图 6 脓毒症患者血浆IL-9的水平与粒细胞群中CD63+Bas比例和数量的相关性 Fig 6 Correlations of plasma IL-9 level with the proportion and count of CD63+Bas in granulocyte population of patients with sepsis |
|
|
脓毒症是由感染引起的危及生命的器官功能障碍综合征,病死率高达70%[12],是重症医学病房内非心脏病患者死亡的主要原因,同时给社会带来了沉重的经济和医疗负担[13]。源于骨髓造血干细胞的Bas在外周血液中分化发育为有生物学功能的成熟的Bas,并在机体的抗感染免疫应答和炎症反应中起重要作用[3]:脓毒症致死患者和迟发型脓毒症早产患儿出生后第一个月内Bas的数量减少,骨骼肌细胞MyD88敲除和IL-6敲减的脓毒症小鼠腹腔Bas的比例也减少。本研究中脓毒症患者PBMC中Bas比例和数量减少;鉴于PBMC中的Bas比粒细胞群中的多形核细胞(含Bas)年轻、并具有很强的迁移能力[14],上述发现不仅证实了之前的研究,同时提示血液PBMC中的Bas可能被募集至原发病灶发挥抗感染作用或诱导炎症反应[15]。另一方面,本研究粒细胞群中Bas的数量增加,但其增加的数量少于PBMC中Bas减少的数量,因此脓毒症患者血液总Bas数量减少。鉴于Bas的抗感染作用[3],Bas总数量减少可能会降低脓毒症患者的抗感染能力,增加继发感染的风险,但需要进一步临床研究。
表达升高的CD63及降低的FcεRIα是实验室和临床评价Bas脱颗粒的金标准[4-5]。本研究中脓毒症患者PBMC和粒细胞群中Bas的CD63 MFI的表达增强,PBMC FcεRIα表达的比例和MFI减少的发现均提示脓毒症患者血液Bas脱颗粒增加。Bas稳定剂预处理小鼠可抑制脓毒症小鼠的炎症反应进而显著降低脓毒症小鼠病死率的报道[16]似乎支持本实验结果,也进一步提示脓毒症患者体内的Bas过度脱颗粒。值得注意的是,Bas脱颗粒时释放的组胺、白三烯等炎症介质可以加重血管渗漏和微循环障碍[17],可能参与了脓毒症患者发生多器官功能障碍[18],但其临床作用仍需进一步验证。此外,本研究基于转录组的结果发现脓毒症PBMC中Bas的3661个下调基因和2 757个上调基因含有FcεRIα和CD63,且其mRNA的表达水平进一步证实了本研究中基于脓毒症PBMC Bas FcεRIα和CD63蛋白表达水平的结果。
此外,本研究中GO富集显示脓毒症患者PBMC Bas分子功能异常包括解旋酶活性、ATP酶活性、胞外基质结构成分、抗原结合、细胞因子、趋化因子和免疫球蛋白受体结合提示脓毒症患者血液Bas功能显著变化;细胞成分如特异性颗粒、溶酶体、嗜碱性颗粒和管腔也发生了显著变化;胞膜、胞外基质、免疫球蛋白复合物等提示感染诱导脓毒症患者血液Bas的胞膜内外和胞膜成分的显著变化;生物学过程主要包括脓毒症感染可诱导Bas内磷酸代谢和DNA复制异常、免疫应答活化提示脓毒症患者Bas的过度活化。Bas可增强小鼠对细菌感染的固有免疫应答并通过Bas分泌的肿瘤坏死因子预防脓毒症[19]、耗竭Bas可降低机体的体液免疫应答并增加其对肺炎链球菌诱导的脓毒症易感性的报道[20]可能支持了本实验结果。
既往研究发现NOD样受体、NFκB、FcεRI和p53参与Bas及其细胞系KU812的活化[21-24],可能支持了本研究中脓毒症患者PBMC中Bas KEGG富集涉及p53、NFκB、NOD样受体信号通路和FcεRI的发现。此外,鉴于CD63是一种溶酶体相关膜蛋白,Bas活化通常伴有氧化磷酸化的改变[23],感染诱导的脓毒症可以影响宿主细胞DNA复制、细胞周期、营养物质代谢、造血细胞系,Bas在T和B细胞分化发育中起重要作用,本研究中脓毒症患者PBMC中Bas溶酶体、氧化磷酸化、DNA复制、细胞周期和营养物质代谢、造血细胞系、细胞因子和细胞因子受体、Th1和Th2细胞分化和B细胞受体信号通路也显著富集的结果可能进一步支持了上述报道。
IL-1β作为经典的促炎细胞因子可通过激活NF-κB通路促进TNF-α、IL-6等炎症因子释放,诱导中性粒细胞浸润、促进组织损伤和激活凝血系统等途径促进脓毒症的病理进程。IL-10可通过下调促炎因子的表达,促进Treg细胞分化,抑制Th17过度活化和促进血管内皮修复等途径抑制脓毒症患者体内过度的炎症应答。本研究中脓毒症患者血浆IL-1β和IL-10的水平升高,进一步证实了脓毒症的核心病理机制:过度炎症应答与免疫抑制的动态失衡[1]。
IL-9是一种经典的Th2型细胞因子,IL-9的来源广泛,人体内的多种血液细胞如Bas[6-7]、Th9细胞、Th17细胞、嗜酸性粒细胞和ILC2等均可分泌。IL-9不仅可以诱导并加重肿瘤和过敏性疾病的炎症反应,还可以通过促进B细胞的增殖和分化,诱导抗体的产生进而发挥抗感染作用[8-9]。本研究中脓毒症患者血浆IL-9的水平升高,而早发脓毒症新生儿的脐血IL-9水平升高的报道[10]可能支持本研究的发现,并证实了脓毒症时体内过度的炎症应答。
值得注意的是,本研究中脓毒症患者血液粒细胞群中Bas的数量、比例和脱颗粒的Bas的数量增加,更重要的是,脓毒症患者升高的血浆IL-9的水平与粒细胞群中CD63+Bas的比例和数量均呈正相关。鉴于Bas脱颗粒后其胞膜表面CD63表达水平上调[4],并可通过分泌大量IL-9加重炎症反应[6],上述结果进一步提示升高的血浆IL-9水平可能部分来源于粒细胞群中脱颗粒的Bas。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙玉寒、任胜勇:实验操作、论文撰写;湛萌萌、董鑫:数据收集及整理、统计学分析;刘仕豪、赵悰怡:数据收集、论文修改;王君灵、秦秉玉:研究设计、论文修改、工作支持
| [1] | Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021[J]. Crit Care Med, 2021, 49(11): e1063-e1143. DOI:10.1097/CCM.0000000000005337 |
| [2] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [3] | 王君灵, 董鑫, 湛萌萌, 等. 白细胞介素-18和白细胞介素-37b与嗜碱粒细胞在脓毒症中的作用研究进展[J]. 中华危重病急救医学杂志, 2025, 37(1): 77-80. DOI:10.3760/cma.j.cn121430-20230320-00196 |
| [4] | Ebo DG, Bridts CH, Mertens CH, et al. Principles, potential, and limitations of ex vivo basophil activation by flow cytometry in allergology: a narrative review[J]. J Allergy Clin Immunol, 2021, 147(4): 1143-1153. DOI:10.1016/j.jaci.2020.10.027 |
| [5] | Sainte-Laudy J, Boumediene A, Touraine F, et al. Use of both CD63 up regulation and IgE down regulation for the flow cytometric analysis of allergen induced basophil activation. Definition of an activation index[J]. Inflamm Res, 2007, 56(7): 291-296. DOI:10.1007/s00011-007-7014-5 |
| [6] | Blom L, Poulsen BC, Jensen BM, et al. IL-33 induces IL-9 production in human CD4+ T cells and basophils[J]. PLoS One, 2011, 6(7): e21695. DOI:10.1371/journal.pone.0021695 |
| [7] | Abdul Qayum A, Koh B, Martin RK, et al. The Il9 CNS-25 regulatory element controls mast cell and basophil IL-9 production[J]. J Immunol, 2019, 203(5): 1111-1121. DOI:10.4049/jimmunol.1900272 |
| [8] | Petit-Frere C, Dugas B, Braquet P, et al. Interleukin-9 potentiates the interleukin-4-induced IgE and IgG1 release from murine B lymphocytes[J]. Immunology, 1993, 79(1): 146-151. |
| [9] | Dugas B, Renauld JC, Pène J, et al. Interleukin-9 potentiates the interleukin-4-induced immunoglobulin (IgG, IgM and IgE) production by normal human B lymphocytes[J]. Eur J Immunol, 1993, 23(7): 1687-1692. DOI:10.1002/eji.1830230743 |
| [10] | Sun JK, Zhou J, Sun XP, et al. Interleukin-9 promotes intestinal barrier injury of sepsis: a translational research[J]. J Intensive Care, 2021, 9(1): 37. DOI:10.1186/s40560-021-00550-y |
| [11] | Wang JL, Zhan MM, Gu FQ, et al. Diagnostic use of CCR3, CD63, CD203c and FcεRIα on blood leukocytes of allergic asthma and combined allergic rhinitis and asthma syndrome[J]. J Cell Mol Med, 2025, 29(12): e70594. DOI:10.1111/jcmm.70594 |
| [12] | Prescott HC, Angus DC. Enhancing recovery from sepsis: a review[J]. JAMA, 2018, 319(1): 62-75. DOI:10.1001/jama.2017.17687 |
| [13] | 俞隼许, 叶宏伟, 温顺, 等. 脓毒症相关性心肌损伤的临床特点及微生物分布情况[J]. 中华急诊医学杂志, 2025, 34(2): 173-179. DOI:10.3760/cma.j.issn.1671-0282.2025.02.007 |
| [14] | Siracusa MC, Perrigoue JG, Comeau MR, et al. New paradigms in basophil development, regulation and function[J]. Immunol Cell Biol, 2010, 88(3): 275-284. DOI:10.1038/icb.2010.1 |
| [15] | Mukai K, Obata K, Tsujimura Y, et al. New insights into the roles for basophils in acute and chronic allergy[J]. Allergol Int, 2009, 58(1): 11-19. DOI:10.2332/allergolint.08-RAI-0059 |
| [16] | Hollmann TJ, Mueller-Ortiz SL, Braun MC, et al. Disruption of the C5a receptor gene increases resistance to acute Gram-negative bacteremia and endotoxic shock: opposing roles of C3a and C5a[J]. Mol Immunol, 2008, 45(7): 1907-1915. DOI:10.1016/j.molimm.2007.10.037 |
| [17] | Nguyen SMT, Rupprecht CP, Haque A, et al. Mechanisms governing anaphylaxis: inflammatory cells, mediators, endothelial gap junctions and beyond[J]. Int J Mol Sci, 2021, 22(15): 7785. DOI:10.3390/ijms22157785 |
| [18] | Poto R, Marone G, Galli SJ, et al. Mast cells: a novel therapeutic avenue for cardiovascular diseases?[J]. Cardiovasc Res, 2024, 120(7): 681-698. DOI:10.1093/cvr/cvae066 |
| [19] | Piliponsky AM, Shubin NJ, Lahiri AK, et al. Basophil-derived tumor necrosis factor can enhance survival in a sepsis model in mice[J]. Nat Immunol, 2019, 20(2): 129-140. DOI:10.1038/s41590-018-0288-7 |
| [20] | Denzel A, Maus UA, Rodriguez Gomez M, et al. Basophils enhance immunological memory responses[J]. Nat Immunol, 2008, 9(7): 733-742. DOI:10.1038/ni.1621 |
| [21] | Yamashita M, Ichikawa A, Katakura Y, et al. Induction of basophilic and eosinophilic differentiation in the human leukemic cell line KU812[J]. Cytotechnology, 2001, 36(1/2/3): 179-186. DOI:10.1023/A:1014001322272 |
| [22] | Jiao DL, Wong CK, Qiu HN, et al. NOD2 and TLR2 ligands trigger the activation of basophils and eosinophils by interacting with dermal fibroblasts in atopic dermatitis-like skin inflammation[J]. Cell Mol Immunol, 2016, 13(4): 535-550. DOI:10.1038/cmi.2015.77 |
| [23] | Chhiba KD, Hsu CL, Berdnikovs S, et al. Transcriptional heterogeneity of mast cells and basophils upon activation[J]. J Immunol, 2017, 198(12): 4868-4878. DOI:10.4049/jimmunol.1601825 |
| [24] | Wong CK, Chu IM, Hon KL, et al. Aberrant expression of bacterial pattern recognition receptor NOD2 of basophils and microbicidal peptides in atopic dermatitis[J]. Molecules, 2016, 21(4): 471. DOI:10.3390/molecules21040471 |
 2025, Vol. 34
2025, Vol. 34