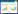血液吸附(hemoadsorption,HA)是利用特定孔径的膜或其他吸附材料与血液或血浆中的中大分子物质(如多肽或蛋白质)结合[1-2],从而清除血液或血浆中的致病物质,以达到有效治疗临床疾病的目的[3]。作为血液净化技术的一种,HA自1964年希腊学者Yatzidis首次将全血吸附(即血液灌流技术)应用于临床以来,已历经60余年的发展。期间,吸附剂材料的选择性、生物相容性及吸附性能,以及吸附技术均取得了显著的进步。吸附膜材料从最初的单一活性炭发展到如今的树脂、多糖、阳离子功能基团、免疫吸附剂及细胞因子吸附柱等多种类型[4]。吸附技术也由最初的HP扩展至细胞吸附、血浆吸附等多个领域,并衍生出连续性血浆滤过吸附(continuity of plasma filtration adsorption,CPFA)、分子吸附再循环系统(molecular adsorption recirculation system,MARES)等先进技术[5]。材料与技术的进步,也推动了高效吸附剂在急危重症救治领域的迅猛发展。目前,HA已广泛应用于急性药物及毒物中毒、横纹肌溶解、急慢性肝功能衰竭,以及某些肾脏疾病(如透析中未能有效清除的毒素)和脓毒症等急危重症的救治中[6](图 1)。然而HA治疗过程中仍有诸如模式、时机选择等众多问题,给临床治疗选择造成困扰。本共识(注册号:PREPARE-2025CN1479)将结合国内外HA治疗相关的循证资料、指南及共识,针对其在急危重症治疗中的临床问题进行深入探讨,给出谨慎科学的推荐,旨在为临床医师提供切实可行的指导意见及建议。
|
| 注: HA血液吸附;AKI急性肾损伤;ECMO体外膜肺氧合 图 1 急危重症患者HA治疗流程图 |
|
|
专家组系统梳理了HA在急诊领域的关键临床问题,涵盖技术应用范围、时机选择、疗效评估等核心争议点,确保共识内容紧密聚焦于临床实践需求。
1.2 证据整合与评估中文数据库(包括中国生物医学文献数据库、万方数据和中国知网);英文数据库(包括PubMed、Medline、Ovid、the Cochrane Library、Wiley Online Library、Springer Link、Elsevier Science Direct、Embase和Cochrane Library),主要纳入系统评价、Meta分析、网状Meta分析、随机对照试验(randomized controlled trial, RCT)、队列研究、病例对照研究等。检索时间截至2025年4月30日。
1.3 证据等级和推荐意见本共识由来自全国急诊医学、重症医学、中毒与职业病、化学损伤救治等相关领域的专家组成的多学科团队共同讨论制定。经过4轮深入讨论,各方最终达成共识,并于9月完成定稿。专家成员对推荐意见逐一进行表决,在最终轮投票时达成一致。推荐强度和循证证据等级见表 1~2,参考推荐意见分级的评估、制定及评价(grading of recommendations, assessment, development and evaluation, GRADE)。
| 证据等级 | 等级释义 |
| Ⅰ级 | 基于多个随机对照试验的荟萃分析或系统评价;大宗随机试验 |
| Ⅱ级 | 基于至少1个质量较高的随机对照试验;设计规范、结果明确的观察性研究或横断面研究;前瞻性队列研究 |
| Ⅲ级 | 基于设计良好的非随机性病例对照研究;观察性研究;非前瞻性队列研究 |
| Ⅳ级 | 基于非随机性回顾性研究;病例报告;专家共识 |
| 推荐强度等级 | 等级释义 | 临床建议 |
| A级 | 强 | 循证证据肯定或良好(Ⅰ~Ⅱ级);循证证据一般(Ⅲ~Ⅳ级),但在国内外指南中明确推荐。能够改善健康结局,利大于弊 |
| B级 | 中等 | 循证证据一般(Ⅲ~Ⅳ级);可以改善健康结局 |
| C级 | 弱 | 循证证据不足或矛盾;无法明确利弊,但可能改善健康结局 |
基于当前临床实践与循证依据,本共识重点聚焦于急性中毒、横纹肌溶解综合征、脓毒症及心脏骤停后综合征这四大核心场景,分别就其应用指征、治疗时机与疗效评估展开详细阐述。
2.1 HA在急性中毒中的应用急性中毒是指人体在短时间内接触毒物或超过中毒剂量的药物后,机体所产生的一系列病理生理变化及其临床表现。急性中毒病情复杂多变,进展迅速,严重者出现多器官功能障碍综合征,甚至危及生命。在中毒治疗过程中,由于大部分毒物缺乏特效解毒剂,以及血液中毒物浓度较高达致死剂量,血液净化技术已被广泛应用于清除毒素和提供生命支持,并取得了良好的效果。
2.1.1 中毒治疗中HA清除药物及毒物的适用范围HA是目前抢救急性重度中毒的重要血液净化模式,对有机磷农药、有机氯杀虫剂、灭鼠药、除草剂等具有较高的清除率;对毒蕈、乌头碱、蜂毒、蛇毒等植物和生物毒素同样表现出较高的清除效果;某些工业毒物和成瘾药物的治疗也可考虑采用HA。
近年来,HA在中毒治疗领域的应用范围不断拓展,已不再局限于现有的临床实践经验。Li等[7]的研究发现,HA治疗能够缩短急性有机磷农药中毒患者乙酰胆碱酯酶活性的恢复时间,降低中间综合征的发生率及病死率。虫螨腈相对分子质量较小,脂溶性较高,HA可有效清除虫螨腈中毒患者体内毒素,减少组织对毒物的摄取和蓄积,是治疗虫螨腈中毒的有效手段,应在入院后尽早开展[8]。夏天皓和林艺花[9]的研究表明,大剂量氯氮平中毒患者接受HA治疗,能够有效清除毒物,促进患者尽快恢复清醒。段昱等[10]采用HA联合盐酸纳洛酮治疗急性重症镇静药物中毒患者,结果显示,与单一使用盐酸纳洛酮治疗相比,HA联合盐酸纳洛酮治疗提高了患者临床总有效率,缩短了意识清醒时间、中毒症状消失时间和住院时间,且血气结果得到明显改善。HA能够稳定且高效地清除血液中的铊,对重度铊中毒患者应尽早行HA治疗。即使在中毒48 h后,HA仍能取得较好的疗效。田甜等[11]通过原子吸收法检测血铊含量,结果发现,HA后血铊含量明显下降,进行4次HA治疗后,可吸附超过90%的铊。抗凝血类鼠药中毒引起的凝血功能异常,其预后与患者年龄、中毒剂量及治疗方法选择有关,特别是针对高龄、高剂量鼠药中毒患者,HA联合维生素K1治疗不仅能降低急性抗凝血类鼠药中毒患者凝血功能异常的发生率,还能有效缩短凝血功能异常的持续时间[12]。
推荐意见1:HA适用于清除具有高血浆蛋白结合率、高脂溶性或中大分子量特性的毒物。(证据等级:Ⅳ级,推荐强度:A级)
2.1.2 急性中毒治疗中HA的启动时机及治疗频次HA在毒物达到血液中浓度峰值时效果最佳,但由于毒物暴露方式和剂量的差异,峰值难以准确预测。在接触药物或毒物后的4~6 h内,HA效果最为显著,此时大多数药物或毒物在血液中的浓度较高,且毒物扩散到周围组织的可能性较小;而在12 h后进行吸附,毒物清除效果则会下降。对于百草枯等重度中毒,建议尽快进行HA治疗,2~4 h内开展治疗者效果更佳。
部分毒物具有高度亲脂性,能在脂肪组织中蓄积。尽管血液中的毒物浓度降低,但外周脂肪组织仍可能再次释放毒物入血;或者因洗胃不彻底,消化道继续吸收毒物,常在洗胃或HA后,血液中毒物浓度再次升高,导致病情加重,一般建议在首次治疗后6~12 h进行评估。对于半衰期长、分布容积大、血浆蛋白结合率高(>80%)的毒物,可在首次治疗后6 h再次启动HA,以减少毒物对机体的持续损害。
Bo等[13]比较了不同频次HA治疗有机磷农药中毒的效果,结果显示,相较于单次HA治疗,早期多次(48 h内3~4次)HA治疗能够减少阿托品的用量,缩短患者的苏醒时间和乙酰胆碱酯酶恢复正常的时间,降低中间综合征的发生率及病死率。鄢涛等[14]采用HA“3-2-1-1”治疗方案(第1天3次,第2天2次,第3天和第4天各1次)治疗49例敌草快中毒患者,结果发现治疗组的血清肌酐、转氨酶和血乳酸水平显著低于常规治疗组,而氧分压和14 d生存率显著提高。徐礼友等[15]救治急性虫螨腈中毒存活患者的过程中发现,在虫螨腈转化为活性代谢产物之前进行HA清除毒物可能发挥了重要作用。此外,HA治疗持续5 d,共计6次,每次持续时长为2 h,有效清除了再次从组织器官释放入血的虫螨腈及其活性代谢产物,是患者未出现迟发性毒性反应最重要的原因。
推荐意见2:对于明确毒物暴露的急性中毒患者,建议在暴露后6 h内启动HA治疗。治疗频率应基于毒物的药代动力学特征和患者临床反应进行动态调整。(证据等级:Ⅳ级,推荐强度:A级)
2.1.3 急性中毒治疗中HA与其他血液净化模式的联合应用急性重症中毒患者常因毒素的直接损伤及全身炎症反应综合征,导致急性肝肾功能衰竭、电解质紊乱和酸碱失衡。在这种情况下,采用HA联合其他血液净化模式进行多靶点干预,成为核心救治策略。
Li等[16]研究发现,百草枯中毒患者若能尽早接受HA加连续性肾脏替代治疗(continuous renal replacement therapy,CRRT),可有效降低百草枯的血药浓度,减少器官损伤,提高生存率。丁文飞等[17]的研究指出,HA联合血浆置换在治疗毒蕈中毒方面展现出显著优势,能够更迅速、高效地清除血液中的毒蕈毒素及其代谢产物,促进肝脏、肾脏、心脏及凝血功能的恢复,对缩短平均住院日、改善预后具有显著效果。Li等[18]的研究显示,HA结合CRRT可以非特异性地清除黄蜂蜇伤患者的黄蜂毒液和炎症细胞因子,改善肝肾功能。乌头碱具有极强的亲脂性,常规治疗难以迅速清除血液中的毒性物质;HA能加速乌头碱及其代谢产物的清除,联合血液透析在清除患者体内毒素的同时,帮助患者纠正电解质紊乱和酸碱平衡紊乱;在保障循环稳定的基础上,加快多余液体的清除,降低心脏负荷,改善心律失常状况,有利于患者恢复[19]。
推荐意见3:对于合并多器官功能障碍的急性重症中毒,推荐采用HA联合CRRT模式,以协同清除毒素、调控炎症并维持内环境稳定,从而改善预后。(证据等级:Ⅳ级,推荐强度:A级)
2.2 HA在横纹肌溶解综合征中的应用横纹肌溶解综合征(rhabdomyolysis syndrome, RM)是一种由肌肉损伤引发的临床综合征,其病理特征表现为横纹肌细胞的破坏和崩解,导致肌酸激酶、肌红蛋白、醛缩酶、乳酸脱氢酶及电解质等细胞内成分大量释放入细胞外液和血液循环中[20]。RM在急诊疾病谱中较为常见,常见诱因包括严重创伤、剧烈运动、血管闭塞,以及感染和脓毒症、药物、电解质紊乱等。其中,肌红蛋白的释放是RM导致器官功能障碍,尤其是急性肾损伤(acute kidney injury, AKI)的核心病理生理机制[21]。过量的肌红蛋白通过物理性肾小管阻塞和免疫介导的损伤,加速AKI的进展。因此,及时清除循环中的肌红蛋白是减少相关并发症的关键。然而,由于肌红蛋白分子量较大(约17 000),常规肾脏替代治疗(renal replacement treatment, RRT)对其清除效果有限。
2.2.1 横纹肌溶解综合征治疗中HA的应用HA技术作为一种高效的血液净化手段,在治疗RM方面展现出显著优势。该技术通过特定的吸附柱,如基于疏水性相互作用的CytoSorb®(吸附上限为55~60 000),以及HA330、HA380和CA330(吸附范围为500 000~60 000),能够高效清除血液中的大分子物质,如肌红蛋白等[22-25]。离体试验表明,HA380能在4 h内将肌红蛋白浓度从约330 000μg/L降至2 042 μg/L,清除率高达99.4%;CA330在2 h内的肌红蛋白清除率可达95.89% [26-27]。通过迅速降低循环中的肌红蛋白浓度,HA技术有效减轻其对肾脏等器官的损害,从而有助于改善患者预后[28-30]。此外,该技术操作简便、安全性高,为RM治疗提供了新的选择。
推荐意见4:HA能有效清除肌红蛋白,可作为横纹肌溶解综合征的辅助治疗手段。(证据等级:Ⅲ级,推荐强度:B级)
2.2.2 横纹肌溶解综合征治疗中HA启动的时机横纹肌溶解后,血清肌红蛋白水平显著升高。然而,由于肌红蛋白可通过肾外途径(主要为网状内皮系统)及肾脏途径(非主要途径,平均清除速率约为3 mL/min)被快速清除,在症状出现后的24 h内,循环肌红蛋白水平可能会迅速降低[20, 31]。因此,启动HA的时机需动态评估,综合考虑血清肌红蛋白浓度的变化趋势、临床症状的严重程度(如肌肉损伤范围、筋膜室综合征风险)以及潜在的器官损伤风险(特别是AKI)。一项纳入43例重症RM患者(SAPSⅡ评分高,预测病死率为92.5%)的回顾性研究表明,当肌红蛋白水平>5 000 ng/mL且合并AKI时,启动高通量透析联合连续性血液净化治疗,能够有效清除肌红蛋白(最高降幅达38%),并显著降低患者的实际住院病死率(67.4% vs.预测值92.5%)[28]。Gräfe等[29]进行的单中心回顾性研究纳入了肌红蛋白水平超过10 000 ng/mL且伴有急性肾损伤(AKI)的成人患者。研究结果表明,在连续肾脏替代治疗(CRRT)的基础上联合使用Cytosorb® HA,可能提高严重横纹肌溶解(RM)患者脱离透析的比例,尤其在存活患者中效果更为显著。Zhou等[30]在近期开展的一项纳入111例RM患者的回顾性队列研究中(采用HA380吸附柱)指出,启动HA的时机应选定为肌酸激酶(creatine kinase, CK)水平超过10 000 IU/L,并伴有AKI。其中,CK的显著升高被视为RM的重要标志,通常与高肌红蛋白血症密切相关。值得注意的是,现有研究在启动HA治疗的具体指标上存在差异,这可能与研究对象的基线病情危重程度、所选用的血液净化模式以及研究设计的不同有关。由来自6个欧洲国家的专家组成的“横纹肌溶解高吸附疗法工作组(hemoadsorption in rhabdomyolysis task force, HRTF)”在其最佳实践共识声明中明确指出,HA疗法的指征为肌红蛋白水平达到或超过10 000 ng/mL[32]。
推荐意见5:建议在血清肌红蛋白>10 000 ng/mL时启动HA治疗;若合并AKI,肌红蛋白浓度>5 000 ng/mL时即应评估联合RRT的必要性。(证据等级:Ⅲ级,推荐强度:B级)
2.2.3 横纹肌溶解综合征治疗中HA吸附柱的更换频率肌红蛋白的清除效率受血浆流量及其百分比减少量的乘积所影响。然而,HA柱的饱和动力学展现出独特的特性:其饱和过程并不直接依赖于肌红蛋白的浓度。这可能是由于吸附柱微球上的吸附位点存在其他分子的竞争性结合,导致肌红蛋白的清除效率随时间迅速降低。尽管HA治疗在清除肌红蛋白方面展现出一定的潜力,但目前尚无明确共识来确立其最佳治疗持续时间。临床研究表明,吸附柱在处理肌红蛋白时会迅速达到饱和状态,这可能会影响治疗效果。Cyto-SOLVE的研究结果显示,Cytosorb®吸附柱虽能显著降低肌红蛋白水平,但其清除效率在治疗3 h后迅速下降;至12 h,吸附柱基本达到饱和[33]。Albrecht等[34]进行的一项随机对照研究表明,连续性静脉-静脉血液透析(CVVHD)联合Cytosorb®吸附柱,在初始5 min内的单次通过相对清除率可达76%。然而,8 h后,由于吸附柱逐渐饱和,清除率显著下降至10%。ReplaceRhabdo研究指出,高通量透析器配合CytoSorb®吸附柱在治疗初期(≤12 h)对肌红蛋白的清除效果显著,尤其适合那些急需迅速清除肌红蛋白的危重患者[35]。基于上述吸附柱快速饱和的特性,HRTF共识亦建议在RRT联合吸附柱清除肌红蛋白时,每8~12 h更换一次HA吸附柱[32]。目前,尚缺乏单独应用HA清除肌红蛋白的相关临床数据。为确保有效的清除效果,临床实践中需密切监测肌红蛋白水平及吸附柱性能,并根据实际情况灵活调整吸附柱的更换频率。未来研究需进一步探讨吸附柱在不同治疗模式下的饱和动力学,以优化治疗方案。
由于缺乏大规模临床试验数据的支撑,目前关于HA治疗RM的最佳应用方案仍需深入探究。尽管现有研究能提供初步指导,但鉴于个体差异及病情的复杂性,治疗方案必须进行个体化调整。未来研究应聚焦于不同患者群体对吸附治疗的反应差异,并结合多参数监测手段,以制定更为精准的治疗策略。
推荐意见6:HA与RRT联合清除肌红蛋白时,建议每8~12 h更换一次吸附柱;若单独使用HA,建议每4~6 h更换一次,以避免吸附柱饱和导致效能下降。(证据等级:Ⅱ级,推荐强度:A级)
2.3 HA在脓毒症中的应用脓毒症是急危重症医学领域所面临的一项重大临床挑战,其病理生理特征表现为由感染引发的反应失调性免疫综合征,进而导致器官功能障碍甚至衰竭。作为一种创新的体外血液净化手段,HA技术通过特异性清除循环中的炎症介质与内毒素,在调节免疫稳态、减轻器官损伤及改善患者预后方面展现出独特的治疗价值。
2.3.1 脓毒症治疗中HA启动的时机大量研究已证实,HA在脓毒症治疗中具有潜在的益处,脓毒症患者应用HA能够稳定血流动力学并改善脏器功能。有证据显示,在早期(通常为12~24 h内)启动HA治疗,对脓毒症及高炎症反应疾病患者均有益处[36-37]。临床实践表明,当脓毒症患者进展至炎症风暴及多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)阶段时,已错失最佳干预时机。因此,在脓毒症患者中应用HA,应从器官功能状态和炎症风暴两方面进行全面评估。
HA在脓毒症患者中的应用应从器官功能和炎症风暴两方面进行全面评估。器官功能评估满足以下任一条件即可考虑启动HA治疗:①序贯器官功能衰竭(sequential organ failure assessment, SOFA)评分≥10分,或6 h内ΔSOFA≥2分;②正在使用血管活性药物[去甲肾上腺素≥0.4 μg/(kg·min)或血管活性药物评分(vasopressor-inotropic score,VIS)≥40分)][38-40]。Fujimori等[41]的研究表明,HA疗效与SOFA评分在10~12分之间具有显著相关性。Chen等[42]开展的多中心、随机化对照研究旨在评估HA对脓毒性休克患者的疗效,纳入了200例符合以下条件的患者:去甲肾上腺素≥0.4 μg/(kg·min)(或等效剂量其他血管活性药)、降钙素原(procalcitonin, PCT)≥50 μg/L和/或IL-6≥1 000 pg/mL。该RCT设计首次以前瞻性方式验证了“去甲肾上腺素≥0.4 μg/(kg·min)”作为启动HA的血流动力学阈值。
理想的治疗窗口期应位于炎症因子水平急剧升高的早期阶段(12~24 h内),此时进行干预能够有效阻断炎症级联反应,重建免疫平衡。当炎症指标符合以下任一条件时,可考虑启动HA治疗:①PCT>10 ng/mL;②IL-6>1 000 pg/mL[38-40]。Sánchez-Morán等[43]开展的前瞻性多中心研究,纳入了符合“炎症风暴”标准的脓毒症患者:PCT>10 ng/mL、IL-6>2 000 pg/mL,去甲肾上腺素剂量≥0.3 μg/(kg·min),并在12~24 h内启动HA治疗。研究结果揭示,PCT、IL-6以及去甲肾上腺素剂量均显著降低。为明确可能从HA治疗中获益的患者群体,提供具有参考价值的生物标志物阈值显得尤为重要。Wendel Garcia等[44]的研究表明,当IL-6浓度超过1000 pg/mL且血管加压药依赖指数(vasopressor dependency index,VDI)大于3时,为难治性脓毒症休克进行HA的明确指征。此外,若PCT水平超过10 ng/mL或IL-6浓度超过1 000 pg/mL,这两项指标可能共同构成启动HA治疗脓毒症的联合触发点,有效阻断炎症级联反应[39, 45]。上述炎症风暴阈值和切点可作为筛选高危人群的“参考阈值”,但不应视为唯一触发条件,且需与器官功能指标联合评估,并在充分知情同意后方可试验性启动HA。
HA在脓毒症患者的治疗中展现出一定的应用潜力。在临床实践中,HA治疗的启动和终止时机通常依据以下指标进行判定:初期治疗反应(如对液体复苏和血管活性药物的敏感性)、疾病背景(包括感染源的类型及严重程度)、器官功能状态(以SOFA评分变化为依据的改善情况)、炎症反应强度(以IL-6、CRP、PCT等细胞因子水平为代表)。然而,这些判断标准具有较强的主观性,导致目前临床研究的异质性较大,部分研究结果之间差异有统计学意义。
推荐意见7:脓毒症患者完成集束化治疗后,若出现以下任一或多个情况,建议早期(12~24 h内)启动HA:SOFA评分≥10分或6 h内ΔSOFA≥2分;大剂量血管活性药物支持[去甲肾上腺素≥0.4 μg/(kg·min)或VIS≥40分];显著炎症反应(PCT>10 ng/mL和/或IL-6>1 000 pg/mL)。(证据等级:Ⅰ级,推荐强度:A级)
2.3.2 脓毒症治疗中HA疗法的疗效监测及评估指标鉴于HA的临床有效性和安全性的对照临床试验数据相对匮乏,在实践中,需对以下方面进行详尽的实时监测、记录和分析:疗法的有效性(即治疗效果)、安全性(涵盖脱靶效应和技术问题),以及临床有效性(以患者为中心的结局)。此外,应定期审查和记录处方及输送治疗的技术细节,包括吸附剂的类型和表面积、血流量(涉及处方和输送)、系统压力、治疗持续时间,以及总体系统的凝血证据。
同时,应通过警戒性监测来确保安全性,以便及时应对紧急事件,如出血、癫痫发作或心律失常,以及潜在的治疗相关不良事件,如低血压、血管加压药使用增加、体温过低,或因抗生素和/或抗炎药脱靶清除导致的脓毒症恶化。
Efe等[46]开展了一项单中心回顾性匹配病例-对照研究,旨在评估HA330对脓毒症休克患者28 d生存率的影响。研究者监测了SOFA评分、休克指数、PaO2/FiO2比值、血管活性药物用量、pH值、乳酸和CRP水平,结果显示这些指标均显著优于基线水平。研究表明,在标准治疗基础上加用HA330灌流,可显著提高脓毒症休克患者的28 d生存率,并快速改善其器官功能和代谢紊乱。Friesecke等[47]开展了一项前瞻性单中心研究,纳入了20例难治性脓毒症休克患者。在休克治疗(7.8±3.7)h后,启动CytoSorb®HA治疗。结果显示,去甲肾上腺素剂量在治疗6 h和12 h后显著降低,乳酸清除率亦显著提升。
以上研究为HA治疗的疗效评估及监测指标的选择奠定了坚实的临床实践基础。尽管体外血液净化疗法(extracorporeal blood purification therapies,EBPTs)为脓毒症的治疗开辟了新的潜在途径,研究表明部分技术能够有效改善某些临床指标、提升肾脏功能、调节免疫反应、减轻炎症并降低细胞因子水平,但目前所获得的证据尚不足以将其确立为标准治疗方案。未来,仍需开展更多高质量的随机对照试验,以便更精准地识别可能从HA疗法中获益的患者群体。
推荐意见8:HA治疗脓毒症期间,应密切监测以评估疗效:每6 h监测血流动力学指标(血管活性药物剂量、平均动脉压、乳酸);每12~24 h评估器官功能(SOFA评分)与炎症标志物(IL-6、PCT等);每24 h进行综合疗效评估。(证据等级:Ⅰ级,推荐强度:A级)
2.3.3 HA治疗脓毒症的终止指征HA终止的选择应基于患者所处的临床阶段、临床适应证、吸附治疗的具体情况以及预期患者人群。在为临床试验和临床实践选择替代终点(生物标志物)和临床终点(以患者为中心的结局)时,需充分考虑疾病和特定背景因素。HA的相对获益及其潜在危害(即脱靶效应)的评估,仍是选择终点(即有效性与毒性的替代终点;有效性与不良事件的临床终点)的关键考量因素。此外,风险获益平衡评估必须涵盖与任何体外吸附治疗相关的潜在不良反应,如导管插入和维护、血液暴露于体外回路以及抗凝等问题。
Hawchar等[48]开展的前瞻性随机对照试验纳入了早期(<24 h)脓毒症休克患者。研究结果显示,Cytosorb®组的去甲肾上腺素需求显著降低,PCT水平显著下降,而对照组的变化则不显著,且未观察到与Cytosorb®治疗相关的不良事件。该研究首次证实了“单独Cytosorb®HA”在脓毒性休克早期应用的安全性和可行性,能够迅速降低升压药需求和炎症介质水平,同时也为后续大规模RCT的监测和终点选择提供了重要依据。
鉴于脓毒症的高度异质性,未来仍需开展更多高质量随机对照研究,以明确其最佳启动和终止时机、滤器的使用及更换频率等关键性问题(图 2)。此外,建立相关注册登记系统,广泛收集临床数据,对于优化治疗方案、提升治疗效果亦具有至关重要的意义。
|
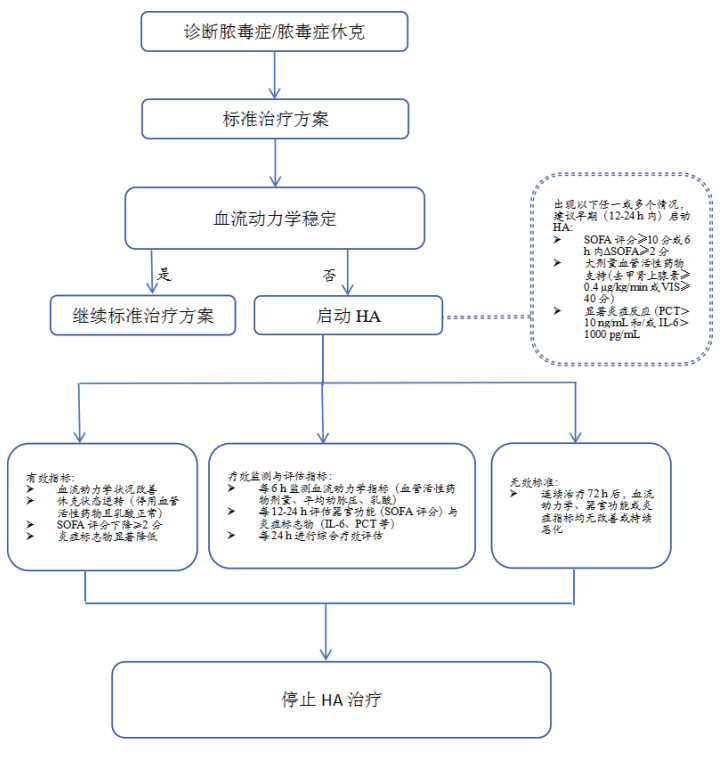
| 注:SOFA: 序贯器官衰竭评分; PCT: 降钙素原; IL: 白介素; VIS: 血管活性药物评分; MAP: 平均动脉压; HA: 血液吸附 图 2 脓毒症患者HA流程图 |
|
|
推荐意见9:HA终止指征:病情已稳定,表现为血流动力学状况改善、休克状态逆转(停用血管活性药物且乳酸正常)、SOFA评分下降≥2分、炎症标志物显著降低;治疗无反应,表现为连续治疗72 h后,血流动力学、器官功能或炎症指标均无改善或持续恶化。(证据等级:Ⅰ级,推荐强度:A级)
2.4 HA在心脏骤停后综合征患者中的应用心脏骤停发生时,全身组织器官会遭受严重的缺血缺氧,炎症因子随之释放,产生多种代谢产物。随着自主循环恢复(return of spontaneous circulation, ROSC),再灌注损伤接踵而至,导致机体出现全身炎症反应和多器官功能障碍。这一系列病理变化被称为心脏骤停后综合征(post cardiac arrest syndrome,PCAS),亦称心肺复苏后综合征。在ROSC早期,全身器官因再灌注损伤而产生大量氧自由基、乳酸、花生四烯酸等炎性介质,引发过度炎症反应。同时,释放的细胞因子和炎症介质导致T淋巴细胞的数量和功能显著下降,进而诱发免疫抑制。这一过程与脓毒症的病理生理机制颇为相似[49],因此PCAS亦被称作类脓毒症样综合征。高炎症反应和免疫抑制是导致PCAS患者出现MODS及死亡的重要因素[49]。
2.4.1 心脏骤停后综合征治疗中HA的应用从理论上讲,HA能够减轻PCAS患者过度炎症反应所致MODS,但目前高质量的临床证据非常有限。Monard等[50]开展了一项针对PCAS患者的随机对照试验,排除了接受ECMO或RRT治疗的患者。结果显示,接受HA治疗的PCAS患者在48 h内的IL-6中位水平降低率显著高于非HA组,这表明启动HA治疗对于PCAS患者是可行且安全的,但其对细胞因子的清除效能仍需进一步验证。Pieri等[51]在一项回顾性研究(n=359)中,纳入了接受HA治疗的ICU患者,其中包括120例在机械胸外按压下难治性心脏骤停的患者。研究结果表明,HA能够改善ICU患者的休克指数评分,减少血管活性药物的用量,但未对心脏骤停患者进行亚组分析。然而,Akin等[52]针对院外心脏骤停(out of hospital cardiac arrest, OHCA)患者的配对研究发现,接受72 h HA治疗组的30 d病死率显著高于未接受HA治疗的对照组,提示在心脏骤停患者中应用HA需要谨慎评估。
近年来,体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)已广泛应用于心脏骤停患者的救治中[53]。ECPR的实施可有效提升全身组织器官的血流和氧供,减轻因缺血缺氧导致的组织器官损伤,促进心脏功能的恢复,并保护脑功能[54]。然而,在ECPR期间,可能引发炎症反应,导致细胞因子过量释放,进而使ECPR患者出现循环不稳定,甚至危及生命[55-56]。无论是院内心脏骤停(in-hospital cardiac arrest, IHCA)还是院外心脏骤停(out-of-hospital cardiac arrest, OHCA),ECPR患者的IL-6和IL-8水平均与神经功能预后、器官功能障碍及血流动力学状态密切相关[56]。Zahn等[57]进行的一项回顾性研究显示,使用HA后,ECPR患者的乳酸水平和去甲肾上腺素用量均显著降低,提示HA的应用有助于稳定ECPR患者的循环状态。然而,仍有部分研究报道指出,PCAS患者并未从HA的实施中获益。Supady等[55]采用倾向评分匹配HA组和非HA对照组,回顾性结果显示,两组患者的生存率差异无统计学意义,ECPR后72 h内乳酸、血管活性药物需求、液体需求差异无统计学意义。同样,Supady等[58]还开展了另一项单中心ECPR患者的RCT,接受72 h HA的治疗组与对照组相比,72 h的IL-6水平、30 d病死率、中枢神经系统损伤程度、心脏损伤标志物及血管活性药物需求量均差异无统计学意义。因此,ECPR早期联合HA治疗对PCAS患者预后的影响还有待更多研究来证实。
目前,针对HA在PCAS患者(包括ECPR患者)中的临床研究较为有限,多数研究为小样本或回顾性研究。尚不清楚HA是否能够有效提升PCAS患者或ECPR患者的生存率及循环稳定性,其启动和应用的指征需进行个体化评估,综合考虑PCAS患者的原发病治疗、血流动力学状态、炎症反应、免疫状态以及器官功能等因素。
推荐意见10:HA或有助于减轻PCAS的炎症反应,但其对预后的改善作用尚需高级别证据证实。应用时应个体化评估患者炎症状态、器官功能及血流动力学稳定性,并谨慎评估其对血流动力学的影响。(证据等级:Ⅲ级,推荐强度:C级)
3 总结与展望本共识系统性地梳理了HA技术在急诊危重症领域的应用现状及其循证依据,重点关注急性中毒、横纹肌溶解综合征、心脏骤停后综合征及脓毒症四大临床场景,提出了10条具备较强实操性的推荐意见。这些建议涉及技术适用人群、启动时机、治疗频次、联合模式选择及疗效评估等关键环节。共识强调,HA在清除中大分子毒素、调控炎症反应、改善内环境紊乱等方面展现出独特优势,尤其在传统治疗手段效果有限的情况下,HA更可作为一种重要的辅助治疗手段。
HA技术的发展仍面临众多挑战与机遇。一方面,吸附材料的生物相容性、选择性及吸附容量尚有提升空间,新型吸附剂的研发及其临床应用亟待进一步推进;另一方面,HA治疗的个体化和精准化仍是未来的重点方向,涵盖基于药代动力学/毒代动力学模型的时机选择、联合治疗模式的优化、疗效预测生物标志物的探索等内容。此外,目前多数研究仍局限于小样本或回顾性分析,亟需开展更多高质量、多中心随机对照试验,以明确HA在不同人群及不同疾病阶段的疗效与安全性。建立完善的HA注册登记系统、推动真实世界研究、加强多学科协作,亦将有助于形成更高级别的临床证据,最终促进HA技术在急诊危重症救治中的规范化、安全化及高效应用。
执笔 闫圣涛(中日友好医院急诊科)陈淼(上海市浦东新区公利医院急诊科)任英莉(山东中医药大学附属医院急诊科)孙立超(吉林大学第一医院急诊内科)莫晓叶(中南大学湘雅医院急诊科)李树生(华中科技大学同济医学院附属同济医院急诊和重症医学科)裴红红(西安交通大学第二附属医院急诊科)曹春水(南昌大学第一附属医院急诊科)燕宪亮(徐州医科大学附属医院急诊医学科)李铁刚(中国医科大学盛京医院急诊科)秦历杰(河南省人民医院急诊医学科)
共识专家组成员(按姓氏汉语拼音排序)曹春水(南昌大学第一附属医院急诊科)陈淼(上海市浦东新区公利医院急诊科)崇巍(中国医科大学附属第一医院急诊科)柴艳芬(天津医科大学总医院急诊医学科)杜力文(宁波市第二医院急诊科)高恒波(河北医科大学第二医院急诊医学科)高艳霞(郑州大学第一附属医院急诊医学部)何小军(中华急诊医学杂志)菅向东(山东大学齐鲁医院中毒与职业病科)刘明华(陆军军医大学西南医院急救部)李湘民(中南大学湘雅医院急诊科)李树生(华中科技大学同济医学院附属同济医院急诊和重症医学科)李铁刚(中国医科大学盛京医院急诊科)陆远强(浙江大学医学院附属第一医院急诊科)卢中秋(温州医科大学附属第一医院急诊医学中心)莫晓叶(中南大学湘雅医院急诊科)马岳峰(浙江大学医学院附属第二医院)裴红红(西安交通大学第二附属医院急诊科)潘曙明(上海中医药大学附属普陀医院)秦历杰(河南省人民医院急诊医学科)邱泽武(解放军总医院第五医学中心化学损伤救治科)任英莉(山东中医药大学附属医院急诊科)孙立超(吉林大学第一医院急诊内科)孙昊(南京鼓楼医院急诊医学科)谢苗荣(首都医科大学附属北京友谊医院急诊科)邢吉红(吉林大学第一医院急诊内科)闫圣涛(中日友好医院急诊科)燕宪亮(徐州医科大学附属医院急诊医学科)张国强(中日友好医院急诊科)张劲松(南京医科大学第一附属医院急诊中心)
利益冲突 所有作者声明无利益冲突
| [1] | Clark WR, Ferrari F, Manna GL, et al. Extracorporeal sorbent technologies: basic concepts and clinical application[J]. Contrib Nephrol, 2017, 190: 43-57. DOI:10.1159/000468911 |
| [2] | 李荣, 宋春燕, 唐思妍, 等. 血液吸附及其抗凝技术的研究进展[J]. 临床肾脏病杂志, 2025, 25(4): 337-343. DOI:10.3969/j.issn.1671-2390.2025.04.010 |
| [3] | 逯旭, 李静. 血液净化吸附技术及吸附膜材料的应用和进展[J]. 中国血液净化, 2025, 24(3): 218-222. DOI:10.3969/j.issn.1671-4091.2025.03.010 |
| [4] | 于茜, 周建辉, 赵小淋, 等. 血液净化吸附材料的临床发展[J]. 中华肾病研究电子杂志, 2021, 10(3): 170-174. DOI:10.3877/cma.j.issn.2095-3216.2021.03.008 |
| [5] | 梅长林. 血液吸附技术新进展[C]. 浙江省医学会肾脏病学学术年会, 杭州, 2018: 9-16. |
| [6] | 国家重症医学专业医疗质量控制中心重症肾脏学质控亚专业组. 中国重症血液吸附专家指导意见(2025年)[J]. 中国急救医学, 2025, 45(06): 461-465. DOI:10.3969/j.issn.1002-1949.2025.06.001 |
| [7] | Li ZH, Wang GX, Zhen GD, et al. Application of hemoperfusion in severe acute organophosphorus pesticide poisoning[J]. Turk J Med Sci, 2017, 47(4): 1277-1281. DOI:10.3906/sag-1611-40 |
| [8] | 时育彤, 毛征生, 陈峰, 等. 血液净化对急性虫螨腈中毒的清除效果评价[J]. 中华急诊医学杂志, 2023, 32(2): 215-219. DOI:10.3760/cma.j.issn.1671-0282.2023.02.015 |
| [9] | 夏天皓, 朴艺花. 血液灌流联合机械通气抢救大剂量氯氮平中毒患者的疗效分析[J]. 中国现代药物应用, 2018, 12(21): 31-32. DOI:10.14164/j.cnki.cn11-5581/r.2018.21.015 |
| [10] | 段昱, 毕淑珍, 陈锦华, 等. 血液灌流联合盐酸纳洛酮治疗急性重症镇静药物中毒患者的疗效分析[J]. 疑难病杂志, 2024, 23(2): 192-201. DOI:10.3969/j.issn.1671-6450.2024.02.013 |
| [11] | 田甜, 王永安, 聂志勇, 等. 基于原子吸收法探究血液灌流对血铊的清除作用[J]. 中华危重病急救医学, 2015, 27(4): 259-262. DOI:10.3760/cma.j.issn.2095-4352.2015.04.007 |
| [12] | 王宏鑫, 李晓寅, 杜海科, 等. 早期血浆吸附灌流治疗对急性抗凝血类鼠药中毒患者凝血功能预后的影响及相关因素分析[J]. 临床误诊误治, 2025, 38(11): 35-38. DOI:10.3969/j.issn.1002-3429.2025.11.008 |
| [13] | Bo L. Therapeutic efficacies of different hemoperfusion frequencies in patients with organophosphate poisoning[J]. Eur Rev Med Pharmacol Sci, 2014, 18(22): 3521-3523. DOI:10.26355/eurrev_201411_12275 |
| [14] | 鄢涛, 谢雯雯, 刘小琴, 等. 血液灌流在治疗敌草快中毒患者中的应用分析[J]. 中国急救复苏与灾害医学杂志, 2020, 15(8): 962-964. DOI:10.3969/j.issn.1673-6966.2020.08.018 |
| [15] | 徐礼友, 骆佳艳, 季流, 等. 急性虫螨腈中毒早期持续血液灌流2例报道及文献回顾[J]. 临床急诊杂志, 2024, 25(7): 370-376. DOI:10.13201/j.issn.1009-5918.2024.07.009 |
| [16] | Li A, Li WX, Hao FT, et al. Early stage blood purification for paraquat poisoning: a multicenter retrospective study[J]. Blood Purif, 2016, 42(2): 93-99. DOI:10.1159/000445991 |
| [17] | 丁文飞, 吴蔚桦, 文莉, 等. 不同血液净化方式治疗毒蕈中毒的临床观察[J]. 实用医学杂志, 2019, 35(9): 1407-1410. DOI:10.3969/j.issn.1006-5725.2019.09.019 |
| [18] | Li L, Wang B, Huang C, et al. Hemoperfusion plus continuous veno-venous hemofiltration in the treatment of patients with multiple organ failure after wasp stings[J]. Int J Artif Organs, 2020, 43(3): 143-149. DOI:10.1177/0391398819881459 |
| [19] | 李蓓蓓, 林建赟, 郑旭东, 等. 早期血液灌流联合阿托品治疗重度乌头碱中毒致严重心律失常患者的临床疗效[J]. 中国全科医学, 2018, 21(2): 103-104. DOI:10.12114/j.issn.1007-9572.2018.z2.032 |
| [20] | Kodadek L, Carmichael Ii SP, Anupamaa Seshadri A, et al. Rhabdomyolysis: an American association for the surgery of trauma critical care committee clinical consensus document[J]. Trauma Surg Acute Care Open, 2022, 7(1): e000836. DOI:10.1136/tsaco-2021-000836 |
| [21] | Boden BP, Isaacs DJ, Ahmed AE, et al. Epidemiology of exertional rhabdomyolysis in the United States: analysis of NEISS database 2000 to 2019[J]. Phys Sportsmed, 2022, 50(6): 486-493. DOI:10.1080/00913847.2021.1956288 |
| [22] | Perkoff GT, Hill RL, Brown DM, et al. The characterization of adult human myoglobin[J]. J Biol Chem, 1962, 237: 2820-2827. DOI:10.1016/S0021-9258(18)60234-0 |
| [23] | UniProt Consortium U. UniProt: a worldwide hub of protein knowledge[J]. Nucleic Acids Res, 2019, 47(D1): D506-D515. DOI:10.1093/nar/gky1049 |
| [24] | Cytosorbents Inc. : Instructions for use[EB/OL]. Document Number 17-0071-14. |
| [25] | Bellomo R, Ronco C. Adsorption: The new frontier in extracorporeal blood purification[M]. S. Karger AG, 2023. |
| [26] | Marcello M, Lorenzin A, Calab MD, et al. Understanding myoglobin adsorption kinetics: an in vitro model[J]. Blood Purif, 2024, 53(suppl 1): 4. DOI:10.1159/000540416 |
| [27] | Zhao YX, Li YL. Hemoperfusion adsorption during in vitro model of CA330[J]. Blood Purif, 2024, 53(suppl 1): 21. DOI:10.1159/000540416 |
| [28] | Scharf C, Liebchen U, Paal M, et al. Blood purification with a cytokine adsorber for the elimination of myoglobin in critically ill patients with severe rhabdomyolysis[J]. Crit Care, 2021, 25(1): 41. DOI:10.1186/s13054-021-03468-x |
| [29] | Gräfe C, Liebchen U, Greimel A, et al. The effect of cytosorb® application on kidney recovery in critically ill patients with severe rhabdomyolysis: a propensity score matching analysis[J]. Ren Fail, 2023, 45(2): 2259231. DOI:10.1080/0886022X.2023.2259231 |
| [30] | Zhou XC, Yang YY, Li PY, et al. Efficacy of haemoadsorption combined with continuous renal replacement therapy in patients with rhabdomyolysis and acute kidney injury: a retrospective study[J]. Clin Kidney J, 2024, 18(2): sfae406. DOI:10.1093/ckj/sfae406 |
| [31] | Lappalainen H, Tiula E, Uotila L, et al. Elimination kinetics of myoglobin and creatine kinase in rhabdomyolysis: implications for follow-up[J]. Crit Care Med, 2002, 30(10): 2212-2215. DOI:10.1097/00003246-200210000-00006 |
| [32] | Forni L, Aucella F, Bottari G, et al. Hemoadsorption therapy for myoglobin removal in rhabdomyolysis: consensus of the hemoadsorption in rhabdomyolysis task force[J]. BMC Nephrol, 2024, 25(1): 247. DOI:10.1186/s12882-024-03679-8 |
| [33] | Graf H, Gräfe C, Bruegel M, et al. Myoglobin adsorption and saturation kinetics of the cytokine adsorber Cytosorb® in patients with severe rhabdomyolysis: a prospective trial[J]. Ann Intensive Care, 2024, 14(1): 96. DOI:10.1186/s13613-024-01334-x |
| [34] | Albrecht F, Schunk S, Fuchs M, et al. Rapid and effective elimination of myoglobin with CytoSorb® hemoadsorber in patients with severe rhabdomyolysis[J]. Blood Purif, 2024, 53(2): 88-95. DOI:10.1159/000534479 |
| [35] | Weidhase L, Borrmann A, Willenberg A, et al. Kidney REPLACEment therapies in patients with acute kidney injury and RHABDOmyolysis (ReplaceRhabdo): a pilot trial[J]. BMC Nephrol, 2025, 26(1): 23. DOI:10.1186/s12882-025-03945-3 |
| [36] | Gaudry S, Quenot JP, Hertig A, et al. Timing of renal replacement therapy for severe acute kidney injury in critically ill patients[J]. Am J Respir Crit Care Med, 2019, 199(9): 1066-1075. DOI:10.1164/rccm.201810-1906CP |
| [37] | 杨莹莹, 张凌, 付平. 脓毒症的血液净化干预时机[J]. 华西医学, 2022, 37(7): 961-965. DOI:10.7507/1002-0179.202206022 |
| [38] | Gao C, Zhang Q, Yang Y, et al. Recent trends in therapeutic application of engineered blood purification materials for kidney disease[J]. Biomater Res, 2022, 26(1): 5. DOI:10.1186/s40824-022-00250-0 |
| [39] | Koc S, Celebi S, Hanikoglu F, et al. Can the reduction of cytokines stop the progression of sepsis?[J]. Cureus, 2022, 14(2): e22325. DOI:10.7759/cureus.22325 |
| [40] | Bottari G, Ranieri VM, Ince C, et al. Use of extracorporeal blood purification therapies in sepsis: the current paradigm, available evidence, and future perspectives[J]. Crit Care, 2024, 28(1): 432. DOI:10.1186/s13054-024-05220-7 |
| [41] | Fujimori K, Tarasawa K, Fushimi K. Effectiveness of polymyxin B hemoperfusion for sepsis depends on the baseline SOFA score: a nationwide observational study[J]. Ann Intensive Care, 2021, 11(1): 141. DOI:10.1186/s13613-021-00928-z |
| [42] | Chen JX, Zhang ZW, Gao J, et al. A multicentre, randomised controlled clinical trial evaluating the effect of the adsorptive filter oXiris on haemodynamics in abdominal septic shock patients requiring continuous renal replacement therapy (Oxiris for Abdominal SEptic Shock study)[J]. BMJ Open, 2025, 15(7): e094792. DOI:10.1136/bmjopen-2024-094792 |
| [43] | Sánchez-Morán F, Mateu-Campos ML, Bernal-Julián F, et al. Haemoadsorption combined with continuous renal replacement therapy in abdominal sepsis: case report series[J]. J Pers Med, 2023, 13(7): 1113. DOI:10.3390/jpm13071113 |
| [44] | Wendel Garcia PD, Hilty MP, Held U, et al. Cytokine adsorption in severe, refractory septic shock[J]. Intensive Care Med, 2021, 47(11): 1334-1336. DOI:10.1007/s00134-021-06512-0 |
| [45] | Koc S, Dokur M, Uysal H. Analysis of the effects of Ha-330 hemo adsorption column application on mortality and morbidity of adult patients with sepsis in general intensive care unit[J]. Med-Science, 2022, 11(1): 124. DOI:10.5455/medscience.2021.09.320 |
| [46] | Efe S, Hanci P, Inal V. Survival benefit of resin cartridge extracorporeal blood purification therapy in patients with septic shock[J]. Turk J Med Sci, 2023, 54(1): 128-135. DOI:10.55730/1300-0144.5773 |
| [47] | Friesecke S, Stecher SS, Gross S, et al. Extracorporeal cytokine elimination as rescue therapy in refractory septic shock: a prospective single-center study[J]. J Artif Organs, 2017, 20(3): 252-259. DOI:10.1007/s10047-017-0967-4 |
| [48] | Hawchar F, László I, Öveges N, et al. Extracorporeal cytokine adsorption in septic shock: a proof of concept randomized, controlled pilot study[J]. J Crit Care, 2019, 49: 172-178. DOI:10.1016/j.jcrc.2018.11.003 |
| [49] | 顾伟, 李春盛. 心脏骤停后综合征—类脓毒症样综合征[J]. 中华急诊医学杂志, 2019, 28(1): 121-123. DOI:10.3760/cma.j.issn.1671-0282.2019.01.025 |
| [50] | Monard C, Bianchi N, Poli E, et al. Cytokine hemoadsorption with CytoSorb® in post-cardiac arrest syndrome, a pilot randomized controlled trial[J]. Crit Care, 2023, 27(1): 36. DOI:10.1186/s13054-023-04323-x |
| [51] | Pieri M, Bonizzoni MA, Belletti A, et al. Extracorporeal blood purification with CytoSorb in 359 critically ill patients[J]. Blood Purif, 2023, 52(9/10): 759-767. DOI:10.1159/000530872 |
| [52] | Akin M, Garcheva V, Sieweke JT, et al. Early use of hemoadsorption in patients after out-of hospital cardiac arrest - a matched pair analysis[J]. PLoS One, 2020, 15(11): e0241709. DOI:10.1371/journal.pone.0241709 |
| [53] | 中国老年医学学会急诊医学分会, 中国老年医学学会急诊医学分会ECMO工作委员会. 成人体外膜肺氧合辅助心肺复苏(ECPR)实践路径[J]. 中华急诊医学杂志, 2019, 28(10): 1197-1203. DOI:10.3760/cma.j.issn.1671-0282.2019.10.005 |
| [54] | 中华医学会急诊医学分会复苏学组, 成人体外心肺复苏专家共识组. 成人体外心肺复苏专家共识[J]. 中华急诊医学杂志, 2018, 27(1): 22-29. DOI:10.3760/cma.j.issn.1671-0282.2018.01.006 |
| [55] | Supady A, Zahn T, Rieder M, et al. Effect of cytokine adsorption on survival and circulatory stabilization in patients receiving extracorporeal cardiopulmonary resuscitation[J]. ASAIO J, 2022, 68(1): 64-72. DOI:10.1097/MAT.0000000000001441 |
| [56] | Kozakov K, Provaznik Z, Foltan M, et al. Comparative analysis of inflammatory response on post resuscitation syndrome in extracorporeal cardiopulmonary resuscitation[J]. Resusc Plus, 2025, 24: 100995. DOI:10.1016/j.resplu.2025.100995 |
| [57] | Zahn T, Wengenmayer T, Staudacher D, et al. Cytokine adsorption in patients after eCPR[J]. Resuscitation, 2019, 142: e44. DOI:10.1016/j.resuscitation.2019.06.106 |
| [58] | Supady A, Zahn T, Kuhl M, et al. Cytokine adsorption in patients with post-cardiac arrest syndrome after extracorporeal cardiopulmonary resuscitation (CYTER)-A single-centre, open-label, randomised, controlled trial[J]. Resuscitation, 2022, 173: 169-178. DOI:10.1016/j.resuscitation.2022.02.001 |
 2025, Vol. 34
2025, Vol. 34